какая валентность кислорода в соединениях
Валентность кислорода
Общие сведения о валентности кислорода
Природный кислород состоит из трех стабильных изотопов 16 O (99,76%), 17 O (0,04%) и 18 O (0,2%).
Наиболее устойчива двухатомная молекула кислорода O2. Она парамгнитна и слабо поляризуется. Температуры плавления (-218,9 o С) и кипения (-183 o С) кислорода очень низкие. Кислород плохо растворяется в воде. При нормальных условиях кислород представляет собой газ без цвета и запаха.
Жидкий и твердый кислород притягивается магнитом, т.к. его молекулы парамагнитны. Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Кислород существует в виде двух аллотропных модификаций – кислорода O2 и озона O3.
Валентность кислорода в соединениях
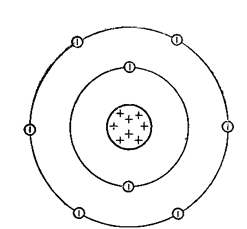
Кислород — восьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VIA группе. В ядре атома кислорода содержится 8 протонов и 8 нейтронов (массовое число равно 16). В атоме кислорода есть два энергетических уровня, на которых находятся 8 электронов (рис. 1).
Рис. 1. Строения атома кислорода.
Электронная формула атома кислорода в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Так как на 2 энергетическом слое нет подуровней кроме 2s и 2p, которые уже заняты электронами, возбужденного состояния у кислорода нет.
Примеры решения задач
| Задание | Валентность V атом азота имеет в соединении: 1)KNO3; 2) KNO2; 3) NO; 4) Ca(NO2)2. |
| Решение | Все перечисленные выше соединения, за исключением вещества под номером 3 (оксид) относятся к классу средних солей. Валентность азота в данном случае определяют следующим образом: находят число атомов кислорода, вычисляют общее число единиц валентности для кислорода, вычисляют общее число единиц валентности для металла, находят разность двух последних величин и делят её на число атомов азота. |
Рассмотрим на примере нитрата калия (KNO3). Общее число атомов кислорода равно 3 (см. нижний индекс). Общее число единиц валентности для кислорода равно: 3 × 2 = 6 (валентность кислорода равна II). общее число единиц валентности для металла равно: 1 (нижний индекс калия) × 1 = 1 (калий элемент IA группы, для которых валентность равна номеру и является постоянной величиной). Разность общих чисел единиц валентностей кислорода и калия равна: 6-1 = 5. Значит валентность азота равная V. Это и есть правильный ответ.
| Задание | Укажите, чему равны валентности элементов, входящих в состав перечисленных соединений: P2O5, CaO, SO3, N2O5, BaO, CO2, Fe2O3 и CO. |
| Ответ | Определение валентностей элементов в химическом соединении стоит начинать с указания валентности известного элемента. Все перечисленные выше соединения относятся к классу оксидов. Валентность кислорода в оксидах всегда равна II. Рассмотрим на примере первого вещества. Запишем его формулу и укажем римскими цифрами валентность известного элемента: |
Находим наименьшее кратное чисел единиц валентностей. Для этого умножаем значение валентности кислорода на количество атомов данного элемента в соединении (5):
Чтобы определить валентность фосфора поделим наименьшее кратное чисел единиц валентностей на количество атомов фосфора в соединении (2):
Это означает, что валентность фосфора равна V:
Какая валентность кислорода в соединениях
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HС l ). С атомом двухвалентного элемента соединяются два атома одновалентного (H2O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:
Число черточек, отходящих от символа химического элемента в структурной формуле и есть валентность данного элемента.
Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
Одновалентные (I) К, Na, Ag, Li, H
Двухвалентные (II) Ca, Mg, Ba, Zn, O
Трехвалентные (III) Al
| N | I | II | III | IV | V | | |
| Cu | I | II | |||||
| Fe | II | III | |||||
| C, Si | II | IV | |||||
| P | III | V | |||||
| Cl, Br, I | I | III | V | VII | |||
| S | II | IV | VI | ||||
| Cr | II | III | VI | ||||
| Sn, Pb | II | IV |
Красным цветом выделена валентность данных элементов в соединениях с водородом.
Правила определения валентности
элементов в соединениях
1. Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
2. Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
3. Высшая валентность равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
7. Валентность может быть постоянной или переменной.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
Алгоритм составления формулы соединения оксида фосфора
Составление формулы оксида фосфора
1. Написать символы элементов
2. Определить валентности элементов
3. Найти наименьшее общее кратное численных значений валентностей
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов
5. Записать индексы при символах элементов
6. Формула соединения (оксида)
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом металла стоит в формуле на первом месте.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
Какая валентность кислорода в соединениях
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HС l ). С атомом двухвалентного элемента соединяются два атома одновалентного (H2O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:
Число черточек, отходящих от символа химического элемента в структурной формуле и есть валентность данного элемента.
Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
Одновалентные (I) К, Na, Ag, Li, H
Двухвалентные (II) Ca, Mg, Ba, Zn, O
Трехвалентные (III) Al
| N | I | II | III | IV | V | | |
| Cu | I | II | |||||
| Fe | II | III | |||||
| C, Si | II | IV | |||||
| P | III | V | |||||
| Cl, Br, I | I | III | V | VII | |||
| S | II | IV | VI | ||||
| Cr | II | III | VI | ||||
| Sn, Pb | II | IV |
Красным цветом выделена валентность данных элементов в соединениях с водородом.
Правила определения валентности
элементов в соединениях
1. Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
2. Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
3. Высшая валентность равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
7. Валентность может быть постоянной или переменной.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
Алгоритм составления формулы соединения оксида фосфора
Составление формулы оксида фосфора
1. Написать символы элементов
2. Определить валентности элементов
3. Найти наименьшее общее кратное численных значений валентностей
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов
5. Записать индексы при символах элементов
6. Формула соединения (оксида)
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом металла стоит в формуле на первом месте.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
Электроотрицательность. Степень окисления и валентность химических элементов
Содержание:
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Для определения валентности применяются определенные правила:
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
Правила определения валентности элементов в соединениях
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
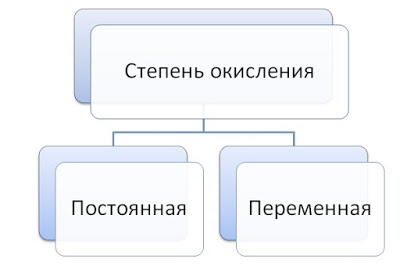
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
Пример
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
Задание 2
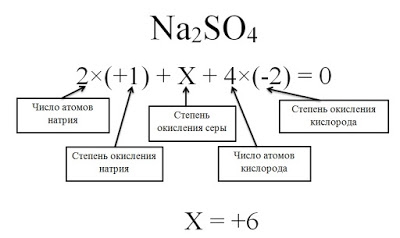
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.