что такое теломеры в организме
Газета «Новости медицины и фармации» 6 (450) 2013
Вернуться к номеру
Система «теломеры — теломераза»: теория старения и пути к его замедлению — нутрицевтики. Актуальность проблемы
Авторы: Шушляпин О.И., к.м.н., врач-терапевт высшей категории; академик профильных академий ХНМУ: член Всемирной организации семейных врачей (WONCA), член Международной Петровской академии наук и искусств, CПб., РФ, член Нью-Йоркской академии наук, член Европейской ассоциации поддержки науки и технологий, Страсбург, Франция, член Лондонской дипломатической академии; Харьковский национальный медицинский университет, Украина
Версия для печати
Теломерная теория старения и пути к продлению жизни основаны на изучении человеческой теломеразы, а соответственно, на попытках генетического омоложения человека.
Человечеству была бы нужна активная теломераза — «волшебный фермент молодости». Один из железных способов продлить жизнь — это принцип калорийноограниченного питания. Но эта пожизненная диета не ведет к увеличению средней и максимальной продолжительности жизни [3].
Теломеры — это маленькие участки на концах наших хромосом, и когда наши клетки делятся, ДНК в хромосомах должна копироваться, и во время этого процесса последняя маленькая частичка молекулярной цепи — кончик теломеры — не копируется, на протяжении нашей жизни теломеры постепенно укорачиваются. Это явление принято называть проблемой репликации концов хромосом, но которую следует назвать проблемой, запланированной заранее [4].
По мере укорочения теломер клетки стареют, хуже функционируют и реже начинают делиться, а стволовые клетки реже производят новые копии, а к какомуто моменту их совсем перестают производить. В результате этого человека подводит зрение, наша кожа теряет эластичность, хуже работает иммунная система и начинает происходить ряд других изменений, связанных со старением, и при этом нельзя изменить скорость возникновения главных болезней — патологии сердца и сосудов, злокачественных опухолей, цереброваскулярных болезней, гриппа и пневмонии (инфекционные болезни), атеросклероза, сахарного диабета, бронхита, бронхиальной астмы, нефрита, цирроза печени, если не удастся добиться замедления скорости старения. При этом старение — это своего рода болезнь, и задача геронтологии заключается не столько в продлении жизни, сколько в замедлении скорости старения, а значит, и прогрессирования главных болезней [5, 6].
Пути реализации проблемы или системные подходы исследований генов клеточного старения и долголетия человека c использованием нутрицевтиков
В настоящее время известно, что реактивация теломеразы продлевает репликативную жизнь соматических клеток, т.е. увеличивает число их делений. Однако это именно то, что происходит в опухолях и приводит их к злокачественному росту [7].
Как же достичь долголетия человека, замедлив старение, в то же время не вызывая развития злокачественных новообразований?
Одним из предлагаемых путей является реактивация теломеразы в пролиферирующих клетках на фоне стимулирования активности нормальных вариантов онкосупрессоров: р53, р16 и ARF. Так, было показано, что конститутивная сверхэкспрессия обратной транскриптазы (субъединицы теломеразы) с повышенной активностью ключевых супрессоров опухолей, перечисленных выше, приводит к значительному увеличению медианной продолжительности жизни и замедлению различных показателей старения, в частности кожи и кишечника [8].
Полагают, что клеточное старение — это генетическая программа необратимой остановки клеточного цикла, блокирующая реакцию клетки на пролиферирующие стимулы и факторы роста при наличии нерепарируемых повреждений ДНК, в частности критически укороченных телемер. Выдвигается даже гипотеза, что в эволюции клеточное старение возникло для того, чтобы не дать переродиться генетически поврежденной клетке в опухолевую, и определяющую роль в этом процессе, возможно, играет ген супрессора опухолей р53. Его продукт экспрессируется повсеместно во всех типах клеток в виде неактивного латентного транскрипционного фактора и активируется только тогда, когда клетка подвергается различным стрессам, таким как потеря теломер, повреждение ДНК, активация онкогенов или оксидативный стресс, и несмотря на то, что в стареющих клетках, в частности фибробластах, уровень белка р32 или его мРНК не увеличивается, но возрастает степень его фосфорилирования, а следовательно, возрастает ДНКсвязывающая активность, и в результате этого уровень основной мишени р53 и белка р21 в стареющих клетках остается значительно повышен и при этом нарастает с числом клеточных делений. Именно р21 отвечает за р53зависимую остановку клеточных делений. Р53зависимая индукция гена 21 приводит к клеточному старению на том основании, что белок р21 ингибирует клеточные регуляторы, в частности регуляторы клеточного цикла — циклинзависимые киназы, а также блокирует репликацию ДНК, связываясь с ядерным антигеном пролиферирующих клеток (PCNA), что и обусловливает необратимость клеточного цикла старения [9, 10].
Недавно было показано, что кодируемые другим локусом — INK4AFRF — белки p16 и р14 (ARF) также представляют собой клеточные регуляторы клеточного старения. Белок р16, как и р21, выступает в роли ингибитора циклинзависимых киназ. Экспрессия р16 заметно увеличивается с возрастом практически во всех тканях — это результат активации белка митогенактивируемой протеинкиназы р38 в ответ на оксидативный либо генотоксический стресс, которая есть не что иное, как опосредованное повышение уровня экспрессии р16 [11, 12].
Удивительным открытием было обнаружение того факта, что р53 играет определяющую роль при старении не только пролиферирующих клеток, но и постмитотических, таких как нейроны или клетки сердечной мышцы, и в этом процессе речь идет о р53зависимом апоптозе, когда, например, экспрессия доминантнонегативных, не способных связываться с ДНК, вариантов р53 в нейронах приводит к продлению на 10–20 % медианной и максимальной продолжительности жизни, но в то же время на других биологических образцах, например различных видах мышей с измененными сверхактивными формами р53, происходит процесс ускоренного старения, характеризуясь короткой продолжительностью жизни и ускоренным развитием возрастзависимых патологий, а при этом в ряде случаев добавочные копии гена р53, находящиеся под нормальным генетическим контролем экспрессии, характеризуются у предыдущих биологических объектов усиленным ответом на ДНК с низкой частотой возникновения злокачественной опухоли, но не проявляют признаков ускоренного старения или стареют медленнее [13].
Старение клетки — это загадочный феномен, возможно, играющий определенную роль в старении целостного организма, и как было показано у человека, при более низких концентрациях теломеразы и меньшей длине теломер в лимфоцитах периферической крови в несколько раз увеличивался риск сердечнососудистых заболеваний, составляющих, как известно, главную причину старческой смертности [14].
Программа клеточного старения может быть активирована в теломеразапозитивных клетках, каковыми являются стволовые клетки, и поэтому убыль количества стволовых клеток является одной из причин возрастзависимых нарушений регенерационной способности организма. Решение данной проблемы возможно на путях введения эмбриональных стволовых клеток в организм человека, но это может приводить к отторжению чужих клеток при их трансплантации. Перепрограммирование собственных дифференцированных клеток в подобие эмбриональных приводит к возникновению устойчивых свойств стволовых клеток благодаря обнаружению ряда регуляторных белков, обусловливающих свойства истинно стволовых клеток и увеличивающих продолжительность жизни человека [15].
Следующие факты указывают на то, что клеточное старение — репликативное и стрессиндуцированное, а также сокращение пролиферирующих клеток вообще и стволовых в частности приводит к нарушению регенераторной способности тканей, и на фоне возрастзависимой активации апоптоза в ряде тканей при подавлении компенсаторной пролиферации (замещение одних клеток другими) происходят дегенеративные нарушения, что снижает функциональные возможности организма, находя выражение в следующих процессах: длина теломер связана со старением целостного организма (1), модельные организмы с дефектами теломеразы характеризуются ускоренным старением и пониженной продолжительностью жизни (2), некоторые симптомы ускоренного старения у человека связаны с преждевременной дисфункцией теломер (3), стареющие клетки способны разрушать межклеточный матрикс, а также индуцировать локальное воспаление и онкогенез (4), снижение пролиферативных способностей или утеря стволовых клеток при старении снижает регенераторные способности любой ткани организма (5) [16].
Ведущие ученые мира видят перспективы исследований клеточного старения для решения новых задач в достижении качественного долголетия на пути:
1) разработки методов определения биологического возраста человека на основании специфических маркеров клеточного старения;
2) создания способов контроля экспресии генов, участвующих в клеточном старении, — теломеразы, р53, р21, р14 и ARF, фармакологическими и генноинженерными методами in vivo [17];
3) отработки безопасных подходов к перепрограммированию дифференцированных клеток в стволовые in vivo, в частности исследованиями, показавшими, что опосредованное ретровирусом введение четырех транскрипционных факторов (Oct4/Sox2/Klf4/cMyc) во взрослые дифференцированные клетки приводило к их переходу в клетки, что повышало продолжительность жизни человека [18].
На протяжении нескольких последних лет обсуждение возможности продления теломер сводилось главным образом к самому важному — к возможности включения этого гена, т.е. к активации теломеразы, и тогда полагали, что когда нам удастся это сделать, то тем самым станет возможным удлинять теломеры во всех клетках организма и таким образом со старением будет покончено. Однако последние исследования in vivo показали, что активация теломеразы не увеличивала среднюю длину теломера и даже не замедляла укорочение теломер в клетках [20].
Теломераза — фермент, удлиняющий теломеры. Ген, который закодирован на это, присутствует в каждой клетке нашего организма. Однако в большинстве из клеток он не выражен, что означает, что он не превратился в теломеразу [19].
Все время, пока ведутся поиски по активации теломеразы, ученых мучает вопрос: что еще может замедлить укорочение теломер? Ответ оказался прост: «Нужно сохранять в целостности те теломеры, которые существуют в клетках, и принимать те натуральные средства или так называемые нутрицевтики, которые могут замедлить старение, воздействуя на его истинную причину — укорочение теломер», в противовес образному выражению «что имеем, то не ценим, потерявши — плачем» [21].
Одним из разработчиков данных по натуральным продуктам стала фирма под торговой маркой Terraternal, авторские права которой защищены международной лицензией на их продажу в 2008 году, а при создании продуктов по защите теломер были взяты результаты научных открытий. Благодаря соединению в одном мощном по воздействию продукте наиболее перспективные в этом отношении нутрицевтики — полезные для здоровья пищевые добавки при длительном курсовом их применении, которые можно заказать по адресу: http://www.terraternal.com/Products/ProductDetails/ru/TelomereGuard/616/155.aspx?gclid=CMLCsvv7obMCFY98c. [22].
Старение — разрушительный биологический процесс в соответствии с генетически запрограммированной теорией старения, описывается наиболее вероятный кандидат в гены старения, который называется «теломерa», при котором ограничивается приспособляемость организма и увеличивается вероятность смерти.
Старение является «дамокловым мечом», занесенным над каждым человеком начиная с 20летнего возраста. Возрастзависимые патологии: инфаркт, инсульт, онкологические заболевания, патология опорнодвигательного аппарата, психические и инфекционные заболевания пожилого возраста [23].
Заключение
Теломераза — фермент, который достраивает укороченную теломеру в половых клетках и клетках опухолей, обеспечивая их бессмертие на основе установленных следующих фактов:
1. Концы линейных хромосом с 3’конца ДНК заканчиваются повторяющимися последовательностями нуклеотидов, получивших название «теломеры», которые синтезируются рибонуклеиновым ферментом — теломеразой.
2. Соматические клетки эукариот, имеющие линейные хромосомы, лишены теломеразной активности. Их теломеры укорачиваются в процессе онтогенеза как по мере старения in vivo, так и при культивировании in vitro.
3. Половые клетки и клетки иммортализованных линий, а также опухоли имеют высокоактивную теломеразу, которая достраивает 3’конец ДНК, на котором реплицируется комплементарная цепь при делении.
4. Структуры теломер сильно различаются среди простейших, однако у всех позвоночных они одинаковы — (TTAGGG)n.
5. Имеются существенные межвидовые различия в длине теломер, причем у мыши общая их длина в несколько раз превышает таковую у человека (до 150 тыс. пар нуклеотидов у некоторых видов мышей и 7–15 тыс. пар нуклеотидов у человека).
6. Репрессия теломеразы характеризует клеточное старение в культуре (лимит Хейфлика).
7. Клетки больных синдромом преждевременного старения Хатчинсона — Гилфорда и синдромом Дауна имеют укороченные теломеры.
8. При введении теломеразы в клетки фибробластов человека, которые в норме делятся лишь 75–80 раз, способны поделиться 280 раз без какихлибо признаков старения и патологии. Тщательное исследование выявило, что в этих клетках нет таких признаков малигнизации, как, например, нестабильность хромосом, независимый от добавления натуральной сыворотки рост, отсутствие контактного торможения и потеря контроля над клеточным циклом. Кроме того, что особенно важно, из этих клеток не развиваются опухоли при трансплантации бестимусным мышам. Полученные данные свидетельствуют о том, что экспрессия теломеразы в культуре клеток человека совсем не обязательно вызывает развитие рака, т.е. теломераза лишена свойств онкогена. Основным свойством теломеразы является контроль клеточного деления, а для возникновения опухолевого роста необходимы дополнительные мутации и биохимические факторы.
9. Введение каталитического компонента теломеразы hTERT или теломеразной активности с помощью онкобелка вируса папиломы человека Е7 в кератоциты или в клетки эпителия человека не приводило к их полной иммортализации (смертельного исхода). Последняя наступала лишь при дополнительном торможении регуляции антионкогена Rb или при угнетении экспрессии р16 в качестве второй важнейшей ступени этого процесса. При элиминации антионкогена р53 такого эффекта не наблюдалось. С другой стороны, протоонкоген сМyc может активировать экспрессию теломеразы. С помощью опосредованного микроклетками переноса маркированную геном пео хромосому 20 из стареющих и молодых диплоидных фибробластов человека ввели в молодые фибробласты. Во всех новообразованных клонах наблюдалось уменьшение пролиферативного потенциала на 17–18 удвоений.
10. К восьмому десятку жизни частота деления кожи сокращается на 50 %.
Клиническое наблюдение
Размер и количество родинок связаны с длиной теломер, что представляет собой потенциальный маркер старения.
Родинки представляют собой один из важных факторов риска развития миелом. Они появляются в детстве и подростковом возрасте и подвергаются инволюции начиная со среднего возраста.
Изучалась длина теломер у 1897 женщин в возрасте от 18 до 79 лет. При этом количество родинок (невусов) положительно коррелировало с длиной теломер.
В среднем на теле взрослого человека можно найти от 30 до 100 родинок, однако в некоторых случаях их может быть более 400. Обнаружена статистически значимая корреляция по длине теломер между участниками исследования с менее чем 25 родинками на теле и теми, у которых их было более 100, в клетках которых теломеры были значительно длинней. Это означало, что по «теломерному маркеру» клетки этих людей были моложе приблизительно на 6–7 лет.
Отсюда вывод: понимание механизмов влияния индукции и инволюции родимых пятен не только поможет в понимании патофизиологии меланомы, но также должно пролить свет на сложную связь между старением и раковыми опухолями. Кроме того, незначительный риск злокачественных новообразований, связанный с большим количеством родинок, с лихвой компенсируется меньшей склонностью к возрастным заболеваниям.
1. Акоев И.Г. Биофизика познает рак. — Москва: Наука, 1987. — 160.
2. Милунски О. Знайте свои гены. — Москва: Мир, 1881. — 392.
3. Каминер Т., Гильхрест В.А. и др. Старение кожи // Principles of Geriatric Medicine and Gerontology. — New York: McGrawHill, 1994. — Вып. 3. — 411429 s.
4. Яар М., Гильхрест В.А. Старение кожи: теоретические допустимые механизмы и вытекающие из них изменения в структуре и функционировании // Clin. Geriatr. Med. — 2001. — 17. — 617630.
5. Дильман В.М. Четыре модели медицины. — Ленинград: Медицина, 1987. — 288.
6. Дильман В.М. Большие биологические часы. — Москва: Знание, 1982. — 208.
7. Фанк В.Д., Ванг С.К., Шелтон Д.Н., Шарли С.В. и др. Экспрессия теломеразы восстанавливает целостность кожи у состарившихся in vitro фибробластов в воссозданной модели кожи // Exp. Cell. Res. — 2000. — 258, 270278.
8. Егоров Н.С., Олексин А.В., Самуилова В.Д. Биотехнология: Учебное издательство для вузов. Книга 1: Проблемы и перспективы. — Москва: Высшая школа, 1987. — 159.
9. Грунченко Е.В. Что нам стоит многоклеточность. — Новосибирск: Наука, 1985 (сибирское отделение). — 135.
10. Сарецки Г., фон Цглиники. Репликационное старение, теломеры и оксидативный стресс // Ann. N. Acad. Sci. — 2002. — 959. — 2429.
11. Эффрос Р.Б. Старение и иммунная система. Восприимчивость и старение: причины и вмешательство / Novartis Foundation Symposium; еds G. Bock and J.A. Goods. — John Willey & Son, Ltd., Chicherst, UK, 2008. — 235.
12. Лоренц М., Сарецки Г., Ситте Н. и др. Фибробласты ВJ демонстрируют высокие оксидативные возможности и замедляют укорачивание теломер независимо от hTERTтрансферазы // Free Radic. Biol. Med. — 2001. — 31. — 824831.
13. Фаyce, Эфрос. Фармакологическое усиление антивирусной функции CDB+Тлимфоцитов на основе теломеразы // Immunology. — 2008, Nov. 15. — 181(10). — 74007406.
14. Канунго М. Биохимия старения. — Москва: Мир, 1982. — 296.
15. Лэмб М. Биология старения. — Москва: Мир, 1980. — 206.
16. Йоку, Фурумото и др. Связанное со старением укорачивание теломер замедляется обогащением внутриклеточного витамина С путем подавления оксидазного стресса // Life Sci. — 1996. — 63(11). — 935938.
17. Ричард Г.А., Фарагер, Дэвид, Киплинг. Как репликативное старение может влиять на старение человека // Bioеssay. — 1998, Des. — Т. 20, вып. 12. — 985991.
18. Гуо Н., Перри Э.М., Ли Л.С., Кэмбу Ф., Лодер Н. и др. Короткие теломеры подвергают риску передачу сигналов и долговечность bклетки // Nature. — 2011. — 6(3), PloS ONE. — e17858.
19. Шей, Райт, Баур. Влияние положения теломеры в клетках человека // Sciense. — 2001. — Т. 292, № 5524. — 20752077.
20. Эргюнм, Сахин и др. Дисфункция теломеров вызывает метаболическую митохондриальную компроментацию // Nature. — 2012. — 470. — 359365.
21. Бласко и др. Активатор теломеразы ТА85 удлиняет короткие теломеры и увеличивает продолжительность жизни взрослых/старых мышей, не увеличивая частоту заболевания раком // Aging Cell. — 2011. — Т. 10, вып. 4. — 604621.
22. Харли, Луи, Бласко и др. Натуральный продукт — активатор теломеразы как часть программы сохранения здоровья // Rejuvenation. — 2010. — Т. 14, № 1. — 3439.
23. Майк Фоссель. Клетки, старение и заболевание человека. — Oxford University Press, 2004. — 290.
Что такое теломеры в организме
Введение
По данным Росстата на 2019 год в РФ насчитывается 36,6 млн. пенсионеров по старости, что составляет более четверти населения. Только за последние 5 лет численность пожилого населения выросла на 8,1%, а к 2036 г., согласно прогнозам, доля пенсионеров по возрасту может вырасти до 30,1% [1, c.1]. Продолжительность жизни населения является показателем социально-экономического развития страны, однако на первый план сегодня выходит не рост продолжительности жизни как таковой, а повышение качества жизни населения, сохранение активного долголетия, снижение заболеваемости, связанной с возрастом. В связи с этим процессы старения и сопровождающие его морфологические и функциональные изменения клеток всё больше привлекают внимание учёных.
Цель исследования: изучение литературных данных о теломерной теории старения, зависимых от теломеразы заболеваниях и возможности активации теломеразной активности.
Материалы и методы исследования: контент-анализ литературных источников, доступных в научных и наукометрических базах NCBI (National Center for Biotechnology Information) и E-Library.
Результаты исследования:
На протяжении столетия геронтологами разработано множество гипотез: от молекулярно-генетической и нейроэндокринной до единой адаптационно-регуляторной теории, которая рассматривает старение, как комплексный и противоречивый процесс, определённый комбинацией экологических и генетических аспектов. Изучение процесса старения на клеточном и субклеточном уровнях отражает теломерная теория, основоположниками которой являются Владимир Чистяков и Алексей Оловников. Генетическая информация, определяющая жизнедеятельность и старение организма, находится в хромосомах, на конце которых были обнаружены ДНК-белковые участки, называемые теломерами. В процессе митоза не обеспечивается полная репликация концов хромосом, теломеры укорачиваются, что приводит к их ломкости, деградации и слипанию, в результате чего клетка перестает делиться, становится сенесцентной, либо подвергается апоптозу. Как известно, предел, достигнув который, клетка прекращает деление, получил название в честь Леонарда Хейфлика [3, c. 3,4]. Важной составляющей «здоровья» теломер являются не только их длина, но и структура, и форма. Теломеры, не требующие восстановления, выглядят как петли в форме скрепки, конец которых спрятан. Когда же теломера обнажает свой конец, она сигнализирует о срочной потребности репарировать ДНК. Деление клетки в таком случае останавливается, она становится более не способной реагировать на агрессивные факторы извне, что сопровождается постепенным ухудшением функционирования клетки, ее старением и смертью. В таком аспекте теломеры играют важнейшую роль в предотвращении неконтролируемого деления и иммортализации клеток. Однако, с другой стороны, укорочение теломер коррелирует со старением клеток, а длинные и правильно сформированные теломеры являются ключом к долголетию без процесса старения [3, c. 5].
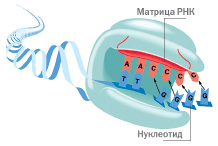
Основным механизмом поддержания длины теломер является достраивание теломерных повторов ДНК при помощи фермента теломеразы. Теломераза представляет собой мультиединичный рибонуклеопротеиновый комплекс, основными компонентами которого являются теломеразная субъединица TER, содержащая матричный участок обратной транскрипции, и теломеразная обратная транскриптаза TERT, осуществляющая координацию связывания и селекции во время репликации. Обнаружен ряд ассоциированных белков DSC (дискератин) и других вспомогательных компонентов, обеспечивающих функционирование теломеразы (посадку теломеразы на теломеру в определенный момент клеточного цикла, регуляцию ее активности, созревание теломеразного комплекса, а также деградацию его компонентов) [3, c. 5].
7 основных причин старения
Старение есть сумма всех механизмов, которые изменяют функции живого существа, препятствуют поддержанию физиологического баланса и в конечном итоге приводят к смерти. Процесс старения это процесс сложный, постепенный, зависящий от многих биологических факторов. Ученые всегда проявляли особый интерес к старению и поиску подходов к изучению этого феномена.
Исследования показали, что старение контролируется генетическими факторами и биологическими процессами, присущими человечеству.
Чтобы замедлить этот естественный процесс и увеличить продолжительности жизни, первым шагом является понимание причин старения: как оно действует на живые организмы, и какие факторы влияют на продолжительность жизни.
Существует 7 основных причин: повреждение генома, эпигенетические факторы, укорочение теломер, развернутая реакция белка, дисфункция митохондрий, клеточное старение и истощение стволовых клеток.
Ошибки репарации ДНК
Геном — это сумма генетической информации человека или вида. Геном является картой для построения всего организма. Генетическая информация, в основном, хранится в ядре клетки в виде молекул ДНК. Участок ДНК, задающий последовательность определённого полипептида, либо функциональной РНК, представляет ген. Геном человека содержит от 25 000 до 30 000 генов.
Но молекулы ДНК не лежат в свободном виде в ядре клетки, они упакованы вместе с белками-гистонами в хромосомы. Хромосомы содержат всю генетическую информацию и реплицируются с каждым клеточным делением.
На протяжении всей жизни клетки делятся множество раз, в результате генетический материал постоянно воспроизводится в живых системах и передается вновь созданным дочерним клеткам. Во время клеточного деления довольно часто наблюдаются генетические ошибки, которые образуются во время репликации ДНК. Они называются ошибками репликации ДНК. Ошибки репликации приводят к нарушению функционирования клетки и могут повлиять на оставшуюся ткань, если клетка не будет устранена в результате запуска апоптоза (гибели клеток) или старения (ухудшения функций клетки).
В организме также существует система, которая восстанавливает молекулу ДНК, модифицированную во время репликации. Система использует белки и ферменты. PARP1 — участвует в репарации ДНК и сиртуинов, а также в регуляции экпрессии генов, ремоделировании хроматина и функционировании митохондрий. NAD+ является косубстратом PARP. С возрастом происходит увеличение экспрессии белков PARP, что говорит о частых ошибках репликации и необходимости их устранения. В ответ на повреждения ДНК из-за работы PARP в клетке также очень быстро истощаются запасы NAD+, что приводит к клеточной гибели.
Активация фермента PARP может индуцировать сверхэкспрессию белка P53. Белок Р53 представляет другую систему контроля жизненного цикла клетки. Р53 отвечает за элиминацию канцерогенных клеток и позволяет продлить жизнь органов, предотвращая развитие раковых клеток. Однако, чем больше белка активируется, тем больше он ускоряет процесс старения, приводя к усиленному разрушению клеток и потери гомогенности тканей.
Механизм укорочения теломерных повторов
Способность диплоидных клеток к пролиферации ограничена. Этот процесс регулируется теломерами. Теломеры оказывают защитное действие на ДНК. Теломеры являются той частью хромосомы, которая не содержит генетической информации, и разрушаются на протяжении всей жизни при каждой репликации до тех пор пока полностью не исчезнут. Поскольку ДНК больше не защищена, при репликации важная информация «разжевывается», что приводит к апоптозу клетки или созданию раковой клетки. Фермент теломераза обеспечивает полную репликацию теломер. Он обнаружен только в стволовых, эмбриональных и раковых клетках. Присутствие этого фермента в раковых клетках объясняет, почему они бессмертны: они могут делиться бесконечно, не останавливаясь на своих «биологических часах». Работа этого фермента представляет большой научный интерес, однако, его активация может быть связана с виндукцией злокачественной трансформации.
Сокращение теломер можно сравнить с биологическими часами, которые активируют старение клеток, как только время истекает. Этот механизм ограничивает продолжительность жизни всех клеток, поэтому является центральным.
Эпигенетические механизмы и старение
Эпигенетика занимается изучением механизмов, управляющих экспрессией генома. Экспрессия генов может варьировать в зависимости от факторов окружающей среды. Органы демонстрируют эту изменчивость: каждая клетка имеет сходную генетическую информацию, но разные функции, что показывает разницу в экспрессии генов в зависимости от окружающей среды.
Белки представлены полипептидной цепью, состоящей из последовательности аминокислот. Работают белки благодаря своей конформационной структуре: вторичной, третичной, четвертичной. Складывание белка представляет физический процесс-фолдинг, посредством которого белок становится функционально активным.
Исследования показали, что нарушение процесса фолдинга белка составляет патофизиологическую основу многих возрастных заболеваний различной этиологии, в том числе болезни Альцгеймера, болезнь Паркинсона и прочих.
Последствия нарушения конформационных структур связаны с накоплением агрегатов белков неправильной конформации.
Митохондриальная дисфункция и возраст
Митохондрии — это клеточные органеллы, ответственные за поддержание клеточного дыхания и синтез АТФ — основного источника энергии. Митохондрии обладают собственной ДНК, называемой мтДНК.
Дисфункция митохондрии является основной причиной старения из-за жизненно важной роли митохондрий в клетках. Возрастная дисфункция наблюдается с возрастом, может привести к гибели клетки. Ее причиной служит окислительный стресс, нарушение клеточно-митохондриальной связи.
Клеточное старение происходит, когда возраст клетки увеличивается и ее функция уменьшается. Клетка прекращает делиться и меняет свою активность. Стареющие клетки можно увидеть на всех этапах жизни. С возрастом их число увеличивается в некоторых тканях, вызывая их гетерогенность.
Механизм клеточного старения полезен в молодости. Он защищает организм от пролиферации раковых клеток, но требует эффективной работы иммунной системы для устранения стареющих клеток. При старении эффективность иммунной системы снижается, обновления стволовых клеток происходит реже.
Стволовые клетки — это недифференцированные клетки, которые не принадлежат к какому-либо конкретному органу и поэтому могут генерировать специализированные клетки посредством «клеточной дифференцировки».
Стволовые клетки позволяют обновлять клетки в органе, они хранятся в организме и используются при необходимости.
Некоторые клетки стареют и умирают регулярно и требуют замены. Срок жизни эритроцита в среднем 120 дней. Другие органы могут расти и требовать больше ткани (например, матка во время беременности). Некоторые органы не имеют стволовых клеток и поэтому не могут быть обновлены при повреждении, например, сердце, поджелудочная железа.
При старении ткани также не восстанавливаются из-за замедления деления клеток и отсутствия замены стволовых клеток. Это объясняется избыточной экспрессией белков, блокирующих клеточный цикл, или накоплением повреждений ДНК на стволовых клетках.
Истощение стволовых клеток является одной из основных причин старения, поскольку препятствует обновлению клеток и является причиной старения органов. Понимание работы стволовых клеток будет жизненно важным для регенеративной медицины в будущем.
Вышеуказанные причины потенциально ответственны за изменение функций организма. Некоторые из них лежат в основе полезных механизмов, которые становятся вредными с возрастом, как в случае с клеточным старением и системой репарации ДНК. Механизмы предотвращают развитие рака, но по мере того, как их активность становится слишком высокой, происходит сбой, дегенерация тела ускоряется.
Другими причинами являются простые механизмы, которые медленно развиваются во времени (митохондриальная дисфункция, укорочение теломер). Необходимо понимать их, если мы когда-нибудь захотим поработать над этим, чтобы потенциально замедлить старение, и увеличить продолжительность жизни человека.