Что такое позитивная реакция опухолевых клеток pms2
ИММУНОГИСТОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ MSH2, MSH6, PMS2, MLH1 В ОПРЕДЕЛЕНИИ СТЕПЕНИ ЗЛОКАЧЕСТВЕННОСТИ АДЕНОКАРЦИНОМЫ ТОЛСТОЙ КИШКИ
Полный текст:
Аннотация
Микросателлитная нестабильность связана с нарушением функций генов MSH2, MLH1, PMS2 и MSH6, которые в норме осуществляют репарацию неспаренных нуклеотидов ДНК. В настоящее время известно, что микросателлитная нестабильность – это независимый прогностический фактор, определяющий степень злокачественности рака толстой кишки. Использование иммуногистохимии для исследования системы репарации неспаренных нуклеотидов имеет свои особенности и ограничения. Материал и методы. В исследование вошло 39 больных аденокарциномой толстой кишки из них умереннодифференцированная аденокарцинома – 28 (72 %), высокодифференцированная аденокарцинома – 3 (8 %), низкодифференцированная аденокарцинома – 5 (12 %), муцинозная аденокарцинома – 3 (8 %) случая. Иммуногистохимически по стандартному протоколу исследовались белки генов MSH2, MSH6, PMS2, MLH1. Результаты. Из 39 исследованных случаев в 6 (15 %) наблюдениях было выявлено выпадение экспрессии как минимум одного из исследованных маркеров. Из 6 полученных случаев с косвенными признаками MSI-H три аденокарциномы были низкодифференцированными, 1 – муцинозной, 2 – умереннодифференцированными. Заключение. Иммуногистохимическое исследование генов репарации ДНК может быть использовано для определения степени злокачественности аденокарциномы толстой кишки совместно с оценкой гистологической дифференцировки опухоли. При использовании только гистологической дифференцировки для определения степени злокачественности аденокарциномы толстой кишки в 10 % случаев она будет оценена неверно.
Ключевые слова
Об авторах
Раскин Григорий Александрович, кандидат медицинских наук, ведущий научный сотрудник.
Петров Семен Венедиктович, доктор медицинских наук, профессор кафедры патологии.
Орлова Рашида Вахидовна, доктор медицинских наук, профессор, заведующая кафедрой онкологии, медицинский факультет,Санкт-Петербургский государственный университет.
Список литературы
1. Раскин Г.А., Янус Г.А., Корнилов А.В., Орлова Р.В., Петров С.В., Протасова А.Э., Пожарисский К.М., Имянитов Е.Н. Иммуногистохимическое исследование MSH2, PMS2, MLH1, MSH6 в сопоставлении с анализом микросателлитной нестабильности в аденокарциноме толстой кишки // Вопросы онкологии. 2014. Т. 60, № 2. С. 47–50.
2. Bosman F.T., Carneiro F., Hruban R.H., Theise N.D. WHO classification of tumors the digestive system. Lyon: IARC Press, 2010. 417 p.
3. Harfe B.D., Minesinger B.K., Jinks-Robertson S. Discrete in vivo roles for the MutL homologs MIh2p and MIh3p in the removal of frameshift intermediates in budding yeast // Curr. Biol. 2000.Vol. 10 (3). P. 145–148.
4. Kadyrov F.A., Dzantiev L., Constantin N., Modrich P. Endonucleolytic function of MutLalpha in human mismatch repair // Cell. 2006. Vol. 126 (2). P. 297–308.
5. Kamat N., Khidhir M.A., Alashari M.M., Rannug U. Microsatellite instability and loss of heterozygosity detected in middle-aged patients with sporadic colon cancer: A retrospective study // Oncol. Lett. 2013. Vol. 6 (5). P. 1413–1420.
6. Kheirelseid E.A., Miller N., Chang K.H., Curran C., Hennessey E., Sheehan M., Kerin M.J. Mismatch repair protein expression in colorectal cancer // J. Gastrointest. Oncol. 2013. Vol. 4. P. 397–408. doi: 10.3978/j.issn.2078-6891.2013.021.
7. Kinzler K.W., Vogelstein B. Lessons from hereditary colorectal cancer // Cell. 1996. Vol. 87 (2). P. 159–170.
8. Lindor N.M., Burgart L.J., Leontovich O., Goldberg R.M., Cunningham J.M., Sargent D.J., Walsh-Vockley C., Petersen G.M., Walsh M.D., Leggett B.A., Young J.P., Barker M.A., Jass J.R., Hopper J., Gallinger S., Bapat B., Redston M., Thibodeau S.N. Immunohistochemistry versus microsatellite instability testing in phenotyping colorectal tumors // J. Clin. Oncol. 2002. Vol. 20 (4). P. 1043–1048.
9. Peltomaki P., Vasen H. Mutations associated with HNPCC predisposition – Update of ICG-HNPCC/INSiGHT mutation database // Dis. Markers. 2004. Vol. 20 (4–5). P. 269–276.
10. Shia J. Immunohistochemistry versus Microsatellite Instability Testing For Screening Colorectal Cancer Patients at Risk for Hereditary Nonpolyposis Colorectal Cancer Syndrome. Part I. The Utility of Immunohistochemistry // J. Mol. Diagn. 2008. Vol. 10 (4). P. 293–300. doi: 10.2353/jmoldx.2008.080031.
Для цитирования:
Раскин Г.А., Петров С.В., Орлова Р.В. ИММУНОГИСТОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ MSH2, MSH6, PMS2, MLH1 В ОПРЕДЕЛЕНИИ СТЕПЕНИ ЗЛОКАЧЕСТВЕННОСТИ АДЕНОКАРЦИНОМЫ ТОЛСТОЙ КИШКИ. Сибирский онкологический журнал. 2015;1(5):80-83.
For citation:
Raskin G.A., Petrov S.V., Orlova R.V. IMMUNOHISTOCHEMICAL STUDY OF MSH2, MSH6, PMS2, MLH1 IN EVALUATION OF DIFFERENTIATION GRADE OF COLON ADENOCARCINOMA. Siberian journal of oncology. 2015;1(5):80-83. (In Russ.)
Что такое позитивная реакция опухолевых клеток pms2
– Насколько важно дифференцировать специальные типы рака молочной железы от неспециального (протокового)?
– Какие дополнительные иммуногистохимические маркеры, кроме общепринятой «четверки», перспективны при РМЖ?
– Во-первых, это диагностические маркеры, которые помогают правильно поставить диагноз. Как уже было сказано, это Е-кадхерин, экспрессия которого исчезает при дольковом раке и сохраняется при неспециальном типе. Андрогеновые рецепторы, которые имеют важное значение для диагностики апокриновой дифференцировки. Кроме того, определение андрогеновых рецепторов имеет и перспективное предиктивное значение в опухолях с «тройным негативом»: в настоящее время ведется большое количество исследований препаратов, направленных на андрогеновые рецепторы при РМЖ. Также, на мой взгляд, андрогеновые рецепторы целесообразно определять в тех случаях, когда гистологическая картина РМЖ похожа на «тройной негатив» (то есть опухоли высокой степени злокачественности), но при этом мы выявляем слабую реакцию на эстрогеновые рецепторы. В настоящее время мы вынуждены отмечать позитивную реакцию, даже если 1% клеток имеет низкую экспрессию рецепторов к гормонам. В таких случаях я часто добавляю комментарий, что данная экспрессия имеет сомнительное клиническое значение, негативная реакция на андрогеновые рецепторы может быть дополнительным доводом в такой ситуации. Выявление миоэпителия необходимо для дифференциальной диагностики инвазивного рака инеинвазивных поражений (рак in situ, склерозирующий аденоз и т.д.). В своей лаборатории мы используем СК14 и р63. Гистологическая картина может быть крайне обманчива. Мы периодически получаем материал на исследование, в котором просят выполнить FISHHER2, то есть уже поставлен диагноз инвазивного рака и определен статус HER2 как сомнительный (2+), а оказывается, что это рак in situ, а иногда и вовсе доброкачественное поражение по типу склерозирующего аденоза. И наоборот, иногда морфологическая картина маскируется под рак in situ, а оказывается инвазивным раком.
– Как часто при раке in situ просят определять все маркеры, включая прогестероновые рецепторы, HER2,
– Это интересная проблема. По рекомендациям ВОЗ 2012 года (последнее издание по РМЖ) имеет значение определение только рецепторов к эстрогену и только при протоковом раке in situ. Остальные маркеры определять нецелесообразно. Это не говорит о том, что мы не можем их определить, тот же рак in situ чаще экспрессирует HER2, чем инвазивный, только это не несет никакой клинической информации. Однако постоянно к нам приходят пациенты с просьбой определить у них и все остальные маркеры. Иногда приходится выполнять исследование с пометкой, что оно не имеет клинического значения. Дольковый рак in situ – это отдельная история. Если протоковый рак in situ – это все-таки показание к операции, то при дольковом in situ можно ограничиться наблюдением. Правда это относится только к классическому его варианту, в случае плеоморфного варианта долькового рака in situ в основном прибегают к более агрессивной тактике.
– А что относительно маркеров для иммунотерапии, таких как MMR/MSI и PD-L1 при РМЖ?
– Дефицит системы репарации неспаренных нуклеотидов ДНК (MMR) – это редкое событие при раке молочной железы, по данным различных источников составляет 1-2% всего РМЖ. Насколько целесообразно протестировать 100-200 пациентов для того, чтобы найти 1-2 пациентов, чувствительных к анти-PD1 терапии, достаточно сложный вопрос. К нам периодически обращаются с такой просьбой, особенно в случае агрессивного РМЖ, резистентного к стандартным схемам лечения, пока ни одного случая не выявили. Но если с дефицитом MMR более или менее понятно, простой ИГХ-анализ 4 маркеров (MSH2, MSH6, PMS2, MLH1), выпадение экспрессии двух из них является показанием к анти-PD1 терапии в США, а скоро и в России, то с PD-L1 – более сложная ситуация. Мое личное мнение, что PD-L1 имеет хорошее предиктивное значение в случае его экспрессии более 50% опухолевых клеток. Буквально в момент записи данного интервью мы выявили в рецидиве метапластического РМЖ, который лечили всеми возможными способами, экспрессию PD-L1 в 70% опухолевых клеток. Я надеюсь, что выявленный показатель поможет пациентке.
– Есть какие-то особенности морфологического исследования молочной железы в России?
– Это вопрос, чтобы спуститься с небес на землю. В настоящее время практически каждая вторая патологоанатомическая лаборатория в России оснащена иммуноавтостейнерами последнего поколения. И это здорово, это стандартизация исследования, так как в таком иммуноавтостейнере все происходит через штрих-коды, система закрытая, что минимизирует человеческий фактор. Но один момент: многие обладатели таких чудо-машин не имеют нормальных микротомов, или лаборантов, или пренебрегают режимом фиксации-проводки, или все вместе взятое. В итоге, когда к нам присылают на пересмотр препараты, в том числе выполненные на суперсовременном иммуноавтостейнере, то оценить их иногда практически невозможно. Значительно же проще купить автомат и начать делать современные исследования, чем налаживать работу всей морфологической службы у себя в учреждении. Мне вспоминаются истории с телемедициной в отношении патологической анатомии, когда ряд учреждений решил закупить сканеры гистологических препаратов для их дистанционной консультации. Идея в принципе неплоха, только для этого надо иметь препараты, которые поместятся в сканер, да еще и достаточного качества, чтобы их можно было оценить. А самый дешевый сканер стоит как 3-4 хороших микротома. Поэтому, когда мы говорим о высоких материях: маркеры для иммунотерапии, онлайн консультации гистологических препаратов и так далее, то меня иногда разбирает смех. И это мы обсуждаем РМЖ, где более или менее все привыкли, что будет выполнено ИГХ-исследование и поэтому относительно внимательно относятся к биопсийному или операционному материалу, а если мы начнем обсуждать толстую кишку или желудок, где раньше никогда не проводилось ИГХ-исследование, то там открываются совсем другие реалии.
Что такое позитивная реакция опухолевых клеток pms2
Иммунная система является ключевым медиатором в процессе гибели опухоли. Однако злокачественные клетки могут уклоняться от иммунного ответа через ряд механизмов, включая активацию иммуносупрессии, приводя к нерегулируемому росту опухоли. Блокада контрольных иммунных точек высвобождает Т-клеточно-негативную костимуляцию, что позволяет активировать противоопухолевый T клеточный ответ, в результате которого происходит распознавание и уничтожение опухоли [1]. Цитотоксический Т-лимфоцит-ассоциированный антиген-4 (CTLA-4) и рецептор запрограммированной гибели клеток 1 (PD-1) действуют как отрицательные регуляторы, ослабляя нормальную активацию Т-клеток. Рецептор PD-1 экспрессируется на поверхности активированного Т-лимфоцита и ингибирует иммуносупрессивные лиганды PD-1 (PD-L1/PD-L2), которые экспрессируются опухолевыми клетками [2]. В отличие от меланомы, рака легкого и колоректального рака 5, иммунотерапия в монорежиме не демонстрирует высокую противоопухолевую активность при распространенных опухолях гинекологического тракта 6.
Что такое микросателлитная нестабильность
У человека существует сложная система, исправляющая нарушения в ДНК, которые возникают достаточно часто. Одним из таких механизмов является система репарации неспаренных оснований ДНК (mismatch repair system – MMR), которая ответственна за распознавание и удаление неправильно спаренных оснований, образованных в результате ошибок в процессе репликации ДНК. За работу системы репарации неспаренных оснований ДНК отвечают 6 генов: MSH2, MLH1, PMS2, MSH3, MSH6 и MLH3. Наличие герминальных мутаций в этих генах приводит к развитию синдрома Линча. Чаще встречается другой, ненаследственный механизм формирования дефицита MMR (dMMR), в подавляющем большинстве случаев заключающийся в метилировании промотера MLH1 в самой опухоли. В результате dMMR появляется большое число мутаций со сдвигом рамки считывания, что приводит к формированию стоп-кодонов и синтезу нефункциональных белков. Микросателлиты представляют собой короткие последовательности в ДНК из 1-5 оснований, повторяющиеся до нескольких десятков раз. Микросателлиты встречаются и в норме, однако при dMMR их число увеличивается, что и может быть выявлено. Понятия dMMR и микросателлитная нестабильность (MSI) описывают один и тот же процесс. Микросателлитную нестабильность оценивают двумя методами – методом ПЦР и иммуногистохимическим [9].
При определении методом ПЦР выделяются 3 варианта MSI: MSI-Н (высокий уровень MSI), когда ≥2 маркеров нестабильны, MSI-L (низкий уровень MSI), когда нестабилен 1 маркер, и MSS (стабильный уровень), когда стабильны все маркеры. Значение низкого уровня MSI до сих пор четко не установлено, и этих пациентов расценивают как больных с MSS опухолями. Вторым вариантом диагностики dMMR является иммуногистохимическое исследование (ИГХ), когда в опухоли изучается экспрессия белков MSH2, MLH1, PMS2, MSH6. В случае отсутствия окрашивания хотя бы одного белка устанавливается дефицит MMR. Обе методики демонстрируют высокую (>95%) конкордантность и являются в сложных случаях взаимодополняющими, так как существуют редкие варианты нарушения MMR, диагностируемые только ПЦР или только ИГХ.
При раке эндометрия MSI-h/dMMR встречается у 48,2% пациенток с метастатическим процессом и может отличаться от первичной опухоли. В основном в таких опухолях отмечаются недифференцированные или смешанные гистологические варианты с высоким уровнем содержания опухоль-инфильтрирующих лимфоцитов. Часто опухоль локализуется в нижних сегментах матки. Но по данным многочисленных исследований прогноз пациенток с MSI-h/dMMR не отличается от больных с опухолями без нарушений в системе репарации ДНК [10,11].
Рак эндометрия и иммунотерапия
По данным статистики, в 2019 г. было диагностировано 62 000 новых случаев рака эндометрия в мире и, что особо настораживает, прогнозируется рост как заболеваемости, так и смертности со скоростью 1-2% в год [12].
Рак эндометрия – генетически гетерогенное злокачественное новообразование, состоящее из четырех различных фенотипов: POLE ультрамутации, гипермутация микросателлитной нестабильности (MSI), низкая копийность генов и высокая копийность генов [13]. Молекулярная характеристика рака эндометрия имеет большое значение для обоснования использования ингибиторов контрольных точек в этой злокачественной опухоли. В результате дефектной системы репликации ДНК, появления POLE-инактивирующих мутаций и дефекта в системе репарации неспаренных оснований ДНК (MMR) (MLH1, MSH2, MSH6, PMS2) происходит значительное увеличение мутационной нагрузки опухоли [14], котороое коррелирует с высоким уровнем неоантигенов и опухоль-инфильтрирующих лимфоцитов (TIL). Это создает определенное микроокружение опухоли, которое является благоприятным для иммунологического ответа [15]. Большинство рецидивов рака эндометрия имеют либо низкую копийность генов, либо высокую копийность с высокой микросателлитной стабильностью (MSS) опухоли, которые часто являются резистентными для лечения. И разработка новых подходов к лечению именно этой группы больных на сегодня является самой актуальной.
Монотерапия ингибиторами иммунных контрольных точек
В 2017 году в рамках 2 фазы исследования изучали активность пембролизумаба при 12 различных типах опухолей с дефицитом репарации ДНК (dMMR), в том числе были и больные раком эндометрия (N=15), где эффективность терапии была очень впечатляющей и составила 53% [8]. Это исследование также показало, что дефицит MMR является биомаркером ответа на лечение, предлагая новый вариант терапии для злокачественных опухолей с дефицитом MMR.
С 2017 года пембролизумаб одобрен для лечения распространенных форм опухолей с dММR/MSI-H, ранее получавших лечение, включая и рак эндометрия [16]. Также пембролизумаб и анти-PD-L1 препарат атезолизумаб изучались при раке эндометрия у 24 пациенток с PD-L1-положительном статусом опухоли, независимо от MSI статуса, и эффективность этих препаратов составила всего 13% [17, 18]. Во 2 фазе исследования при распространенном раке эндометрия (N=23) применяли монотерапию ниволумабом с эффективность лечения в 23%, независимо от MSI статуса [19].
Также в 1/2 фазе исследования изучался препарат достарлимаб (анти-PD-1) у 125 больных прогрессирующим раком эндометрия, где клинический ответ независимо от MSI статуса составил 29,6%. Частота ответов в группе MSI-H и MSS составила 48,8% и 20,3% соответственно. С последующим наблюдением в течение 10 месяцев 84% пациенток все еще находились на лечении, и медиана продолжительности ответа (DOR) не была достигнута [20].
Во 2 фазе исследования ингибиторы PD-L1 авелумаб (N=31) и дурвалумаб (N=70) показали объективный ответ 26,7% и 43% у пациенток с dММR и 6,25% и 3% со стабильным статусом MMR у пациенток распространенным раком эндометрия соответственно [21, 22]. Также в настоящее время продолжаются исследования монотерапии ингибиторов контрольных точек при рецидивирующем раке эндометрия – ниволумаба и пембролизумаба. В обоих исследованиях производится селекция пациентов в соответствии с MSI, POLE, или dMMR статусом.
Скромные ответы монотерапии ингибиторов контрольных точек подчеркивают общий принцип, что иммуногенность и противоопухолевые ответы зависят в значительной степени от мутагенности опухоли и, следовательно, изменить иммунологический ответ можно в сочетании иммунотерапии с комбинированной терапией.
Комбинация ингибиторов контрольных точек с другими методами лечения
В настоящее время проводится 3 фаза исследования ленватиниба с пембролизумабом в сравнении с доксорубицином или еженедельным паклитакселом в поздних линиях лечения рака эндометрия, а также в первой линии лечения продолжается исследование ленватиниба с пембролизумабом в сравнении с карбоплатином и паклитакселом.
Промежуточные результаты продолжающегося исследования 2 фазы дурвалумаба и тремелимумаба (анти-CTLA-4) в сравнении с одним дурвалумабом при рецидивирующем раке эндометрия независимо от статуса MMR (86% пациентов в каждой когорте были со стабильным статусом MMR) демонстрируют скромные результаты лечения: объективный ответ монотерапии дурвалумабом составил 14,8% и 11,1% при комбинации дурвалумаба с тремелимумабом [23].
До недавнего времени стандартом лечения распространенных форм рака эндометрия и рецидивов являлись монотерапия цитостатиками и гормонотерапия с медианой выживаемости без прогрессирования всего 1,0-3,2 месяца. Но с выявлением ряда биомаркеров подход к лечению такого резистентного к терапии рака, как рак эндометрия, существенно изменился: при опухолях с высокой мутационной нагрузкой (dММR/MSI-H) ингибитор контрольных точек пембролизумаб продемонстрировал высокую эффективность лечения.
Но доля пациентов со стабильным статусом MMR остается очень высокой, и для этой группы больных лечение комбинированной терапией ленватиниба с пембролизумабом является очень перспективным.
Что такое позитивная реакция опухолевых клеток pms2
Рак желудка: что нам ожидать от новых методов лечения?
Рак пищевода и рак желудка – это агрессивные онкологические заболевания, в лечении которых наступает новая эра. Роль некоторых молекулярных механизмов, как, например, факторов VEGF, EGFR, рецепторов фактора роста фибробластов, PIK3CA и PARP-1, были изучены, и в ближайшем будущем ожидается разработка новых препаратов на основе этих сигнальных путей. Согласно отчету проекта «Атлас ракового генома» в 80% случаев опухолей, вызванных вирусом Эпштейна-Барр (EBV), и в 42% случаев опухолей, ассоциированных с микросателлитной нестабильностью, имеются мутации в гене PIK3CA. Это дает возможность предположить, что данный молекулярный механизм можно использовать для разработки нового вида системной терапии рака желудка. Следует отметить, что при раке желудка обнаруживается повышенная экспрессия PARP-1, что может свидетельствовать о более поздней стадии заболевания и о более неблагоприятном прогнозе. Кроме того, при раке желудка наблюдаются такие явления, как экспрессия PD-L1, высокая микросателлитная нестабильность и дефект репарации неспаренных оснований. Это позволяет думать, что у подобных пациентов иммунотерапия может также играть важную роль. В данной статье обсуждаются основные направления возможных новых видов лечения для пациентов с раком пищевода и раком желудка, которые могут появиться в ближайшем будущем.
Относительная частота рака желудка снизилась в последние десятилетия: если в 1975 году это был самый частый вид рака, то в настоящий момент рак желудка находится на пятом месте по распространенности онкологических заболеваний. Также рак желудка является третьей ведущей причиной смерти от онкологических заболеваний по всему миру у пациентов обоих полов [1,2]. Кроме того, рак желудка является ведущим видом онкологических заболеваний, возникших на фоне инфекций [3], так как в его этиологии играют роль Helicobacter pylori и вирус Эпштейна-Барр (EBV). Рак желудка в два раза чаще встречается у мужчин, чем у женщин. Его распространенность в мире неодинакова: самая высокая частота возникновения и смертности наблюдается в странах Азии, таких как Корея, Япония и Китай, а самый низкий показатель – в странах Запада, в частности, в Северной Америке, где он является одним из наименее распространенных видов онкологических заболеваний [4,5]. Южная Европа, где данное заболевание находится на шестом месте по распространенности злокачественных заболеваний, также считается регионом с высоким риском [6]. Среди факторов риска развития рака желудка такие факторы, как высокое потребление переработанных продуктов из красного мяса или копченых консервированных продуктов, курение, большое потребление алкоголя и инфекция Helicobacter pylori, которая является основной причиной возникновения рака внекардиальных отделов желудка; однако в странах с низким доходом, где высока частота встречаемости рака желудка, было проведено очень небольшое количество исследований [7].
По гистологическому признаку аденкарциномы желудка подразделяются на кишечный тип (85-90%) и диффузный тип (10-15%). Большинство случаев желудочных аденокарцином являются спорадическими (90-95%), и только в 5-10% случаев отмечается семейная предрасположенность. С анатомической точки зрения опухоли проксимального отдела более распространены в странах Запада, а опухоли вне проксимального отдела желудка чаще встречаются в странах Азии [6]. Опухоли проксимального отдела желудка, которые распространяются за пределы желудочно-пищеводного перехода, по системе стадирования Американского объединенного комитета по раку (AJCC) относятся к раку пищевода, соответственно подход к их лечению такой же, как при раке пищевода [8].
Традиционно рак желудка подразделяется на кишечный и диффузный гистологические подтипы по так называемой классификации Lauren, но наблюдается и смешанный подтип [9]. Тщательный анализ драйверных мутаций в желудочных аденокарциномах выявил, что в развитии и прогрессировании этого вида рака принимает участие множество генов, в том числе TP53, ARID1A, PIK3CA и RHOA 11. Некоторые из этих мутаций ассоциируются с определенным видом рака желудка; например, мутации RHOA встречаются практически исключительно при диффузном типе рака желудка. Кроме того, встречаются такие генетические аберрации, как амплификация генов ERBB2, FGFR2, MET и KRAS, приводящие к активации нисходящего сигнального пути рецептора тирозинкиназы и RAS, что открывает новые возможности для таргетной терапии (см. ниже). Однако в этом случае, как и при других типах аденокарцином, ответ на лечение монотаргетными препаратами часто бывает неудовлетворительным, что предполагает более комплексный подход и необходимость поиска дополнительных биомаркеров.
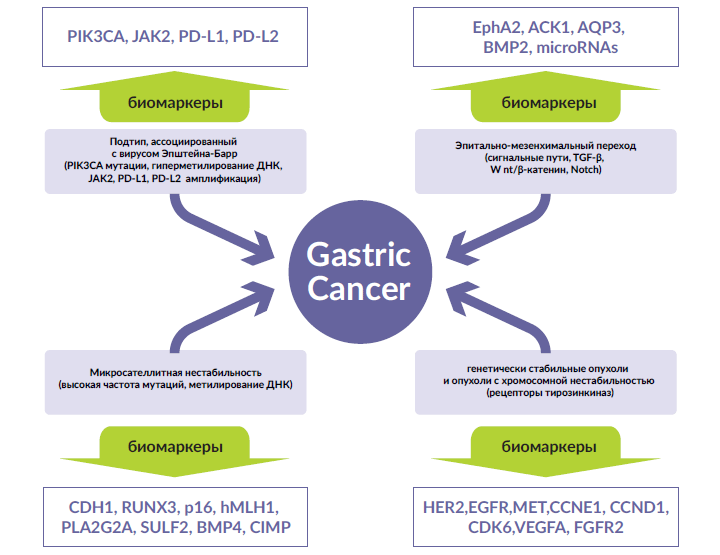
В своей основной публикации проект «Атлас ракового генома» (АРГ) предлагает разделять раковые опухоли желудка в зависимости от вида генетических нарушений на четыре молекулярных подтипа: EBV-ассоциированные опухоли (с повторными мутациями PIK3CA, крайне высокой степенью гиперметилирования ДНК и с амплификацией JAK2, PD-L1 и PD-L2), опухоли, обусловленные микросателлитной нестабильностью (MSI), генетически стабильные опухоли и опухоли с хромосомной нестабильностью (т.е. опухоли с выраженной анеуплоидией и с фокальной амплификацией гена рецептора тирозинкиназ) [13]. Чтобы объединить ситуации не только геномных аберраций, но и эпигенетических модификаций и гетерогенность микроокружения, в том числе, свойства иммунного инфильтрата и статус активации стромы, была разработана подробная классификация на основе экспрессии генов. Первые исследования были направлены на изучение профиля генной экспрессии, ассоциированной с раком кишечного типа и с диффузным раком желудка [14]. Tan et al [15] использовали репрезентативные клеточные линии для создания профилей, которые позволяли бы различить два подтипа рака желудка на основе данных экспрессии генов. Такое различение имеет также прогностическую ценность, поскольку клеточные линии, характерные для кишечного типа, как правило, отвечали на терапию оксалиплатином, тогда как клеточные линии диффузного рака желудка лучше отвечали на терапию цисплатином. В дальнейшем эта классификация была расширена и было определено три подтипа: пролиферативный тип, метаболический тип и мезенхимальный тип [16]. В этом случае ответ разных подтипов на терапию также отличался: опухоли желудка мезенхимального подтипа были чувствительны к применению ингибиторов PIK3CA, AKT и mTOR, а метаболический тип рака желудка был особо чувствителен к терапии фторурацилом. Позднее Азиатская группа по изучению рака (ACRG – Asian Cancer Research Group) предложила другую классификацию на основе экспрессии генов. В этой классификации было четыре подтипа опухолей: тип опухолей с микросателлитной нестабильностью, опухоли мезенхимоподобного типа, а также p53-активный и p53-неактивный типы опухолей [17]. Клиническое значение этих классификаций лучше всего показано для классификаций АРГ и ACRG.
Что касается классификации АРГ, наилучший прогноз был у опухолей EBV-ассоциированного типа, на втором месте были опухоли с микросателлитной нестабильностью и с хромосомной нестабильностью, а опухоли с геномной нестабильностью ассоциировались с наихудшим прогнозом [18]. Классификация ACRG также продемонстрировала прогностическую ценность в нескольких когортных исследованиях, поскольку было выявлено, что подтип опухолей с микросателлитной нестабильностью ассоциируется с хорошим прогнозом, а мезенхимоподобный тип – с неблагоприятным исходом заболевания. В самом деле, определение подтипа опухоли (по классификации АРГ или ACRG) может помочь с определением тактики лечения, прогноза и в исследовании новых видов таргетной терапии.
Опухоли с хромосомной нестабильностью представляют 50% от всех случаев рака желудка [18]. При исследовании этого вида опухолей выявляется повторная амплификация таких генов, как HER2, EGFR, MET, CCNE1, CCND1, CDK6, VEGFA и FGFR2, которые могут представлять собой потенциальную мишень.
Подгруппа с высоким уровнем MSI составляет 22% всех случаев рака желудка и характеризуется повышенным уровнем мутаций и гиперметилирования. Медиана возраста при данном виде опухолей составляет 72 года, большинство пациентов (56%) – женщины. Более высокий уровень мутаций повышает вероятность образования неоантигенов, по этой причине опухоли с высоким уровнем MSI представляют собой потенциальную мишень для иммунотерапии [18,19].
Генетически стабильные опухоли составляют 20% всех случаев рака желудка. При этом подтипе могут обнаруживаться отдельные генетические изменения, такие как мутация гена сигнального пути RHOA, гибридный ген CLDN18-ARHGAP26 и амплификация гена рецептора фактора роста фибробластов (FGFR) 2 и гена VEGFA [5].
EBV-ассоциированный подтип, как правило, локализован на дне или в теле желудка, чаще встречается у мужчин (81%) и составляет 9% от всех злокачественных опухолей желудка. Данный вид опухоли характеризуется высоким уровнем гиперметилирования промоторов ДНК, повышенной экспрессией PD-L1 и PD-L2, амплификацией JAK2 и мутацией гена PIK3CA. Таким образом, повышенная экспрессия PD-L1 и PD-L2 повышает возможности для иммунной терапии данной подгруппы опухолей, равно как и опухолей с высокой микросателлитной нестабильностью. Амплификация гена JAK-2 и мутации в гене PIK3CA также могут служить возможными мишенями для терапии у данной группы пациентов (рис. 1).
Рисунок 1. Молекулярные механизмы и наиболее перспективные биомаркеры при раке желудка.
Сокращения: ACK1 – активированная Cdc42-ассоциированная киназа 1; AQP3 – аквапорин 3; BMP2 – костный морфогенетический белок-2; BMP4 – костный морфогенетический белок-4, CCND1 – циклин D1; CCNE1 – циклин E1; CDH1 – ген кадгерина-1; CDK6 – циклинзависимая протеинкиназа 6; CIMP – фенотип метилирования CpG-островков; EphA2 – эритропоэтинпродуцирующий гепатоцеллюлярный рецептор A2; FGFR2 – рецептор фактора роста фибробластов 2; hMLH1 – ген человека, кодирующий белок MLH1; p16 – ген-суппрессор опухолевого роста p16; MET – эпителиально-мезенхимальный переход; PIK3CA – ген, кодирующий PI3K; PLA2G2A – фосфолипаза A2 группы IIA; RUNX3 – транскрипционный фактор RUNX3 домена runt; SULF2 – ген SULF2.
В 2017 году рак желудка составлял 1,7% от всех случаев рака в США, ежегодно здесь регистрируют 28 000 новых случаев. (В России в общей структуре онкологической заболеваемости рак желудка составлял 6,2% в 2016 году, было зарегистрировано 37 135 новых случаев – прим.) Показатель относительной пятилетней выживаемости в США составлял 67,2% при локализованной форме заболевания, 30,7% в случае местнораспространенного рака и 5,2% при метастатической болезни.
В США примерно 50% пациентов диагноз рака ставится на поздних стадиях заболевания, однако в некоторых странах, таких как Япония и Южная Корея, где скрининговые обследования являются рутинной процедурой, ранняя диагностика чаще имеет место [2]. Продолжительность пятилетней общей выживаемости (ОВ) при метастатическом раке желудка колеблется от 3 месяцев при проведении только симптоматической терапии до 16 месяцев в случае пациентов, имевших возможность принять участие в клинических исследованиях; таким образом, рак желудка остается одной из проблем в онкологии, решить которую еще только предстоит [20]. В большинстве стран Запада рак желудка и рак дистального отдела пищевода часто объединяют, применяя к ним единый подход в лечении и единые критерии включения пациентов в клинические исследования. В США рак пищевода является пятым по частоте раком желудочно-кишечного тракта, при этом ежегодно регистрируется 16 940 новых случаев. В мире это шестой по распространенности вид рака [21]. Примерно половина пациентов узнает о диагнозе рака пищевода на этапе, когда опухоль является неоперабельной или когда имеются метастазы. Терапия таких пациентов сводится к лечению дисфагии и других симптомов заболевания, улучшению качества жизни и продлению жизни. За прошедшие два десятилетия был достигнут умеренный успех в лечении неоперабельного рака без метастазов у пациентов, которым не показано хирургическое лечение, и у пациентов с нерезектабельной опухолью при местно-распространенном раке. В случае метастатического рака пищевода в качестве терапии первой линии было разработано несколько двухкомпонентных или трехкомпонентных режимов химиотерапии. Более того, за последние несколько лет были опубликованы отдаленные результаты нескольких крупных рандомизированных исследований III фазы с применением дополнительной таргетной терапии, которые могут повлиять на имеющиеся в настоящее время стандарты лечения и на дальнейшее направление научных исследований [21]. В данной статье мы бы хотели обсудить возможные терапевтические подходы в будущем, а также применение биомаркеров в лечении рака пищевода и рака желудка на поздних стадиях заболевания.
Какие методы лечения рака желудка на поздних стадиях существуют сегодня?
В настоящий момент лечение рака желудка на поздних стадиях представляет собой серьезную проблему для онкологов по всему миру. Режимы химиотерапии, в том числе различные схемы с препаратами платины, фторпиримидинами, таксанами и антрациклинами, являются основой терапии первой линии при лечении этого вида рака на поздних стадиях [22,23]. Тем не менее, в последние годы в этот стандарт были включены некоторые новые виды терапии. Исследования показали, что пациенты с HER2-позитивным раком желудка демонстрируют гораздо лучшие результаты лечения при добавлении трастузумаба к комбинации платины с фторпиримидином [24]. Кроме того, по результатам клинических исследований III фазы RAINBOW и REGARD рамуцирумаб, представляющий собой антиангиогенное моноклональное антитело, был одобрен в виде монотерапии или в комбинации с паклитакселом в качестве терапии второй линии для лечения рака желудка [25,26]. Ингибитор тирозинкиназы (ТКИ) апатиниб, блокирующий VEGFR-2, продемонстрировал определенную эффективность у пациентов с раком желудка на поздних стадиях заболевания и с метастатическим раком желудка, резистентным к химиотерапии, что позволяет рассматривать его как возможный препарат третьей или последующих линий терапии [26]. Но, несмотря на все вышеизложенное, роль препаратов таргетной терапии в лечении рака желудка остается ограниченной. Тем не менее, дальнейшие исследования в этой области могут сделать терапию пациентов с раком желудка более эффективной.
Новые мишени и новое лечение
Гиперэкспрессия HER2 при раке желудка наблюдается в 9-23% случаев и встречается чаще при кишечном подтипе рака. Прогностическая ценность данного маркера остается пока неясной, однако анализ на HER2 методом модифицированного иммуногистохимического исследования следует делать всем пациентам, которым был диагностирован рак желудка с метастазами [27]. После получения крайне успешных результатов для рака молочной железы этот рецептор стал объектом изучения различных клинических исследований рака желудка.
В исследовании ToGA медиана ОВ составила 13,8 месяца у тех пациентов, которые были распределены в группу лечения трастузумабом в дополнение к химиотерапии, и 11,1 месяца в группе пациентов, получавших только химиотерапию. По результатам этого исследования Управление по надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) в 2010 г. одобрило трастузумаб в комбинации с химиотерапией в качестве еще одного возможного стандарта лечения пациентов с HER2-позитивным раком желудка или раком гастроэзофагеального перехода (ГЭП) на поздних стадиях [24]. Более того, в настоящее время проводится ряд исследований, изучающих методы лечения HER2-позитивных пациентов различными комбинациями моноклональных антител, таких как трастузумаб, пертузумаб, TDM-1 или ТКИ лапатиниб, в сочетании с химиотерапией или с лучевой терапией (ЛТ). Таким образом, у различных комбинаций таргетных препаратов при лечении HER2-позитивных видов рака есть большой клинический потенциал. В настоящее время на сайте ClinicalTrials.gov зарегистрировано более 118 клинических исследований, изучающих терапию HER2-позитивного рака желудка. Информация об отдельных клинических исследованиях, которые авторы данной статьи сочли значимыми, приведена в таблице 1.
Таблица 1. Клинические исследования III фазы по изучению препаратов для терапии рака желудка с опубликованными результатами (опубликована в Газете RUSSCO №4 – 2019 (см. архив)).
В 2017 г. Doi et al. [28] опубликовали любопытные данные клинического исследования I фазы, которое изучало безопасность и противоопухолевую активность лекарственного средства трастузумаб дерукстекан, который является конъюгатом антитела к HER2 и препарата, при лечении пациентов на поздних стадиях рака молочной железы, рака желудка и гастроэзофагеального рака. Doi et al. оценивали данные 23 пациентов, у 10 (43%) из которых отмечался объективный ответ на терапию, а у 21 (91%) был достигнут контроль опухолевого процесса. Самыми частыми видами токсичности степени 3 и 4 были лимфопения, нейтропения и анемия. Таким образом, конъюгат трастузумаб дерукстекан продемонстрировал выраженную противоопухолевую активность в случае опухолей с гиперэкспрессией HER2. Необходимо дальнейшее проведение исследований II и III фазы, чтобы оценить роль этого препарата в лечении пациентов с РПЖ [28].
Следует подчеркнуть, однако, что, в отличие от рака молочной железы, результаты таргетной терапии HER2-позитивных опухолей у пациентов с РПЖ не были стабильно положительными. В недавно проведенном исследовании JACOB (NCT01774786) 780 пациентов с HER2-позитивным метастатическим или местнораспространенным неоперабельным раком ГЭП или раком желудка получали в качестве терапии первой линии трастузумаб в комбинации с химиотерапией и с пертузумабом либо без него. К сожалению, в данном исследовании не было обнаружено преимущества в ОВ у пациентов, получавших терапию комбинацией пертузумаб, трастузумаб и химиотерапия, по сравнению с пациентами, получавшими трастузумаб, химиотерапию и плацебо. ОВ в первой группе составила 17,5 месяца, а в группе плацебо – 14,2 месяца (отношение рисков [Hazard ratio, HR] 0,84; 95% ДИ 0,71-1,00; p=,0565) [40]. Помимо этого, были проведены исследования TRIO-013/LOGIC и TyTan, в которых участвовали 545 пациентов. Медиана ОВ в группах лечения лапатинибом и плацебо составила 12,2 мес. (95% ДИ 10,6-14,2 мес.) и 10,5 мес. (95% ДИ 9,0-11,3 мес.) соответственно. Таким образом, статистически значимой разницы выявлено не было (HR 0,91; 95% ДИ 0,73-1,12). Несмотря на то, что исследования TRIO-013/LOGIC и TyTan дали отрицательные результаты [35,38], были и другие исследования терапии HER2-позитивного рака желудка лапатинибом, продемонстрировавшие более многообещающие результаты. Одним из таких протоколов было исследование MAGIC-B, в котором изучалось добавление лапатиниба или бевацизумаба к предоперационной химиотерапии эпирубицином, цисплатином и капецитабином. Исследование должно было закончиться в декабре 2017 г., его результаты пока не получены.
Наконец, было проведено клиническое исследование II фазы (NCT02015169), целью которого было изучить эффективность и безопасность комбинации схемы XELOX (капецитабин и оксалиплатин) с лапатинибом для лечения пациентов с HER2-позитивным раком желудка с метастазами в печень. Первичным критерием эффективности была частота полной резекции (частота случаев R0 резекции). Предполагаемая дата окончания исследования – май 2017 г. Несмотря на небольшое количество участников (32 пациента), это исследование может помочь определить актуальные проблемы других видов анти-HER2 терапии помимо трастузумаба.
Трансмембранный гликопротеин EGFR активирует каскад сигнальных тирозинкиназных путей Ras/Raf или Akt/mTOR. Таргетная терапия для этого рецептора успешно используется для лечения метастатического колоректального рака с диким типом опухоли по гену KRAS с применением терапии моноклональными антителами панитумумаб и цетуксимаб, а терапия цетуксимабом применяется для лечения плоскоклеточного рака головы и шеи. Кроме того, анти-EGFR ТКИ, такие как эрлотиниб, были одобрены для лечения рака легкого.
EGFR может служить независимым прогностическим фактором неблагоприятного исхода у пациентов с раком желудка [41]; его гиперэкспрессия наблюдается в 30-50% случаев гастроэзофагеальных опухолей, в этом случае данный рецептор может служить потенциальной мишенью таргетной терапии [23].
Препараты цетуксимаб (в исследовании EXPAND) и панитумумаб (в исследовании REAL3) не смогли продемонстрировать клиническое преимущество при лечении гастроэзофагеальных опухолей на поздних стадиях. Возможно, что гиперэкспрессия EGFR не является ведущим онкогенным механизмом, однако в этих исследованиях пациенты не отбирались на основании гиперэкспрессии EGFR; подобный подход следует применить при разработке новых исследований или для анализа в подгруппах [42].
В более позднем клиническом исследовании II фазы другого анти-EGFR моноклонального антитела – нимутузумаба – для лечения пациентов с раком желудка на поздних стадиях увеличения ОВ или выживаемости без прогрессирования в популяции в целом не отмечалось, однако у пациентов с гиперэкспрессией EGFR данные показатели были значительно лучше, что в очередной раз говорит о целесообразности отбора пациентов для анти-EGFR таргетной терапии на основании статуса EGFR [43]. Интересный ретроспективный анализ биомаркеров в исследовании COG [44] дает основания предполагать, что субпопуляция опухолей с числом копий гена EGFR может отвечать на анти-EGFR терапию. Это говорит о том, что выявление биомаркера EGFR может приводить к положительным результатам.
Ингибиторы контрольных точек иммунитета
Злокачественные новообразования верхнего отдела желудочно-кишечного тракта, а именно рак пищевода, рак ГЭП и рак желудка, отличаются высоким уровнем соматических мутаций, уступая по частоте мутаций в опухолевых клетках только меланоме, раку легкого и раку мочевого пузыря [45]. Принимая во внимание успешность иммунотерапии при лечении этих видов рака с высоким уровнем мутаций, в последнее время был проведен ряд фундаментальных и клинических исследований злокачественных опухолей верхних отделов желудочно-кишечного тракта, результаты лечения которых стандартной химиотерапией по-прежнему неудовлетворительны.
Целью иммунотерапии является изменение баланса между провоспалительными иммунными клетками-эффекторами и противовоспалительными клетками-супрессорами. Понятие «контрольные точки иммунитета» относится к различным ингибиторным сигнальным путям иммунной системы, которые играют важную роль в аутотолерантности, уменьшая выраженность и длительность физиологических иммунных реакций. Опухолевые клетки используют этот механизм для создания опухолевой резистентности посредством взаимодействия лиганд-рецептор. Ингибиторы контрольных точек потенциально могут усиливать противоопухолевый иммунитет, оказывая влияние на лиганд-рецепторное взаимодействие между опухолевыми клетками и T-клетками [46].
В настоящее время FDA одобрило два класса иммунотерапии: ингибиторы рецептора PD-1 и его лиганда (PD-L1) и ингибиторы CTLA-4 [47]. Экспрессия PD-L1 наблюдается в 35-45% случаев рака пищевода [48,49], что позволяет говорить о целесообразности применения иммунотерапии для этого вида рака. Недавно завершенные, а также проходящие в настоящий момент клинические исследования изучают применение ингибиторов PD-1/PD-L1 и CTLA-4 в качестве монотерапии или в комбинации с другими видами терапии для лечения злокачественных заболеваний ЖКТ.
Экспрессия PD-L1, высокий уровень MSI, а также дефект репарации неспаренных оснований обнаруживаются и при раке желудка, что может говорить о целесообразности иммунотерапии при лечении пациентов с данным заболеванием. Пембролизумаб, гуманизированное моноклональное анти-PD-1 антитело, изначально изучался в исследовании IB фазы в качестве препарата для лечения пациентов с раком пищевода или ГЭП с противоопухолевой терапией в анамнезе, у которых экспрессия PD-L1 была более 1% [28]. Общий ответ на лечение составил 30,4% (95% ДИ 13,2-52,9%). При анализе в подгруппах доля пациентов, ответивших на лечение, среди пациентов с аденокарциномой составила 40,0%, а среди пациентов с плоскоклеточным раком – 29,4%. В более позднем клиническом исследовании II фазы с участием пациентов с раком желудка и ГЭП на поздних стадиях общий ответ на лечение составил 13,3% (95% ДИ 8,2-20%), при этом полный ответ отмечался в 1,4% случаев [50], а частичный ответ – в 11,9% случаев [51]. В исследовании могли участвовать пациенты с уровнем экспрессии PD-L1 в опухолевых или стромальных клетках не ниже 1% на основе данных иммуногистохимического исследования. В результате было получено ускоренное одобрение FDA этого препарата для лечения пациентов с рецидивирующей, местнораспространенной или метастатической формой аденокарценомы желудка или ГЭП. В более крупном исследовании III фазы, в котором пембролизумаб изучался в качестве препарата терапии второй линии при лечении пациентов с аденокарциномой желудка или ГЭП на поздних стадиях, первичная конечная точка, которой служил показатель ОВ у пациентов с экспрессией PD-L1 в опухолевых клетках более 1%, не была достигнута (HR 0,82; 95% ДИ 0,66-1,03; p=,042) [52]. Есть вероятность, что PD-L1 не является оптимальным биомаркером при раке желудка либо что минимальный уровень экспрессии, определенный как 1%, оказался недостаточным. Возможно, что при отборе пациентов с более высоким уровнем экспрессии PD-L1 результаты терапии были бы более благоприятными.
Ниволумаб является полностью человеческим моноклональным антителом IgG4, ингибирующим PD-1, который экспрессируется на активированных T-клетках. В исследовании II фазы принимали участие пациенты с раком пищевода на поздних стадиях, ранее получавшие противоопухолевую терапию. PD-L1 статус не являлся критерием отбора. Объективный ответ на лечение был получен в 17% случаев (95% ДИ 10-28%) [50,53]. Похожие результаты были получены в исследовании III фазы, в котором участвовали больные раком желудка или ГЭП на поздних стадиях, получившие, по крайней мере, две линии химиотерапии, у которых при этом отмечалась непереносимость данной терапии. Ответ на лечение в этом исследовании составлял 11%. Также отмечалось улучшение показателя 12-месячной ОВ у пациентов, получавших ниволумаб, который в этой группе составил 26,2% (95% ДИ 20,7-32,0%), в сравнении с 10,9% (95% ДИ 6,2-17,0%) в группе плацебо [54]. В настоящее время проходит прямое сравнительное исследование III фазы, в котором лечение ниволумабом сравнивается со стандартной химиотерапией доцетакселом или паклитакселом у аналогичной когорты пациентов с рефрактерностью к химиотерапии [55].
Тремелимумаб ингибирует CTLA-4, белковый рецептор, относящийся к суперсемейству иммуноглобулинов, который является контрольной точкой иммунитета. При экспрессии на поверхности клетки Т-хелпера он передает ингибирующий сигнал Т-клеткам при связывании с CD80 или CD86 на поверхности антиген-презентирующих клеток [56]. В исследовании II фазы с участием пациентов с метастатическим раком желудка или пищевода, ранее получавших противоопухолевую терапию, при лечении тремелимумабом объективного ответа на лечение выявлено не было. Несмотря на это, показатель длительности ответа в отдельной небольшой группе больных был обнадеживающим [57].
В настоящий момент имеются ограниченные данные о том, что комбинированная иммунотерапия более эффективна по сравнению с монотерапией. В исследовании I/II фазы с участием пациентов с раком желудка, пищевода или ГЭП, ранее получавших интенсивную противоопухолевую терапию, изучалось лечение ипилимумабом в комбинации с ниволумабом. На фоне данной терапии отмечался длительный ответ на лечение и повышение долгосрочной ОВ [58]. В настоящий момент проводится несколько исследований, изучающих комбинацию могамулизумаба, гуманизированного моноклонального антитела, связывающегося с хемокиновым рецептором, и ниволумаба для лечения рака верхних отделов ЖКТ на поздних стадиях [59,60]. В других текущих исследованиях с участием пациентов с метастатическим раком верхних отделов желудочно-кишечного тракта изучается комбинация LAG525, который связывается с молекулой LAG-3, и спартализумаба, комбинированного анти-PD-1 препарата [61]. Кроме того, изучается комбинация тремелимумаба с дурвалумабом, человеческим моноклональным антителом иммуноглобулин G1 каппа, которое блокирует взаимодействие PD-L1 с молекулами PD-1 и CD80 [62].
Традиционно химиотерапия и лучевая терапия применяются на разных стадиях рака верхних отделов ЖКТ. При метастатическом раке верхних отделов ЖКТ частота ответа на лечение химиотерапией составляет от 35% до 40%, а преимущество по медиане выживаемости составляет 9-11 месяцев. Лучевая терапия применяется в случае местнораспространенного рака, а также в качестве паллиативного лечения у пациентов с метастатическим раком. Поскольку при лечении метастатического рака химиотерапией эффект лечения является довольно скромным, следующим логическим шагом было изучить эффективность иммунотерапии. Несмотря на то, что в доклинических исследованиях были получены обнадеживающие результаты, на стадии клинических испытаний терапевтическое преимущество при лечении рака верхних отделов ЖКТ было небольшим, а улучшения эффективности по сравнению с применением химиотерапии выявлено не было. Поскольку химиотерапия обладает доказанным преимуществом, в настоящее время проводятся исследования, в которых изучается комбинация химиотерапии с иммунотерапией и/или лучевой терапией.
Научное обоснование целесообразности комбинирования химиотерапии с иммунотерапией базируется на данных доклинических исследований. Их результаты говорят о том, что цитотоксические препараты могут выступать в роли иммуномодулятора посредством презентации опухолевых антигенов. В результате происходит стимуляция экспрессии опухолевых антигенов и молекул главного комплекса гистосовместимости I класса, с которыми связывается антиген. Также существует альтернативный молекулярный механизм, при котором химиотерапевтический препарат может также способствовать усилению выработки ко-стимулирующих молекул, таких как B7-1, или подавлению выработки ко-ингибирующих молекул, таких как PD-L1/B7-1H или B7-H4, экспрессирующихся на поверхности опухоли. При этом увеличивается выраженность эффекторной активности Т-клеток, происходит истощение популяции регуляторных T-клеток, высвобождаются гомеостатические или провоспалительные цитокины 64. Химиотерапевтические агенты также могут делать клетки опухоли более чувствительными к лизису, опосредованному Т-клетками, с помощью fas-, перфорин- и гнанзим B- зависимых механизмов [67,68].
С учетом этих механизмов начали проводить клинические исследования, в которых изучается комбинированное применение химиотерапии и иммунотерапии при злокачественных опухолях верхних отделов желудочно-кишечного тракта. В настоящее время проходит клиническое исследование III фазы, в котором оценивается применение ниволумаба и ипилимумаба, ниволумаба в комбинации с фторурацилом и цисплатином либо в комбинации только с фторурацилом или только с цисплатином [69,70]. Первичными конечными точками в этом исследовании выступают выживаемость без прогрессирования и ОВ у пациентов на поздних стадиях неоперабельного, рецидивирующего или метастатического плоскоклеточного рака пищевода, ранее не получавших противоопухолевую терапию. Также в настоящее время проводятся исследования пембролизумаба, применяемого самостоятельно или в комбинации с химиотерапией, в сравнении с лечением только химиотерапией у пациентов с аденокарциномой желудка или ГЭП в качестве первой линии [70], а также в качестве адъювантной и неоадъювантной терапии [71]. Целью еще одного исследования I/II фазы является оценка безопасности дурвалумаба в комбинации с оксалиплатином/капецитабином при лечении рака с метастазами.
ЛТ является ключевым методом лечения многих форм рака пищевода. Также как и химиотерапия, лучевая терапия в доклинических исследованиях проявляла иммуномодулирующие свойства, задействуя различные механизмы, в том числе образование неоантигенов, увеличение экспрессии провоспалительных цитокинов, которые являются активаторами лейкоцитов, а также активацию иммунных клеток и привлечение их в зону опухолевого микроокружения [72,73]. Было обнаружено, что при воздействии на мышей ионизирующего облучения в микроокружении опухоли активируется экспрессия PD-L1 [74]. Подобное повышение экспрессии PD-L1 подавляет противоопухолевые свойства эффекторных Т-клеток, что говорит о целесообразности комбинации иммунотерапии и ЛТ.
Доклинические модели [63,75,76] дают лишь ограниченное представление об эффектах сочетания ЛТ и иммунотерапии. Проведенный ранее небольшой ретроспективный анализ серии случаев продемонстрировал приемлемую переносимость и некоторое улучшение в ответе на лечение при сочетании иммунотерапии и ЛТ при различных формах заболевания [77,78]. На основе этих данных в настоящее время проводятся клинические исследования с участием пациентов с раком верхних отделов желудочно-кишечного тракта. Пембролизумаб в сочетании с ЛТ изучается для лечения пациентов с метастатическим раком пищевода [79], а также с раком желудка и ГЭП на поздних стадиях [80]. В качестве неоадъювантной терапии пембролизумаб, дурвалумаб, ниволумаб и ипилимумаб изучаются при их сочетании с химиолучевой терапией 82.
И, наконец, открытие опухолевых специфических антигенов позволяет говорить о специфических мишенях для новых видов иммунотерапии, в том числе о применении этих опухолевых специфических антигенов в клеточной терапии аутологичными Т-клетками, которые специфично связываются с данными антигенами у пациентов, опухоли которых их экспрессируют. Два наиболее часто встречающихся антигена, изученных в настоящий момент, которые экспрессируются при раке пищевода, – это ассоциированный с меланомой антиген 3 и NY-ESO-1. В 2017 г. Lu et al. [84] изучали случаи 17 пациентов с метастатическим раком, которые получали лечение с использованием главного комплекса гистосовместимости II – рестриктированного Т-клеточного рецептора, мишенью терапии был ассоциированный с меланомой эмбриональный раковый антиген 3. Пациенты получали лечение на базе противолимфоцитарной подготовительной терапии, после которого проводился адоптивный перенос очищенных CD4+ T-клеток, в которые с помощью ретровируса внедрялся Т-клеточный рецептор к ассоциированному с меланомой антигену 3, плюс системная терапия высокими дозами интерлейкина-2. Из девяти пациентов, которые получили самые высокие дозы, объективный частичный ответ наблюдался у пациента с раком пищевода (продолжительность – 4 месяца) [84]. Следует надеяться, что проходящие в настоящий момент исследования помогут выявить наилучшие сочетания при применении иммунотерапии, химиотерапии и/или лучевой терапии в оптимальных дозах и режимах.
Сигнальный путь PI3K/Akt/mTOR играет важную роль в различных клеточных механизмах, таких как клеточный рост, клеточная пролиферация, трансляция белка и метаболизм. Нарушение регуляции этого пути, компонентом которого являются различные тирозинкиназы, часто наблюдается при многих опухолях. Это послужило основой для разработки разных видов таргетной терапии, которые воздействуют на звенья этого пути. Эти виды терапии испытывались на нескольких видах солидных опухолей, в том числе при раке желудка [85]. Согласно отчету АРГ, в 80% случаев EBV-ассоциированных опухолей и в 42% случаев MSI опухолей имеются мутации PIK3CA. Это дает основания предполагать, что данный сигнальный путь может служить потенциальной мишенью для новых видов терапии рака желудка.
В клиническом исследовании III фазы GRANITE, в котором изучался эверолимус для лечения пациентов с раком желудка на поздних стадиях, ранее получавших противоопухолевую терапию, улучшения выживаемости не происходило; однако в этом исследовании не изучались мутации PIK3CA, наличие мутаций PIK3CA у пациентов не проверялось и отбора пациентов по этому признаку не проводилось [34]. Перспективной тактикой лечения пациентов с раком желудка в будущем может стать предварительное определение мутации PIK3CA и проведение таргетной терапии, направленной на данный сигнальный путь, только пациентам с мутацией PIK3CA. Также в настоящее время для лечения рака желудка исследуются некоторые ингибиторы AKT, например, афуресертиб и AZD5363. Результаты этих исследований ожидаются в скором времени [5].
Важная роль образования новых сосудов в формировании и развитии резистентности злокачественных новообразований хорошо изучена [86]. VEGF, белок, представленный в различных изоформах, является стимулятором роста клеток эндотелия. Он в большом количестве экспрессируется в клетках различных солидных опухолей, особенно в зонах некроза и гипоксии. Гиперэкспрессия биомаркеров – факторов ангиогенеза ассоциируется с более агрессивным течением заболевания, таким образом, эти биомаркеры являются потенциальными мишенями при терапии рака желудка.
Бевацизумаб является анти-VEGF антителом, которое широко применяется при разных видах солидных опухолей, таких как колоректальный рак, рак яичников, рак молочной железы и рак легкого [85,87], однако при раке желудка его клиническая польза по-прежнему не определена. В клинических исследованиях III фазы AVATAR и AVAGAST клинического преимущества бевацизумаба при лечении рака желудка или ГЭП на поздних стадиях выявлено не было [29,30]. Тем не менее, рамуцирумаб, полностью человеческое моноклональное антитело, связывающееся с VEGFR-2, в клинических исследованиях III фазы REGARD [26] и RAINBOW [25] продемонстрировал клиническое преимущество при применении в качестве терапии второй линии у пациентов с раком желудка на поздних стадиях. В исследовании REGARD на фоне монотерапии рамуцирумабом в качестве второй линии терапии наблюдалось повышение ОВ в сравнении с оптимальной поддерживающей терапией. Медиана ОВ составила 5,2 мес. (межквартильный размах – 2,3-9,9 мес.) у пациентов группы рамуцирумаба и 3,8 мес. (межквартильный размах – 1,7-7,1 мес.) у пациентов группы плацебо (HR 0,776; 95% ДИ 0,603-0,998) [26]. В исследовании RAINBOW на фоне лечения рамуцирумабом в комбинации с паклитакселом наблюдалось повышение выживаемости без прогрессирования и ОВ по сравнению с группой лечения плацебо плюс паклитаксел. ОВ была значимо выше в группе лечения комбинацией рамуцирумаб плюс паклитаксел по сравнению с группой плацебо плюс паклитаксел (медиана – 9,6 мес. [95% ДИ 8,5-10,8 мес.] в сравнении с 7,4 мес. [95% ДИ 6,3-8,4 мес.]; HR 0,807; 95% ДИ 0,678-0,962) [25].
ТКИ апатиниб блокирует VEGFR-2. Данный препарат продемонстрировал эффективность и безопасность в клинических исследованиях II и III фазы у пациентов с метастатическим раком желудка или раком желудка на поздних стадиях, с резистентностью к химиотерапии, что позволяет говорить о том, что препарат может потенциально служить терапией третьей или последующих линий [88]. Несмотря на положительные результаты предшествующих исследований, существуют некоторые опасения относительно клинической пользы рамуцирумаба и апатиниба при лечении рака желудка. Небольшое клиническое преимущество наблюдалось при лечении афатинибом (1,8 месяца) и рамуцирумабом (1,4-2,2 месяца), однако, возможно, дальнейшие исследования биомаркеров, комбинированной терапии, результатов секвенирования и поддерживающей терапии обеспечат более значимые результаты таргетной анти-VEGF терапии при раке желудка [89,90].
PARP – это группа ферментов, катализирующих АДФ-рибозилирование различных внутриклеточных белков [91]. Ферменты PARP участвуют в различных клеточных процессах, таких как транскрипция, репликация, рекомбинация и репарация ДНК [92]. Особенно важна их роль в репарации ДНК, поскольку некоторые опухоли, в которых поврежден механизм гомологичной рекомбинации, используют репарацию ДНК, опосредованную PARP, и могут быть чувствительны к ингибированию этого механизма репарации [93]. Ингибирование PARP уже занимает значимое место в лечении BRCA-ассоциированного рака молочной железы и рака яичников и может также играть важную роль в лечении других видов рака, таких как аденокарцинома желудка [94]. При раке желудка обнаруживается повышенная экспрессия PARP-1, что может говорить о более поздней стадии заболевания и менее благоприятном прогнозе.
После получения довольно многообещающих результатов в клиническом исследовании II фазы было проведено клиническое исследование III фазы GOLD, в котором на фоне лечения ингибитором PARP олапарибом значимого увеличения ОВ у пациентов с раком желудка на поздних стадиях, в том числе у группы пациентов с негативным результатом анализа на мутантный белок атаксии-телеангиэктазии, не отмечалось [33]. Возможно, причиной того, что в некоторых исследованиях конечные точки эффективности не были достигнуты, были особенности методов статистического анализа (например, определение статистически значимого p-значения