что такое фосфин в химии
Фосфин
| Фосфин | |||
|---|---|---|---|
| |||
| Систематическое наименование | Фосфин | ||
| Хим. формула | PH3 | ||
| Состояние | газ | ||
| Молярная масса | 34,00 г/моль | ||
| Плотность | 1,379 г/л, газ (25 °C) | ||
| Энергия ионизации | 9,96 ± 0,01 эВ | ||
| Температура | |||
| • плавления | −133,8 °C | ||
| • кипения | −87,8 °C | ||
| Пределы взрываемости | 1,79 ± 0,01 об.% | ||
| Энтальпия | |||
| • образования | 5,4 кДж/моль | ||
| Давление пара | 41,3 ± 0,1 атм | ||
| Растворимость | |||
| • в воде | 31,2 мг/100 мл (17 °C) | ||
| Рег. номер CAS | [7803-51-2] | ||
| PubChem | 24404 | ||
| Рег. номер EINECS | 232-260-8 | ||
| SMILES | |||
| RTECS | SY7525000 | ||
| ChEBI | 30278 | ||
| Номер ООН | 2199 | ||
| ChemSpider | 22814 | ||
| Токсичность | Чрезвычайно токсичен, СДЯВ | ||
| Пиктограммы ECB |   | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
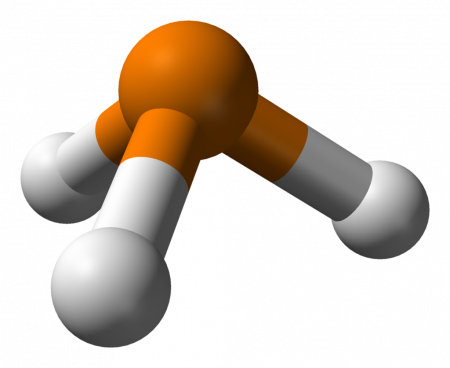
Фосфин (фосфористый водород, фосфид водорода, гидрид фосфора, по номенклатуре IUPAC — фосфан) PH3 — бесцветный ядовитый газ (при нормальных условиях). Чистый фосфин не имеет запаха, но образцы технического продукта обладают неприятным запахом, похожим на запах тухлой рыбы (чеснока).
Содержание
Физические свойства
Бесцветный газ. Плохо растворяется в воде, образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства. При низких температурах образует твёрдый клатрат 8 PH3·46 H2O. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
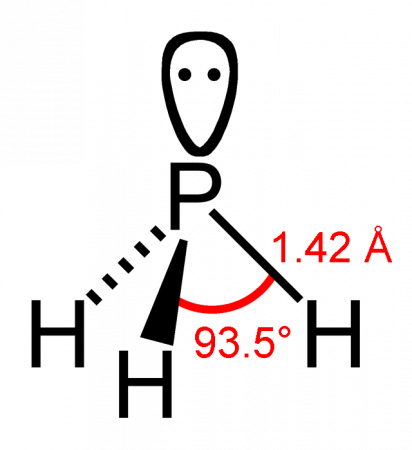
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0,142 нм, ∠HPH = 93,5°). Дипольный момент составляет 0,58 Д, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому по сравнению с аммиаком, фосфин имеет более низкие температуры плавления и кипения.
Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:
Также его можно получить воздействием воды или кислот на фосфиды:
Хлористый водород при нагревании взаимодействует с белым фосфором:
Разложение йодида фосфония:
Разложение фосфоновой кислоты:
или её восстановление:
Химические свойства
Фосфин сильно отличается от своего аналога, аммиака. Его химическая активность выше, он плохо растворим в воде, как основание значительно слабее. Последнее объясняется тем, что связи H−P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s 2 ) ниже, чем у азота (2s 2 ) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
На воздухе горит согласно уравнению:
Проявляет сильные восстановительные свойства:
то возможно протекание следующей реакции:
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4 + (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Соли фосфония, как и сам фосфин, являются сильными восстановителями.
Самовозгорание
Абсолютно чистый и сухой фосфин не способен к самовоспламенению на воздухе и загорается только при температуре 100-150°. Однако фосфин, получающийся, например, при взаимодействии фосфидов с водой всегда имеет примесь дифосфина P2H4, который на воздухе самовоспламеняется. В частности, таким образом могут появляться «блуждающие огни».
Токсичность
Фосфин очень ядовит. Поражает в первую очередь нервную систему, нарушает обмен веществ; также действует на кровеносные сосуды, органы дыхания, печень, почки. Запах фосфина ощущается при концентрации 2—4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ может привести к летальному исходу. ПДК — 0,1 мг/м³.
При остром отравлении фосфином в лёгких случаях беспокоит боль в области диафрагмы, чувство холода, впоследствии может развиться бронхит. При среднетяжёлом отравлении — чувство страха, озноб, рвота, стеснение в груди, удушье, боль за грудиной. В тяжёлых случаях на первый план выходят неврологические симптомы — оглушение, неверная походка, подёргивания в конечностях, мидриаз; cмерть от паралича дыхания или сердечной мышцы может наступить через нескольно дней, а при высоких концентрациях — мгновенно.
Хроническое отравление может привести к расстройству зрения, походки, речи, пищеварения, бронхиту, болезням крови и жировому перерождению печени.
Применение
В 2019 году фосфин был предложен в качестве биосигнатурного газа для поиска жизни на землеподобных экзопланетах, поскольку на Земле он производится анаэробными экосистемами. Слабой стороной фосфина для этой цели является его высокая реакционная способность, что требует большой интенсивности производства этого газа для его детектирования. Для его обнаружения в атмосфере экзопланеты потребуются десятки часов наблюдения телескопа «Джеймс Уэбб».
Фосфин
Действующие вещества
Содержание:
Физико-химические свойства
Чистый фосфин
По другим литературным источникам, фосфин – бесцветный газ, обладающий неприятным запахом. Некоторые соединения с карбаматом аммония формируют запах аммиака, который служит сигнальным агентом.
В водных растворах в реакции с некоторыми кислотами вещество образует нестойкие соли фосфония.
Фосфин имеет низкий молекулярный вес и низкую точку кипения. Он в 1,2 раза тяжелее, чем воздух, поэтому легко смешивается с ним, не наслаиваясь. Молекула фосфина маленькая и неполярная, вследствие чего газ быстро проникает в предметы потребления и сквозь препятствия типа упаковочных бумаг и пленки.
Дегазация (или проветривание) – освобождение продукции, складских и производственных помещений от остатков фумигантов (газов).
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
» data-toggle=»tooltip» data-container=».articleBody» data-placement=»auto» data-html=»true» title=»
Фумигация (газация) – введение пестицида в среду обитания вредного организма в газообразном состоянии.
Подробнее при переходе по ссылке
«>фумигации фосфин быстро выветривается из продукции, практически не оставляя никаких следов.
Восстановитель
Подробнее при переходе по ссылке
» data-toggle=»tooltip» data-container=».articleBody» data-placement=»auto» data-html=»true» title=»
Фумигация (газация) – введение пестицида в среду обитания вредного организма в газообразном состоянии.
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
«>таблетки нужно распределять равномерно и все остатки препаратов следует закапывать.
Физические характеристики
При высоких концентрациях фосфин вызывает коррозию меди, латуни, медных сплавов, драгоценных металлов типа серебра и золота. Может вступать в реакцию с металлическими солями на фотографической пленке. По этой причине фосфин редко используется в строениях с электропроводкой, электрическими приборами, телефонным оборудованием, компьютерами. Вещество не действует на сталь, белую и оцинкованную жесть, хлопчатобумажные и шелковые ткани, дерево, брезент, мешковину.
Пестицид – вещество (или смесь веществ) химического либо биологического происхождения, предназначенное для уничтожения вредных насекомых, грызунов, сорняков, возбудителей болезней растений и животных, а также используемое в качестве дефолианта, десиканта и регулятора роста.
Подробнее при переходе по ссылке
» data-toggle=»tooltip» data-container=».articleBody» data-placement=»auto» data-html=»true» title=»
Пестицид – вещество (или смесь веществ) химического либо биологического происхождения, предназначенное для уничтожения вредных насекомых, грызунов, сорняков, возбудителей болезней растений и животных, а также используемое в качестве дефолианта, десиканта и регулятора роста.
Подробнее при переходе по ссылке
В практике борьбы с вредными организмами используют 3 действующих вещества, выделяющих газ фосфин:
для сельского хозяйства:
Действие на вредные организмы
Фосфин высокотоксичен для насекомых и животных.
Механизм действия пестицидов – совокупность и последовательность биохимических, физиологических и других процессов, протекающих на молекулярном, клеточном и субклеточном уровнях и приводящих к нарушению нормальной жизнедеятельности вредного организма и его гибели.
Подробнее при переходе по ссылке
Резистентность (от латинского resistento-сопротивляемость) – устойчивость различных организмов к химическим и биологическим препаратам.
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
Популяции Зернового точильщика (Rhyzoperthadominika), резистентые к фосфину, обнаружены в Индии, ОАР, Сирии, Гвинеи, Ливии, Аргентине, Греции. Наличие резистентных популяций этого вредителя к фосфину в 90-х годах ХХ века было подтверждено в Азии и Австралии, а также в Индии. Уровни Резистентность (от латинского resistento-сопротивляемость) – устойчивость различных организмов к химическим и биологическим препаратам.
Подробнее при переходе по ссылке
«>резистентности популяций Зернового точильщика устаналивали по имагинальной стадии. В экспериментах индийских исследователей было показано, что у резистентной популяции Зернового точильщика устойчивыми к действию фосфина оказались и Яйцо у членистоногих – форма развития, при которой зародыш развивается под защитой яйцевых оболочек вне организма матери.
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
«>яиц чувствительной расы и резистентной популяции составляли, соответственно, 0,56 и 3,25 г/л зерновой массы.
Подробнее при переходе по ссылке
«>вредителями зерновых запасов при хранении являются сеноеды Psocoptera, особенно Liposcelis entomophila, Liposcelis bostrychophila, Liposcelis decolor. Для борьбы с этими Вредитель – это организм, повреждающий растения, продукты, животных, вещи, угрожающий здоровью человека.
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
» data-toggle=»tooltip» data-container=».articleBody» data-placement=»auto» data-html=»true» title=»
Фумигация (газация) – введение пестицида в среду обитания вредного организма в газообразном состоянии.
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
«>резистентность сеноедов к фосфину. Для ее преодоления рекомендовано применение комбинации спиносада с хлорпирифосметилом. Эта смесь была эффективна в течение трех месяцев.
Резистентность (от латинского resistento-сопротивляемость) – устойчивость различных организмов к химическим и биологическим препаратам.
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
» data-toggle=»tooltip» data-container=».articleBody» data-placement=»auto» data-html=»true» title=»Фумигант (от латинского fumigo–окуривать, дымить) – пестицид, химическое вещество, проникающее в организм насекомых и животных через дыхательные пути в виде газа.
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
» data-toggle=»tooltip» data-container=».articleBody» data-placement=»auto» data-html=»true» title=»
Фумигация (газация) – введение пестицида в среду обитания вредного организма в газообразном состоянии.
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
» data-toggle=»tooltip» data-container=».articleBody» data-placement=»auto» data-html=»true» title=»
Родентицид – химическое средство для борьбы с грызунами.
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
«>отравления у грызунов начинают проявляться через 1-3 часа после поедания приманки, поэтому поедание прекращается. Грызуны, не успевшие принять Летальная (смертельная) доза (или ЛД) – это доза пестицида, вызывающая гибель подопытного объекта.
Подробнее при переходе по ссылке
«>летальную дозу, остаются живыми и в дальнейшем избегают любых приманок.
Фосфин
Фосфин
Нажмите на фотографию для увеличения
Фосфин – газ, выделяется из фосфидов магния, алюминия и цинка, применяется в практике фумигации помещений, продукции и сырья против вредных членистоногих, а также для борьбы с вредными грызунами.
Содержание:
Физико-химические свойства
Чистый фосфин
По другим литературным источникам, [6] фосфин – бесцветный газ, обладающий неприятным запахом. Некоторые соединения с карбаматом аммония формируют запах аммиака, который служит сигнальным агентом. [6]
В водных растворах в реакции с некоторыми кислотами вещество образует нестойкие соли фосфония. [6]
Фосфин имеет низкий молекулярный вес и низкую точку кипения. Он в 1,2 раза тяжелее, чем воздух, поэтому легко смешивается с ним, не наслаиваясь. Молекула фосфина маленькая и неполярная, вследствие чего газ быстро проникает в предметы потребления и сквозь препятствия типа упаковочных бумаг и пленки.
Дегазация
Восстановитель
Физические характеристики
При высоких концентрациях фосфин вызывает коррозию меди, латуни, медных сплавов, драгоценных металлов типа серебра и золота. Может вступать в реакцию с металлическими солями на фотографической пленке. По этой причине фосфин редко используется в строениях с электропроводкой, электрическими приборами, телефонным оборудованием, компьютерами. [14] Вещество не действует на сталь, белую и оцинкованную жесть, хлопчатобумажные и шелковые ткани, дерево, брезент, мешковину. [7]
Выделение фосфина
Таблетка алюминия фосфида (слева) и образовавшийся через 3 суток оксид аллюминия (справа).
Пестициды на основе фосфина
В практике борьбы с вредными организмами используют 3 действующих вещества, выделяющих газ фосфин:
для сельского хозяйства:
закончился срок регистрации:
Действие на вредные организмы
Фосфин высокотоксичен для насекомых и животных. [14]
Механизм действия
Резистентность у насекомых
Популяции Зернового точильщика (Rhyzoperthadominika), резистентые к фосфину, обнаружены в Индии, ОАР, Сирии, Гвинеи, Ливии, Аргентине, Греции. Наличие резистентных популяций этого вредителя к фосфину в 90-х годах ХХ века было подтверждено в Азии и Австралии, а также в Индии. Уровни резистентности популяций Зернового точильщика устаналивали по имагинальной стадии. В экспериментах индийских исследователей было показано, что у резистентной популяции Зернового точильщика устойчивыми к действию фосфина оказались и яйца. Так, ЛД99 фосфина для яиц чувствительной расы и резистентной популяции составляли, соответственно, 0,56 и 3,25 г/л зерновой массы. [11]
В Австралии серьезными вредителями зерновых запасов при хранении являются сеноеды Psocoptera, особенно Liposcelis entomophila, Liposcelis bostrychophila, Liposcelis decolor. Для борьбы с этими вредителями применяется фумигация фосфином. В начале ХХI века зарегистрирована резистентность сеноедов к фосфину. Для ее преодоления рекомендовано применение комбинации спиносада с хлорпирифосметилом. Эта смесь была эффективна в течение трех месяцев. [11]
Резистентность у грызунов
Осторожно — фосфин!
Э. С. Илларионова,
агрохимик, кандидат сельскохозяйственных наук (Дом ученых Пущинского научного центра РАН)
«Экология и жизнь» №6, 2008
Рассказ о газообразных соединениях фосфора, и прежде всего о фосфине, наверное, стоило бы начать со слов: «мерцающий свет, появляющийся на болотах (знаменитые «блуждающие огни») — результат самопроизвольного воспламенения фосфина». Ну а следующее определение — уже энциклопедического толка: «фосфин, или фосфористый водород (PH3) — это бесцветный газ с неприятным запахом (гниющей рыбы, чеснока или промышленного карбида), ядовит, образуется при биохимическом восстановлении эфиров фосфорной кислоты, преимущественно в анаэробных условиях, т. е. без доступа кислорода».
Соединения фосфора в природе
В природе встречается множество и других газообразных фосфорорганических соединений, в молекулах которых атом фосфора P соединен с атомом углерода C. Их насчитываются тысячи. Многие из них входят в состав экосистем, в том числе в живые клетки растений и микроорганизмов. Самая большая группа соединений со связями C–P открыта лет пятьдесят назад именно в живых объектах.
Есть в почвах и фосфонаты — производные фосфорорганических соединений с сохранившимися связями C–Р. Их, правда, немного, не более 1–2% от содержащегося в органике фосфора, поэтому на пашне их можно выявить далеко не всегда, зато в болотистых почвах и на лугах их содержание повышается до 3–4%.
В обычных (аэробных) условиях природные соединения органического и минерального фосфора — это фосфаты (ортофосфаты). Их существует великое множество. Для органических фосфатов характерна связь C–О–Р, иными словами, углерод и фосфор соединяются через атом кислорода.
Одна из удивительных загадок природы состоит в том, что органические фосфаты в живых системах (например, в водорослях и микроорганизмах) синтезируются и разлагаются не произвольно, а по правилу «золотого сечения», подчиняясь определенному закону, описываемому знаменитым рядом чисел Фибоначчи (1, 1, 2, 3, 5, 8. ), в котором каждый следующий член равен сумме двух предыдущих. Гармония природы непостижимым образом проявляется здесь в накоплении и расходовании в экосистемах энергии и вещества (в частности, фосфора), описываемых соотношением, которое приближенно дается классическим коэффициентом «золотого сечения» 1,618 (5/3, 8/5, 13/8 и т. д.), т. е. 62% упомянутых соединений должно связываться и аккумулироваться и только 38% — разрушаться или улетучиваться. Эти закономерности сказываются в дальнейшем и на накоплении гумуса, и на круговороте фосфора и азота, и на газообразных потоках, определяемых выбросами и «стоками» углекислого газа СО2, и на «дыхании» почвы (выделении СО2 и усвоении кислорода О2). На самом деле в природе наблюдаются колебания числовых значений этого соотношения в пределах 1,3–1,7. Но, как не раз отмечалось в трудах автора и других ученых, гораздо страшнее оказывается то, что главной причиной отклонений и даже нарушения этой закономерности стала антропогенная деятельность.
Некоторые специалисты уже обратили внимание на то, что нас могут подстерегать новые опасности, если это отношение стремится к единице, т. е. накопление и разложение идут с одинаковой интенсивностью, как это происходит, например, в цикле углерода, где за счет «вмешательства» мировой экономики океан и биосфера поглощают ныне лишь половину выбросов углерода (а надо бы 62%).
Применение, свойства, опасности
Для фумигации (избавления хранилищ зерна и сельскохозяйственной продукции от клещей и иных вредителей) обычно используют фосфиды, в частности, соединения фосфора с металлами. Реагируя с влагой воздуха, фосфиды выделяют фосфин. Содержащие фосфиды таблетки и ленты раскладывают в хранилищах из расчета 9 г/т зерна или другой подлежащей долгому хранению продукции, добавляют их даже в яблоки. Считается, что при проветривании фосфин улетучивается, хотя по имеющимся в научной литературе данным в фуражном зерне поглощается до 13% ядовитого газа. Разве одно это обстоятельство не должно заставить относиться к такой «дезинфекции» с предельной осторожностью?!
Ныне для фумигации зерна при транспортировке и хранении разрешены к применению два соединения — метилбромин и метилфосфин, причем первое на порядок менее токсично (и эффективно), чем второе. Применяя последнее, молчаливо предполагают, что ядовитый фосфин после поглощения содержимым хранилища чудесным образом извлекается и улетучивается, отравив лишь клещей и других вредителей. Похоже, раньше было не принято задумываться над тем, насколько эта картина соответствует действительности. Между тем еще почти полвека назад было установлено, что метилфосфин (смесь двух газов — метана СН4 и фосфина РН3) чрезвычайно токсичен, почти как сам фосфин.
Метан и фосфин в биосфере
Это довольно опасная тенденция, особенно если принять во внимание, что на долю нашей страны приходится 2/3 всех болот на Земле. Наши площади заболоченных земель превышают площадь всех сельскохозяйственных угодий: по данным на 2003 года, 343 млн га болот (из них не поросших лесом — 130 млн га) и 221 млн га сельскохозяйственных угодий (из них 123 млн га пашни).
А вот как оценили выделение метана сотрудники МГУ в 2007 году по результатам измерений на болотах в Томской области. По их оценкам, среднее значение величины потока метана составляло около 10 мг/м 2 за час. В летний период за сутки может выделяться 2,4 кг/га, за сезон (6 месяцев) 432 кг/га. А со 130 млн га болот — почти 60 млн т. На окисление такого количества метана потребуется вдвое больше кислорода — 120 млн т.
Это упущение объясняется, в частности, тем, что лишь немногие специалисты знают о методах, позволяющих измерить содержание в атмосфере фосфора в газообразном состоянии. Ведь даже в научном мире до сих пор бытует мнение, что фосфор в природе существует преимущественно в форме фосфатов и после гидролиза связей Р–О–Р, Р–О–С и даже Р–С превращается в твердое вещество. Потоки фосфора в атмосферу в виде летучих соединений типа РН3 считаются ничтожными и ими пренебрегают. Определение содержания фосфора, поступившего в атмосферу с фосфином, лишь привычными методами, используемыми для выявления фосфора в твердых соединениях, заметно искажает реальную картину круговорота фосфора в экосистемах. При этом игнорируется появление в атмосфере ядовитого и самовозгорающегося фосфина.
Фосфиновая угроза: простые оценки
Между тем простейшую количественную оценку выделения фосфина в экосистемах можно получить, изучая затопленные водой территории, имитирующие заливные луга или рисовые чеки. Как было установлено в проведенной еще в 1926 году в Московской сельскохозяйственной академии им. К. А. Тимирязева серии из шести опытов, выполнявшихся в строго контролируемых условиях, в газовую форму (фосфин) переходит 9,7 мг фосфора из 1 кг почвы за час. Не слишком сложный расчет дает 2,13 кг/га за сутки. Но ведь это почти столько же, сколько выделяется метана из болот! Стало быть, за сезон получаем 383 кг/га, а со всей площади безлесных болот (130 млн га) — около 50 млн т РН3. На его окисление до фосфорной кислоты по формуле
потребуется, как нетрудно видеть, вдвое больше кислорода — почти 100 млн т (для метана эти значения составляли 60 и 120 млн т соответственно).
Косвенным подтверждением выделения фосфина из почв служат и исследования потоков фосфора на рисовых чеках — от посадки до уборки урожая потери фосфора в затопленных почвах в 3–8 раз превышают его содержание в зерне и соломе. Максимальный вынос Р2O5 достигает 100 кг/га. Из почв органических соединений фосфора выводится в 4 раза больше, чем запасается в растениях. Общие потери фосфора из верхнего (20 см) слоя почв, по разным оценкам, составляют 960–2940 кг/га. Есть данные, свидетельствующие о том, что при выращивании риса на затопленных чеках в течение 32 лет из почвы теряется больше половины гумуса, а с ним, конечно же, выносятся азот и фосфор.
Это может происходить и за счет выделения их газообразных форм — аммиака (NH3) и фосфина (РН3). Давно известно, что по химическим свойствам они представляют собой химические структурные аналоги. Повторюсь, определение фосфора и азота только в минеральной форме, игнорирование газовых составляющих не отражает истинных процессов в экосистемах, особенно в анаэробных условиях. В частности, прямое подтверждение того, что в экосистемах болот вместе с метаном выделяется и фосфор, получено в недавних исследованиях. **
Возвращаясь же к рассуждениям о возможной недооценке содержания фосфина в атмосфере, следует заметить, что вполне ощутимый вклад могут вносить не только болота Севера или тропиков, но и обширные рисовые плантации (прежде всего в Индии, Китае, Японии и странах Юго-Восточной Азии).
В научной литературе встречаются данные о том, что с осадками на землю выпадает до 3,5 кг/га фосфора. Иными словами, это примерно лишь 1% того фосфора, который, по имеющимся оценкам, выносится из болотных систем или затапливаемых почв фосфином в атмосферу (383 кг/га), остальные 99%, похоже, быстро окисляются, осаждаются или разлагаются (например, в результате гидролиза) в приземных слоях воздуха, литосфере и биосфере, обеспечивая перераспределение фосфора на поверхности земли.
По результатам измерений на упомянутой выше метеостанции Териберка было установлено, что в 1990 году в атмосферу с территории России было выброшено 48,8 млн т метана (напомним, наши оценки для всей площади безлесных болот составили около 60 млн т). За 1996–2003 гг. самая высокая концентрация была зафиксирована именно в 2003 году. Этот год был самым теплым для всей России, особенно же это относилось к лету и осени в зонах болот и тундры (Якутия, Западная Сибирь) — в среднем температура здесь оказалась выше многолетней почти на 6°С. В этих условиях одновременно наблюдалось и летнее снижение содержания верхового озона O3 над Севером России на 5–10%. А ведь летом и здесь ускоряются процессы фотосинтеза и образования кислорода. Поэтому очевидно, что для окисления возросшего количества метана и фосфина в условиях теплого 2003 года здесь интенсивно расходовался озон.
От фосфина к кислороду: немного статистики и философии
Не секрет, что из-за богатейших биоресурсов Россию уже привыкли считать всемирным донором кислорода. По оценкам специалистов, над ее территорией ежегодно формируется 8130 млн т O2. Думается, мы не слишком погрешим против истины, предположив, что и процесс фотосинтеза, ответственный за формирование этой массы кислорода, подчиняется упомянутому «закону всемирной гармонии» — правилу «золотого сечения». Ведь на образование 1 т органики при фотосинтезе тратится 1,47 т углекислого газа, 0,6 т воды и 3,84 Гкал солнечной энергии и при этом выделяется 1,07 т кислорода. Соотношение между количеством поглощенного СO2 и выделенного O2 (1,47 : 1,07) не так уж отличается от «золотого».
По некоторым опубликованным оценкам, потребление кислорода в России (дыхание, сжигание топлива и другие промышленные нужды) составляет 2784 млн т. Тогда его «производство» Россией превышает ее расход на 5346 млн т. Но в других расчетах, где учтено потребление кислорода микрофлорой (прежде всего почвы) на «дыхание», российский избыток выработки кислорода над его потреблением оказывается уже на порядок ниже — 560 млн т. Между тем, как считают некоторые исследователи, «дыхание» почвы регулируется своим правилом «золотого сечения», определяющим соотношение выделяемого микрофлорой углекислого газа и потребляемого кислорода. На целине значение этой величины близко к 1,58, а на пашне колеблется в пределах 1,3–1,75 — иными словами, кислород в процессе «дыхания» почвы расходуется «экономно» (42–37%), а углекислого газа выделяется больше (58–63%). Если исходить из среднего значения «золотого сечения» 1,52 для соотношения СO2 : O2, то при эмиссии СO2 из почв России 10 409 млн т кислорода на «дыхание» российских почв потребляется еще 6848 млн т (оценки 2004 года по данным сотрудников Института фундаментальных проблем биологии РАН, в частности В. Н. Кудеярова).
Своеобразная «золотая пропорция» соблюдается и между стоком СO2 и его эмиссией в масштабе России. Соотношение между стоком, составляющим 4450 млн т за год (в пересчете на углерод), и эмиссией (2800 млн т — в тех же единицах) оказывается равным 1,59, т е. удивительно близко к «золотому». Что ж, пока над Россией в целом нет избытка СO2, наши экосистемы поглощают больше, чем мы выбрасываем, наши леса нас спасают и покрывают «грехи» наши. Но в последние годы (прежде всего на Севере) все чаще отмечается, что экосистемы не справляются с «планом» по поглощению и отмеченное соотношение нарушается.
Впрочем, гораздо важнее, что, как следует из ряда оценок, на территории России общий расход кислорода за год на наши нужды (2784 млн т), дыхание почвы (6848 млн т) и окисление метана и фосфина (220 млн т) приближается к 10 млрд т, а это почти на 2 млрд т больше, чем его вырабатывают все наши леса. И этот печальный баланс представляется мне гораздо более серьезной проблемой, чем ожидаемая торговля квотами. Ради сохранения окружающей среды и биосферы планеты, ресурсов которой мы сегодня расходуем на 25% больше, чем они успевают восстанавливаться, нужно наконец осознать, что без ограничения потребления нам и нашим потомкам просто не выжить. И не в последнюю очередь это касается кислорода. В атмосфере его вроде бы немало (21%), но нельзя допускать, чтобы на Земле его потреблялось больше, чем вырабатывается.
Подводя итоги
Не секрет, что за последние 100 лет в результате бездумной деятельности человека и игнорирования им законов природы выбросы углекислого газа в атмосферу (и его содержание там), по разным оценкам, выросли на 25–35%. Одним из плохо просчитываемых последствий глобального потепления может стать резкая интенсификация биохимических процессов в природных зонах болот и вечной мерзлоты. При этом может резко возрасти выделение не только метана (это уже почти очевидно), но и мало изученных по влиянию на биосферу газов: аммиака, силана и фосфина, которым для окисления и нейтрализации потребуется немало кислорода. А ведь есть еще и не вполне проанализированные эффекты обратной связи (например, более интенсивное выделение метана ускорит дальнейший рост концентрации СO2 в атмосфере, что, в свою очередь, может привести к резкому замедлению фотосинтеза). Как следует из недавних исследований, в 90-х годах прошлого века заметно ослабла компенсирующая роль фотосинтеза в бореальных лесах. А ведь прежде было твердо установлено, что деревья на всех широтах достоверно способствовали фотосинтезу и ассимиляции СO2. Опасная тенденция! И примеры подобных «метаморфоз» лесов множатся год от года.
В настоящее время мы почти ничего не знаем о выделении и окислении не раз упоминавшегося в этой статье силана (SiH4). Между тем все болотные растения, злаки и микроорганизмы богаты органическим кремнием. В торфе верховых болот — 43% SiO2, переходных — 28%, низинных — 21%. Пока есть лишь отрывочные данные о том, что силан в соединении с фосфином образует недостаточно исследованные комплексы — силилфосфины. Процессы выделения силана, его окисления и соединения с другими элементами нуждаются в серьезном изучении.
И в заключение — выглядящий фантастическим сюжет, который должен заставить задуматься всех, кто еще не утратил эту способность. В приземном слое атмосферы в связи со стремительным ростом содержания углекислого и некоторых других «мертвых» газов в обозримом будущем может возникнуть нехватка кислорода не только из-за замедления фотосинтеза, роста потребления на окисление, сжигание и дыхание, но и из-за «экрана» ядовитых газов, мешающего притоку O2 из более высоких слоев атмосферы.
Миллиарды лет основой всего живого на Земле был фотосинтез, исправно снабжавший планету кислородом. Увы, как справедливо отмечают некоторые исследователи, современная цивилизация впервые в истории, похоже, ухитрилась замедлить пополнение атмосферы кислородом, а природу довела до точки бифуркации. Выдержит ли она?