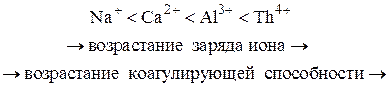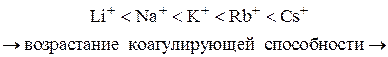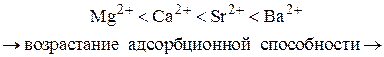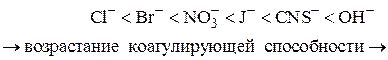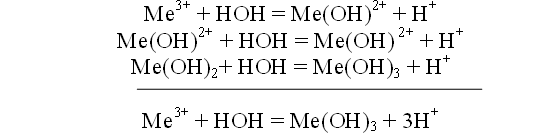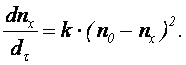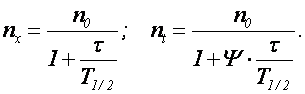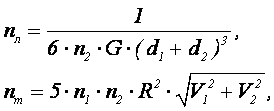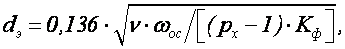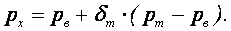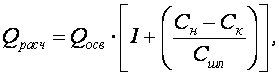Что такое порог коагуляции
Что такое порог коагуляции
1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию.
Минимальная концентрация электролита, вызывающая коагуляцию золя за определённый короткий промежуток времени, называется порогом коагуляции.
2. Коагулирующим действием обладает не весь электролит, а только тот ион, заряд которого совпадает по знаку с зарядом противоионов мицеллы лиофобного золя (заряд коагулирующего иона противоположен заряду коллоидной частицы). Этот ион называютионом – коагулянтом.
3. Коагулирующая способность иона – коагулянта тем больше, чем больше заряд иона. Количественно эта закономерность описывается эмпирическим правилом Шульце – Гарди, а теоретически обоснованную связь между зарядом коагулирующего иона и порогом коагуляции дает теория Дерягина – Ландау.
Следовательно, коагулирующая способность трёхзарядного иона в 729 раз выше коагулирующей способности однозарядного иона.
В настоящее время установлены отклонения от правила Шульце – Гарди – Дерягина – Ландау (правило значности). На порог коагуляции кроме заряда оказывают влияние радиус коагулирующего иона, способность к адсорбции и гидратации, а также и природа иона, сопутствующего коагулирующему.
4. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус.
Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке:
Ag + > Cs + > Rb + > NH 4 + > K + > Na + > Li +
Эмпирические правила электролитной коагуляции



1. Все без исключения сильные электролиты при определенной концентрации могут вызвать коагуляцию коллоидного раствора.
2.Правило знака заряда: коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы. Этот ион электролита называют ионом-коагулятором.
3. Каждый электролит по отношению к коллоидному раствору обладает порогом коагуляции.
Порог коагуляции (γ, Скр) – некоторая минимальная (критическая) концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя:
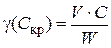
где 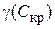
Коагулирующая способность (сила) электролита (P) – величина, обратно пропорциональная порогу коагуляции:
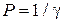
4.Влияние заряда (валентности) иона коагулятора (правило Шульце – Гарди).Коагулирующая способность электролита возрастает с увеличением валентности иона-коагулятора.
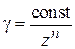
где 
5. Коагулирующая сила ионов-коагуляторов одной и той же валентности возрастает с увеличением радиуса иона-коагулятора (лиотропные ряды).
Пример 5.3.Золь гидроксида цинка получен путем сливания растворов ZnCl2 и NaOH. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции растворов электролитов следующие:
| Электролит | Na2SO4 | Mg(NO3)2 | Na3PO4 | NaCl |
| γ, моль/л | 0,05 | 3,0 | 0,004 | 3,0 |
Запишем строение мицеллы:
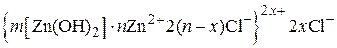
Пример 5.4.Золь иодида серебра получен сливанием растворов KI и AgNO3. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции растворов электролитов следующие:
| Электролит | KCl | KNO3 | Ba(NO3)2 | La(NO3)3 |
| γ, моль/л | 5,2 | 5,1 | 0,08 | 0,007 |
Запишем строение мицеллы:
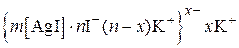
Пример 5.5.Золь гидроксида алюминия получен путем сливания растворов AlCl3 и NaOH. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции электролитов следующие:
| Электролит | Na2SO4 | Mg(NO3)2 | Na3PO4 | NaCl |
| γ, моль/л | 0,011 | 0,70 | 0,001 | 0,70 |
Решение. Определим знак заряда частиц золя. У Mg(NO3)2 и NaCl одинаковые пороги коагуляции, одинаковый заряд аниона, но разный заряд катиона. Следовательно, коагуляцию золя вызывают анионы электролитов.
Запишем строение мицеллы:
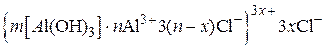
5.3. Теория устойчивости
лиофобных дисперсных систем ДЛФО
В процессе развития коллоидной химии возникало много теорий, авторы которых пытались связать устойчивость гидрофобных золей, в частности коагулирующее действие электролитов, с теми или иными параметрами системы и явлениями, возникающими при взаимодействии дисперсной фазы с дисперсионной средой.
Каждая из теорий (химическая, адсорбционная, электростатическая и др.) объясняла только ряд факторов, но оказывалась бессильной перед множеством других факторов, т.к. все эти теории носили, в основном, односторонний характер и связывали сложный процесс коагуляции с каким-либо одним параметром системы.
Современная физическая теория устойчивости была предложена Б.В. Дерягиным, совместно с Л.Д. Ландау (1937–1941 гг.). Несколько позже теоретическая разработка, почти аналогичная и приводящая к тем же результатам, была осуществлена независимым путем Е. Фервеем и Дж. Овербеком. Поэтому, современная теория устойчивости обозначается в литературе как теория ДЛФО (DLFO).
Современная теория устойчивости ДЛФО рассматривает процесс коагуляции как результат совместного действия Ван-дер-Ваальсовых сил притяжения и электростатических сил отталкивания между частицами. В зависимости от баланса этих сил в тонкой прослойке жидкости между сближающимися частицами возникает «расклинивающее давление».
Коагуляция (дисперсная система)
Из Википедии — свободной энциклопедии
Коагуляция ведёт к выпадению из коллоидного раствора осадка или к застудневанию. Коагуляция может быть как самопроизвольной (старение) с расслаиванием коллоидного раствора на твёрдую фазу и дисперсную среду и достижением состояния минимальной энергии, так и искусственно вызванной с помощью специальных реактивов (коагулянтов или флокулянтов).
Коагуляция — это процесс уменьшения степени дисперсности и числа частиц дисперсной системы путём слипания первичных частиц. В результате коагуляции обычно происходит выпадение (седиментация) дисперсной фазы или хотя бы изменение свойств первичной дисперсной системы.
Коагуляционные структуры образуются при потере дисперсной системой агрегативной устойчивости, при достаточном содержании дисперсной фазы обеспечивается армирование всего объема дисперсной системы. Соответствующее содержание коллоидно-дисперсной фазы, способное «отверждать» жидкую дисперсную среду, может быть очень малым (особенно в случае резко анизометрических частиц), например всего лишь несколько процентов по массе для бентонитовых глин, и еще значительно меньше для нитевидных частиц.
Характерным свойством коагуляционных структур наряду с относительно невысокой прочностью является их обратимость по отношению к механическим воздействиям — способность к самопроизвольному восстановлению после механических разрушений (в подвижной дисперсной среде); это свойство называют тиксотропией. Коагуляционные дисперсные структуры образуются пигментами и наполнителями лаков, красок, полимеров. Характерный пример тиксотропных структур — это пространственные сетки, возникающие в дисперсиях глин при их коагуляции под действием электролитов.
Теория коагуляции (М. Смолуховский) развита на основе следующих представлений: частицы дисперсной фазы совершают независимое друг от друга броуновское движение до тех пор, пока при сближении двух частиц расстояние между их центрами не делается равным так называемому радиусу сферы влияния d. Эта величина приблизительно равна сумме радиусов частиц, что соответствует их непосредственному контакту. На этом расстоянии появляются (сразу, скачком!) силы взаимодействия между частицами, в результате чего создается возможность их агрегирования. В результате коагуляции происходит взаимодействие только двух частиц, так как вероятность столкновения большего числа частиц очень мала. Таким образом, сталкиваются одиночные частицы, образуя двойные, одиночные с двойными, двойные друг с другом, тройные с одиночными и т. д. Такое представление процесса коагуляции позволяет формально свести его к теории бимолекулярных химических реакций.
Что такое порог коагуляции
Разработка и внедрение программ, направленных на защиту окружающей среды и сохранение флоры и фауны водоемов, проходят в каждом регионе. Предприятия, осуществляющие слив сточных вод в естественные водоемы, несут бремя ответственности, а соблюдение ими правил организации стоков, очистки и обеззараживания загрязненной и бывшей в использовании воды контролируются на правительственном уровне. Именно поэтому вопросу выбора наиболее эффективной, безопасной и надежной системы очистки сточных вод уделяется особое внимание.
Метод коагуляции – новое направление в очищении и обеззараживании сточных вод. Сегодня существует несколько методов очищения загрязненных сточных вод, среди которых особую популярность получил коагуляционный метод очистки воды, относящийся к категории химических, не представляющий угрозы природе. Коагуляция воды направлена на качественную очистку подвергающихся обработке и переработке жидкостей, которые используются на промышленных объектах. Проведенное очищение и обеззараживание загрязненной воды позволяет вторично ее использовать или осуществлять сброс в реки, не нанося вред окружающей среде, живой флоре и фауне, что особенно важно сегодня, когда вопросам экологии и сохранения природных ресурсов уделяется столько внимания. Основная задача системы очистки стоков – удаление загрязнений, для которых подбирается строго определенный коагулянт для очистки воды с целенаправленным действием. Коагуляция позволяет эффективно очистить сточные воды с использованием специальных реагентов, нахождение в воде которых впоследствии не приведет к нарушению микрофлоры природного водоема, куда идет слив сточных вод предприятия.
Важнейшие экспериментальные факты, способные служить базой для построения теории коагуляции базируются на многообразии причин, вызывающих коагуляцию, на коагулирующем действии электролитов, на влиянии величины заряда иона-коагулятора [1–6].
Установленные закономерности коагуляции нашли свое выражение в правиле Шульце-Гарди, высказанном еще в конце XIX века [1–6].
В ходе развития представлений об устойчивости и механизмах коагуляции гидрофобных коллоидов растворами электролитов возникло много теорий, которые пытались объяснить три вопроса [1–5]:
1) почему коагуляция наступает при определенной концентрации электролита-коагулятора;
2) почему при этом основную роль играет концентрация иона, несущего заряд, противоположный заряду частицы;
3) почему влияние заряда иона-коагулятора подчиняется закономерности, выраженной правилом Шульце-Гарди.
Все теории коагуляции в основном подразделяются на адсорбционные и электростатические [1–6]. Современная физическая теория устойчивости и коагуляции коллоидных систем была развита Б.В. Дерягиным и Л.Д. Ландау (1937), Э. Фервеем и Я. Овербеком (1941). В соответствии с первыми буквами фамилий авторов теория носит название ДЛФО. Согласно этой теории, между любыми частицами при их сближении возникает расклинивающее давление разделяющей жидкой прослойки в результате действия сил притяжения и отталкивания. Состояние системы зависит от баланса энергии притяжения и энергии отталкивания. Преобладание энергии отталкивания приводит к устойчивости системы. Преобладание энергии притяжения вызывает нарушение агрегативной устойчивости, т.е. коагуляцию [1, 5, 6].
Коагуляция сложный процесс, который зависит как от природы золя, так и от природы коагулирующих электролитов. Настоящая работа посвящена изучению закономерностей и механизма коагуляции под действием индифферентных электролитов на примере коллоидной системы – золя Fe(OH)3.
Васильевым С.Е. выполнена экспериментальная часть работы и изучен механизм коагуляции.
Коагуляция гидрофобных золей. Факторы, вызывающие коагуляцию
Лиофобные дисперсные системы (золи, суспензии, эмульсии) агрегативно неустойчивы, поскольку обладают избытком поверхностной энергии Гиббса. Процесс укрупнения частиц (коагуляция) протекает самопроизвольно, так как он ведет к уменьшению удельной поверхности и снижению поверхностной энергии Гиббса. Коагуляция представляет собой процесс слипания (или слияния) частиц дисперсной фазы при потере системой агрегативной устойчивости [1–6].
При коагуляции изменяются физико-химические свойства систем: появляется мутность, снижается осмотическое давление, изменяются электрическая проводимость и характер вязкости. На изменении физико-химических свойств основаны методы наблюдения и изучения процесса коагуляции.
Фактором, вызывающим коагуляцию, может быть любой агент, нарушающий агрегативную устойчивость системы, например изменение температуры (сильное нагревание или охлаждение вплоть до замораживания), механическое воздействие (интенсивное встряхивание, перемешивание, перекачивание по трубам), действие света и различного рода излучений, действие электрических зарядов. Однако наиболее важным фактором является действие электролитов. Электролиты, добавляемые к золям, чрезвычайно быстро и резко влияют на толщину ДЭС и на z-потенциал, являющийся одним из главных факторов устойчивости гидрофобных коллоидных систем.
Коагуляция под действием электролитов. Правило Шульце-Гарди
Наблюдения Г. Шульце (1882) показали, что коагулирующей способностью обладает один из ионов добавляемого электролита (ион-коагулятор). Коагулирующая способность иона-коагулятора возрастает с увеличением его заряда (правило Шульце). Несколько позже М.Гарди (1900) нашел, что заряд коагулирующего иона всегда противоположен заряду коллоидной частицы (правило Гарди). Следовательно, коагуляцию отрицательного золя вызывают катионы добавленного электролита. Для золя с положительно заряженными частицами ионами-коагуляторами являются анионы [1–6].
Закономерности, найденные Шульце и Гарди и подтвержденные многочисленными исследователями, известны как правило Шульце-Гарди: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы; коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора (правило значности).
Порогом коагуляции (g) называют наименьшее количество электролита, необходимое для коагуляции 1 м3 золя. Его выражают в ммоль/л или моль/л.
Для расчета порога коагуляции достаточно умножить концентрацию электролита с (кмоль/м3) на объем его раствора, вызвавшего коагуляцию, V (м3), и произведение разделить на взятый объем золя W (м3):
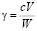
Глава 1. Основы очистки сточных вод
5. Физико-химические процессы очистки сточных вод
5.1. Коагуляция
Коагуляция – это слипание частиц коллоидной системы при столкновениях в процессе теплового движения, перемешивания или направленного перемешивания во внешнем силовом поле. В результате коагуляции образуются агрегаты – более крупные (вторичные) частицы, состоящие из скопления мелких (первичных) частиц. Первичные частицы в таких агрегатах соединены силами межмолекулярного взаимодействия непосредственно или через прослойку окружающей (дисперсной) среды. Коагуляция сопровождается прогрессирующим укрупнением частиц и снижением их общего числа в объеме дисперсной среды. Слипание однородных частиц называется гомокоагуляцией, а разнородных – гетерокоагуляцией.
Производственные сточные воды в большинстве случаев представляют собой слабоконцентрированные эмульсии или суспензии, содержащие коллоидные частицы размером 0,003-0,1 мкм, мелкодисперсные частицы 0,1-10 мкм, а также частицы размером 10 мкм и более. В процессе механической очистки сточных вод достаточно хорошо удаляются частицы размером 10 мкм и более, мелкодисперсные и коллоидные частицы практически не удаляются. Таким образом, сточные воды многих производств после сооружений механической очистки представляют собой агрегативно устойчивую систему. Для их очистки применяются методы коагуляции: агрегативно устойчивая система при этом нарушается, образуются более крупные агрегаты частиц, которые удаляются из сточных вод механическими методами. Одним из видов коагуляции является флокуляция, при которой мелкие частицы, находящиеся во взвешенном состоянии, под действием специально добавляемых веществ (флокулянтов) образуют интенсивно оседающие рыхлые скопления.
Методы коагуляции и флокуляция широко распространены для очистки сточных вод предприятий химической, нефтехимической, нефтеперерабатывающей, целлюлозно-бумажной, легкой, текстильной и других отраслей промышленности. Эффективность коагуляционной очистки зависит от вида коллоидных частиц; концентрации и степени дисперсности коллоидных частиц; наличия в сточных водах электролитов и других примесей; величины электрокинетического потенциала.
В сточных водах могут содержаться твердые (глина, волокна, цемент, кристаллы солей и т.п.) и жидкие (нефть и нефтепродукты, смолы и другие) загрязнения. Коллоидные частицы, представляющие собой совокупность большого числа молекул вещества, содержащегося в сточной воде в диспергированном состоянии, при перемешивании прочно удерживают покрывающий их слой воды. Обладая большой удельной площадью поверхности, коллоидные частицы адсорбируют находящиеся в воде ионы преимущественно одного знака, которые значительно снижают свободную поверхностную энергию коллоидной частицы. Ионы, непосредственно прилегающие к ядру, образуют слой поверхностно-ядерных ионов, или так называемый адсорбционный слой. В этом слое может находиться также небольшое количество противоположно заряженных ионов.
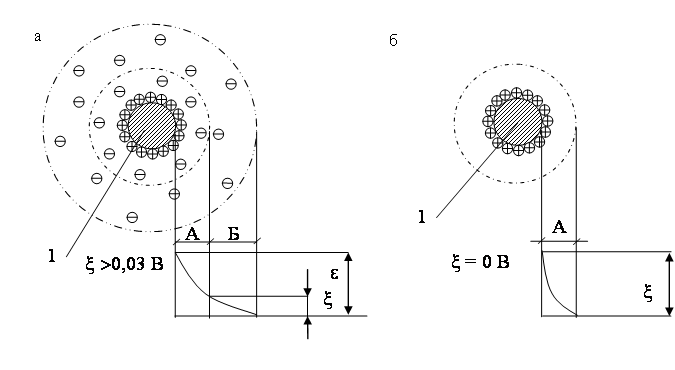
Коагулирующее действие есть результат гидролиза, который происходит вслед за растворением. Силы взаимного притяжения между коллоидными частицами начинают преобладать над электрическими силами отталкивания при ξ – потенциале системы менее 0,03 В. При ξ = 0 В, коагуляция происходит с максимальной интенсивностью, состояние коллоидной системы в этом случае называется изоэлектрическим, а величина рН называется изоэлектрической точкой системы (рис. 1.15.).
Рис. 1.15. Строение мицеллы:
А – адсорбционный слой; Б – диффузионный слой; 1 – ядро
Процесс гидролиза коагулянтов и образования хлопьев происходит по следующим стадиям:
В действительности процесс гидролиза значительно сложнее. Ион металла образует ряд промежуточных соединений в результате реакций с гидроксид-ионами и полимеризации. Образующиеся соединения имеют положительный заряд и легко адсорбируются отрицательно заряженными коллоидными частицами. Одним из методов снижения ξ – потенциала коллоидной системы является увеличение концентрации электролитов в сточной воде. Способность электролита вызывать коагуляцию коллоидной системы возрастает с увеличением валентности коагулирующего иона, обладающего зарядом противоположным по знаку заряду коллоидных частиц. Соотношение коагулирующей способности одно-, двух- и трехвалентных ионов приблизительно 1:30:1000, т.е., чем выше валентность, тем более эффективно коагулирующее действие.
При коагуляции хлопья образуются сначала за счет взвешенных частиц и коагулянта или только коагулянта. Образовавшиеся хлопья коагулянта сорбируют вещества, загрязняющие сточные воды, и, осаждаясь вместе с ними, очищают воду.
Основным процессом очистки производственных сточных вод является гетерокоагуляция – взаимодействие коллоидных и мелкодисперсных частице агрегатам и, образующимися при введении в сточную воду коагулянтов. При использовании в качестве коагулянтов солей алюминия и железа в результате реакции гидролиза образуются малорастворимые в воде гидроксиды железа и алюминия, которые сорбируют на раз витой хлопьевидной поверхности взвешенные мелкодисперсные частицы, коллоидные частицы при благоприятных гидродинамических условиях оседают на дно отстойника, образуя осадок:
Образующуюся в процессе гидролиза серную и соляную кислоты следует нейтрализовать известью или другими щелочами. Нейтрализация образующихся при гидролизе коагулянтов кислот может также протекать за счет щелочного резерва сточной жидкости:
В целях уменьшения расходов коагулянтов процесс коагуляции следует осуществлять в диапазоне оптимальных величин рН. Значения рН при оптимальных условиях коагуляции будут следующими:
— для Fе(ОН)3 рН = 4-6 и 8-10.
Для очистки производственных сточных вод применяют различные коагулянты: соли алюминия, соли железа, соли магния, известь, шламовые отходы и отработанные растворы отдельных производств (например, хлорид алюминия является отходом при производстве этилбензола, сульфат двухвалентного железа – травление металлов, известковый шлам и другие).
Соли магния – хлорид магния MgCl2·6H2O, сульфат магния MgSO4·7H2O. Соли железа, как коагулянты, имеют ряд преимуществ перед солями алюминия: действие при низких температурах воды; более широкая область оптимальных значений рН среды; большая плотность и гидравлическая крупность хлопьев; возможность использовать для вод с более широким диапазоном солевого состава; способность устранять вредные запахи и привкусы, обусловленные присутствием сероводорода. Однако имеются и недостатки: образование при реакции катионов железа с некоторыми органическими соединениями сильно окрашивающих растворимых комплексов; сильные кислотные свойства, усиливающие коррозию аппаратуры; менее развитая поверхность хлопьев.
При использовании смесей Аl(SO4)3 и FeCl3 соотношениях от 1:1 до 1:2 достигается лучший результат коагулирования, чем при раздельном использовании реагентов. Происходит ускорение осаждения хлопьев. Кроме названных коагулянтов для обработки сточных вод могут быть использованы другие реагенты – глины, алюмосодержащие отходы производства, травильные растворы, пасты, смеси, шлаки, содержащие диоксид кремния. Оптимальную дозу реагента устанавливают на основании пробного коагулирования.
Количество коагулянта, необходимое для осуществления процесса коагуляции, зависит от вида коагулянта, расхода, состава, требуемой степени очистки сточных вод и определяется экспериментально.
Недостатки метода коагуляционной очистки сточных вод (значительный объем коагулянтов, большой объем получающегося осадка, сложность его обработки и складирования, увеличение степени минерализации обрабатываемой сточной воды) не позволяют рекомендовать коагуляцию как самостоятельный метод очистки.
Коагуляционный метод очистки сточных вод применяется в основном при небольших расходах воды и при наличии дешевых коагулянтов.
Расширению оптимальных областей коагуляции (по рН и температуре) способствуют флокулянты, повышающие плотность и прочность образующихся хлопьев, снижающие расход коагулянтов, снижающие расход коагулянтов, повышающие надежность работы и пропускную способность очистных сооружений.
При растворении в сточных водах флокулянты могут находиться в неионизированном и ионизированном состоянии. Последние носят название растворимых полиэлектролитов. В зависимости от состава полярных групп флокулянты бывают:
— анионные – полимеры, содержащие анионные группы: –СООН, –SО3Н, –OSO3H (активная кремниевая кислота, полиакрилат натрия, альгинат натрия, лигносульфонаты и др.);
— катионные – полимеры, содержащие катионовые группы: –NH2, =NH (полиэтиленимин, сополимеры винил пиридина, ВА-2, ВА-102, ВА-202 и др.);
— амфотерные – полимеры, содержащие одновременно анионные и катионные группы: полиакриламид, белки и др.
Скорость и эффективность процессов флокуляции и коагуляции зависят от состава сточных вод, их температуры, интенсивности перемешивания последовательности введения коагулянтов и флокулянтов. Дозы флокулянтов составляют обычно 0,1-10 г/м, а в среднем 0,5-1 г/м. Так применение добавок полиакриламида в концентрации 1 г/м 3 при коагуляции сточных вод металлургического завода позволило увеличить удельную нагрузку на радиальные отстойники в два раза.
Процесс очистки сточных вод методом коагуляции или флокуляцией состоит из следующих стадий: дозирование и смешивание реагентов со сточной водой; хлопьеобразование и осаждение.
В реагентное хозяйство на очистных сооружениях входят склады для хранения коагулянтов. Широко применяется так называемое мокрое (рис. 1.16) хранение коагулянтов — в виде раствора или кускового продукта в концентрированном растворе, в баках и резервуарах, располагаемых внутри или вне зданий. Емкости, располагаемые вне зданий, следует утеплять. Растворение коагулянтов в воде осуществляется в специальных растворных баках с устройствами для барботажа сжатым воздухом интенсивностью 4-5 л/с на 1 м 2 площади колосниковой решетки.
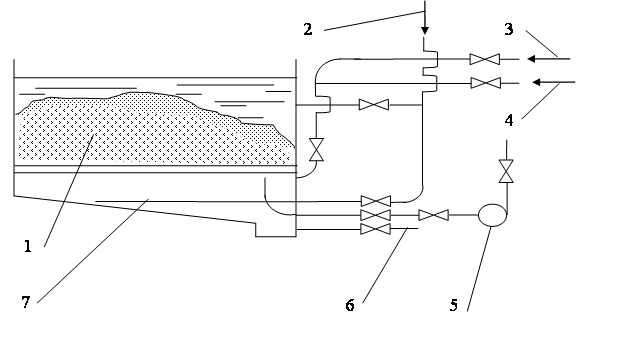
Рис. 1.16. Бак для хранения мокрого коагулянта:1 – кусковой коагулянт; 2 – подача воды; 3 – подача пара; 4 – подача сжатого воздуха;
5 – центробежный насос для перекачки раствора в растворные баки;
6 – выпуск осадка в канализацию; 7 – подача воды для смывания осадка
Применяются также баки с лопастными и пропеллерными мешалками для растворения соответственно зернистых и кусковых материалов размером не более 20 см.
Из растворных баков коагулянты перекачивают в расходные баки, а оттуда дозируют в обрабатываемую воду с помощью дозаторов различных конструкций. Коагулянты вводят в обрабатываемую воду обычно в виде 1-10 % растворов, а флокулянты 0,1-1 % растворов. Коагулянты смешивают с обрабатываемой сточной водой в смесителях в течение 1-2 мин. Для смешения коагулянтов применяют гидравлические и механические смесители. В гидравлических смесителях смешение происходит вследствие изменения направления движения и скорости тока воды.
Применяют перегородчатые, шайбовые и вертикальные смесители, а также механические с пропеллерными или лопастными мешалками. Трубопроводы или, отводящие воду из смесителей в камеры хлопьеобразования, и осветлители с взвешенным слоем осадка рассчитывают на скорость движения сточной воды 0,8-1 м/с и продолжительность ее пребывания в них не более двух минут. После смешивания сточных вод с коагулянтами начинается процесс образования хлопьеобразования. Эти камеры могут быть водоворотные, перегородчатые, вихревые, с механическим перемешиванием.
Водоворотные камеры хлопьеобразования представляют собой цилиндр, в верхнюю часть которого из смесителя вводится сточная вода, имеющая скорость на выходе из сопла 2-3 м/с. В нижней части камеры перед выходом в отстойник находятся гасители вращательного движения воды. Продолжительность пребывания воды в камере 15-20 мин.
Перегородчатые камеры могут быть горизонтальные (рис. 1.17) и вертикальные. В горизонтальной камере сточная вода протекает по нескольким последовательно соединенным коридорам. Перемешивание осуществляется за счет 8-10 поворотов. Коридоры устраиваются таким образом, чтобы скорость движения сточной воды в первом была 0,2-0,3 м/с, а в последнем – 0,1 м/с. Продолжительность пребывания воды в перегородчатых камерах 20-30 мин. Высота камеры определяется высотой отстойника, а ширина коридоров составляет не менее 0,7 м.
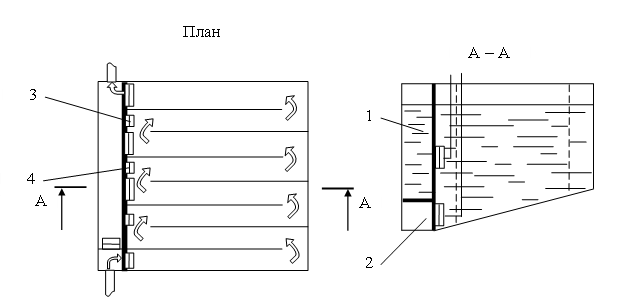
Рис. 1.17. Горизонтальная перегородчатая камера хлопьеобразования:
1 – отводной канал сточной воды; 2 – отводной канал осадка;
3 – шиберы для отключения части коридоров; 4 – шиберы для выпуска осадка
В камерах хлопьеобразования с лопастными мешалками скорость движения воды 0,15-0,2 м/с, а продолжительность пребывания – 20-30 мин.
Последующее осветление сточной воды производится в горизонтальных, радиальных или вертикальных отстойниках.
Наиболее целесообразной является двухступенчатая схема отстаивания сточных вод. На первой ступени осуществляется простое отстаивание в отстойнике без коагулянта. На второй ступени – обработка сточных вод коагулянтами и флокулянтами с последующим отстаиванием в отстойнике.
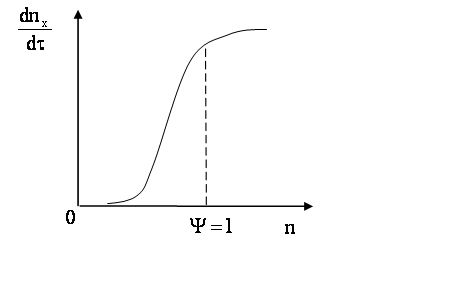
Для обеспечения нормальной работы осветлителя сточную воду после смешения с коагулянтами направляют в воздухоотделитель, где она освобождается от пузырьков воздуха, выделяющихся в результате реакции. В течение одного часа допускается колебание температуры не более чем на 1 0 С, а расхода – не более чем на 10 %. Скорость коагуляции (рис. 1.18) зависит от концентрации электролита.
Рис. 1.18. Общая зависимость относительной скорости коагуляции от концентрации электролита
При малых числах соударений частиц, т.е. отношений числа столкновений окончившихся слипанием скорость близка к нулю (у = 0). По мере роста концентрации скорость коагуляции повышается, но не все столкновения эффективны – такую коагуляцию называют медленной. При 
Скорость быстрой коагуляции для неподвижной среды при броуновском движении частиц по теории Смолуховского равна
Количество частиц в единице объема воды за время Т для быстрой и медленной коагуляции определяются по формулам
Для ламинарного и турбулентного движения потока воды число взаимодействий частиц за единицу времени в единицу объема жидкости 
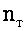
где 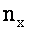
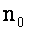
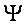
В полудисперсных системах коагуляция происходит быстрее, чем в монодисперсных, т.к. крупные частицы при оседании увлекают за собой более мелкие.
Форма частиц также влияет на скорость коагуляции. Например, удлиненные частицы коагулируют быстрее, чем шарообразные.
Размер хлопьев (в пределах 0,5-3 мм) определяется соотношением между молекулярными силами, удерживающими частицы вместе, и гидродинамическими силами отрыва, стремящимися разрушить агрегаты. Для характеристики хлопьев пользуются (определением) понятием эквивалентного диаметра
где 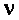
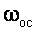
Плотность хлопьев определяется с учетом плотностей воды рв и твердой фазы 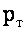
Прочность хлопьев зависит от гранулометрического состава образующихся частиц и пластичности. Агломераты частиц, неоднородных по размеру, прочнее, чем однородных. Вследствие выделения газов из воды, а также в результате аэрации и флотации происходит газонасыщение хлопьев, которые сопровождаются уменьшением плотности хлопьев и снижением скорости осаждения.
Резкие колебания скорости движения воды не допускаются. Величина восходящей скорости потока в зоне осветления зависит от концентрации взвешенных веществ. Так, при обработке сточных вод сульфатом алюминия при содержании взвешенных веществ в одном литре до 40 мг расчетная скорость восходящего потока:
Высота слоя взвешенного осадка принимается равной 1,5-2,5 м; высота защитной зоны от верха осадкоотводящих окон или труб до лотков для сбора осветленной воды 1-1,5 м; низ осадкоприемных окон или кромка осадкоотводящих труб располагается на расстоянии 1,5-1,75 м выше перехода наклонных стенок осветлителя в вертикальные; угол наклона к горизонту нижних частей стенок осветлителей и осадкоуплотнителей принимается не менее 45 0 С.
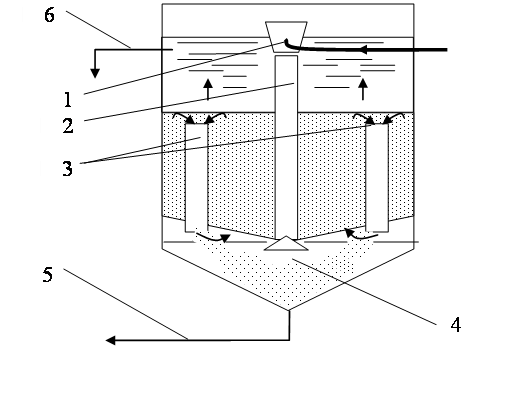
Избыток шлама, накапливающегося в осветлителе со взвешенным слоем осадка (рис. 1.19), перетекает под действием разности плотностей осветленной воды и взвешенного слоя в осадкоуплотнитель – это осветлитель с естественным отсосом шлама, либо отсасывается вследствие разностей уровней отбора воды из рабочей камеры и уплотнителя – это осветлитель с принудительным отсосом избытка шлама. Осветлители второй конструкции работают эффективнее.
Рис. 1.19. Схема осветлителя со взвешенным слоем осадка:
1 – воздухоотделитель; 2 – спускная труба; 3 – осадкоотводящие трубы;
4 – осадкоуплотнитель; 5 – трубопровод отводящего осадка;
6 – отвод осветленной воды
Исходя из концентрации взвешенных веществ в обрабатываемой сточной воде Сн, при известных расчетах скорости восходящего потока воды в зоне осветлителя Vрасч, эталонной концентрации взвешенных веществ во взвешенном слое Сэ (при скорости движения воды 1 мм/с) и концентрации взвешенных веществ в осадке после его уплотнения Сшл, можно определить расход воды и размеры осветлителя (табл. 1.1). Расчетный расход сточной воды, проходящей через осветлитель
Параметры для расчета осветлителя со взвешенным слоем осадка.