что такое фтор сырье
Продукты питания богатые фтором

Функции фтора в организме
Фтор присутствует почти во всех тканях человеческого организма, но наивысшая концентрация вещества (почти 96 %) – в составе зубов и костей. Фториды, попадающие в организм с пищей, полностью ионизируются и быстро всасываются, распределяясь между клетками.
Абсорбируется вещество в кишечнике, по телу транспортируется с током крови. Довольно быстро выводится из организма с мочой. Фтор увеличивает биодоступность кальция и снижает агрессивность кислот в ротовой полости. Необходим для нормальной минерализации костей и формирования зубной эмали. Фтор и кальций тесно взаимосвязаны в пределах человеческого организма и работают в основном в тандеме, чаще во внешних частях костей.
Дефицит и передозировка фтора
Общепринятая суточная доза F для взрослого человека составляет 1,5-2 мг (немного больше при остеопорозе). Недостаточное потребление этого микроэлемента вызывает кариес, ухудшает зрение, усиливает уязвимость организма перед инфекциями.
Последствия хронического F-дефицита:
Передозировка фтором хоть и редко, но все-таки встречается. В случае отравления минералом важно пить много воды (больше 2 литров в сутки) и принимать кальция глюконат (способствует более быстрому выведению фтора из организма). Быстрый эффект для очищения от излишков микроэлемента дают слабительные препараты, содержащие натрия сульфат. Избавиться от проявлений флюороза поможет отбеливание эмали зубов.
Пищевые источники
Фтор содержат: спаржа, авокадо, брюссельская капуста, морковь, тмин, цветная капуста, огурцы, финики лимонная трава, петрушка, репа, ботва свеклы, одуванчики, семена подсолнечника, чеснок, шпинат, помидоры, зеленые листовые овощи, орехи (особенно миндаль), репа, водоросли.
Кстати, интересно, что фтор обладает способностью «мигрировать» в воду, что особенно полезно для отваров и чаев. Например, при заваривании черного чая примерно 70-90 процентов фтора переходит из его листьев в жидкость. Из мяты «выходит» примерно 30% содержащегося минерала, из шиповника – примерно 20 процентов, а ромашка отдает только 5 % полезного микроэлемента.
| Продукт (200 г) | Фтор (мг) |
|---|---|
| Чай (черный, зеленый, белый) | 20 |
| Скумбрия | 3 |
| Тунец | 2 |
| Минеральная вода | 1,5 |
| Хек | 1,4 |
| Минтай | 1,4 |
| Треска | 1,4 |
| Путассу | 1,4 |
| Орехи грецкие | 1,3 |
| Ставрида | 1 |
| Камбала | 0,9 |
| Лещ морской | 0,86 |
| Макрель | 0,86 |
| Лосось | 0,86 |
| Форель | 0,86 |
| Рак | 0,86 |
| Гребешки морские | 0,86 |
| Устрицы | 0,86 |
| Кефаль | 0,86 |
| Баранье мясо | 0,3 |
| Свинина | 0,3 |
| Птица | 0,28 |
| Куриные яйца | 0,18 |
| Гречка | 0,1 |
| Манка | 0,1 |
| Молоко | 0,1 |
| Картошка | 0,1 |
| Макароны | 0,1 |
| Говяжье мясо | 0,032 |
| Редис | 0,012 |
| Морковь | 0,006 |
Топ-10 продуктов, необходимых для детей
О важности фтора для детей не приходится напоминать. Растущий организм, как никто другой нуждается в этом микроэлементе для формирования здоровых костей и зубов, укрепления эмали и предотвращения стоматологических болезней.
Дефицит фтора, как и кальция, чреват серьезными нарушениями в развитии детей: от искривлений в позвоночнике до потери зрения.
Но это не значит, что ребенка с ранних лет необходимо кормить биодобавками с F. Источниками нутриента для детей должны быть только натуральные продукты. Избыток минерала также не самое приятное, что может случиться с человеком. Потребление более 0,5 мг фтора на 1 кг веса ребенка вызывает флюороз (проявляется белыми и темными пятнами на зубной эмали). Большая передозировка вызывает ноющие боли в костях, пятна на зубах (белые и коричневые). Такие же признаки отравления фтором могут возникать и у взрослых. Но у них, ко всему прочему, ещё добавляются узловатость суставов, быстрое старение костной ткани, появление морщин и развитие склеродермии (образование жестких участков кожи).
Составляя список продуктов, богатых фтором, в первую очередь важно помнить о воде, которая является лучшим источником минерала. Также важно ввести в детский рацион чай, орехи, подсолнечные семена, фрукты и овощи. В частности, делая акцент на моркови, репе, ботве свеклы, чесноке, шпинате, листовой зелени.

Важное замечание. Дети, особенно в раннем возрасте (до 2 лет), часто склонны к пищевым аллергиям. Поэтому вводить в рацион любой из названных продуктов стоит медленно, осторожно и маленькими порциями. Только после того, как организм привыкнет к новой пище и порции, частоту приема того или иного продукта можно увеличивать. Не пренебрегайте этим правилом! Любой продукт должен нести пользу, а не порождать проблемы со здоровьем.
Другие гастрономические рекомендации

Все супы, приготовленные на костях, и бульоны из птицы (мясо должно быть также с костями) являются не только сытным блюдом, но и чрезвычайно концентрированным источником F. Хотя есть одно замечание. Желаете быть уверенными в пользе такого бульона – позаботьтесь о качестве мяса. И если нет возможности есть домашнюю птицу, то, по крайней мере, покупайте продукт от проверенных производителей.
Конечно, свежеприготовленная пища – это вкуснее и полезнее всего. Но и консервы не всегда плохо. Рыбные, например, (особенно с костями) являются одним из лучших продуктовых источников F. Но в этом случае также важно проверить качество и свежесть продукта.
Категорически не приемлете консервы? Не беда. Рыба, приготовленная самостоятельно, ничем не хуже. А по вкусу – лучше во много раз. Единственно правило: варить, тушить, запекать или жарить рыбу желательно с костями. Такой продукт содержит в себе в разы больше фтора, чем филе тех же сортов. Продолжая тему даров моря, стоит напомнить, что моллюски также благотворно влияют на состояние костей и зубов.
Овсянка принадлежит к списку продуктов, богатых микроэлементами, в частности фтором. Но маленькое предостережение. Все-таки лучше отдавать предпочтение обычным «геркулесовым» хлопьям, чем новомодным кашам, быстрого приготовления, напичканным усилителями вкуса и химическими «Е»-добавками. В связи с этим, повезло любителям проросших зерен – они получают от злаков больше всего пользы.
Фруктовые и овощные соки – в числе продовольствий, насыщенных фтором. Но опять-таки, полезными могут называться только свежевыжатые фреши из качественных продуктов. Выращенное «на химии» не стоит выбирать в качестве сырья для витаминного напитка. От таких соков вреда больше, чем пользы. И конечно же, лучше навсегда забыть о существовании напитков, изготовленных из концентратов.
Токсичные источники
Наверное, многие слышали о фторированной воде, попадающей в наши дома по коммунальным водопроводам. В состав жидкости из крана обычно входит неорганическая форма фтора. А это, как убеждают медики, не самый безопасный способ пополнения запасов минерала. И уж тем более, не стоит применять такую воду (даже после кипячения) для приготовления еды малышам.
Высокую концентрацию фтора нередко можно найти и в вине. Но причислить такой напиток к полезным трудно, хотя бы по той причине, что источниками фтора в нем является пестицид (криолит), которым обрабатывали виноградники. Используют криолит (содержит фторид натрия) как средство против насекомых-вредителей. Порой концентрация F в бокале такого вина может превышать содержание микроэлемента в литре специально фторированной воды.
Выбирайте только правильные продукты для поддержания витаминно-минерального баланса, и организм непременно отблагодарит вас хорошим здоровьем.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Фторсодержащее сырье
Фтористое сырье.
Фтор и его соединения активно используется в различных отраслях промышленности.
Фтор является самым активным (даже больше кислорода) окислителем в природе. Образует соединения, взаимодействующие с металлами и стеклом. Так же имеет полезное для промышленности свойство – снижать температуру плавления не только металлов, но и керамических материалов.
Основным его источником служит Плавиковый шпат – минерал Флюорит. Вторым по объемам источником фтора служит побочное извлечение его при переработке апатитов и фосфоритов – фосфатного сырья – для производства Ортофосфорной кислоты и минеральных удобрений.
Единственный фтористый природный минерал – Криолит – раньше добывался в Гренландии, но на сегодня его природные запасы истощены. В связи с этим производится искусственный синтетический Криолит.
Плавиковый шпата потребляется металлургией, но особенность технологии состоит в том, что необходимы куски размером более 5 сантиметров. Куски такого размера технологически сложно добываются, в связи с этим металлургического плавикового шпата не так много.
Второе направление – производство фторидов алюминия и искусственного криолита.
На третьем месте по потреблению Флюорита стоит изготовление фторводорода и фтористоводородной кислоты. Например мировое использование фтористоводородной кислоты только в химической промышленности более 650 тыс. т./год. Тогда как мировое потребление Плавикового шпата составляет 4,5 млн. тонн.
На четвертом месте – для производства сварочных электродов. Для этого необходимо содержание серы и фосфора менее 0,1%.
Так же фтор применяется в следующих отраслях:
Лидирующие позиции в мировом потреблении принадлежат Китаю, США и Японии. Причем при мировой добыче флюорита 4,5млн. тонн Китай производит 2,5 млн. тонн (по данным 2002 года). На втором месте по производству – 650 тыс. тонн – стоит Мексика.
В России добывается до 190 тыс. тонн плавикового шпата. У нас использование фторсодержащего сырья около 300 тыс. тонн в год. Около половины идет на металлургию. Из них только производство алюминия потребляет 30% и так же все вторичное фторсодержащее сырье.
Общие тенденции рынка:
В итоге четко прослеживается растущий спрос на фторсодержащее сырье в целом по миру и в России в частности.
| Фтор | |
|---|---|
| Жёлтая жидкость (при криогенных температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.) | |
 |
Фтор (устар. флюор ; F, лат. fluorum ) — химический элемент 17-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA) с атомным номером 9. Самый химически активный неметалл и сильнейший окислитель, самый лёгкий элемент из группы галогенов. Как простое вещество при нормальных условиях фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Токсичен.
Содержание
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P3/2.
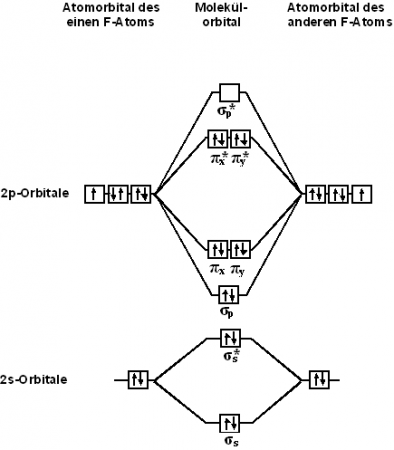
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
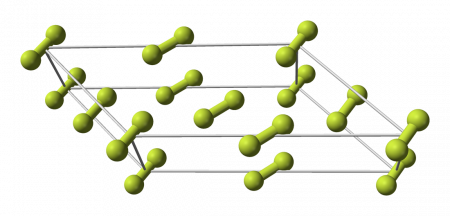
Кристаллы
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Ядерные свойства изотопов фтора
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
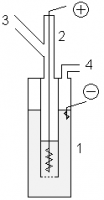
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Применение
Фтор используется для получения:
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
Виды вторичного сырья и примеры его переработки
Бытовые и промышленные отходы, выброшенные в урну, составляют угрозу для экологии. Выходом из ситуации стало применение их в качестве вторсырья. Сдача мусора предприятиями и физическими лицами позволяет не только предотвратить экологическую катастрофу, но и заработать дополнительные средства, на том, что ранее попросту выбрасывалось на свалку.
Что такое вторсырьё
Вторсырьё – это отходы производств, быта, продуктов жизнедеятельности человека и животных, которые пригодны для дальнейшей переработки. Переработав его можно получить новое полезное изделие, сырьё или полуфабрикат для дальнейшего использования. Это «вторая жизнь» старых предметов.
Что относится к вторичному сырью
Всё, что можно переработать повторно относятся к вторсырью. Это понятие включает огромное количество наименований материалов, бытового, промышленного, крупногабаритного, строительного, автомобильного мусора и отходов жизнедеятельности. Его различают по нескольким основным критериям:
Далее, в зависимости от основных критериев, мусор распределяют по видам. Вот основные из них.
| Виды вторсырья | Наименование материалов и составляющих, входящих в данный вид |
| Древесина | Ветви и листья деревьев, опилки, древесно-стружечные плиты, обрезки древесины |
| Биологические отходы | Пищевые отходы, жиры, древесные отходы, макулатура, фикалии, трупы животных (только те, которые органы ветеринарного надзора допустили к переработке) |
| Полимеры | Пластиковые бутылки, мешки, сломанные пластиковые ведра и тазы, а также полиэтиленовая пленка, ПВХ изделия. |
| Строительные отходы | Кирпич, бетон, старые обои, железобетон |
| Текстиль | Спецодежда, постельное белье, скатерти, покрывала, шторы, лоскутки материи, обреки тканей. Все подобные изделия, которые образуются вследствие брака или изношенности на предприятиях, в домашнем хозяйстве, производствах. |
| Макулатура | Бумаги, картона, бумажные мешки, книги, журналы (кроме глянцевых), упаковочная бумага, шпагат |
| Стекло | Бутылки, банки, стеклобой, пробирки |
| Металлолом | Лом различных сплавов: алюминиевый, медный, титановый и свинцовый, а также отходы обрабатывающих производств (стальная стружка, обрежки) |
| Химикаты | Кислота, щелочные и органические элементы |
| Нефтепродукты | Асфальт, битум, мазут, гудрон |
| Электроника | Электроприборы, их платы, провода, флешки, компьютерные и телефонные чипы, бытовая техника |
| Резина | Автомобильные шины, покрышки, манжеты, РТИ |
| Сточные воды | Сточные воды из производительных предприятий |
Куда сдавать вторсырье
Пригодные к переработке отходы сдают на специальные пункты приёма вторсырья. Они оснащены необходимым оборудованием для приема и хранения конкретного (реже нескольких) видов вторсырья и имеют лицензию на работу с отходами.
Сдачу вторсырья через специализированные пункты осуществляют в основном частные лица и небольшие компании. Крупные холдинги и предприятия свозят отходы непосредственно в места их переработки.
Примеры переработки вторичного сырья
Способы переработки отходов и необходимое для этого оборудование зависит от типа материалов. А переработка любого вида вторсырья начинается с его сортировки. Рассмотрим несколько способов переработки мусора.
Переработка макулатуры в пульпу
Пульпа является ценным компонентом для производства бумаги. Для её получения собранную макулатуру замачивают в баках, отбеливают и очищают от типографской краски. После чего сбивают массу в пену — пульпу. Из неё в дальнейшем можно изготовить широкий ассортимент бумажных изделий: салфетки, туалетная бумага, эковата, писчая бумага, картон и т.п.
Получение удобрений из биологических отходов
Органические отходы перерабатывают в компост с последующей переработкой в гумус. Его используют для удобрения в садоводстве и сельском хозяйстве. Переработка биологических отходов осуществляется путем компостирования и перегнивания органического мусора, а полученный в результате компостирования газ можно в дальнейшем использовать для получения электроэнергии.
Переплавка цветных и черных металлов
Металлолом перед непосредственной переработкой сортируется по виду металла. Затем удаляют грязь и различные примеси, если они присутствуют. Крупные куски металла режут с помощью специального электроинструмента и отправляют на переплавку.
Цветные металлы извлекают из микросхем, радиодеталей, процессоров.
Переплавка стекла
Этапы переплавки стекла:
После переплавки, стеклянную массу снова превращают в готовую стеклянную тару.
Измельчение резины в крошку
Один из способов переработки старых покрышек – измельчение в крошку. Но сначала необходимо удалить из неё металлический корд и ткань. В зависимости от технологии, дальнейшее измельчение может происходить тремя способами:
Измельчённая резиновая крошка используется как сырьё для производства новых РТИ.
Какие изделия производят из вторсырья
Из вторичного сырья изготовляют широкий ассортимент изделий, которые в дальнейшем могут прослужить не один год. Так, из битого стекла можно изготовить новую вазу или стекловату. Из ненужных газет и картона – произвести полезную в быту туалетную бумагу, а из биологических отходов: компост и удобрения для растений.
Так что не спешите выбрасывать мусор в урну: сортируйте его, сдавайте на специальные пункты приема. Так вы не только сохраните экологию, но и заработаете на том, что ранее казалось обычным мусором. Переработка отходов – это достаточно прибыльное и важное дело, способное дать старой вещи новую жизнь.
Методы переработки промышленного мусора и твердых бытовых отходов
Все о древесных измельчителях — описание, характеристики
Виды и назначение оборудования для переработки пластиковых отходов
Мусорные баки для раздельного сбора отходов в офисах и домах
Оборот стеклотары и методы утилизации стекла
Назначение и разновидности мусоросортировочных комплексов