Оксид водорода что это значит
Оксид водорода
в земной атмосфере
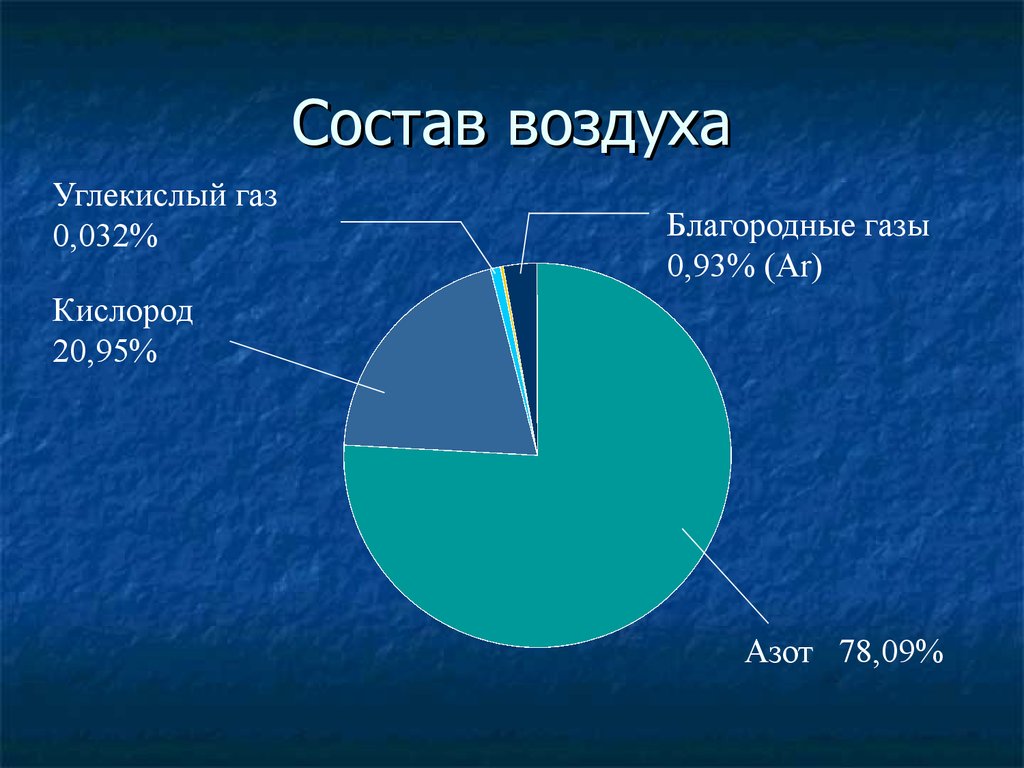
О химическом составе атмосферного воздуха справочники сообщают следующую информацию:
в любом произвольно выбранном объеме сухого воздуха содержится:
78,08 % азота N2,
20,95 % кислорода 02,
0,93 % аргона Аг;
оставшиеся 0,04 % приходятся на ряд других газов, из которых наибольшую концентрацию (в среднем 0,03 %) имеет диоксид углерода С02.
Однако в действительности атмосферный воздух не является сухим, а содержит значительное количество вещества, имеющего химическую формулу Н20, которое химики называют оксидом водорода.
По имеющимся оценкам, общая масса оксида водорода в земной атмосфере постоянна и составляет 1,4e16 кг, т. е. 0,27 % общей массы атмосферы (напомним, что общая масса атмосферы равна 5,2 e18 кг).
Оксид водорода присутствует в атмосфере частично в трех агрегатных состояниях:
Туманы и облака — это огромные скопления мелких водяных капель и ледяных кристаллов. Заметим, что термин «оксид водорода», как правило, на практике не применяется. Обычно предпочитают говорить о «воде» — газообразной воде (водяном паре), жидкой воде (собственно воде), твердой воде (льде или снеге).
Таким образом, три состояния вещества, молекулы которых состоят из двух атомов водорода и одного атома кислорода, рассматривают как три состояния воды.
Газообразное состояние оксида водорода (Туман).
Жизкое состояние оксида водорода (Вода)
Твердое состояние оксида водорода (Лёд)
Итак, в атмосфере Земли постоянно присутствуют примерно 1,4e16 кг (более десяти триллионов тонн!) оксида водорода.
Часто говорят: над поверхностью Земли находятся более десяти триллионов тонн воды. Следует, однако, иметь в виду, что только часть этих десяти триллионов находится в виде водяных капель, тогда как другая часть присутствует в виде ледяных кристаллов или водяного пара. Десять триллионов тонн воды (правильнее сказать, оксида водорода) в атмосфере! Много это или мало? По сравнению с массой всего Мирового океана эти десять триллионов тонн, конечно, очень малы. Они составляют лишь стотысячную долю. Впрочем, масса этой стотысячной доли всего в два раза меньше массы воды в Байкале. Или в Балтийском море. Или во всех пяти Великих североамериканских озерах. Масса оксида водорода в атмосфере в два раза больше массы воды, которая ежегодно изливается в океан самой полноводной рекой Земли Амазонкой. Она в 20 раз больше годового стока Лены и в 60 раз больше годового стока Волги. Не имеет смысла пытаться оценить, какая масса атмосферного оксида водорода находится в том или ином состоянии, поскольку в атмосфере все время совершаются процессы перехода оксида
водорода из одного состояния в другое.
Влажность воздуха и водность облаков
Оксид водорода в атмосфере Земли состоит, во-первых, из водяного пара и, во-вторых, из водяных капель и ледяных кристаллов в облаках (а также в туманах).
Будем обозначать через р плотность атмосферного оксида водорода, т. е. суммарную массу молекул Н20 в единице объема атмосферы. Эту величину можно назвать влагосодержанием атмосферы. Она складывается из абсолютной влажности воздуха и водности облаков.
Абсолютная влажность воздуха есть масса водяного пара в единице объема воздуха (ее называют также плотностью водяного пара). Водность облака (тумана) есть общая масса водяных капель и ледяных кристаллов в единице объема облака (тумана).
Единица измерения обеих этих величин — г/м3.
Как уже отмечалось, общая масса оксида водорода постоянна и составляет 1,4e16 кг. При этом установлено, что за год из атмосферы уходят 5,2e17 кг оксида водорода, выпадая на поверхность Земли в виде осадков — дождей, снегопадов, града. Такое же количество оксида водорода возвращается в течение года обратно в атмосферу в виде водяного пара в результате испарения с поверхности Земли (главным образом с поверхности Мирового океана). Так в природе совершается круговорот оксида водорода.
Обычно говорят о «круговороте воды в природе», что представляется нам не вполне корректным. Используют также термин «влагооборот в природе». Он вполне корректен. Однако более точен на наш взгляд термин «круговорот оксида водорода в природе».
Водорода оксид: описание вещества, получение, свойства
Что собой представляет кислородное соединение водорода? Оксид данного элемента обладает определенными физическими и химическими свойствами. Попробуем понять двойственность признаков данного соединения и выявить его отличительные характеристики.
Определение
Самым важным и распространенным на нашей планете веществом является именно кислородное соединение водорода. Оксид его знаком нам в качестве обычной воды. Сложно представить себе какое-то иное соединение, которое имеет такое же значение для живых организмов. Оксидами принято называть бинарные соединения, в составе которых есть кислород. Важным условием при этом является расположение кислорода в конце химической формулы.
Классификация
В настоящее время выделяют три группы оксидов. Основными считают кислородные соединения, которые образованы металлами, имеющими низкую валентность (один или два). В качестве исключений из общего правила можно рассмотреть оксиды бериллия и цинка. Несмотря на то что валентность этих металлов равна двум, их кислородные соединения относят к амфотерным оксидам. Особенностью амфотерных соединений считают их взаимодействие с кислотами и щелочами. Двойственные свойства также проявляют оксиды металлов, имеющих валентность три.
Кислотные оксиды образуются неметаллами, а также металлами с валентностью от четырех до семи. К какой группе относится соединение водорода? Оксид данного элемента проявляет двойственные химические свойства, поэтому считается амфотерным соединением.
Получение в лаборатории
Восстановление оксидов водородом является одним из способов получения воды. Данный процесс используется в промышленности для переработки металлолома, выделения из него черных и цветных металлов. Гидрирование относится к термическому и каталитическому процессу, одним из продуктов которого является жидкая вода.
Распространенность в природе
Физические свойства и особенности строения
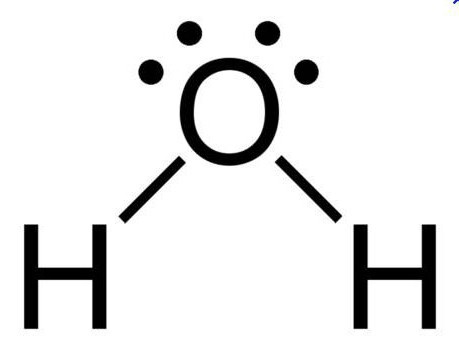
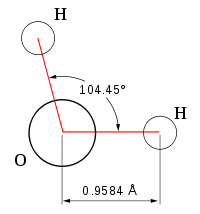
При нормальных условиях вода является бесцветной жидкостью, не имеющей вкуса и запаха. Данное вещество считается отличным полярным растворителем, поэтому многие процессы протекают именно в водной среде. Температура ее кипения составляет 100 градусов. При нулевой же температуре вода превращается в лед. Данное соединение имеет дипольное строение, а объяснить это можно особенностями молекулы. Так как у кислорода остаются незадействованными две электронные пары, в оксиде sp3 гибридное состояние имеет атом кислорода, величина валентного угла составляет 110 градусов.
Химические свойства
Конечным продуктом такого взаимодействия является щелочь.
Помимо реакций с оксидами, вода способна к взаимодействию с металлами. Щелочные металлы (без нагревания) образуют щелочь, при этом образуется и газообразный водород.
Металлы средней активности (при нагревании) образуют в реакции с водой оксид и водород. Малоактивные металлы, которые располагаются в электрохимическом ряду напряжений металлов после водорода, не способны взаимодействовать с водой.
Последовательность лабораторного получения воды может быть представлена в следующем виде: водород-оксид. Реакция, протекающая в этом случае, является экзотермической и сопровождается выделением большого количества тепловой энергии. Конечным продуктом ее является оксид водорода. Уравнение реакции имеет вид: 2Н2+О2=2Н2О
Дипольное строение молекулы воды объясняет возможность образования этим неорганическим соединением водородных связей, имеющих ковалентный характер. У этого соединения самое высокое значение теплопроводности, поэтому именно вода является тем веществом, которое применяют в отопительных системах.
Биологическое значение
Невозможно представить жизнь человека без воды. Этот универсальный растворитель нужен не только в химической лаборатории. Каждую секунду в живых существах осуществляются сложные биохимические процессы. Вода не только является активным участником многих синтезов, но и выступает в качестве побочного продукта многих из них. За шестьдесят лет своего существования, человек пропускает через свой организм около 50 тонн этого уникального неорганического вещества.
Оксид водорода нашел применение во многих сферах промышленной деятельности человека. Данное соединение незаменимо в медицине, востребовано в сельском хозяйстве.
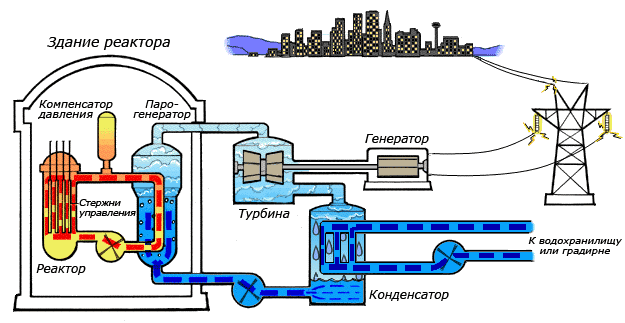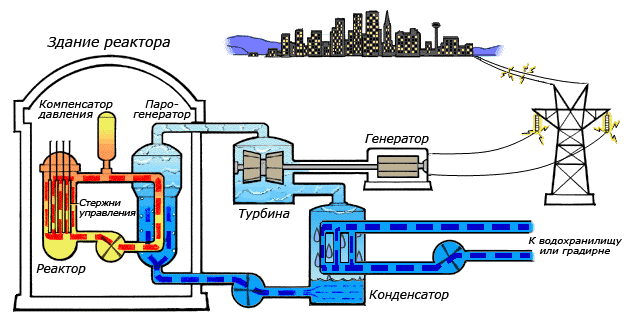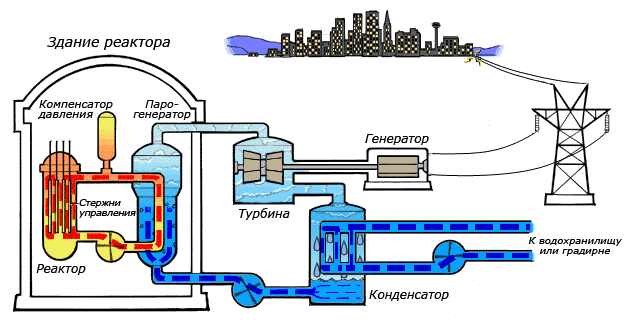
Например, в теплоэнергетике описываемое химическое соединение является рабочим телом и основным теплоносителем. Электрические станции, базирующиеся на нем, расходуют до 40 кубических метров воды за одну секунду. К примеру, для полного охлаждения конденсатора гидротурбины, необходимо до десяти тысяч кубических метров оксида водорода. В металлургической отрасли вода применяется в качестве охлаждающего вещества для основного оборудования, используются и ее физические характеристики, например высокая теплопроводность.
В химической отрасли она востребована как хороший растворитель, а также отличное «транспортное средство» для перемещения реагентов из одного технологического препарата в другой.
Отметим, что и вывод жидких производственных отходов также осуществляется в виде суспензий и эмульсий. Сложно достоверно оценить те объемы оксида водорода, которые идут на бытовые и промышленные нужды.
Кстати, среди многочисленных существ, которые обитают на нашей планете, не нуждаются в воде только вирусы.
Оксид водорода
Оксид водорода
| Вода | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид водорода |
| Традиционные названия | вода |
| Химическая формула | Н2O |
| Молярная масса | 18,01528 г/моль |
| Физические свойства | |
| Плотность вещества | 0,9982 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Динамическая вязкость (ст. усл.) | 0,00101 Па·с (при 20 °C) |
| Кинематическая вязкость (ст. усл.) | 0,01012 см²/с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 0 °C |
| Температура кипения | 99,974 °C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Критическая точка | 374 °C, 22,064 MПа |
| Молярная теплоёмкость (ст. усл.) | 75,37 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | 0,56 Вт/(м·K) |
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Содержание
Физические и химические свойства
Физические свойства
Вода обладает рядом необычных особенностей:
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а так же того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект слабее, чем обычное тепловое расширение; при испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. [2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чем основан принцип действия микроволновой печи.
Агрегатные состояния
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находится в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).
Химические свойства
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода в природе
Атмосферные осадки
Осадки согласно направлению
| «Вертикальные» осадки | «Горизонтальные» осадки | Свободно-парящие структуры |
|---|---|---|
| Дождь | Роса | Облака |
| Дождь со снегом | Иней | Туман |
| Изморось | Атмосферное оледенение | Морская пена |
| Переохлаждённая морось | Гололёд | |
| Снег | ||
| Снежная крупа | ||
| Снежные зерна | ||
| Ледяная крупа | ||
| Ледяной дождь | ||
| Град | ||
| Ледяные кристаллы |
Осадки согласно состоянию
| Жидкие осадки | Твёрдые осадки |
|---|---|
| Дождь | Снег |
| Дождь со снегом | Снежная крупа |
| Изморось | Снежные зерна |
| Переохлаждённая морось | Ледяная крупа |
| Роса | Ледяной дождь |
| Град | |
| Ледяные кристаллы | |
| Иней | |
| Атмосферное оледенение | |
| Гололёд |
Виды воды
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и в свою очередь приобретать самые разные формы, которые зачастую соседствуют друг с другом. Водный пар и облака в небе, морская вода и айсберги, горные ледники и горные же реки, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни» её нередко подразделяют на типы.
Характеристики вод
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Исследования воды
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Биологическая роль
Вода играет уникальную роль, как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Применение
Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90% в некоторых странах.
Питьё и приготовление пищи
Живое человеческое тело содержит от 55% до 78% воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить от 1 до 7 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и пр.
Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции от огня в составе пены.
Спорт
Многие вида спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
Инструмент
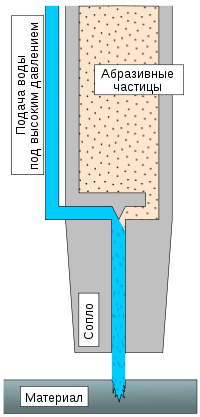
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.