Окклюзия пмжв что это
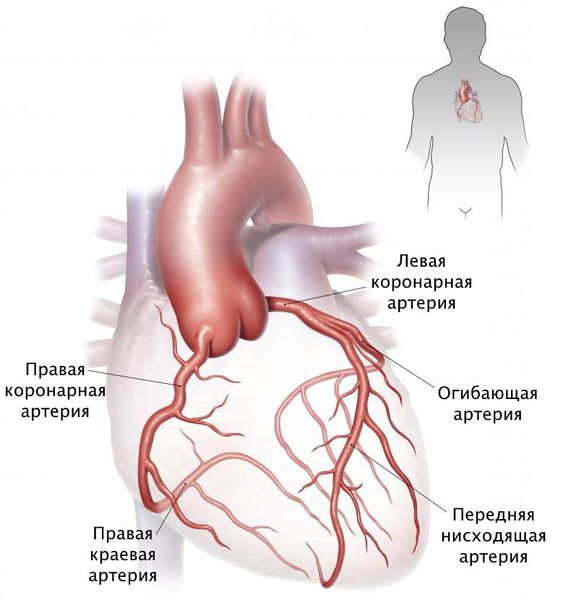
Ишемическая болезнь сердца
Больным ишемической болезнью сердца (ИБС) в настоящее время предлагается широчайший спектр диагностических пособий: коронарография и вентрикулография, радионуклидные исследования жизнеспособного объема миокарда, с которыми в последнее время эффективно конкурируют эхокардиографические методы исследования с применением различных нагрузочных проб.
Проба с нагрузкой (рис.1).

Лечение
Коронарограмма пациента с ИБС.



 |  |
Хирургия коронарной болезни в Центре прошла путь от первых непрямых вмешательств в конце 50-х годов до самых современных прямых воздействий на коронарный кровоток. В настоящее время достигнуты уникальные результаты у больных с осложненными формами ИБС (аневризма сердца, ишемическая дисфункция клапанов сердца, дефекты межжелудочковой перегородки), осложняющих течение заболевания резким снижением сократительной способности миокарда (фракция выброса менее 25%), недостаточностью кровообращения III-IV стадий. Благодаря особым режимам искусственного кровообращения, применению новых методов кардиоплегии, интенсивному использованию вспомогательного кровообращения и новым операциям с моделированием исходной геометрии левого желудочка удалось до минимума снизить риск таких вмешательств и добиться существенного повышения насосной функции сердца.
Что такое стеноз коронарных артерий? Причины возникновения, диагностику и методы лечения разберем в статье доктора Тарасовой Анастасии Николаевны, кардиолога со стажем в 15 лет.
Определение болезни. Причины заболевания
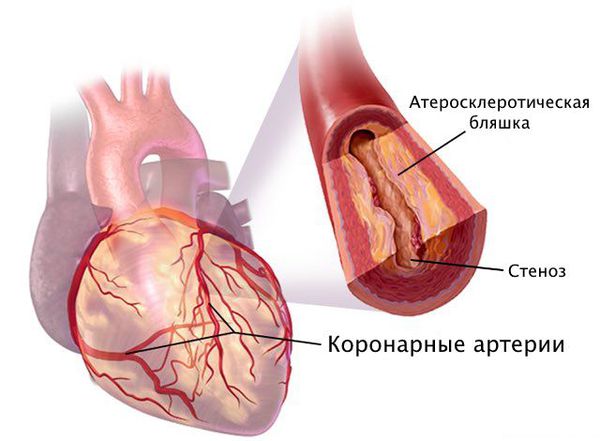
Стеноз коронарных артерий — это стойкое сужение просвета сосудов, по которым к сердцу поступает кислород и питательные вещества, необходимые для его нормальной работы. При сужении этих артерий сердце продолжает работать в обычном режиме, но постепенно перестаёт справляться со своими функциями в полной мере, из-за чего начинает страдать весь организм: нарушается объём циркулирующей крови, состояние сосудов и внутренних органов.
К основным причинам сужения сердечных артерий относятся:
Р едкие причины сужения сердечных артерий:
К факторам риска относятся:
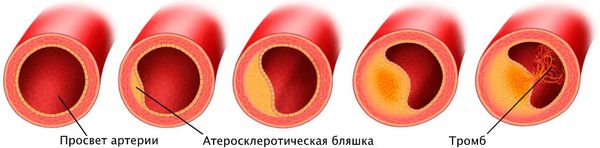
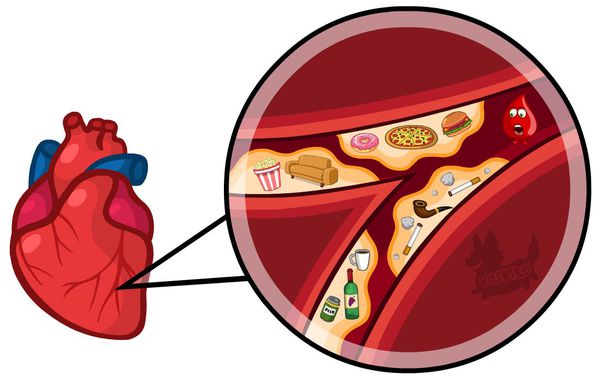
Наиболее частая причина стеноза — атеросклероз. С возрастом холестериновые бляшки прикрепляются к внутренней стенке сосуда, увеличиваются и значительно сужают его просвет, тем самым затрудняя движение крови.
Симптомы стеноза коронарных артерий
Болезнь часто проявляет себя не сразу, так как развивается стеноз довольно медленно и долго — десятки лет.
На ранних этапах симптоматика размытая. Нередко признаки болезни проявляются только во время физических нагрузок. В таком случае присутствует:
При развитии хронической сердечной недостаточности к этим симптомам присоединяется отёк ног.
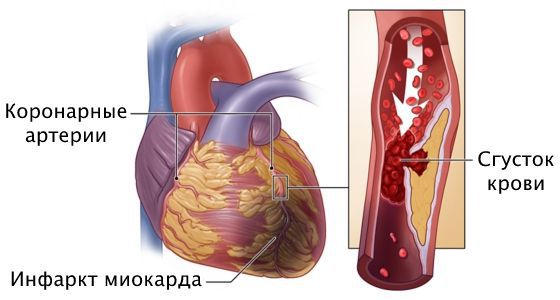
При прогрессировании стеноза происходит полное закупоривание артерии, вызывая некроз сердечной мышцы, т. е. гибель отдельных участков сердца. Это приводит к инфаркту миокарда и острой сердечной недостаточности. В таком случае загрудинная боль становится ещё сильнее, артериальное давление падает ниже 90 мм рт. ст. или на 30 мм рт. ст. ниже нормы, пациента «бросает в пот», ему не хватает воздуха, возникает слабость, тревога, нарушается сердечный ритм. Возможна потеря сознания вплоть до смертельных исходов. Эти симптомы могут наступить молниеносно или развиваться в течение нескольких часов или дней.
Почему признаки стеноза чаще проявляется только при физической нагрузке?
Дело в том, что при хронической ишемии сердца, которая развивается на фоне стеноза, организм начинает активно использовать компенсаторные механизмы: в кровотоке возникают обходные пути, которые без определённой физической нагрузки полностью или частично сглаживают проявления стеноза.
Патогенез стеноза коронарных артерий
Патогенез стеноза при атеросклерозе связан с атеросклеротической бляшкой. Её увеличение уменьшает просвет артерии и снижает кровоснабжение сердца.
Поражение сердечных сосудов при атеросклерозе начинается с повреждения сосудистой стенки и увеличения концентрации в крови «плохого» холестерина — липопротеинов низкой плотности. Эти причины приводят к скоплению липопротеинов в области трещины стенки сосуда. Сливаясь между собой, они срастаются слоем соединительной ткани.
Выделяют три стадии развития атеросклероза:
Вероятно, атеросклероз нарушает функциональное состояние артерий или вызывает склеивание тромбоцитов с выделением тромбоксана, который способствует вазоспазму — непроизвольному сокращению мышечного слоя артерии.
В то же время, при атеросклерозе без признаков стеноза вазоспазм может привести к значимому снижению кровотока. Кроме того, вазоспазм бывает причиной тяжёлых аритмий у людей с неизменёнными коронарными артериями.
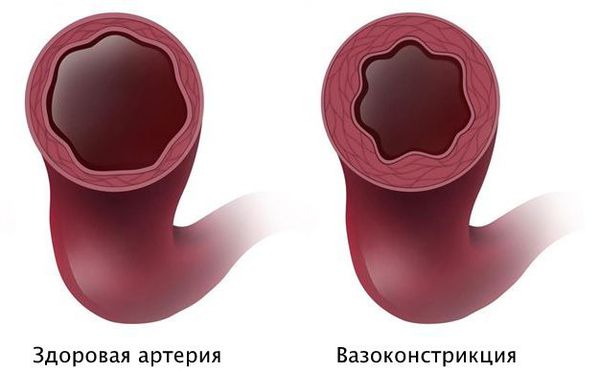
Патогенез стеноза при спазме коронарных артерий связан с повышенной склонностью к вазоконстрикции — сужению просвета из-за временного гипертонуса сосудистой стенки. Возникающий вазоспазм способствует локальному склеиванию тромбоцитов и развитию инфаркта миокарда.
Короткий интенсивный спазм артерии может быть сле дствием дисфункции эндотелия, когда внутренняя оболочка сосуда не может нормально выполнять свои функции.
К другим факторами развития спазма относят:
Классификация и стадии развития стеноза коронарных артерий
Стенозы коронарных артерий различают по локализации и степени сужения.
По локализации выделяют:
По степени сужения артерий различают:
Осложнения стеноза коронарных артерий
Сужение сердечных артерий может проявиться в виде стабильной/нестабильной стенокардии или безболевой ишемии миокарда — гипоксии сердца. Без адекватного лечения стеноз может вызвать инфаркт миокарда и острую сердечную недостаточность с летальным исходом.
Стенокардия — это приступы боли или сдавления за грудиной с иррадиацией в область челюсти, шеи, левой руки, предплечья и живота. Этот приступ провоцируют:
Безболевая ишемия миокарда проявляется в виде сильной утомляемости и одышки. Иногда провоцирует развитие сердечной недостаточности. В патогенезе такой ишемии не исключена роль генетической недостаточности рецепторов восприятия боли — ноцицепторов.
Нестабильная стенокардия включает в себя:
Вазоспастическая спонтанная стенокардия возникает из-за спазма коронарных артерий, чаще в состоянии покоя. Как правило, вазоспазм развивается в поражённых, суженных атеросклерозом артериях в связи с их повышенной чувствительности к сосудосуживающим воздействиям. При этом на ЭКГ не появляются признаки инфаркта миокарда, хотя клинические проявления этой болезни схожи с симптомами такой стенокардии.
Инфаркт миокарда — это омертвение участка сердечной мышцы из-за острого нарушения кровоснабжения. При развитии этого осложнения самочувствие человека резко ухудшается, загрудинная боль усиливается, длится 20 минут и больше, возникает одышка, падает артериальное давление, проступает холодный пот, нарушается сердечный ритм, кожа бледнеет, человек может потерять сознание. Требуется экстренная госпитализация в отделение реанимации или кардиологии. Промедление чревато летальным исходом.
Причина инфаркта — стремительная закупорка сердечной артерии. Этому событию предшествует атеросклероз с вазоспазмом, тромбоз, эмболии или воспаление стенок артерий.
Диагностика стеноза коронарных артерий
Во время опроса пациента врач должен обратить внимание на характер и локализацию боли, её провоцирующие факторы, связь с физической нагрузкой, эффективность приёма нитратов для купирования боли и т. д.
Однако зачастую стеноз коронарных артерий протекает бессимптомно и проявляет себя только при остром тромбозе. Поэтому в диагностике болезни важны клинические данные и инструментальные методы исследования:
Перед коронарографией обязательно проводятся нагрузочные тесты и стресс-ЭхоКГ. Они помогаю определить, нужна пациенту эта процедура или нет.
Нагрузочные тесты включают велоэргометрию и тредмил-тест. Они представляют собой запись ЭКГ во время бега на беговой дорожке или езды на велотренажёре. Это позволяет оценить изменения ЭКГ на фоне физической нагрузки.
Стресс-ЭхоКГ — ультразвуковое исследование сердца во время нагрузки: медикаментозной или физической. Медикаментозная нагрузка показана пациентам, которые не могут перенести другой вид нагрузки. Она включает приём специальных препаратов, например добутамина.
Выявить стеноз коронарных артерий также помогают:
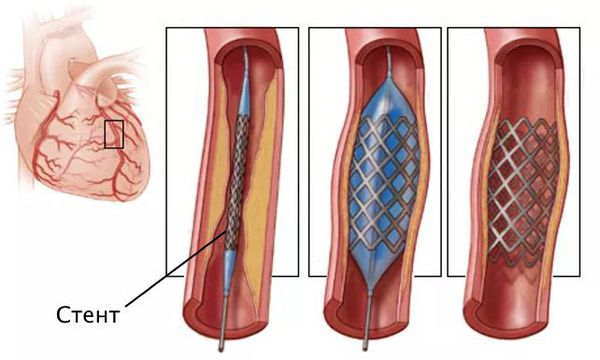
При подтверждении ишемии выполняют коронарную ангиографию с возможным стентированием — установкой специального каркаса (стента) в просвет поражённого сосуда.
Лечение стеноза коронарных артерий
Выделяют две группы методов лечения:
Длительность приёма у каждого препарата разная. Коррекция доз и замена лекарств производится строго под контролем врача.
Хирургическое лечение включает два основных вида воздействия на стеноз коронарных артерий:
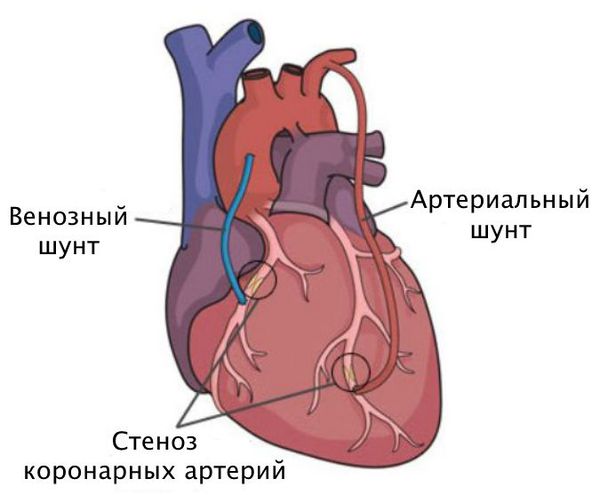
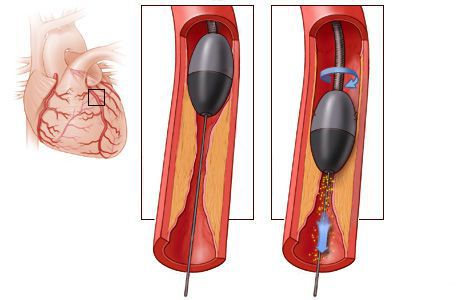
Стентирование предполагает установку стента в суженный сосуд. С тент представляет собой металлический каркас. При помощи проводника через бедренную или лучевую артерию этот каркас продвигают до поражённой коронарной артерии, фиксируют там и расправляют. Он не даёт артерии сужаться и нормализует кровоток.
Стентирование производится как планово для профилактики инфаркта миокарда, так и экстренно. Операция малоинвазивная: не требует обширных разрезов и общего наркоза.
Шунтирование направлено на создание нового пути кровотока в обход закупоренного сосуда. Материалом для шунта служат собственные вены и артерии пациента. Хирург подшивает их выше и ниже сужения коронарной артерии.
Прогноз. Профилактика
В основе профилактики лежит комплекс мероприятий по предотвращению сужения коронарных артерий. Это:
Обследование включает общеклинические анализы, исследование липидного профиля, ЭКГ, УЗИ сердца, суточное мониторирование ЭКГ и нагрузочные пробы. При необходимости проводится стресс-ЭхоКГ, МРТ сердца и мультиспиральная КТ коронарных артерий, по показаниям — коронароангиография.
Опыт эндоваскулярного лечения ишемической болезни сердца у пациентов с хронически окклюзированными коронарными артериями
Хронически окклюзированные коронарные артерии составляют значительную часть коронарных поражений, выявляемых у пациентов с ишемической болезнью сердца (ИБС) при проведении диагностической коронароангиографии (КАГ) и, в определенной клинической ситуации,
Хронически окклюзированные коронарные артерии составляют значительную часть коронарных поражений, выявляемых у пациентов с ишемической болезнью сердца (ИБС) при проведении диагностической коронароангиографии (КАГ) и, в определенной клинической ситуации, требующих проведения реваскуляризации миокарда.
Так, окклюзированные коронарные артерии выявляются примерно у 40% пациентов, а коронарная ангиопластика на хронически окклюзированных коронарных артериях составляет 10—20% всех интервенционных процедур [1].
Многие авторы ссылаются на то, что при ангиопластике хронических окклюзий коронарных артерий процент успешных вмешательств ниже, тогда как время облучения больше и стоимость процедуры выше, чем при ангиопластике у больных со стенотическими поражениями [10].
В Научно-практическом центре интервенционной кардиоангиологии (НПЦИК) при проведении плановой диагностической КАГ также довольно часто обнаруживаются полные хронические окклюзии 1-2 или более коронарных артерий. В связи с чем нами было проведено исследование, целью которого явилась оценка эффективности эндоваскулярного лечения хронически окклюзированных коронарных артерий.
В НПЦИК в период с октября 1997 по декабрь 2002 гг. были осуществлены 380 попыток механической реканализации хронически окклюзированных коронарных артерий у 375 больных. При этом успешными процедуры были признаны у 253 больных (67,5%), которым реканализировали 258 сегментов. В 122 случаях (32,5%) процедура реканализации оказалась неэффективной.
Проводниковая реканализация и коронарная ангиопластика окклюзированной артерии выполнялись 107 больным на 107 сегментах; реканализация, транслюминальная баллонная ангиопластика (ТЛАП) и стентирование — 146 больным, которым был реканализирован 151 сегмент.
В нашем исследовании в 2 случаях (0,53%) имелись осложнения — разрыв коронарной артерии передней межжелудочковой ветви левой коронарной артерии (ПМЖВ) и правой коронарной артерии (ПКА), потребовавшие хирургического вмешательства — эмболизации и ушивания артерии соответственно. Оба пациента живы и выписаны из клиники.
В настоящем исследовании представлены результаты обследования и лечения 185 человек ИБС, которым была выполнена процедура реканализации хронически окклюзированной коронарной артерии и которые прошли контрольное обследование, включающее коронароангиографию.
Пациенты были разделены на 2 группы: у 146 человек проводилось стентирование 151 сегмента после реканализации хронически окклюзированной коронарной артерии, у 107 больных — проведена ТЛАП. В исследование не включались больные, у которых процедура осуществлялась в острой стадии инфаркта миокарда (ИМ), а также пациенты, перенесшие ранее процедуры на венечных сосудах.
Диагностику ИБС и ее форм проводили на основании тщательного сбора анамнеза, данных электрокардиографии (ЭКГ), холтеровского мониторирования ЭКГ, эхокардиографического исследования (ЭхоКГ), велоэргометрической пробы (ВЭМ), клинического и биохимического анализа крови (КФК, КФК-МБ, АСТ, ЛДГ, холестерина и липидного спектра крови). Для оценки состояния и степени поражения коронарных артерий, сократительной и функциональной способности миокарда левого желудочка (ЛЖ) всем пациентам выполняли селективную коронароангиографию и левую вентрикулографию (ВГ).
Показаниями для проведения эндоваскулярной процедуры являлись приступы стенокардии, признаки ишемии миокарда, по данным суточного мониторирования ЭКГ, а также положительные результаты нагрузочных проб.
Клиническая характеристика пациентов представлена в таблице. В подавляющем большинстве случаев наблюдался III функциональный класс (ФК) стенокардии напряжения — 60,0 и 72,0% в 2 группах соответственно. Стенокардия напряжения I ФК в обеих группах больных в исследовании не встречалась. У 3 (4%) пациентов из группы ТЛАП была выявлена безболевая ишемия миокарда.
Инфаркт миокарда ранее перенесли 80% человек из первой группы и 86,7% пациентов второй группы, гипертоническая болезнь различной стадии и длительности была выявлена соответственно у 60,9 и 69,3% больных.
Сахарным диабетом 2 типа страдали 7,3% пациентов в группе стентирования и 5,3% больных в группе ТЛАП. Во всех случаях имела место средняя тяжесть течения заболевания. Сахарный диабет 1 типа не встречался в нашем исследовании ни в одном случае.
Предполагаемая длительность («возраст») окклюзии определялась как период времени от перенесенного инфаркта миокарда в области, кровоснабжаемой окклюзированной артерией, либо от эпизода стенокардии большей, чем обычно, интенсивности. Длительность окклюзии до 3 мес. наблюдалась у 46,4% пациентов из первой группы и у 46,7% — из второй группы. «Возраст» окклюзии от 3 до 6 мес. был выявлен у 30,9% больных первой группы и у 25,3% больных второй группы, от 6 до 12 мес. — 14,5 и 17,3% соответственно, свыше 12 мес. — 8,2 и 10,7% больных соответственно.
Для уточнения характера поражения коронарного русла и оценки функции ЛЖ всем больным выполнялись селективная КАГ и левая ВГ. Гемодинамически значимыми считались поражения, стенозирующие просвет коронарной артерии более чем на 50%.
Общее количество гемодинамически значимых атеросклеротических поражений (больше 50% просвета артерии) составило 248 у 110 больных в группе стентирования и 152 у 75 больных в группе ТЛАП. Основное количество поражений было локализовано в ПМЖВ и ПКА.
Наиболее часто процедура выполнялась на ПМЖВ — 50,45 и 56,0%, в первой и второй группах соответственно. На ПКА было выполнено 25,67% процедур в группе стентирования и 21,30% в группе ТЛАП. На огибающей ветви левой коронарной артерии (ОВ ЛКА) — 19,47 и 17,30% процедур соответственно.
Все больные получали симптоматическую терапию, заключавшуюся в назначении нитратов (нитросорбид, кардикет, моно мак), β-блокаторов (атенолол, конкор, эгилок, беталок-ЗОК, дилатренд), антагонистов Са (амловас, норваск, нормодипин, лацидипин), ингибиторов АПФ (эналаприл, престариум, фозиноприл) и статинов (зокор, липримар, симгал).
Непосредственный ангиографический успех процедуры у больных после проведения стентирования и баллонной ангиопластики был довольно высоким, остаточный стеноз не превышал 30%, а антеградный кровоток у всех пациентов определялся как TIMI III. В подавляющем большинстве случаев диаметр стентированного сегмента практически не отличался от прилегающих интактных сегментов коронарной артерии.
Для имплантации применялись различные стенты, однако наиболее часто использовались следующие стенты: BX Velocity (Cordis, Johnson&Johnson) — 26 (23,0%), BX Sonic (Cordis, Johnson&Johnson) — 15 (13,3%), CrossFlex (Cordis, Johnson&Johnson) — 14 (12,4%), Biodivysio (Biocompatible) — 12 (10,6%), Angiostent (Angio Dynamics, NJ) — 10 (8,9%), Multilink (Guidant, Santa Clara, CA) — 7 (6,2%). Средняя длина стента составила 17,96±4,79 мм, средний диаметр стента — 2,98±0,27 мм.
У 9 (8,2%) больных в основную артерию были установлены по 2 коронарных стента. У 1 (0,9%) больного в основную артерию имплантировано 3 стента.
При проведении стентирования ни в одном случае не отмечалось острого или подострого тромбоза стента. Спазм коронарной артерии после стентирования определяли в 2 (1,8%) случаях, что потребовало только медикаментозной коррекции. У 3 (2,7%) пациентов была отмечена окклюзия боковой ветви, ни в одном случае не сопровождавшаяся существенной клинической симптоматикой или развитием инфаркта миокарда.
Одновременно с основной процедурой 31 больному проводилась эндоваскулярная процедура на другом поражении коронарного русла. При этом у 24 (21,8%) больных была выполнена одна дополнительная процедура, у 7 (6,4%) пациентов — 2 процедуры.
В результате проведенного эндоваскулярного лечения полная реваскуляризация миокарда, т. е. устранение всех гемодинамически значимых стенозов, оказалась выполнена более чем у 60% больных в обеих группах.
На госпитальном этапе отсутствие обострений после вмешательства отмечали у 100% больных в группе стентирования и у 98,7% в группе ТЛАП, т. е. у всех больных проведение эндоваскулярных процедур обусловило стабилизацию состояния и купирование приступов стенокардии. Развития острого инфаркта миокарда, необходимости в оперативном лечении ни в одном случае отмечено не было. Госпитальной летальности в нашем исследовании также не наблюдалось.
Полученные в настоящее время данные рандомизированных исследований свидетельствуют о том, что позднее открытие окклюзированных венечных артерий оказывает положительное влияние на частоту неблагоприятных кардиальных событий в отдаленном периоде (снижение смертности, частоты повторных ИМ), улучшает функцию ЛЖ, влияет на его ремоделирование после перенесенного ИМ.
Отмечено, что выживаемость пациентов через 2 года после коронарной ангиопластики составляет 98%, а отсутствие инфарктов за тот же период отмечалось у 94% больных [2, 12].
По данным исследования, проведенного P. A. Sirnes, у пациентов после реканализации, ТЛАП и стентирования хронически окклюзированных коронарных артерий в отдаленном периоде наблюдалось значительное улучшение клинического состояния по сравнению с исходным. До ТЛАП 83% пациентов принимали b-блокаторы и 55% — нитраты. В отдаленном периоде соответствующие цифры составили 53 и 9% (p Рисунок 1. Ангиограмма пациента Ф. (68 лет), с хронической окклюзией ПКА
Частота рестеноза ТЛАП, согласно многочисленным исследованиям, выполненным в различных странах, колеблется в пределах от 17 до 50% [3, 4, 5, 7, 8, 9, 13].
По данным P. A. Sirnes и соавт., после баллонной ангиопластики хронически окклюзированных коронарных артерий частота отдаленного рестеноза составляет 53%, после стентирования коронарных артерий — 40% [11].
Анализ наших собственных данных (НПЦИК) показывает, что в отдаленные сроки после стентирования хороший ангиографический результат процедуры сохранялся в 68 (60,2%) артериях (рис. 1—3). Рестеноз стента был выявлен в 28,3%, реокклюзия — в 11,5% случаев.
 |  |
| Рисунок 2. Ангиограмма пациента Ф. (68 лет) после проведения механической реканализации, ТЛАП и стентирования ПКА | Рисунок 3. Отдаленный результат механической реканализации, ТЛАП и стентирования хронически окклюзированной ПКА (через 7 месяцев) |
Менее утешительные результаты получены после коронарной ангиопластики в аналогичных ситуациях: хороший результат процедуры выявлен лишь в 41,3% случаев, рестеноз в месте проведения ангиопластики наблюдали в 38,7% случаев, а реокклюзию — у 20% больных.
Таким образом, в отношении сохранения хороших результатов проведения ангиопластики стентирование хронически окклюзированных венечных артерий обладает достоверными преимуществами по сравнению с баллонной ангиопластикой.
Мы считаем, что по мере развития материально-технической базы медицинских учреждений, накопления опыта проведения интервенционных вмешательств, а также более точного отбора больных доля успешно выполненных процедур будет расти.
На основании всего вышеизложенного можно сделать следующие выводы.
По вопросам литературы обращайтесь в редакцию.
Д. Г. Иоселиани, доктор медицинских наук, профессор
М. В. Яницкая, кандидат медицинских наук
А. В. Кононов, О. В. Захарова, П. Ю. Лопотовский
Научно-практический центр интервенционной кардиоангиологии, Москва