какая валентность у озона
Какая валентность у озона
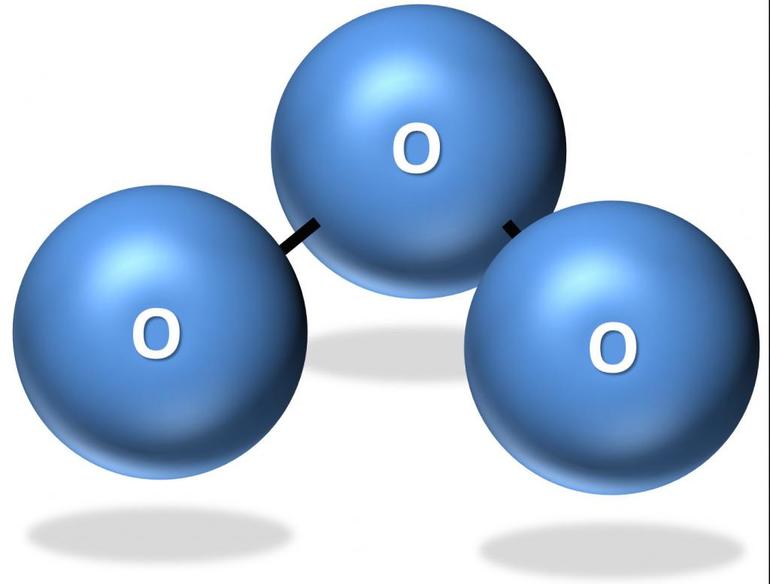
С озоном вы уже знакомились в главе 1, когда мы рассказывали о составе атмосферного воздуха, в котором озон присутствует в виде незначительной примеси. В чистом виде озон O3 – голубой газ с резким запахом (греческое озос – пахучий). Строение молекулы озона можно изобразить разными способами. Например, комбинацией двух крайних (или резонансных) структур. Каждая из таких структур не существует в реальности (это как бы «чертеж» молекулы), а настоящая молекула представляет собой нечто среднее между двумя резонансными структурами.
Хотя молекулярный кислород и озон составлены из атомов одного и того же элемента кислорода – это разные вещества. С таким же явлением на примере углерода мы уже сталкивались в главе 3 (алмаз и графит). Оно называется аллотропией. Графит и алмаз – разные вещества, хотя и тот и другой состоят только из углерода. Теперь мы наблюдаем такое же явление у кислорода.
Если какой-либо элемент образует два или несколько простых веществ, то такие вещества называются аллотропными модификациями. Само это явление называется аллотропией.
Итак, озон и молекулярный кислород – две разные аллотропные модификации элемента кислорода.
В лаборатории озон получают при «тихом» (без искр) электрическом разряде в стеклянной трубке, через которую пропускается ток кислорода. Такой прибор называется озонатором. Есть и другие лабораторные способы получения озона.
** Кому-то из читателей (особенно участникам химических олимпиад) наверняка знаком классический способ получения пероксида водорода H2О2 из пероксида бария BaO2 при действии разбавленной серной кислоты.
Пероксиды – это вещества, содержащие связь О–О. Интересно, что если взять не разбавленную, а концентрированную серную кислоту, то реакция идет по другому пути и образуется озон:
Резина быстро разрушается в атмосфере озона, а спирт при соприкосновении с ним воспламеняется. В чем же причина такой высокой окислительной способности озона?
С другой стороны, способность озона разлагаться с образованием атомарного кислорода делает его почти идеальным средством для обеззараживания питьевой воды. Озон убивает болезнетворные бактерии окислением, частично превращаясь при этом в молекулярный кислород. Поэтому озонированная вода лучше и вкуснее хлорированной, которую до сих пор приходится пить жителям многих городов.
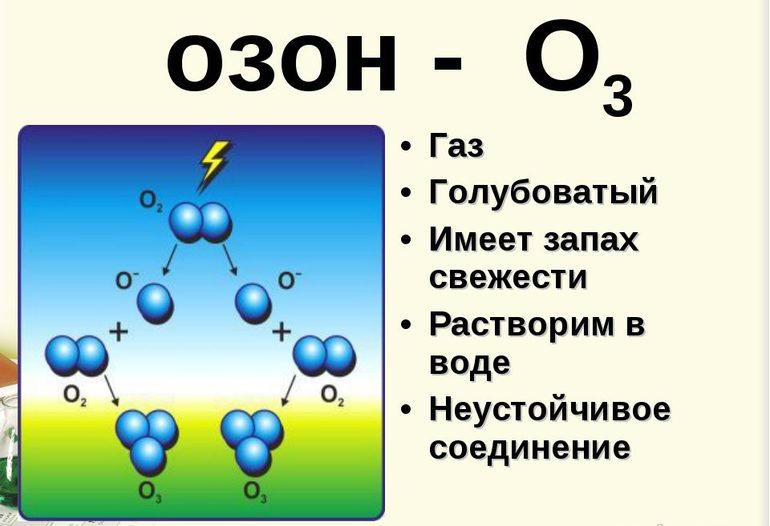
Основная масса природного озона образуется в верхних слоях атмосферы из молекул O2 в результате поглощения «жесткого» (т.е. несущего много энергии) ультрафиолетового излучения Солнца:
Рис. 6-7. Озон образуется под действием ультрафиолетовых лучей с длиной волны менее 180 нм. УФ-свет с большей длиной волны (около 320 нм), наоборот, способствует разложению озона. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов. Когда мы загораем на солнце, на нашу кожу падают «мягкие» ультрафиолетовые лучи, не способные принести вреда здоровью (если загорать в меру).
Ряд исследователей считает, что возникновение озоновых дыр связано не столько с загрязнением атмосферы хлор- и фторуглеводородами, сколько с особенностями атмосферной циркуляции в различных районах Земли. Вопрос пока остается открытым. Впрочем, снижение промышленного загрязнения атмосферы в любом случае пошло бы на пользу климату и биосфере нашей планеты.
Вполне вероятно, что проблема промышленных выбросов в атмосферу – это не только проблема загрязнения поверхности Земли вредными веществами, но еще и проблема «загрязнения» солнечного спектра жестким, вредным для человека ультрафиолетовым излучением в результате частичного разрушения озонового слоя.
Но не стоит и преувеличивать опасность: полное исчезновение озона не грозит атмосфере до тех пор, пока в ней есть кислород и пока светит Солнце.
Таблица валентности.
В таблице валентности приведены значения валентности элементов периодической таблицы Менделеева. Что такое валентность?
Точками здесь обозначаются неподеленные пары электронов, однако в структурных формулах их отмечают не каждый раз.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность. Чтобы проще было понимать и не путаться, ниже приведена таблица валентностей всех элементов периодической таблицы.
Цифра положительной валентности элемента соответствует количеству отданных атомом электронов, а отрицательной валентности – количеству электронов, которые атом должен забрать себе для завершения внешнего энергетического уровня.
Значение, приведенное в скобках таблицы валентности, перечисляет менее распространенные валентности. Если у элемента указана только одна цифра, значит он может иметь только одну валентность.
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число
Русское / Английское наименование
История открытия
Озон был открыт в 1785 году. Нидерландский физик Мартин Ван Марум обнаружил вещество во время проводимых им опытов. Учёный пропустил через воздух электрический ток, после чего возник незнакомый запах. В результате реакции получился неизвестный газ синеватого цвета. По окислительным свойствам вещество оказалось сильнее кислорода. Кроме того, неизвестный газ воздействовал на ртуть при нормальных условиях и заставлял её терять характерный блеск и прилипать к стеклу.
Ван Марум полагал, что это была некая электрическая материя. Но он не считал его открытие важным. Только через половину столетия этим газом снова заинтересовались учёные.
Немец Кристиан Фридрих Шенбейн тщательно изучил нераскрытую материю и её свойства. В 1840 году он дал веществу название «озон», что на греческом означает «пахнуть». Такое наименование было связано со специфическим запахом газа. По ошибке многие считают, что именно Шенбейн был первооткрывателем этой материи. Учёный провёл эксперимент, в ходе которого озон вытеснял иод из иодида калия. Эта качественная реакция позволяет определить наличие вещества при помощи иодкрахмальной бумаги, которая приобретает синий оттенок.
В 1860 году было доказано, что при превращении кислорода в озон объём газа уменьшался. Для опытов химики Тэт и Эндрюс использовали стеклянную трубку с манометром, наполненную O2, с впаянными в неё проводниками из платины, которые способствовали получению электрического заряда.
Способы получения
Газ образуется во многих процессах, которые сопровождаются выделением атомарного кислорода. Озон формируется при разложении пероксидов, окислении фосфора и т. д.
В промышленной сфере вещество получают в специальном оборудовании, которое называют озонатор. Через воздух проводят электрическую искру, которая даёт реакцию 3O2→cur2O3. Получившийся газ отделяют фракционной перегонкой.
В лабораторных условиях используют пероксид бария, который обрабатывают концентрированной серной кислотой. В результате реакции получаются сульфат бария и озон.
В медицинских учреждениях, где вещество применяют для оздоровления пациентов, средство получают путём облучения кислорода ультрафиолетом. Именно этим способом газ образуется и в атмосфере нашей планеты под воздействием солнца.
Вещество в атмосфере
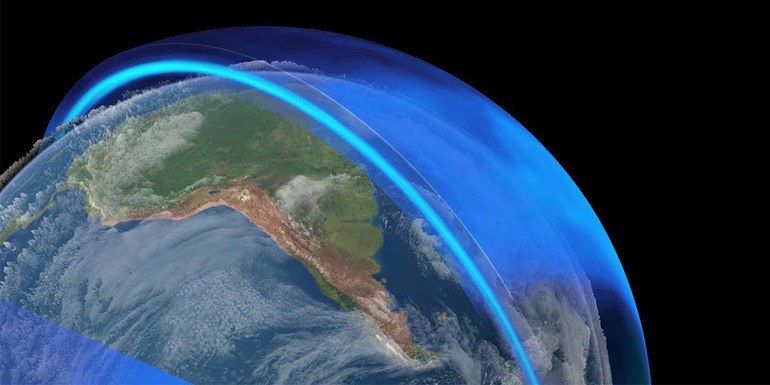
В атмосфере Земли озон находится в объёме 4 млрд тонн. Его концентрация растёт с удалением от поверхности планеты. Максимальное количество газа находится в стратосфере. Озоновый слой наблюдается на высоте 20−25 км от Земли. Хотя озона в атмосфере не так много, его хватает для обеспечения жизни на планете. Газ создаёт особый защитный слой, который не даёт опасным ультрафиолетовым лучам достичь поверхности Земли.
В последние годы специалисты уделяют много внимания появлению «озоновых дыр». В этих областях наблюдается значительно уменьшенный объём стратосферного вещества. Через такой тонкий газовый слой до Земли доходит жёсткое ультрафиолетовое излучение. Озон могут разрушать пыль, газы и различные естественные факторы.
Кроме того, существуют искусственные причины, воздействующие на озоновый слой. Например, фирмы создают фреоны с атомами хлора, которые используются в холодильной технике и для заполнения аэрозольных баллончиков. Эти соединения попадают в воздух, а затем постепенно поднимаются и достигают озонового слоя. Под воздействием солнечной радиации фреоны разлагаются и разрушают его.
Также следует учитывать тот факт, что сегодня люди вдыхают больше озона, чем в далёком прошлом. Это связано с загрязнением воздуха большими объёмами метана и оксидов азота.
Физические особенности
Основные физические свойства озона:
O 3 растворяется в воде в 10 раз быстрее, чем кислород. А с наличием примесей реакция ускоряется в несколько раз. В виде газа озон выступает диамагнетиком, а в жидком состоянии — слабым парамагнетиком. Производная кислорода отлично растворяется во фреонах с образованием стабильных растворов, которые возможно перевозить. Жидкий озон можно смешивать с азотом, аргоном, метаном, фтором, углекислотой и тетрахлоруглеродом в том же агрегатном состоянии.
Химическая природа
Молекулы озона отличаются неустойчивостью. После образования они существуют около 10−30 минут, а затем начинают разлагаться, образуя кислород и большой объём тепла. Если температура окружающей среды будет высокой, тогда процесс реакции ускорится. Тот же эффект наблюдается и при понижении атмосферного давления.
Среди химических свойств озона следует выделить его высокую реакционную способность. Он окисляет металлы (за исключением платины, золота и иридия), органические вещества, а также повышает степень окисления у оксидов. Действующим началом газа в качестве окислителя выступает атомарный кислород, который образуется при распаде молекулы озона. Однако в некоторых случаях в окислении участвуют все три атома элемента. Озон считается сильным окислителем, хотя уступает в этом плане фтору и фториду кислорода.
Если смешать озон с концентрированным раствором аммиака, получится нитрит аммония с выделением белого дыма. Вещество также способно «чернить» изделия из серебра, образуя AgO и Ag2O3.
Молекула газа становится стабильнее, если она превращается в отрицательный ион О3-. Такие анионы содержатся в озонидах (озонокислых солях). Соединения разлагаются во время хранения или при избытке H2O. Озонокислые соли хорошо растворяются в жидком аммиаке.
Газ способен уменьшать токсичность некоторых веществ. Например, он может окислить цианиды до цианатов, которые безопаснее для живых организмов.
Области использования
В Российской Федерации озон относится к группе вредных веществ первого класса опасности. Сильные окислительные свойства делают его опасным для здоровья человека. Однако вещество широко используется в разных сферах.
Основные области применения озона:
Озон применяется для дезинфекции одежды и помещений, озонирования растворов медицинского назначения. Также вещество используется в качестве дезинфицирующего средства при очистке воздуха и воды от вредных микроорганизмов.
Озонирование воды имеет много преимуществ перед хлорированием, поскольку в обработанной жидкости отсутствуют токсины. Кроме того, озон лучше растворяется в воде.
Если верить заявлениям озонотерапевтов, здоровье пациентов значительно улучшается, когда лечение включает пероральное или внутривенное применение вещества. Однако пока нет объективных клинических подтверждений терапевтического эффекта. Сегодня озонотерапию используют только в некоторых частных клиниках развитых стран, где она не считается лечебным методом. Поскольку доказано мутагенное и токсическое действие этого вещества, пациентов лечат озоном только с их согласия и лишь в тяжёлых случаях.
С начала XXI века многие компании начали выпускать бытовые озонаторы. Такие устройства предназначены для дезинфекции помещений. Перед их использованием необходимо прочитать инструкцию по применению техники. Поскольку некоторые фирмы не пишут в аннотациях о мерах безопасности при работе с озонаторами, не рекомендуется приобретать их продукцию.
Влияние на здоровье человека
Некоторые считают, что озон, как и кислород, полезен для организма. Многие люди любят гулять после дождя, когда в воздухе остаётся этот газ из-за грозы. Озон действительно разрушает токсические соединения и очищает кислород от вредных примесей. Из-за этого воздух после дождя свежий и приятный, а небо приобретает привлекательный лазурный оттенок.
Наличие в воздухе озона позволяет легче дышать, но сильный окислитель способен вызвать отравление и привести к летальному исходу. Негативные последствия происходят при превышении определённого порога концентрации и времени вдыхания этого вещества. Газ может вызывать мигрень, головокружения, раздражение слизистых органов зрения и обоняния, снижение артериального давления. Чрезмерное вдыхание вещества нередко способствует тому, что организм перестаёт сопротивляться бактериальным инфекциям дыхательной системы.
Учёные считают, что предельно допустимая концентрация (пдк) озона в воздухе составляет 0,1 мкг/л. Если человек проведёт несколько часов в помещении, где в воздухе будет содержаться больше 0,4 мкг/л вещества, у него появятся болезненные ощущения в груди, кашель и бессонница. Кроме того, возможно снижение остроты зрения. Более тяжёлые последствия наблюдаются при концентрации озона в воздухе свыше 2 мкг/л.
Опасный газ может образовывать с кислородом другое опасное вещество — пероксиацетилнитрат. Органическое соединение затрудняет дыхание и вызывает слезоточивость. Высокие концентрации этого вещества могут привести к параличу сердца.
Занимательные факты
Озон вызывает большой интерес не только у учёных, но и у обычных людей. Хотя это вещество ещё не полностью изучено, о нём уже имеется немало занимательной информации:
Вещество продолжают изучать не только из-за озоновых дыр, которые могут повлиять на будущее людей и всех других живых организмов. Хотя озон опасен, учёные считают, что он способен заменить многие лечебные средства при борьбе с тяжёлыми заболеваниями.
Газ озон: химические, физические свойства, формула, отличия и другое
Содержание:
Кислород – элемент VIA группы. Для него свойственны две аллотропные модификации с разными химическими формулами – кислород О2 и озон О3. Они отличаются не только составом молекул, но и различными характеристиками.
В конце XVIII века ученый Мартин Ван Марум провел эксперимент, в результате которого получил озон. Он через воздушное пространство пропускал электричество. Таким образом, образовался озон – это голубоватый газ с необычным запахом. Ученый предполагал, что полученный газ представляет собой электрическую материю.
В 1840 году ученый Кристиан Фридрих Шенбейн раскрыл структуру и свойства озона. Полученный газ он назвал «озоном» (с греч. языка «пахнуть»). Кристиан Фридрих Шенбейн провел эксперимент, где озон вытеснил йод из иодида калия.
Получение озона
Существует несколько способов получения молекул озона.
Физические свойства озона
Озон – бесцветный (в толстых слоях голубоватый) газ. Он почти в два раза тяжелее воздуха. Озон обладает специфическим запахом свежести.
Озон растворим в воде. Примеси позволяют растворяться еще быстрее. Если озон находится в состоянии газа, то он выступает в роли диамагнетика. Если озон – это жидкость, то проявляет свойства слабого парамагнетика.
Озон ядовит и губителен для бактерий. Его используют при обеззараживании воздуха и воды.
Химические свойства озона
Озон обладает сильными окислительными свойствами по сравнению с кислородом. Он реагирует с рядом веществ.
Если озон находится в состоянии газа, то реакция с сероводородом выглядит следующим образом:
H2S + O3 = SO2 + H2O
Озон способен взаимодействовать со ртутью при обычных условиях. В результате металл теряет блеск и способность липнуть к стеклу.
Токсичность озона
При умеренных концентрациях озон безвреден. Реакции с озоном характеризуются формированием свободных радикалов кислорода, которые губительны для организма при высоком содержании. Чрезмерное воздействие озона часто приводит к гибели. Озон особенно губителен для органов дыхания.
Озоновый слой в верхних слоях атмосферы
Озоновый слой – слой в верхней части атмосфера Земли, который состоит из бесцветного нестабильного газа. Он располагается на высоте 15-20 км над поверхностью планеты. Стратосфера – слой атмосферы, в котором содержится много озона.
Озон образуется в результате воздействия ультрафиолета на кислород. Слой газа задерживает все формы поступающей ультрафиолетовой коротковолновой радиации.
Озоновый экран защищает от вредного излучения, длина волн которого 290-320 нм. Это излучение может спровоцировать рак кожи. Озоновый слой появился на Земле около 600 млн лет назад в результате процесс фотосинтеза. Благодаря озоновому слою первые живые организмы смогли выйти из океана на сушу.
Дыры в озоновом слое
Озоновые дыры – локальное истощение озонового слоя. Самая большая озоновая дыра находится над Антарктидой. Если озоновый слой полностью исчезнет, то все живое на планете погибнет.
Озоновые дыры возникают по многим причинам, главная из которых – загрязнение окружающей среды. Озоновый слой разрушается под воздействием хлора, водорода, кислорода, брома и других продуктов сгорания. Выбросы фабрик, заводов и различных производств негативно влияют на выработку озона в верхних слоях атмосферы.
Реактивные самолеты выбрасывают окислы азота. Чем выше мощность турбореактивного двигателя, тем больше разрушающего вещества попадает в атмосферу. Ежегодно в воздух выбрасывается более 1 млн т соединений азота, из которых треть выбрасывают самолеты.
Защита озонового слоя
До 1989 года на производствах часто применялись галогенированные углеводороды, которые разрушают озоновый слой. Монреальская конвенция разработала программу по сокращению использования хлорфторуглеродов, которые быстро испарялись и достигали стратосферы. Они разлагаются на компоненты и разрушают озоновый слой. Из этих соединений раньше изготавливали аэрозоли, растворители и др.
Озоновые дыры произвольно создаются и исчезают. Это связано с некоторыми природными явлениями и даже климатическими особенностями. Газ озон образуется в результате воздействия ультрафиолета на кислород. Во время полярной ночи дыры образуются из-за того, что солнце не заходит несколько недель и ультрафиолет постоянно влияет на кислород. Во время полярного дня озоновый слой восстанавливается и воздействие ультрафиолета на живые организмы снижается.
Дыры могут формироваться в период активности Солнца. В результате этого они появляются и пропадают. Иногда это занимает несколько дней, реже растягивается на несколько месяцев.
Таблица валентности химических элементов
Таблица валентности химических элементов.
Таблица валентности химических элементов:
Ниже приводится таблица валентности химических элементов с примерами соединений.
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Таблица валентности химических элементов:
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.