какая валентность у марганца
Валентность марганца
Валентность марганца.
Валентность марганца:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
| Валентность марганца в соединениях | |
| II | MnO, Mn(OH)2, MnCl2, MnS, MnCO3, Mn3(PO4)2 |
| III | MnCl3, Mn2O3 |
| IV | MnO2 |
| VI | MnF6, MnOF4, MnO3 |
| VII | Mn2O7, MnO3F |
Таблица валентности.
В таблице валентности приведены значения валентности элементов периодической таблицы Менделеева. Что такое валентность?
Точками здесь обозначаются неподеленные пары электронов, однако в структурных формулах их отмечают не каждый раз.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность. Чтобы проще было понимать и не путаться, ниже приведена таблица валентностей всех элементов периодической таблицы.
Цифра положительной валентности элемента соответствует количеству отданных атомом электронов, а отрицательной валентности – количеству электронов, которые атом должен забрать себе для завершения внешнего энергетического уровня.
Значение, приведенное в скобках таблицы валентности, перечисляет менее распространенные валентности. Если у элемента указана только одна цифра, значит он может иметь только одну валентность.
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число
Русское / Английское наименование
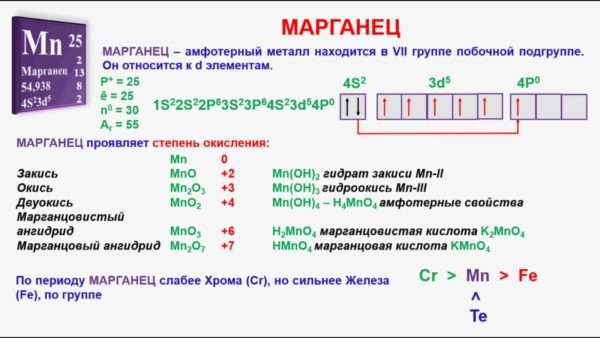
Марганец Mn
Марганец в таблице менделеева занимает 25 место, в 4 периоде.
| Символ | Mn |
| Номер | 25 |
| Атомный вес | 54.9380440 |
| Латинское название | Manganum,Manganesium |
| Русское название | Марганец |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
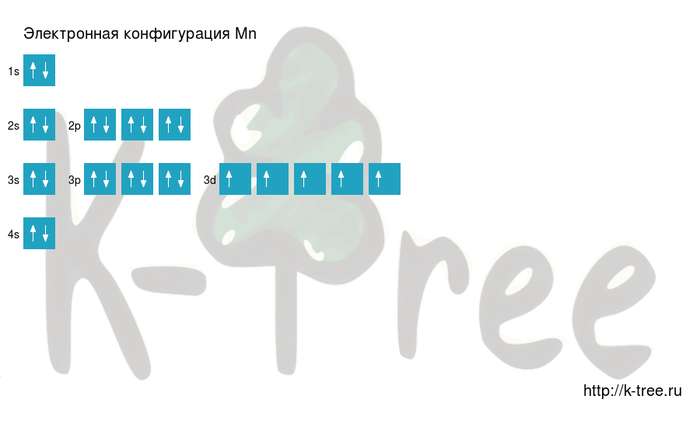
Электронная схема марганца
Mn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5
Короткая запись:
Mn: [Ar]4s 2 3d 5
Порядок заполнения оболочек атома марганца (Mn) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Марганец имеет 25 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
5 электронов на 3d-подуровне
Степень окисления марганца
Ионы марганца
Валентность Mn
Атомы марганца в соединениях проявляют валентность VII, VI, V, IV, III, II, I.
Валентность марганца характеризует способность атома Mn к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mn
Квантовые числа определяются последним электроном в конфигурации, для атома Mn эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Что такое марганец: изучаем химический элемент
Долгое время одно из соединений этого элемента, а именно его двуокись (известна под названием пиролюзит) считалось разновидностью минерала магнитный железняк. Лишь в 1774 году один из шведских химиков выяснил, что в пиролюзите есть неизученный металл. В результате нагревания этого минерала с углем удалось получить тот самый неизвестный металл. Вначале его называли манганум, позже появилось современное название — марганец. Химический элемент обладает многими интересными свойствами, речь о которых пойдет далее.
Марганец как химический элемент
Расположен в побочной подгруппе седьмой группы периодической таблицы (важно: все элементы побочных подгрупп — металлы). Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (типичная формула d-элемента). Марганец как свободное вещество имеет серебристо-белый цвет. Из-за химической активности в природе встречается лишь в виде соединений, таких как окислы, фосфат и карбонат. Вещество тугоплавкое, температура плавления составляет 1244 градуса по шкале Цельсия.
Интересно! В природе встречается только один изотоп химического элемента, имеющий атомную массу 55. Остальные изотопы получены искусственным путем, и наиболее устойчив радиоактивный изотоп с атомной массой 53 (период полураспада примерно такой же, как у урана).

Степень окисления марганца
У него шесть разных степеней окисления. В нулевой степени окисления элемент способен образовывать комплексные соединения с органическими лигандами (например, P(C5H5)3), а также неорганическими лигандами:
Степень окисления +2 типична для солей марганца. Важно: у этих соединений сугубо восстановительные свойства. Наиболее устойчивые соединения, имеющие степень окисления +3, — оксид Mn2O3, а также гидрат этого оксида Mn(OH)3. В степени окисления +4 наиболее устойчивы MnO2 и амфотерный оксид-гидроксид MnO(OH)2.
Степень окисления марганца +6 типична для существующей только в водном растворе марганцеватой кислоты и ее солей. Степень окисления +7 типична для существующей только в водном растворе марганцевой кислоты, ее ангидрида, а также солей — перманганатов (аналогия с перхлоратами) — сильных окислителей. Интересно, что при восстановлении перманганата калия (в быту называется марганцовкой) возможны три разные реакции:

Химические свойства
В обычных условиях малоактивен. Причина — появляющаяся при воздействии кислорода воздуха оксидная пленка. Если же порошок металла слегка нагреть, он сгорает, превращаясь в MnO2.
При нагревании взаимодействует с водой, вытесняя водород. В результате реакции получается практически нерастворимый гидрат закиси Mn(OH)2. Это вещество препятствует дальнейшему взаимодействию с водой.
Интересно! Водород растворим в марганце, и при повышении температуры растворимость увеличивается (получается раствор газа в металле).
При очень сильном нагревании (температура выше 1200 градусов по шкале Цельсия) взаимодействует с азотом, при этом получаются нитриды. Эти соединения могут иметь различный состав, что типично для так называемых бертоллидов. Взаимодействует с бором, фосфором, кремнием, а в расплавленном виде — с углеродом. Последняя реакция протекает при восстановлении марганца коксом.
При взаимодействии с разбавленной серной и соляной кислотами получается соль и выделяется водород. А вот взаимодействие с крепкой серной кислотой иное: продукты реакции — соль, вода и двуокись серы (вначале серная кислота восстанавливается в сернистую, но из-за неустойчивости сернистая кислота распадается на диоксид серы и воду).
Это интересно! Что такое алканы: строение и химические свойства
При реакции с разбавленной азотной кислотой получается нитрат, вода, окись азота.
Образует шесть оксидов:
Интересно! Закись под воздействием кислорода воздуха постепенно превращается в окись. Ангидрид марганцеватой кислоты не выделен в свободном виде.
Закись-окись — соединение с так называемой дробной степенью окисления. При растворении в кислотах образуются соли двухвалентного марганца (соли с катионом Mn3+ неустойчивы и восстанавливаются до соединений с катионом Mn2+).
Двуокись, окись, закись-окись — наиболее устойчивые оксиды. Марганцевый ангидрид неустойчив. Прослеживаются аналогии с другими химическими элементами:
Несложно заметить и аналогию с хлоратами и перхлоратами. Манганаты, подобно хлоратам, получаются косвенным путем. А вот перманганаты можно получить как прямым путем, то есть при взаимодействии ангидрида и оксида/гидроксида металла в присутствии воды, так и косвенным.
В аналитической химии катион Mn2+ попал в пятую аналитическую группу. Есть несколько реакций, позволяющих обнаружить этот катион:
Валентности марганца
Элемент находится в седьмой группе. Типичные валентности марганца – II, III, IV, VI, VII.
Нулевая валентность типична для свободного вещества. Двухвалентные соединения — соли с катионом Mn2+, трехвалентные – оксид и гидроксид, четырехвалентные – двуокись, а также оксид-гидроксид. Шести- и семивалентные соединения — соли с анионами MnO42- и MnO4-.
Как получить и из чего получают марганец? Из марганцевых и железо-марганцевых руд, а также из растворов солей. Известно три разных способа получения марганца:
В первом случае в качестве восстановителя используется кокс, а также окись углерода. Восстанавливается металл из руды, где есть примесь оксидов железа. В результате получается как ферромарганец (сплав с железом), так и карбид (что такое карбид? это соединение металла с углеродом).
Для получения более чистого вещества используется один из способов металлотермии — алюмотермия. Сначала прокаливается пиролюзит, при этом получается Mn2O3. Затем полученный оксид смешивают с порошком алюминия. В ходе реакции выделяется много теплоты, в результате получающийся металл плавится, а оксид алюминия покрывает его шлаковой «шапкой».
Марганец — металл средней активности и стоит в ряду Бекетова левее водорода и правее алюминия. Это значит, что при электролизе водных растворов солей с катионом Mn2+ на катоде восстанавливается катион металла (при электролизе весьма разбавленного раствора на катоде восстанавливается и вода). При электролизе водного раствора MnCl2 протекают реакции:
Катод (отрицательно заряженный электрод): Mn2+ + 2e Mn0
Анод (положительно заряженный электрод): 2Cl- 2e 2Cl0 Cl2
Итоговое уравнение реакции:
При электролизе получается наиболее чистый металлический марганец.
Полезное видео: марганец и его соединения
Применение
Применение марганца довольно широко. Используется как сам металл, так и его различные соединения. В свободном виде используется в металлургии для разных целей:
Для изготовления гальванических элементов Zn-Mn используется MnO2. В электротехнике применяются MnTe и MnAs.
Это интересно! Уроки химии: что это такое галогены

Интересные факты
Перманганат калия, часто называемый марганцовкой, широко применяется как в быту (для лечебных ванночек), так и в промышленности и лабораториях. Малиновая окраска перманганата обесцвечивается при пропускании через раствор ненасыщенных углеводородов с двойными и тройными связями. При сильном нагревании перманганаты разлагаются. При этом получаются манганаты, MnO2, а также кислород. Это один из способов получить химически чистый кислород в лабораторных условиях.
Получить соли марганцеватой кислоты можно лишь косвенным путем. Для этого MnO2 смешивают с твердой щелочью и в присутствии кислорода нагревают. Другой способ получения твердых манганатов – прокаливание перманганатов.
Растворы манганатов имеют красивую темно-зеленую окраску. Однако эти растворы неустойчивы и подвергаются реакции диспропорционирования: темно-зеленая окраска меняется на малиновую, также выпадает бурый осадок. В результате реакции получается перманганат и MnO2.
Это интересно! Для чего делают и что это такое гидролиз солей
Диоксид марганца применяется в лаборатории как катализатор при разложении хлората калия (бертолетовой соли), а также для получения чистого хлора. Интересно, что в результате взаимодействия MnO2 с хлороводородом получается промежуточный продукт – крайне неустойчивое соединение MnCl4, распадающееся на MnCl2 и хлор. Нейтральные или подкисленные растворы солей с катионом Mn2+ имеют бледно-розовую окраску (Mn2+ создает комплекс с 6 молекулами воды).
Полезное видео: марганец элемент жизни
Вывод
Такова краткая характеристика марганца и его химические свойства. Это серебристо-белый металл средней активности, взаимодействует с водой лишь при нагревании, в зависимости от степени окисления проявляет как металлические, так и неметаллические свойства. Его соединения используются в промышленности, в быту и в лабораториях для получения чистого кислорода и хлора.
Словари
Нахождение в природе
Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе (см. ст. Железо (см. ЖЕЛЕЗО)) при восстановлении руд железа и марганца коксом (см. КОКС). В ферромарганце содержание углерода составляет 6-8 % по массе. Чистый марганец получают электролизом водных растворов сульфата марганца MnSO4, который проводят в присутствии сульфата аммония (NH4)2SO4.
Физические и химические свойства
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn3O4 и внутреннего слоя состава MnO. Марганец образует несколько оксидов: MnO, Mn3O4, Mn2O3, MnO2 и Mn2O7. Все они, кроме Mn2O7, представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9°C, твердые кристаллические вещества. Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn2O3. Этот же оксид марганца образуется при нагревании MnO2 на воздухе при температуре примерно 600°C:
Оксид Mn2O3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO2. Если MnO2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn3O4:
С фосфором марганец образует фосфиды составов MnР, MnP3, Mn2P, Mn3P, Mn3P2 и Mn4P. Известно несколько карбидов и силицидов марганца. С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH)2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца(II):
Из растворов солей Mn 2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH)2:
так и восстановителей
В водных растворах манганаты диспропорционируют на соединения марганца(+4) и марганца(+7):
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4. При давлении около 10 МПа безводный MnCl2 в присутствии металлоорганических соединений реагирует с оксидом углерода(II) CO с образованием биядерного карбонила Mn2(CO)10.