какая бывает сера в химии
Какая бывает сера в химии
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
В местах вулканической активности встречаются залежи самородной серы.
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Какая бывает сера в химии
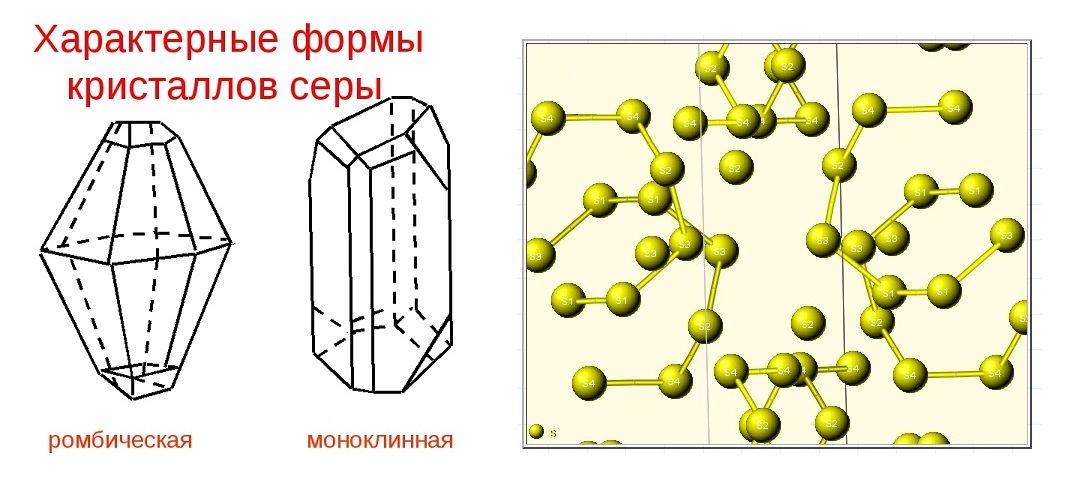
Чистая желтая сера
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
СТРУКТУРА
Кристаллическая структура и две сингонии серы
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
СВОЙСТВА
МОРФОЛОГИЯ
Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ
Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H2S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы — кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ
Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера (S)
Соединения серы:
В природе сера встречается, как в виде самородков, так и в виде разнообразных соединений: сульфидов (FeS2; FeCuS2) и сульфатов (BaSO4), входящих в состав разнообразных минералов (пирит, медный колчедан, гипс, барит). Также сера в виде соединений присутствует в природных углеводородах: нефте, газе, угле.
Атом серы содержит 16 электронов, при этом у серы, как и у атома кислорода, на внешнем энергетическом уровне находится 6 валентных электронов (см. Электронная структура атомов).
В отличие от кислорода, атом серы способен образовывать не только 2 (H2S) ковалентные связи, но и 4 (H2SO3) или 6 (H2SO4) (см. Ковалентная связь). Данное свойство объясняется наличием у атома серы свободного d-подуровня, на который могут переходить 1 или 2 электрона с s- или р-подуровня (см. Атомы 16(VIa) группы).
Сера, как простое вещество
Молекула S2 имеет строение, аналогичное O2.
Сера при высоких температурах может существовать в газообразном состоянии:
Химические свойства серы
Сера является типичным активным неметаллом.
В воде сера практически не растворяется (даже не смачивается водой), а в органических растворителях сера растворяется хорошо.
При взаимодействии с другими веществами сера может выступать, как в роли окислителя, так и в роли восстановителя, в зависимости от окислительно-восстановительных свойств веществ, с которыми сера вступает в реакцию:
Реакции, в которых сера является окислителем:
Реакции, в которых сера является восстановителем:
Взаимодействие серы со сложными веществами:
Аллотропные модификации серы
α-сера
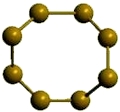
Рис. Ромбическая α-сера.
β-сера
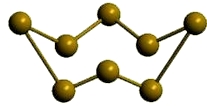
Рис. Моноклинная β-сера.
Пластическая сера
Рис. Пластическая сера.
Получение и применение серы
Способы получения серы:
Применение серы:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Сера. Общая характеристика, получение, химические свойства
Сера (S), Sulfur
При нормальных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S8.
Физические свойства серы
Сера образует более 30 твердых аллотропов, больше, чем любой другой элемент.
Сера содержит 23 известных изотопа, четыре из которых являются стабильными:
Природные минералы серы:
— колчеданы (FeS2 – железный колчедан (пирит), FeCuS2 – медный колчедан (халькопирит))
— сульфиды (ZnS – цинковая обманка, PbS – свинцовый блеск, CuS – медный блеск (халькозин)).
Сера является десятым наиболее распространенным элементом по массе во Вселенной и пятым наиболее распространенным на Земле.
Хотя иногда серу можно найти в чистом природном виде, на Земле она обычно встречается в виде сульфидных и сульфатных минералов.
Сера в изобилии в естественной форме была известна в древние времена, и ее упоминали в древней Индии, древней Греции, Китае и Египте. В Библии сера упоминается как «горящий камень».
Сегодня почти вся элементарная сера производится как побочный продукт удаления серосодержащих загрязнений из природного газа и нефти.
Элементная сера используется в спичках, инсектицидах и фунгицидах.
Какой у серы запах?
Многие соединения серы имеют душистый аромат, а запах органических газов, специфический неприятный запах у скунса, грейпфрута и чеснока происходят из-за сероорганических соединений.
Сера в Космосе
32S создается внутри массивных звезд на глубине, где температура превышает 2,5 × 109 К, в результате слияния одного ядра кремния с одним ядром гелия.
Отличительные цвета вулканической спутника Юпитера Ио приписываются различным формам расплавленной, твердой и газообразной серы.
Сера на Земле
Элементарная сера может быть найдена около горячих источников и вулканических областей во многих частях мира, особенно вдоль Тихоокеанского Огненного Кольца; такие вулканические отложения в настоящее время добываются в Индонезии, Чили и Японии.
Самородная сера синтезируется анаэробными бактериями, действующими на сульфатные минералы, такие как гипс в соляных куполах.
Сера и Геология
Самородная сера может быть получена только в результате геологических процессов.
Обычные природные соединения серы включают
Сера и ее соединения
Некоторые из основных классов серосодержащих органических соединений включают следующие:
Сероорганические соединения ответственны за некоторые неприятные запахи разлагающегося органического вещества.
Не все органические соединения серы неприятно пахнут при всех концентрациях:
Серная горчица (иприт), сильнодействующий реагент, использовалась в Первой мировой войне в качестве средства для выведения из строя.
Сера и Римская мифология
В наиболее распространенном типе промышленного «отверждения» и упрочнения натурального каучука элементарная сера нагревается с каучуком до такой степени, что химические реакции образуют дисульфидные мостики между изопреновыми звеньями полимера.
Из-за высокой температуры и серы процесс был назван вулканизацией в честь римского бога кузницы Вулкана.
Сера и древние времена
Будучи в изобилии доступным в естественном виде, сера была известна в древние времена и упоминается в Торе (Бытие).
Согласно папирусу Эберса, серная мазь использовалась в древнем Египте для лечения зернистых век.
Он упоминает ее использование для фумигации, медицины и отбеливания ткани.
К 3-му веку китайцы обнаружили, что сера может быть извлечена из пирита.
Военный трактат династии Сун в 1044 году нашей эры описывает различные формулы для китайского черного порошка, который представляет собой смесь нитрата калия (KNO3), древесный уголь и серу. Этот состав до сих пор остается компонентом черного пороха.
В 1777 году Антуан Лавуазье помог убедить научное сообщество, что сера является элементом, а не соединением.
Сера вступает в реакцию непосредственно с метаном с образованием дисульфида углерода, который используется для производства целлофана и вискозы.
Сера и Растения
Сера все чаще используется в качестве компонента удобрений.
Со временем почвенные бактерии могут превращать его в растворимые производные, которые затем могут использоваться растениями.
Это важное питательное вещество для роста растений, формирования корневых клубеньков бобовых, а также иммунитета и защитных систем.
Поскольку атмосферные поступления серы продолжают уменьшаться, дефицит ввода / вывода серы, вероятно, увеличится, если не использовать серные удобрения.
Важно! Газообразный сероводород и гидросульфидный анион чрезвычайно токсичны для млекопитающих из-за их ингибирования кислородоносности гемоглобина и некоторых цитохромов способом, аналогичным цианиду и азиду.
Сера и Лекарства
Сероорганические соединения используются в фармацевтике, красителях и агрохимикатах.
Большинство β-лактамных антибиотиков, включая пенициллины, цефалоспорины и монолактамы, содержат серу.
Сульфат магния, известный как соль Эпсома в гидратированной кристаллической форме, может использоваться в качестве слабительного средства, добавки для ванн, эксфолианта, добавки магния для растений или (в обезвоженном виде) в качестве осушителя.
Сера и Пестициды
Элементарная сера является одним из старейших фунгицидов и пестицидов.
Она обладает хорошей эффективностью против широкого спектра мучнистой росы, а также от черных пятен.
Сера и Вино
Небольшие количества добавляемого газообразного диоксида серы (или эквивалентное добавление метабисульфита калия) к ферментированному вину с образованием следов серной кислоты (образующейся при взаимодействии SO2 с водой) и ее сульфитных солей в смеси, называют «самым мощным инструментом в виноделии».
Без этой стадии консервирования обычно требуется непременное охлаждение продукта перед употреблением.
Сера и Кожа
Сера (в частности, октасерная кислота, S8) используется в фармацевтических препаратах для кожи для лечения прыщей и других состояний.
Общие побочные эффекты включают раздражение кожи в месте нанесения, в виде сухости, жжения, зуда и шелушения.
Это седьмой или восьмой самый распространенный элемент в организме человека по массе, примерно равный по содержанию калию и немного превышающий натрий и хлор.
Человеческое тело весом 70 кг (150 фунтов) содержит около 140 г серы.
Сера и Белки
У растений и животных аминокислоты цистеин и метионин содержат большую часть серы, и этот элемент присутствует во всех полипептидах, белках и ферментах, которые содержат эти аминокислоты.
Дисульфидные связи (связи S-S) между остатками цистеина в пептидных цепях очень важны для сборки и структуры белка.
Например, высокая прочность перьев и волос частично обусловлена высоким содержанием связей S-S с цистеином и серой.
Высокое содержание дисульфидных связей в волосах и перьях способствует их неперевариваемости и характерному неприятному запаху при сгорании.
Во внутриклеточной химии сера действует как носитель восстановления водорода и его электронов для клеточного восстановления окисления.
Тиоредоксины, класс малых белков, необходимых для всей известной жизни, используют соседние пары восстановленных цистеинов для работы в качестве общих белков-восстановителей с аналогичным эффектом.
У бактерий важные ферменты нитрогеназы содержат кластер Fe-Mo-S и являются катализатором, который выполняет важную функцию азотфиксации, превращая атмосферный азот в аммиак, который может использоваться микроорганизмами и растениями для производства белков, ДНК, РНК, алкалоидов. и других органических соединений азота, необходимых для жизни.
Сера и Биогеохимия
Цикл серы был первым из обнаруженных биогеохимических циклов.
Виноградский назвал эту форму метаболизма неорганическим окислением (окисление неорганических соединений).
Примитивные бактерии, которые живут вокруг глубоководных вулканических жерл, окисляют сероводород в этом пути с кислородом;
Гигантский трубчатый червь является примером большого организма, который использует сероводород (через бактерии) в качестве пищи для окисления.
Кто дышит серой?
Так называемые сульфатредуцирующие бактерии, например, «дышат сульфатом» вместо кислорода.
Сульфатредуцирующие бактерии используют серу в качестве акцептора электронов и восстанавливают различные окисленные соединения серы обратно в сульфид, часто в сероводород.
Сероводород, производимый этими бактериями, ответственен за некоторые запахи кишечных газов (газы) и продукты разложения.
Сера поглощается корнями растений из почвы в виде сульфата и транспортируется в виде фосфатного эфира.
SO4 2- → SO3 2- → H2S → цистеин → метионин
Сера в Химии
Сера горит синим пламенем с образованием диоксида серы, который имеет удушающий и раздражающий запах.
Сера реагирует почти со всеми другими элементами, за исключением благородных газов.
Растворимые сульфатные соли плохо абсорбируются и оказывают слабительное действие.
Когда сера горит в воздухе, она производит диоксид серы (SO2)
В воде этот газ производит серную кислоту и сульфиты; сульфиты являются антиоксидантами, которые подавляют рост аэробных бактерий и полезную пищевую добавку в небольших количествах.
Триоксид серы (получаемый в результате катализа из диоксида серы) и серная кислота одинаково сильно кислотны и вызывают коррозию в присутствии воды.
Серная кислота является сильным дегидратирующим агентом, который может удалять имеющиеся молекулы воды и компоненты воды из сахара и органических тканей.
После этой познавательной информации необходимо изучить химические свойства серы, а также ее получение, поэтому я составила таблицу для использования в подготовке к ОГЭ и ЕГЭ по химии.
Таблица: химические свойства серы
1) Получение
Из водных растворов:
2) В промышленности
4) H2S (газ) → S↓ + H2 (t > 400 C);
5) SO2 +C → CO2 + S↓ (t).
2) SO2 + C → CO2 + S↓ (t).
1) CaSO4 + 4C → 4CO↑ + CaS (t);
2) Химические свойства
Окислительные и
восстановительные свойства
1) С металлами:
3S + 2Al → Al2S3 (t);
S + 2Na → Na2S (расплав);
S + Me → MeS + Q (Me = металлы, кроме Au, Pt, Ir).
2) С неметаллами:
S (тв.) + H2 → H2S (150 – 350 C);
2S + C → CS2 (800-900 C);
3S + 2P → P2S3 (расплав);
5S + 2P → P2S5 (без доступа воздуха).
3) С щелочами:
3S + 6NaOH → 2NaS + Na2SO3 + 3H2O;
3S + 3Ca(OH)2 → 2CaS + CaSO4 + 3H2O (кипячение);
2S + 4NaOH + 3O2 → 2Na2SO4 + 2H2O (расплав, t).
4) С кислотами:
S + 2HI → H2S + I2.
5) C солями:
3S + 2KClO3 → 3SO2↑ + 2KCl (t);
S + 2KMnO4 → K2SO4 + 2MnO2 (в слабощелочной среде);