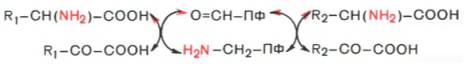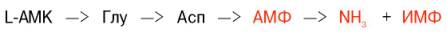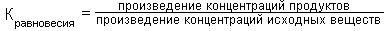какая альфа кетокислота образуется при реакции трансаминирования альфа аланина
Какая альфа кетокислота образуется при реакции трансаминирования альфа аланина
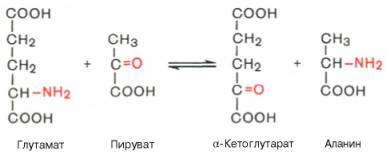
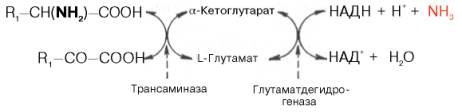
Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Впервые реакции трансаминирования (прежнее наименование переаминирования) были открыты в 1937 г. советскими учеными А. Е. Браунштейном и М. Г. Крицман при изучении дезаминирования глутаминовой кислоты в мышечной ткани. Было замечено, что при добавлении к гомогенату мышц глутаминовой и пировиноградной кислот образуются α-кетоглутаровая кислота и аланин без промежуточного образования аммиака; добавление аланина и α-кетоглутаровой кислоты соответственно приводило к образованию пировиноградной и глутаминовой кислот:
Реакции трансаминирования являются обратимыми, и, как выяснилось позже, универсальными для всех живых организмов. Эти реакции протекают при участии специфических ферментову названных А. Е. Браунштейном аминоферазами (или, по совремменной классификации, аминотрансферазами либо трансаминазами). Теоретически реакции трансаминирования возможны между любой амино- и кетокислотой, однако наиболее интенсивно они протекают в том случае, когда один из партнеров представлен дикарбоновой амино- или кетокислотой.
Следует отметить, что в тканях животных и у микроорганизмов доказано существование реакций трансаминирования также между одними монокарбоновыми амино- и кетокислотами. Донаторами NH2-группы могут также служить не только α-, но и β-, γ-, δ- и ω-аминогруппы ряда аминокислот. В лаборатории А. Майстера доказано, кроме того, трансаминирование глутамина и аспарагина с кетокислотами в тканях животных.
Опуская промежуточные стадии образования шиффовых оснований, обе стадии реакции трансаминирования можно представить в виде обшей схемы:
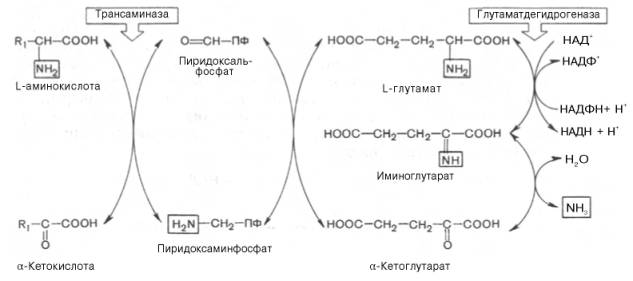
Пиридоксальфосфат в первой стадии принимает NН2-группу от аминокислоты с образованием пиридоксаминофосфата и соответствующей кетокислоты. Этот процесс протекает через промежуточное образование шиффовых оснований (альдимина и кетимина). Во второй стадии образовавшийся пиридоксаминфосфат реагирует с какой-либо α-кетокислотой, причем образуется промежуточное соединение, которое также подвергается внутримолекулярным превращениям (перераспределение энергии двойной связи, лабйлизация а-водородного атома) и распадается гидролитически на аминокислоту, соответствующую исходной кетокислоте, и пиридоксальфосфат. Таким образом, пиридоксальфосфат в реакциях трансаминирования действительно выполняет роль промежуточного переносчика аминогруппы и в конечной стадии освобождается и может вновь вступить в ферментативный процесс.
Наличие подобного механизма реакции трансаминирования доказано методами спектрального анализа по идентификации промежуточных продуктов, а существенность для реакции альдегидной группы пиридоксальфосфата показана в опытах с блокированием ее реагентами на карбонильную группу, в частности фенилгидразином, гидразидом изоникотиновой кислоты и др. Так, например, при взаимодействии пиридоксальфосфата с фенилгидразином образуется весьма прочный комплекс, не гидролизуемый водой, и кофермент выводится из сферы химической реакции:
В последнее время получены новые доказательства существования в живых организмах приведенного выше механизма трансаминирования и выяснены некоторые новые детали механизма действия трансаминаз и других пиридоксалевых (содержащих в качеству кофермента пиридоксальфосфат) ферментов. Методами спектрального анализа показано, что во всех пиридоксалевых ферментах карбонильная группа кофермента (-СНО) не свободна, а соединена иминной связью с ε-аминогруппой лизина белковой части фермента. В этом случае, по представлениям А. Е. Браунштейна и Снелла, взаимодействие между субстратом, т. е. аминокислотой, и пиридоксальфосфатом происходит не путем конденсации с выделением молекулы воды, а путем реакции замещения, при которой аминогруппа субстата вытесняет ε-аминогруппу остатка лизина в молекуле ферментного белка, что приводит к формированию пиридоксальфосфатсубстратного комплекса.
Роль трансаминаз (соответственно реакций трансаминирования) в обмене аминокислот. Чрезвычайно широкое распространение трансаминаз в животных тканях, у микроорганизмов и растений, их высокая резистентность к физическим, химическим и биологическим воздействиям (факторам), абсолютная стереохимическая специфичность по отношению к L- и D-аминокислотам, а также их высокая каталитическая активность в процессах трансаминирования послужили предметом детального исследования роли этих ферментов в обмене аминокислот. Выше было указано, что при физиологических значениях pH среды активность оксидазы L-аминокислот резко снижена. Учитывая эти обстоятельства, а также высокую скорость протекания реакции трансаминирования, А. Е. Браунштейн выдвинул гипотезу о возможности существования в животных тканях непрямого пути дезаминирования аминокислот через реакции трансаминирования, названного им трансдезаминированием. Основой для выдвижения этой гипотезы послужили также данные Г. Эйлера о том, что в животных тканях из всех природных аминокислот с высокой скоростью дезаминируется только L-глутаминовая кислота, катализируемое высокоактивной и специфической глутаматдегидрогеназой.
По этой теории все или почти все природные аминокислоты сначала реагируют с а-кетоглутаровой кислотой в реакции трансаминирования с образованием глутаминовой кислоты и соответствующей кетокислоты. Образовавшаяся глутаминовая кислота затем подвергается непосредственному окислительному дезаминированию (см. выше) под действием глутаматдегидрогеназы. Схематический механизм трансдезаминирования можно представить в следующем виде:
Суммарная реакция при этом сводится к следующей:
Поскольку обе реакции (трансаминирование и дезаминирование глутаминовой кислоты) являются обратимыми, создаются условия для синтеза по существу любой аминокислоты, если в организме имеются соответствующие α-кетокислоты. Известно, что организм животных и человека не наделен способностью синтеза углеводных скелетов (α-кетокислот) так называемых незаменимых аминокислот (см. выше); этой способностью обладают только растения и многие микроорганизмы.
Механизм, при помощи которого в живых организмах осуществляется синтез природных аминокислот из α-кетокислот и аммиака, был назван А. Е. Браунштейном трансреаминированием. Сущность его сводится к восстановительному аминированию α-кетоглутаровой кислоты с образованием глутаминовой кислоты (реакцию катализирует НАДФ-зависимая глутаматдегидрогеназа, работающая в режиме синтеза, и к последующему трансаминированию глутамата с любой α-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте, и вновь освобождается α-кетоглутаровая кислота, которая может акцептировать новую молекулу аммиака. Схематически роль реакций трансаминирования как в дезаминировании, так и биосинтезе аминокислот может быть представлена в следующем виде:
Видно, что трансаминазы катализируют опосредованное через глутаматдегидрогеназу как дезаминирование природных аминокислот (стрелки вниз), так и биосинтез аминокислот (стрелки вверх).
Получены доказательства существования в организме теплокровных животных еще одного механизма непрямого дезаминирования α-аминокислот, при котором Глу, Асп и аденозинмонофосфат (АМФ) выполняют роль системы переноса NH2-группы; гидролитическое дезаминирование АМФ приводит к образованию инозинмонофосфаа (ИМФ) и аммиака.
Возможно, что в аналогичной системе в качестве промежуточного переносчика NH2-группы участвует вместо АМФ (и ИМФ) НАД (и дезамидо-НАД).
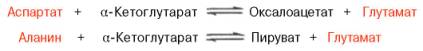
Аспартат + α-Кетоглутарат ЩУК + Глутамат
Аланин + α-Кетоглутарат ПВ + Глутамат
Табл. 38 дает представление об уровнях аспартат- и аланин-аминотрансфераз в сыворотке крови и некоторых других тканях здорового взрослого человека.
| Таблица 38. Активность трансаминаз в органах и тканях здорового человека в условных единицах Боданского | ||
| Объект исследования | Активность, уcл. ед. | |
| аспартатамино- трансфераза | аланинамино- транcфераза | |
| Сердечная мышца | 150 000 | 7 000 |
| Печень | 140 000 | 44 000 |
| Скелетные мышцы | 100 000 | 5 000 |
| Почки | 90 000 | 12 000 |
| Поджелудочная железа | 30 000 | 20 000 |
| Сыворотка крови | 5-40 (20) | 4-35 (15) |
Видно, что в сыворотке крови здоровых людей активность этих трансаминаз в среднем составляет 15 и 20 единиц по сравнению с десятками и сотнями тысяч единиц в других органах и тканях. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающихся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь.
Так, при инфаркте миокарда уровень аспартатаминотрансферазы сыворотки крови уже через 3-5 ч после наступления инфаркта резко повышается, достигая 300-500 единиц. Максимум активности обеих трансаминаз крови приходится на конец первых суток, а уже через 2-3 дня при благоприятном исходе болезни уровень сывороточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или при наступлении повторного инфаркта миокарда наблюдается новый пик повышения активности этих ферментов в крови. Этим объясняется тот факт, что в клинике трансаминазный тест используется не только для постановки диагноза заболевания, но и для прогноза и проверки эффективности метода лечения.
При гепатитах также наблюдается гипертрансаминаземия (за счет преимущественного повышения уровня аланинаминотрансферазы, см. табл. 38), но она имеет только более умеренный и затяжной характер, и повышение активности ферментов осуществляется медленно. При различного рода коронарной недостаточности (стенокардия, пороки сердца и др., кроме инфаркта миокарда) гипертрансаминаземия или не наблюдается или она имеет умеренный характер. Определение трансаминаз сыворотки крови при заболеваниях сердца следует отнести к дифференциально-диагностическим лабораторным тестам.
Укажем также, что опухоли печени или метастазы опухолей, органов в печень характеризуются умеренным повышением трансаминазной активности сыворотки крови. Однако этот тест не является абсолютно специфичным для опухолей, поскольку при циррозах печени наблюдается аналогичная гипертрансаминаземия. Повышение уровня трансаминаз сыворотки крови отмечено, кроме того, при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей, прогрессивной мышечной дистрофии и т. д.
Интересно, что инфаркт легкого и кровоизлияния в мозг не сопровождаются повышением уровня трансаминаз в крови. Ряд исследователей на основании этих данных склонны рассматривать определение аспартатаминотрансферазы сыворотки крови в качестве основного теста при проведении дифференциального диагноза между инфарктом миокарда и инфарктом легких. Таким образом, трансаминазный тест сыворотки крови, несомненно, является весьма перспективным лабораторным методом, оказывая врачу большую помощь при постановке диагноза болезней сердца, печени, скелетной мускулатуры и других органов.
Трансаминирование аминокислот
Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Впервые реакции трансаминиро-вания (прежнее название «переаминирование») были открыты в 1937 г. советскими учеными А.Е. Браунштейном и М.Г. Крицман при изучении дезаминирования глутаминовой кислоты в мышечной ткани. Было замечено, что при добавлении к гомогенату мышц глутаминовой и пировиноградной кислот образуются α-кетоглутаровая кислота и аланин без промежуточного свободного аммиака; добавление аланина и α-кетоглутаровой кислоты приводило к образованию соответственно пировиноградной и глутаминовой кислот.
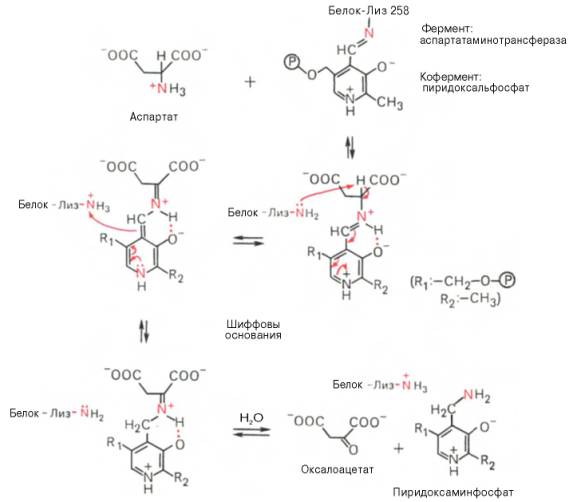
В переносе аминогруппы активное участие принимает кофермент транс-аминаз пиридоксальфосфат (производное витамина В6; см. главу 5), который в процессе реакции обратимо превращается в пиридоксаминфосфат.
Более подробно механизм действия трансаминаз представлен на рис. 12.3.
В связи с тем что во всех пиридоксалевых ферментах (включая транс-аминазы) карбонильная группа кофермента (—СНО) оказалась связанной с ε-аминогруппой лизина белковой части, в классический механизм реакции трансаминирования А.Е. Браунштейн и Э. Снелл внесли следующее дополнение. Оказалось, что взаимодействие между субстратом, т.е. L-амино-кислотой (на рисунке – аспартат), и пиридоксальфосфатом происходит не путем конденсации с выделением молекулы воды, а путем реакции замещения, при которой NH2-группа субстрата вытесняет ε-NН2-группу лизина в молекуле ферментного белка, что приводит к формированию пиридоксальфосфатного комплекса.
Существование представленного механизма реакции трансаминирова-ния доказано разнообразными методами, включая методы спектрального анализа по идентификации промежуточных альдиминных и кетиминных производных пиридоксальфосфата.
Роль трансаминаз и реакций трансаминирования в обмене аминокислот.
Суммарная реакция при этом следующая:
Поскольку обе реакции (трансаминирование и дезаминирование глу-таминовой кислоты) являются обратимыми, создаются условия для синтеза по существу любой аминокислоты, если в организме имеются соответствующие α-кетокислоты. Известно, что организм животных и человека не наделен способностью синтеза углеродных скелетов (α-кетокислот), так называемых незаменимых аминокислот; этой способностью обладают только растения и многие микроорганизмы.
Механизм, при помощи которого в живых организмах осуществляется синтез природных аминокислот из α-кетокислот и аммиака, был назван А.Е. Браунштейном трансреаминированием. Сущность его сводится к восстановительному аминированию α-кетоглутаровой кислоты с образованием глутаминовой кислоты (реакцию катализирует НАДФ-зависимая глута-матдегидрогеназа, работающая в режиме синтеза) и к последующему трансаминированию глутамата с любой α-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте, и вновь освобождается α-кетоглутаровая кислота, которая может акцептировать новую молекулу аммиака. Роль реакций трансаминирования как в дезаминировании, так и в биосинтезе аминокислот может быть представлена в виде схемы:
Таким образом, трансаминазы катализируют опосредованное через глутаматдегидрогеназу дезаминирование природных аминокислот (черные стрелки) и биосинтез аминокислот (красные стрелки). В более упрощенной форме роль этих ключевых ферментов азотистого обмена представлена на рис. 12.4.
Получены доказательства существования в организме теплокровных животных еще одного механизма непрямого (опосредованного) дезами-нирования L-аминокислот, при котором Глу, Асп и АМФ выполняют роль системы переноса NН2-группы; гидролитическое дезаминирование АМФ приводит к образованию инозинмонофосфата (ИМФ) и аммиака:
Возможно, что в аналогичной системе в качестве промежуточного переносчика NH2-группы вместо АМФ участвует НАД.
Клиническое значение определения активности трансаминаз. Широкое распространение и высокая активность трансаминаз в органах и тканях человека, а также сравнительно низкие величины активности этих ферментов в крови послужили основанием для определения уровня ряда трансаминаз в сыворотке крови человека при органических и функциональных поражениях разных органов. Для клинических целей наибольшее значение имеют две трансаминазы – аспартат-аминотрансфераза (AcAT) и аланин-аминотрансфераза (АлАТ), катализирующие соответственно следующие обратимые реакции:
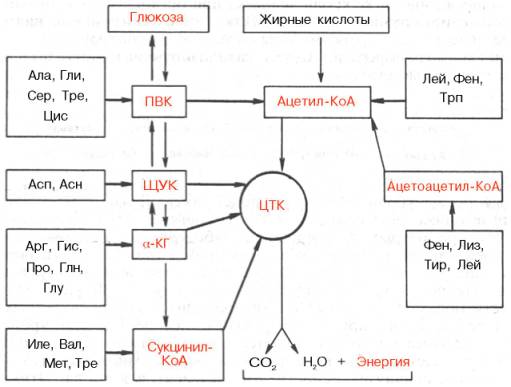
Превращения α-кетокислот. Образовавшиеся в процессе дезаминиро-вания и трансдезаминирования α-кетокислоты подвергаются в тканях животных различным превращениям и могут вновь трансаминироваться с образованием соответствующей аминокислоты. Это так называемый синтетический путь превращения. Опыты с перфузией растворов α-кето-кислот и аммиака через изолированную печень показали, что в оттекающей из печени жидкости действительно имеются соответствующие исходным кетокислотам L-аминокислоты. Открыты, кроме того, гликогенные, кето-генные и окислительные пути, ведущие к образованию соответственно глюкозы, жирных кислот, кетоновых тел и компонентов цикла трикарбоновых кислот (ЦТК). Эти процессы можно представить в виде общей сводной схемы:
Углеродные скелеты аминокислот могут включаться в ЦТК через ацетил-КоА, пируват, оксалоацетат, α-кетоглутарат и сукцинил-КоА. Пять аминокислот (Фен, Лиз, Лей, Трп, Тир) считаются «кетогенными», поскольку они являются предшественниками кетоновых тел, в частности ацетоуксусной кислоты, в то время как большинство других аминокислот, обозначаемых как «гликогенные», служат в организме источником углеводов, в частности глюкозы. Подобный синтез углеводов de novo усиливается при некоторых патологических состояниях, например при сахарном диабете, а также при гиперфункции коркового вещества надпочечников и введении глюкокортикоидов (см. главу 8). Разделение аминокислот на «кетогенные» и «гликогенные» носит, однако, условный характер, поскольку отдельные участки углеродных атомов Лиз, Трп, Фен и Тир могут включаться и в молекулы предшественников глюкозы, например Фен и Тир – в фумарат. Истинно «кетогенной» аминокислотой является только лейцин.
ТРАНСАМИНИРОВАНИЕ АМИНОКИСЛОТ



Эта реакция заключается в том, что аминокислота и кетокислота обмениваются друг с другом своими функциональными группами при альфа-углеродном атоме. В результате вступившая в реакцию аминокислота превращается в соответствующую альфа-кетокислоту, а кетокислота становится аминокислотой.
ГЛАВНЫЕ ОСОБЕННОСТИ РЕАКЦИИ ТРАНСАМИНИРОВАНИЯ:
3. Каждая трансаминаза обычно специфична для одной пары субстратов и соответствующей ей пары продуктов и все стадии реакции катализируются только одним ферментом. По участникам процесса для данного фермента дают ему название:
Фермент, который катализирует приведенную реакцию, можно назвать: Аланинаминотрансфераза (АлТ) (глутаминово-пировиноградная трансаминаза (ГПТ)).
Определение активности этих ферментов в сыворотке крови имеет важное значение в ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ таких заболеваний, как ВИРУСНЫЙ ГЕПАТИТ и ИНФАРКТ МИОКАРДА.
АсТ и АлТ являются внутриклеточными ферментами. Поэтому в норме их активность в крови очень мала. При вирусном гепатите или при инфаркте миокарда наблюдается разрушение клеток печени или миокарда соответственно. Поэтому в крови будет наблюдаться повышение активности и АлТ, и АсТ, но неодинаковое для каждого из ферментов.
Поэтому определение активности этих ферментов в крови помогает врачам в постановке правильного диагноза.
БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ.
1. ОБЕСПЕЧИВАЮТ СИНТЕЗ НОВЫХ АМИНОКИСЛОТ ИЗ ЧИСЛА ЗАМЕНИМЫХ. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты.
Эта функция позволяет ругулировать содержание различных аминокислот в клетках организма (корректировка аминокислотного состава клеток).
Для большинства реакций трансаминирования эта константа равновесия близка к единице.

2.ОБЕСПЕЧИВАЮТ ПРОТЕКАНИЕ РЕАКЦИЙ КОСВЕННОГО ДЕЗАМИНИРОВАНИЯ.
3.ОБЕСПЕЧИВАЮТ СИНТЕЗ МОЧЕВИНЫ
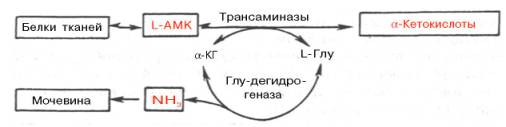
КОСВЕННОЕ ДЕЗАМИНИРОВАНИЕ (ТРАНСДЕЗАМИНИРОВАНИЕ).
Оксидазы аминокислот в клетках организма человека имеют очень низкую активность. Поэтому прямое окислительное дезаминирование аминокислот почти не протекает. Исключением является никотинамидный фермент глутаматдегидрогеназа, который легко дезаминирует глутаминовую кислоту, расщепляя ее до NH3 и альфа-кетоглутарата. Альфа-кетоглутарат может легко вступать в реакции трансаминирования с другими аминокислотами, превращаясь обратно в глутаминовую кислоту.
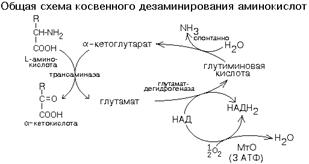
Некоторые аминокислоты не имеют «своей собственной» трансаминазы, которая могла бы перенести их аминогруппу на альфа-кетоглутарат (лизин, треонин, пролин, оксипролин), но для этих аминокислот есть специальные реакции, в результате которых аминогруппа этих аминокислот оказывается в составе глутаминовой кислоты.
Таким образом, глутаминовая кислота работает в паре с альфа-кетоглутаровой: альфа-кетоглутарат принимает у разных аминокислот азот в форме аминогруппы, превращаясь в глутамат; глутамат легко дезаминируется прямым путем высокоактивной глутаматдегидрогеназой с образованием аммиака.
Общий итог косвенного дезаминирования такой же, как и результат прямого окислительного дезаминирования.
Это вариант дезаминирования, который протекает в две стадии:
а) трансаминирование с участием альфа-кетоглутаровой кислоты;
б) дезаминирование образовавшейся на первой стадии глутаминовой кислоты.
Косвенное дезаминирование является наиболее важным, т.к. именно таким путем дезаминируются большинство аминокислот живого организма. Это обусловлено тем, что фермент глутамат-ДГ более активен, чем оксидазы аминокислот.
ПРЕИМУЩЕСТВА КОСВЕННОГО ДЕЗАМИНИРОВАНИЯ ПЕРЕД ПРЯМЫМ:
1. В этом процессе не образуется Н2О2, в отличие от прямого дезаминирования, а образуется Н2О и 3 молекулы АТФ (энергия).
2. Косвенное дезаминирование обеспечивает гораздо более быстрое дезаминирование (благодаря высокой активности фермента глутамат-ДГ и трансаминазы);
3. Косвенное дезаминирование протекает не только быстрее, но скорость этого процесса может регулироваться. Возможность регуляции косвенного дезаминирования обусловлена обратимостью процесса и автономной саморегуляцией. Аллостерическими регуляторами глутаматдегидрогеназы являются АДФ (сильный активатор) и АТФ (ингибитор). Ингибирующее действие на этот фермент оказывают также ГТФ и НАДН2.
Если АТФ начинает расходоваться больше, чем образуется в процессе биоокисления в митохондриях, то после активации глутамат-ДГ происходит смещение реакций в сторону образования АТФ, благодаря тому, что глутамат начинает быстрее дезаминироваться, а образующиеся кетокислоты, либо сразу, либо после определенных превращений, могут также вступать на путь митохондриального окисления. Это наблюдается при недостатке жирных кислот или углеводов. То есть при недостатке жиров и углеводов в пище, в качестве дополнительного источника энергии организм начинает использовать аминокислоты. Нередко приходится при голодании разрушать собственные белки. Т.е. при похудании в организме разрушаются не только жиры и углеводы, но и собственные белки. Присутствие достаточного количества жиров и углеводов в пище позволяет сберечь белки от нерационального использования.
СИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ В ОРГАНИЗМЕ
Иногда в организме возникает ситуация, когда потребность в тех или иных аминокислотах больше, чем их поступление с пищей. Допустим, организму требуется 7 граммов аланина и 15 граммов глутамата, а с пищей поступило всего лишь 5 граммов аланина, но зато 20 граммов глутамата. Тогда организм, используя механизм трансаминирования, может синтезировать недостающее количество аланина из ПВК, который синтезируется в бих количествах (сотни граммов в сутки). Таким образом, в организме постоянно происходит корректировка аминокислотного состава, но это не уменьшает потребности организма в пищевом белковом азоте. Эта корректировка осуществляется с использование соответствующих альфа-кетокислот, образующихся в ходе метаболизма углеводов и жиров.
Незаменимые аминокислоты не могут образуются в организме, потому что в ходе распада углеводов и жиров не образуется соответствующих им альфа-кетокислот.
Подводя итог, можно сказать, что в результате общих путей катаболизма аминокислот, они разрушаются до СО2, NH3 и безазотистых фрагментов, которые также могут разрушаться до СО2 и Н2О. Аммиак подвергается реакциям обезвреживания.