как предотвратить цитокиновый шторм при какой температуре
Почему происходит цитокиновый шторм?
На сегодняшний день у науки нет однозначного ответа не этот вопрос. В некоторых случаях речь может идти о генетической предрасположенности. Также ненормальную активность иммунной системы могут спровоцировать некоторые аутоиммуные заболевания (например, волчанка или ревматоидный артрит), а также некоторые виды терапии, которые повышают активность иммунной системы. Еще одна вероятная причина – сепсис, прием некоторых препаратов, а также некоторые вирусы.
Так, исследователи полагают, что «испанка» — разновидность гриппа, эпидемию которого мир пережил в 1918-1919 годах, вызывалась вирусом, который был способен спровоцировать цитокиновый шторм.
Какие симптомы цитокинового шторма?
Какой бы ни была причина, вызвавшая чрезмерный иммунный ответ, симптомы практически всегда одинаковые:
Но важно помнить, что для окончательной диагностики шторма необходимы лабораторные анализы крови (при гиперреакции иммунной системы будут сильно повышены С-реактивный белок и ферритин), также необходимы исследование почек и другие.
Как лечат цитокиновый шторм?
Только в реанимации. Помимо терапии лекарствами, подавляющими иммунитет, необходима постоянная поддержка организма, который при цитокиновом шторме буквально разрывается от разного рода воспалений. К сожалению, терапия далеко не всегда завершается удачей: это слишком опасное состояние, лечить которое мы пока не умеем.
Действительно ли коронавирус вызывает цитокиновый шторм?
Эта версия была очень популярна в начале пандемии коронавируса. Действительно, клиническая картина во многом напоминала повышенную активность иммунной системы: сильнейшее воспаление, которое быстро развивалось и поражало многие внутренние органы.
Цитокиновый шторм при различных вариантах течения COVID-19
В декабре 2019 года в городе Ухань, Китай, был обнаружен новый штамм коронавируса, вызывающий тяжелый острый респираторный синдром — коронавирус 2 (SARS-CoV-2). Наряду с SARS-CoV и коронавирусом, ассоциированным с ближневосточным респираторным синдромом — (MERS-CoV), SARS-CoV-2 является третьим коронавирусом, вызывающим тяжелые респираторные заболевания у людей, объединенных под названием «коронавирусная болезнь 2019 года» (COVID-19). Эта вспышка была признана Всемирной организацией здравоохранения (ВОЗ) в марте 2020 года пандемией и оказала значительное влияние на экономику и здравоохранение во всем в мире.
Хотя ситуация развивается стремительно, тяжелое течение заболевания, проявляющееся лихорадкой и пневмонией, приводящее к острому респираторному дистресс-синдрому (ОРДС), было описано в 20 % случаев COVID-19. Это напоминает течение ОРДС, вызванного синдромом выброса цитокинов (цитокиновый шторм), и вторичный гемофагоцитарный лимфогистиоцитоз, наблюдаемый у пациентов с SARS-CoV и MERS-CoV, а также у пациентов с лейкемией, получающих Т-клеточную терапию. Учитывая этот опыт, необходимо создание терапевтических средств, основанных на подавлении синдрома выброса цитокинов, таких как тоцилизумаб, которые прошли клинические испытания для лечения COVID-19.
SARS-CoV-2 — это бета-коронавирус, который наиболее тесно связан с SARS-CoV. Оба вируса используют рецептор ангиотензинпревращающего фермента, связанный с карбоксипептидазой (ACE2), чтобы проникнуть в клетки. Этот рецептор повсеместно экспрессируется в сердечной и легочной ткани, а также в некоторых кроветворных клетках, включая моноциты и макрофаги. Ключевой особенностью инфекции COVID-19 является лимфопения (низкий уровень лимфоцитов в крови), которая коррелирует с клинической тяжестью процесса. При SARS-CoV инфицируются моноциты и дендритные клетки, тогда как при MERS-CoV инфицируются моноциты и Т-клетки через дипептидилпептидазу 4 (DPP4). Возможно, что SARS-CoV-2 также поражает дендритные клетки. Апоптоз и истощение пула Т-клеток в результате нарушения процессов активации из-за дисфункции дендритных клеток может способствовать патологии иммунной системы при COVID-19. Однако лимфопения не является специфическим биомаркером неблагоприятного прогноза при COVID-19, поскольку она также является биомаркером, который коррелирует с летальным исходом в пандемии гриппа A (H1N1) 2009 года.
Было установлено, что цитокиновый шторм является основным фактором тяжелого течения SARS-CoV и MERS-CoV у пациентов. Повышенные сывороточные концентрации интерлейкина-6 (IL-6) и других провоспалительных цитокинов являются признаками тяжелого течения инфекции MERS-CoV. Синдром высвобождения цитокинов часто встречается у пациентов с COVID-19, а повышенный уровень IL-6 в сыворотке коррелирует с дыхательной недостаточностью, ОРДС и неблагоприятными клиническими исходами. Повышенный уровень C-реактивного белка (CРБ),экспрессия которого стимулируется IL-6, также является биомаркером тяжелой бета-коронавирусной инфекции.
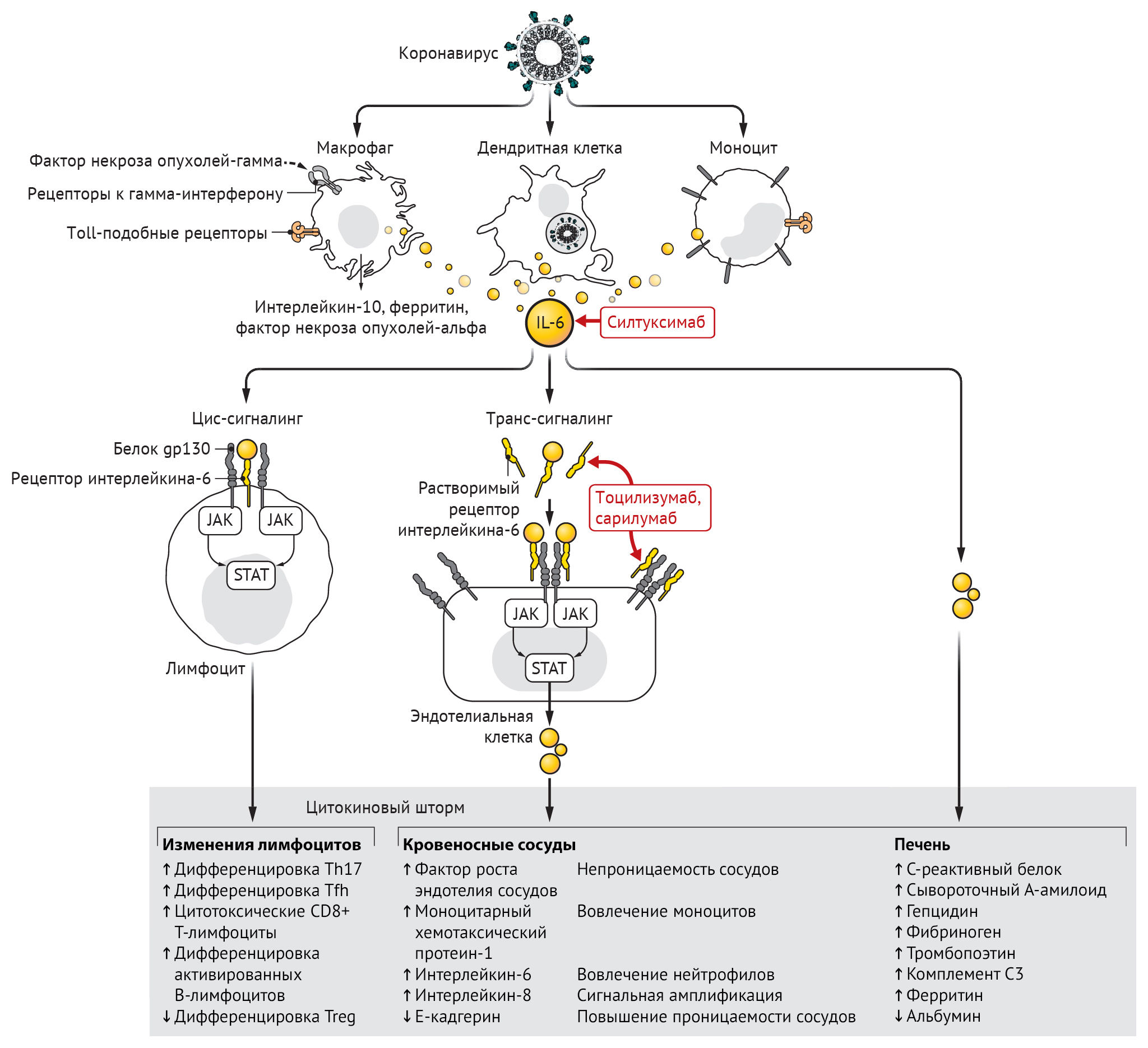
Инфицирование бета-коронавирусом моноцитов, макрофагов и дендритных клеток приводит к их активации и секреции IL-6 и других провоспалительных цитокинов. IL-6 обладает выраженными провоспалительными свойствами (см. рис. 1). IL-6 может передавать сигналы по двум основным путям, которые называются классической цис-передачей или транс-передачей. При передаче цис-сигналов IL-6 связывается с мембраносвязанным рецептором IL-6 (mIL-6R) в комплексе с gp130; нисходящая сигнальная трансдукция опосредуется, в свою очередь, JAKs (Janus kinases) и STAT3 (сигнальный преобразователь и активатор транскрипции-3). Связанный с мембраной комплекс gp130 экспрессируется повсеместно, в отличие от mIL-6R, экспрессия которого ограничена в основном иммунными клетками. Активация передачи сигналов в рамках цис-передачи приводит к плейотропным эффектам на приобретенный иммунитет (В- и Т-клетки), а также врожденную иммунную систему [нейтрофилы, макрофаги и естественные клетки-киллеры (NK)], которые могут вносить вклад в возникновение цитокинового шторма.
При передаче сигналов высокие концентрации циркулирующих IL-6 связываются с растворимой формой IL-6R (sIL-6R), образуя комплекс с димером gp130 на всех клеточных поверхностях. В результате сигнальный каскад IL-6-sIL-6R-JAK-STAT-3 активируется в клетках, которые не экспрессируют mIL-6R, таких как эндотелиальные клетки. Это приводит к системному «цитокиновому шторму», включающему секрецию сосудистого эндотелиального фактора роста (VEGF), хемоаттрактантного белка моноцитов–1 (МСР-1), IL-8 и дополнительного IL-6, а также снижение экспрессии E-кадгерина на эндотелиальные клетки. VEGF и пониженная экспрессия E-кадгерина способствуют проницаемости сосудов, которые участвуют в патофизиологии гипотонии и легочной дисфункции при ОРДС.
Вторичный гемофагоцитарный лимфогистиоцитоз — это гипервоспалительный синдром, характеризующийся высвобождением цитокинов, цитопенией (низкое количество клеток крови) и полиорганной недостаточностью (включая печеночную). У взрослых вторичный гемофагоцитарный лимфогистиоцитоз чаще всего связан с тяжелыми вирусными инфекциями, но также встречается у пациентов с лейкемией, получающих специальную Т-клеточную терапию. В дополнение к повышенным уровням цитокинов для вторичного гемофагоцитарного лимфогистиоцитоза характерны высокие уровни ферритина в сыворотке крови. Экспрессирующие CD163 макрофаги выступают в качестве источника ферритина. Учитывая их роль в передаче сигналов ретикулоэндотелиального железа, вторичный гемофагоцитарный лимфогистиоцитоз известен также как синдром активации макрофагов. Ретроспективное исследование пациентов с COVID-19 показало, что повышение сывороточного ферритина и IL-6 коррелировало с уровнем выживаемости и наблюдалось у погибших.
У пациентов, получающих CART-терапию (лечение Т-клетками химерного рецептора антигена (chimeric antigen receptor — CAR)), также могут развиться как цитокиновый шторм, так и вторичный гемофагоцитарный лимфогистиоцитоз. CART-терапия включает перепрограммирование Т-лимфоцитов пациента с целью повышения экспрессии на них молекул CAR, которые распознают антигены на опухолевых клетках. При переливании этих перепрограммированных клеток обратно пациенту они нацеливаются на опухолевые клетки, тем самым активируя противоопухолевый иммунный ответ. Эмили Уайтхед, первый пациент, получивший CD19-нацеленные Т-клетки CAR-19 с целью лечения острого лимфобластного лейкоза в 2012 году, побочным эффектом получила тяжелую форму цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза, что привело к развитию ОРДС, полиорганной недостаточности и гипотонии, которая была невосприимчива к стандартному лечению стероидами. Из-за значительного повышения сывороточного IL-6 у этой пациентки эмпирически было принято решение о начале терапии тоцилизумабом, антагонистом IL-6R, одобренным в то время для лечения ревматических состояний, таких как ювенильный идиопатический артрит. Она получала однократную дозу тоцилизумаба на 7-й день после введения CARТ-лимфоцитов. Спустя несколько часов у пациентки снизилась температура, после чего было принято решение об отмене лечения гипотонии и отказ от поддержки ИВЛ после разрешения ОРДС. В настоящее время тоцилизумаб с подтвержденной эффективностью и минимальными побочными эффектами у сотен пациентов одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения заболеваний, протекающих с синдромом цитокинового шторма, вызванного CARТ-терапией.
Эффективность антагонистов IL-6-IL-6R для лечения цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза подчеркивает центральную роль передачи сигналов IL-6 в патофизиологии цитокин-управляемых гипервоспалительных синдромов. Тяжелые случаи COVID-19 можно лечить как раз путем ингибирования пути IL-6, учитывая связанные с цитокиновым штормом и подобным вторичному гемофагоцитарному лимфогистиоцитозу повышения цитокинов в сыворотке крови. Действительно, предварительные результаты исследования 21 пациента с COVID-19, получавшего тоцилизумаб в Китае, обнадеживают: лихорадка спадала у всех пациентов в течение первого же дня приема тоцилизумаба. Потребность в кислороде была снижена у 75 % пациентов.
Во всем мире проводятся контролируемые клинические испытания с целью тестирования эффективности антагонистов IL-6 и IL-6R для лечения пациентов с COVID-19 с тяжелыми респираторными осложнениями. Один вопрос, который необходимо решить, заключается в том, будет ли иметь место дифференциальная эффективность между антагонистами IL-6 и антагонистами IL-6R. Относительно этого поднимается вопрос, что ингибиторы IL-6R могут подавлять как цис-, так и транс-передачу сигналов, а также транс-презентацию, недавно описанный третий способ передачи сигналов. Транс-презентация включает связывание IL-6 с mIL-6R, экспрессируемым на иммунной клетке, которая образует комплекс с gp130 на клетках T-хелпера-17 (TH17), что приводит к передаче сигналов Т-клеток вниз по каскаду, который может приводить к ОРДС. Однако ингибиторы IL-6 могут подавлять только цис- и транс-передачу сигналов. Непосредственная цель применения антагонистов IL-6 состоит в том, чтобы облегчить течение тяжелых случаев COVID-19 и свести к минимуму потребности в интенсивной терапии данных пациентов. Долгосрочная цель должна заключаться в разработке противовирусных препаратов и вакцин, которые предотвращают инфекцию или облегчают ее течение.
Есть ряд предостережений, которые необходимо брать во внимание, учитывая глобальную потребность в терапии COVID-19. При сепсис-ассоциированном ОРДС часто назначают кортикостероиды. Однако применение кортикостероидов у пациентов с SARS и MERS не улучшило показатели выживаемости и не привело к каким-либо изменениям вирусного клиренса. В результате консенсус экспертов-инфекционистов из профильных институтов и ВОЗ рекомендует клиницистам избегать системных кортикостероидов у пациентов с COVID-19 в настоящее время. Теоретическая возможность состоит в том, что подавление воспаления антагонистами IL-6 может задержать выведение вируса из организма. Однако блокада IL-6 также приводит к быстрому снижению сывороточного IL-10, иммуносупрессивного цитокина, секретируемого макрофагами, что может смягчить опасения по поводу продления клиренса вируса. Более того, одна или две дозы антагониста IL-6 вряд ли приведут к таким осложнениям, как грибковые инфекции или остеонекроз челюсти, возникающие у пациентов, которым ежемесячно вводят эти препараты для лечения хронических состояний, например, ревматоидного артрита. Примечательно, что тоцилизумаб был впервые одобрен для лечения ревматических заболеваний, а затем — цитокинового шторма у пациентов, получающих CARТ-терапию, и в настоящее время подвергается «перепрофилированию» для борьбы с пандемией COVID-19. Вполне возможно, что направленная на IL-6 терапия будет использоваться в лечении пациентов на случай будущих пандемий, вызванных другими вирусами, таких как грипп и лихорадка Эбола.
Не ПЦРом единым. Как не пропустить опасные осложнения COVID-19
Часто осложнения COVID-19 опаснее самой инфекции, и большинство летальных исходов при коронавирусной инфекции связаны именно с осложнениями. Учитывая стремительное ухудшение эпидемиологической обстановки, постоянные мутации вируса и увеличение случаев тяжелого течения COVID-19 даже среди молодых людей, чтобы спасать жизни, необходимо действовать очень быстро. В большинстве случаев развитие осложнений можно предотвратить, если вовремя на них отреагировать и выработать индивидуальную стратегию медицинского сопровождения. А спрогнозировать тяжелое течение и вовремя принять необходимые лечебные меры поможет лабораторная диагностика.
SARS-CoV 2 затрагивает не только легкие – под ударом весь организм. Осложнения COVID-19 проявляются в виде поражения сердца и сосудов, мозга, печени и почек, системы кроветворения, а новый штамм «Дельта» почти в 15% случаев затрагивает еще и ЖКТ. Особо опасны изменения в системе гемостаза, воспалительные процессы в органах и системах, а также присоединение бактериальной инфекции. Поэтому жизненно важно контролировать состояние не только легких, но оценивать изменения биохимических и гематологических маркеров, параметров гемостаза и лабораторных предикторов острого воспаления.
Для оценки степени поражения самых уязвимых органов и систем в ДІЛА доступны следующие комплексные исследования:
Комплексы помогут обнаружить специфические биологические маркеры развития осложнений и снизить вероятность их появления.
В программу «Оценка состояния организма при COVID-19, минимальный» входит исследования наиболее важных показателей:
Таким образом, лабораторные комплексы от ДІЛА помогут определить общее состояние как системы кроветворения, так и других органов и систем организма, выявить острые воспалительные процессы, контролировать развитие дыхательной недостаточности и септических осложнений у пациентов с диагностированным COVID-19. Маркеры, входящие в состав программ, также позволят диагностировать обменные нарушения, развитие полиорганной недостаточности, наличие процессов тромбообразования.
Самые опасные осложнения
Несмотря на то, что COVID-19 является, прежде всего, инфекцией дыхательных путей, опыт борьбы с SARS-COV-2 во всем мире указывает, что COVID-19 – заболевание системное, затрагивающее не только легкие, но также сердечно-сосудистую, нервную, кроветворную, пищеварительную, иммунную и эндокринную системы.
Большинство этих осложнений проявляются характерными изменениями биохимических маркеров – С-реактивного белка, ферритина и Д-димера, а также изменениями коагулограммы и результатов общего анализа крови. Рассмотрим эти маркеры подробнее.
Лабораторные предикторы осложнений
Воспаления и «цитокиновый шторм». В ответ на инфицирование SARS-CoV-2 запускается реакция макрофагов, которые провоцируют воспалительный процесс. Воспаление проявляется повышением уровня специфических маркеров:
На фоне воспалительных процессов и «цитокинового шторма» развивается прогрессирующая полиорганная недостаточность, поэтому расширенные комплексы дополнительно включают определение уровней креатинина, АСТ, АЛТ, общего билирубина и лактатдегидрогеназы (ЛДГ), а также тропонина I и прокальцитонина:
Также диагностическую ценность имеет определение концентрации интерлейкина IL-6 – противовоспалительного цитокина, являющегося главным участником цитокинового шторма. Интерлейкин-6 – чувствительный маркер острых системных воспалений, который поможет вовремя выявить повышенный нерегулируемый иммунный ответ организма под воздействием коронавируса (синдром высвобождения цитокинов). Он приводит к повреждению тканей (часто легочной) и органов, тяжелому течению инфекции с возможным летальным исходом. Определение уровня IL-6 показано пациентам с тяжелым течением COVID-19.
Нарушения со стороны системы кроветворения. COVID-19-ассоциированная коагулопатия, которая сопровождается нарушением системы свертываемости крови, может стать причиной почечной недостаточности, ухудшения работы печени, сердца, органов ЖКТ. Страдают также эндокринная и нервная системы. Поэтому мониторинг маркеров коагуляции является важным критерием оценки рисков тромбоэмболических осложнений у пациентов с диагностированным COVID-19.
К этим маркерам относятся:
Систематический контроль параметров гемостаза требуется не только при тяжелом течении COVID-19, но даже в случае отсутствия характерных клинических проявлений инфекции. В совокупности все эти гемостатические изменения могут указывать на опасные формы коагулопатии и предрасположенность к тромбоэмболическим проявлениям.
Для оценки общего состояния всей системы кроветворения в состав всех комплексов также включен развернутый анализ крови. Он позволяет своевременно обнаружить и отследить в динамике опасные состояния:
Изменения гематологических параметров также прогностически опасны.
Как видно, программы содержат множество показателей и предназначены для всесторонней оценки состояния разных органов и систем при диагностированном COVID-19. Оценить полученные результаты может только врач. Поэтому с полученными результатами исследования необходимо обратиться к терапевту или семейному врачу, а если есть отклонения от референсных значений – обратиться немедленно, так как состояния вроде цитокинового шторма опасны для жизни и могут развиваться очень быстро.
Когда и кому проходить исследование?
Комплексы позволяют из одной пробы крови получить все необходимые данные для быстрой оценки состояния организма и определить, входите ли вы в группу риска по развитию осложнений COVID-19.
Исследование рекомендуется пройти в обязательном порядке людям следующих категорий:
Даже если вы не относитесь ни к одной из групп риска и у вас легкое либо среднетяжелое течение коронавирусной инфекции, но вы ощущаете ухудшение самочувствия и состояния (обычно наблюдается на 5-10 день болезни), также рекомендуется пройти обследование. Это необходимо для оценки тяжести состояния, обширности поражений и определения потребности в госпитализации, в том числе экстренной.
Заключение
Тяжелое инфекционное заболевание, вызванное коронавирусом SARS-CoV 2, с эпидемической вспышки в Ухане быстро переросло в пандемию с миллионами летальных случаев и сотнями миллионов зараженных. В Украине и в мире количество больных вновь увеличивается. И, если год назад COVID-19 называли, прежде всего, инфекцией дыхательных путей, то сегодня его рассматривают как системное заболевание, поражающее многие органы и системы.
Наряду с такими факторами риска, как возраст и наличие сопутствующих заболеваний, некоторые лабораторные параметры заблаговременно могут указывать на тяжелое течение COVID-19 и повышенный риск смертности:
Комплексы рекомендуется проходить не только людям из группы риска, но и всем, у кого ПЦР-тест подтвердил инфицирование коронавирусом SARS-COV-2. Маркеры, входящие в состав программы, позволят диагностировать опасные для жизни осложнения и своевременно назначить соответствующую терапию.
Не стоит забывать, что осложнения и последствия COVID-19 могут сохраняться в течение нескольких месяцев, и проявляться в виде постковидного синдрома, диагностика и мониторинг которого также проводится с помощью лабораторных маркеров. Поэтому переболевшим обязательно нужно проверять состояние своего здоровье и вовремя принимать соответствующие меры.
Как предотвратить цитокиновый шторм при какой температуре
В связи с пандемией коронавируса все чаще мы стали слышать про цитокиновый шторм, который является следствием заражения вирусными инфекциями, в том числе SARS-CoV-2. Что это такое? Почему он появляется при COVID-19? Давайте разбираться вместе.
Начнем с того, что такое цитокины. Цитокины – группа информационных гормоноподобных белков и пептидов, которые выделяются клетками иммунной системы и некоторыми другими. При атаке вирусной инфекции, организм начинает усиленно вырабатывать эти молекулы. Они выполняют четыре функции:
• управляют различными иммунными реакциями (гомеостаз, восстановление);
• регулируют гемопоэз (кровотворение).
Избыточная выработка цитокиновых молекул приводит к цитокиновому шторму.
Цитокиновый шторм – агрессивная иммунная реакция организма на вирусную инфекцию и лекарственные препараты, влекущее за собой системное воспаление и нарушение правильной работы иммунитета. При цитокиновом шторме в организме нарушается функция свертываемости крови, вырабатывается избыточное количество медиаторов воспаления, а также очагов разрушения собственных клеток и тканей. При усилении этих процессов иммунная реакция становится неконтролируемой – интерфероны, хемокины, ФНО (факторы некорза опухоли) и другие молекулы из группы цитокинов начинают активно высвобождаться.
При развитии цитокинового шторма, в ответ на атаку вируса, возникает иммуно-воспалительная реакция, из-за которой уровень цитокинов резко возрастает – именно поэтому заболевание имеет в названии слово «шторм». Лимфоциты атакуют не только инфекционный возбудитель, но и жизненно важные клетки, в результате чего прекращается работа целых органов.
Главная опасность цитокинового шторма при COVID-19 – иммунная недостаточность, т.к. она облегчает присоединение бактериальных инфекций. Воспалительный процесс и системное повреждение тканей может привести к нарушению работы внутренних органов и смерти.
На данный момент механизм развития цитокинового шторма до конца не изучен, однако COVID-19 является одной из причин его возникновения. Вы можете постараться избежать заражения путем вакцинации и соблюдения всех мер предосторожности. Будьте здоровы.
Основные прогностические факторы риска цитокинового шторма у пациентов с COVID-19 (ретроспективное клиническое исследование)
Полный текст
Аннотация
Обоснование. По данным Всемирной организации здравоохранения (WHO Coronavirus Disease), на 31.03.2021 в мире зарегистрировано 127 877 462 подтвержденных случая новой коронавирусной инфекции COVID-19, в том числе 2 796 561 со смертельным исходом. COVID-19 характеризуется широким спектром клинических проявлений — от бессимптомного до быстрого прогрессирования в тяжелую и крайне тяжелую форму. Прогностические биомаркеры раннего выявления лиц из группы высокого риска стали неотложной медицинской необходимостью. Цель исследования — поиск предикторов цитокинового шторма, характеризующего тяжелое течение инфекции COVID-19, создание шкалы риска развития этого осложнения у пациентов для практической работы. Методы. В исследование вошли 458 пациентов с подтвержденной инфекцией COVID-19 и признаками вирусного поражения легких по данным компьютерной томографии. Пациенты разделены на 2 группы: со стабильным течением средней тяжести (n=100) и с прогрессирующим течением средней, тяжелой и крайне тяжелой степени (n=358). Результаты. Установлено, что основными факторами риска развития цитокинового шторма у пациентов с COVID-19 являются концентрация интерлейкина-6 >23 пг/мл, динамика индекса по шкале NEWS ≥0, концентрация ферритина >485 нг/мл, D-димера >2,1, С-реактивного белка >50 мг/л, количество лимфоцитов в крови 9 /л, возраст ≥40 лет. Частота случаев цитокинового шторма коррелирует с увеличением числа факторов риска. Для практического применения шкалы выделены 3 группы риска: у пациентов первой группы (0–1 фактор) риск цитокинового шторма практически отсутствует, во второй группе (2–3 фактора) вероятность шторма составляет 55% (увеличивается в 35,5 раза), в третьей группе (≥4 факторов риска) достигает 96% (увеличивается в 718 раз). Заключение. У пациентов с инфекцией COVID-19 установлены критерии диагностики и контроля цитокинового шторма. Разработанная прогностическая шкала позволяет выделить пациентов с высоким риском развития цитокинового шторма для раннего назначения противовоспалительной терапии.
Ключевые слова
Полный текст
ОБОСНОВАНИЕ
Инфекция COVID-19 (COronaVIrus Disease 2019), вызываемая коронавирусом SARS-CoV-2, остается глобальной проблемой для всемирного здравоохранения. У большинства людей, инфицированных SARS-CoV-2, болезнь протекает в легкой форме. У части пациентов иммунный ответ становится нерегулируемым, что приводит к тяжелому повреждению легких и проявляется как острый респираторный дистресс-синдром (ОРДС) с последующим развитием острой дыхательной недостаточности, дисфункции внелегочных органов и высокой смертностью. Болезнь COVID-19 обычно связана с повышением уровней воспалительных биомаркеров, цитокинов и хемокинов, особенно при тяжелом течении. Помимо того, часто встречаются лимфоцитопения и нейтрофилия со значительным уменьшением числа CD8+ Т-клеток, CD4+ Т-клеток и естественных клеток-киллеров (natural killer, NK) [1]. Смертность госпитализированных пациентов колеблется от 15 до 20% и выше у нуждающихся в интенсивной терапии [2].
Центральной в патофизиологии COVID-19 является иммунная дисфункция с выраженной неконтролируемой генерализованной системной воспалительной реакцией вследствие усиленной продукции воспалительных цитокинов — цитокиновый шторм (ЦШ). ЦШ сопровождается лихорадкой, цитопенией, гиперферритинемией, аномальными печеночными показателями, коагулопатией и поражением легких (в том числе ОРДС) [3]. При всех этих состояниях интерлейкины (interleukin, IL) 1β, 18, 6 и интерферон гамма (interferon gamma, IF N-γ) являются основными медиаторами гипервоспаления. COVID-19-ассоциированный ЦШ является уникальной формой гипервоспалительной реакции, требующей разработки критериев его установления [4].
Цель исследования — поиск биомаркеров-предикторов ЦШ у пациентов с COVID-19 и создание на их основе прогностической шкалы риска развития ЦШ для использования в повседневной врачебной деятельности.
МЕТОДЫ
Дизайн исследования
Обсервационное клиническое исследование.
Критерии соответствия
Проведен анализ 458 историй болезни пациентов с COVID-19, находившихся на лечении в ГБУЗ «Городская больница № 40» Санкт-Петербурга в период с 18.04.2020 по 21.11.2020, имевших положительный результат теста на наличие РНК SARS-CoV-2 методом амплификации нуклеиновых кислот в полимеразной цепной реакции (ПЦР); клинические проявления и симптомы (лихорадку, общую слабость и недомогание, кашель и одышку); изменения по типу вирусной пневмонии на КТ-изображении легких без внутривенного контрастного усиления (преимущественно двустороннего нижнедолевого, периферического, периваскулярного, мультилобулярного характера; многочисленные периферические уплотнения в виде «матового стекла» округлой формы различной протяженности; уплощение междолькового интерстиция по типу булыжной мостовой, участки консолидации, симптом воздушной бронхограммы и др.) [5].
Методы регистрации исходов
У всех пациентов проводили сбор анамнестических данных с уточнением особенностей течения заболевания; объективный осмотр с оценкой параметров гемодинамики, дыхательной системы (частота дыхательных движений, частота сердечных сокращений, артериальное давление, степень насыщения крови кислородом, SpO2; степень дыхательной недостаточности); оценку по шкале раннего выявления риска у пациентов с внезапными острыми заболеваниями (National Early Warning Score, NEWS), рекомендованной к использованию для пациентов с COVID-19 [6]; компьютерную томографию (КТ) органов грудной клетки с оценкой формы заболевания по четырехзначной шкале (КT- 1, КT-2, КT-3, КT-4); лабораторные исследования (клинический анализ крови; биохимический минимум; определение уровней ферритина, С-реактивного белка, IL-6, лактатдегидрогеназы, D-димера), электрокардиографию; при необходимости использовали дополнительные инструментальные методики.
Статистический анализ
Пороговые уровни для возраста, индекса NEWS и лабораторных данных определяли с помощью метода построения деревьев классификации (Classification Trees) [7].
Относительный риск ЦШ (odds ratio, OR): отношение вероятности развития определенного исхода в группах сравнения изучали путем построения четырехпольной таблицы сопряженности с расчетом стандартной формулы и границ доверительного интервала. При наличии в таблице нулевых значений для расчета использовали поправку Халдейна.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Демографические данные, данные эпидемиологического анамнеза и сопутствующие заболевания пациентов исследуемой когорты представлены в табл. 1.
Таблица 1 / Table 1
Демографические, эпидемиологические и анамнестические данные пациентов
Patients’ demographic, epidemiological and anamnestic data
Показатель
n (%)
Контакт с инфекционными больными
Выезд за пределы места проживания в течение ближайших 14 дней
Наличие у близких родственников проявлений простуды
(лихорадка, кашель, слабость)
Наличие заболеваний в анамнезе:
• ишемическая болезнь сердца
• состояние после инсульта
• состояние после острого инфаркта миокарда
• состояние после оперативного лечения
• ревматоидный артрит и другие аутоиммунные заболевания
• хроническая болезнь почек 3-5 стадий
• хроническая обструктивная болезнь легких
Основные результаты исследования
Распространенность сопутствующих заболеваний у наших пациентов существенно превышает этот показатель у взрослых пациентов с COVID-19 по литературным данным (31% [8]). Высокий процент сочетанной патологии у наших пациентов связан с определенной профилизацией нашего корпуса, а именно с лечением пациентов с тяжелым и крайне тяжелым течением болезни. В отделении реанимации и интенсивной терапии из других отделений и стационаров в связи с прогрессирующим течением COVID-19 переведен 221 (48%) пациент.
При поступлении у пациентов зарегистрированы лихорадка (365; 80%), кашель (329; 72%), одышка (265; 57,86%), боль в мышцах (43; 9,39%), общая слабость (344; 75,11%), головная боль (36; 7,86%), боль в горле (29; 6,33%), насморк, ринорея (46; 10,04%), боль в грудной клетке (51; 11,14%), диарея (34; 7,42%), тошнота и рвота (13; 2,84%), снижение обоняния и вкуса (40; 8,73%). Наличие одного и более симптома заболевания отмечено у 450 (98,25%), КТ-признаков пневмонии — у 458 (100%) пациентов.
Пациенты были разделены на две группы, сравнимые по возрасту. Первую группу составили 100 (21,8%) пациентов с клинико-рентгенологическими особенностями, характеризующими стабильное течение заболевания средней степени тяжести; вторую — 358 (78,2%) человек с прогрессирующим среднетяжелым, тяжелым и крайне тяжелым течением болезни (табл. 2).
Таблица 2 / Table 2
Характеристика тяжести течения заболевания в группах пациентов
Characteristics of the disease severity in different groups of patients
Показатель
1-я группа
2-я группа
Всего
Степень тяжести течения заболевания:
• тяжелая; крайне тяжелая
Форма заболевания по КТ 1–4 при поступлении:
Лечение COVID-19 и его осложнений в 1-й группе включало антибактериальные и противовирусные препараты, профилактику гиперкоагуляции и ДВС-синдрома, симптоматическое лечение, кислородную терапию. Во 2-й группе в соответствии с тяжестью состояния для предупреждения или лечения ЦШ стандартная терапия была дополнена назначением реконвалесцентной патогенредуцированной плазмы, антицитокиновых препаратов, а именно: ингибиторов рецептора IL-6 (тоцилизумаб, олокизумаб, левилимаб), IL-1 (канакинумаб, RH104), JAK-киназ (тофацитиниб, руксолитиниб, барицитиниб), тирозинкиназы Bcr-Abl (радотиниб), в ряде случаев — глюкокортикоидов. По показаниям проводили этапную респираторную терапию, модифицированную антибактериальную терапию, экстракорпоральную мембранную оксигенацию, лечение сепсиса и септического шока (экстракорпоральная детоксикация и гемокоррекция и др.) [5].
При поступлении у пациентов 1-й группы достоверно чаще отмечена форма заболевания КТ-1, тогда как пациенты 2-й группы чаще, чем пациенты 1-й группы, госпитализировались с более тяжелыми формами — КТ-2, КТ-3 и КТ-4. Несмотря на преобладание во 2-й группе КТ-признаков среднетяжелого поражения легких (КТ-2), при поступлении у пациентов отмечались явления прогрессирующей дыхательной недостаточности и лихорадки (табл. 3).
Таблица 3 / Table 3
Сравнение групп пациентов по шкале NEWS, срокам поступления в стационар и длительности госпитализации
Comparison of patient groups via the NEWS scale, times of admission to the hospital and duration of the hospital stay
Показатель
Характеристики
1-я группа
2-я группа
Значение
Значение
Индекс NEWS при поступлении
Превышение пороговых величин основных предикторов ЦШ достоверно чаще наблюдалось у пациентов 2-й группы (табл. 6).
Таблица 6 / Table 6
Частота цитокинового шторма при различном числе факторов риска
Cytokine storm incidence for different numbers of risk factors
Число факторов риска
цитокинового шторма
1-я группа
2-я группа
Всего
В дальнейшем выполняли комплексную оценку риска ЦШ с ранжированием показателей, которыми, в соответствии с рангом прогностической значимости, полученным методом построения деревьев классификации, к началу терапии ЦШ оказались:
1) динамика индекса по шкале NEWS;
2) уровень IL-6 крови выше 23 пг/мл;
3) уровень СРБ крови равный или выше 50 мг/л;
4) абсолютное количество лимфоцитов меньше 0,72×10 9 /л;
5) положительный результат теста на РНК коронавируса (SARS-CoV-2);
6) возраст пациентов 40 лет и старше.
Эти биомаркеры могут быть использованы в качестве критериев для оценки риска ЦШ. Необходимо отметить, что гендерные различия несущественны в дальнейшей комплексной оценке риска развития ЦШ.
На рис. 1 проиллюстрировано возрастание риска ЦШ (OR) в зависимости от величины лабораторных показателей.
Рис. 1. Увеличение риска цитокинового шторма (OR) при неблагоприятных значениях показателей.
Fig. 1. Increase of the cytokine storm risk with the unfavorable values of indices.
Увеличение частоты случаев ЦШ коррелирует с увеличением числа факторов риска (коэффициент корреляции Rg +0,91, р
Рис. 2. Частота случаев цитокинового шторма при различном количестве факторов риска.
Fig. 2. Cytokine storm incidence for a different number of risk factors.
Для практического применения нашей прогностической модели выделены следующие категории риска:
Полученные результаты согласуются с оценкой факторов риска ЦШ при COVID-19 других авторов [11, 12] и позволяют обосновать выбор лечебной тактики с ранним назначением упреждающей противовоспалительной терапии и антиковидной плазмы реконвалесцентов для пациентов с высоким риском развития ЦШ.
ОБСУЖДЕНИЕ
Поскольку в настоящее время не разработаны убедительные прогностические критерии развития ЦШ при COVID-19, мы на примере 458 пациентов с различным течением заболевания проанализировали прогностическую силу доступных к изучению клинических, инструментальных и лабораторных параметров, стремясь найти когерентные группы или кластеры тех из них, которые являются полезными для формулирования прогноза, и установить их прогностическую силу. Для этого использовали регистрацию клинических признаков и симптомов при поступлении в стационар и в анамнезе; демографические, эпидемиологические сведения; клинические характеристики и оценку тяжести состояния по шкале NESW; степень тяжести COVID-19; коморбидность; анализ изменений в динамике легочной ткани («матовое стекло» ± консолидация) на КТ легких по стандартному протоколу без внутривенного контрастирования [5], а также значения лабораторных показателей крови [13] в пределах 24 ч до или после установления диагноза ЦШ и в течение последующих 7 дней госпитализации. В течение последующих 10 дней оценивали результаты определения РНК SARS-CoV-2; продолжительность лечения в стационаре и исходы болезни. При проведении сравнительной характеристики пациентов, имеющих клинико-рентгенологические признаки ЦШ, и пациентов без признаков ЦШ, выявлены потенциальные факторы риска развития ЦШ.
Нарастающее увеличение показателя по шкале NEWS характеризует клиническую тяжесть течения заболевания и прогрессирование гемодинамических нарушений. Так, в 1-й группе пациенты при поступлении имели индекс не более 4 баллов, который уменьшался на фоне терапии на 1–2 балла, в то же время у пациентов 2-й группы отмечалось увеличение числа баллов на 1,24±1,86 при исходном более высоком значении индекса. Достоверные различия между 1-й и 2-й группами получены при анализе уровней IL-6, СРБ, ферритина, количества лимфоцитов. Таким образом, при прогрессирующем течении заболевания мы видим нарастающие показатели биомаркеров, которые участвовали в реализации клинической картины ЦШ у наших пациентов.
ЗАКЛЮЧЕНИЕ
К основным факторам риска развития цитокинового шторма у больных COVID-19 относятся мужской пол, возраст старше 40 лет, положительный тест на РНК SARS-CoV-2, лимфопения, уровни ЛДГ, D-димера, ферритина и IL-6, динамика индекса по шкале NEWS. Лабораторными критериями для диагностики и динамического контроля за течением цитокинового шторма являются абсолютное количество лимфоцитов, уровни ЛДГ, СРБ, ферритина, D-димера и IL-6. Разработанная прогностическая шкала позволяет выделить группу пациентов с высоким риском развития ЦШ для раннего назначения противовоспалительной терапии.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Участие авторов. А.Ю. Анисенкова — лечение пациентов, обсуждение результатов исследования, написание текста статьи; С.В. Апалько, З.П. Асауленко — лабораторные исследования биологических образцов пациентов; А.Н. Богданов, Д.А. Вологжанин — обсуждение результатов исследования, редактирование текста статьи; Е.Ю. Гарбузов — лечение пациентов; О.С. Глотов — тестирование биологических образцов пациентов на наличие коронавируса SARS-CoV-2; Т.А. Камилова — поисково-аналитическая работа, обсуждение и редактирование текста статьи; О.А. Клиценко — обработка и обсуждение результатов исследования; Е.М. Минина — рентгенологическая диагностика; С.В. Мосенко — обследование пациентов, обсуждение результатов исследования, редактирование текста статьи; Д.Н. Хоботников — лечение пациентов; С.Г. Щербак — руководство лечением пациентов, обсуждение результатов исследования.
Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Источник финансирования. Исследование и публикации статьи финансируются из бюджета СПб ГБУЗ «Городская больница № 40 Курортного административного района».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.