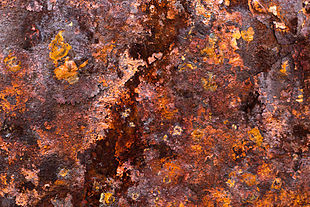к какому явлению относится ржавление железа
Ржавление
Ржавление
| Причины отказа механики |
|---|
| Прогиб |
| Коррозия |
| Пластическая деформация |
| Усталость материала |
| Удар |
| Пиздец.вот и пришла сессия |
| Трещина |
| Плавление |
| Износ |
Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это — разрушение любого материала — будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: 4Fe + 2Н2О + ЗО2 = 2(Fe2O3•Н2О)
В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозии полимеров. Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.
Содержание
Классификация видов коррозии
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
По условиям протекания коррозионного процесса различаются следующие виды:
По характеру разрушения:
Главная классификация производится по механизму протекания процесса. Различают два вида:
Коррозия неметаллических материалов
По мере ужесточения условий эксплуатации (повышение температуры, механических напряжений, агрессивности среды и др.) и неметаллические материалы подвержены действию среды. В связи с чем термин «коррозия» стал применяться и по отношению к этим материалам, например «коррозия бетонов и железобетонов», «коррозия пластмасс и резин». При этом имеется в виду их разрушение и потеря эксплуатационных свойств в результате химического или физико-химического взаимодействия с окружающей средой. Но следует учитывать, что механизмы и кинетика процессов для неметаллов и металлов будут разными.
Коррозия металлов
Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Химическая коррозия
При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.) как, например, при ржавлении железа во влажной атмосфере:
Электроды образуют либо различные элементы структуры материала, либо два различных соприкасающихся материала. Если в воде растворены ионы солей, электропроводность ее повышается, и скорость процесса увеличивается. Особо сильно действуют хлорид-ионы (содержащиеся, например в морской воде или в воде, образовавшейся при таянии снега зимой, когда дороги посыпают солью), так как они катализируют процесс коррозии. С получающимися в процессе коррозии Fe3+ — ионами ионы хлора образуют растворимые комплексы, что способствует ускорению окисления металла.
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый, коррозионный элемент. Он представляет собой ни что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с отрицательным окислительно-восстановительным потенциалом. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например сварочные швы или заклепки
Водородная и кислородная коррозия
Если происходит восстановление ионов H30 + или молекул воды H2O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:
Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией:
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна.
Борьба с коррозией
Коррозия приводит ежегодно к миллиардным убыткам, и разрешение этой проблемы является важной задачей. Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией. Вот почему ежегодные потери от неё в промышленно развитых странах столь велики. Истинные убытки от неё нельзя определить, оценив только прямые потери, к которым относятся стоимость разрушившейся конструкции, стоимость замены обрудования, затраты на мероприятия по защите от коррозии. Ещё больший ущерб составляют косвенные потери. Это простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов.
Обычно выделяют три направления методов защиты от коррозии:
Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы.
В качестве защиты от коррозии может применяться нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента (пассивный метод).
Красочное покрытие, полимерное покрытие и эмалирование должны, прежде всего, предотвратить доступ кислорода и влаги. Часто также применяется покрытие, например, стали другими металлами, такими как цинк, олово, хром, никель. Цинковое покрытие защищает сталь даже когда покрытие частично разрушено. Цинк имеет более отрицательный потенциал и корродирует первым. Ионы Zn 2+ токсичны. При изготовлении консервных банок применяют жесть, покрытую слоем олова. В отличие от оцинкованной жести, при разрушении слоя олова корродировать начинает железо, так как олово имеет более положительный потенциал. Другая возможность защитить металл от коррозии — применение защитного электрода с большим отрицательным потенциалом, например, из цинка или магния. Для этого специально создается коррозионный элемент. Защищаемый металл выступает в роли катода, и этот вид защиты называют катодной защитой. Растворяемый электрод, называют, соответственно, анодом протекторной защиты Этот метод применяют для защиты от коррозии морских судов, мостов, котельных установок, расположенных под землей труб. Для защиты корпуса судна на наружную сторону корпуса крепят цинковые пластинки.
Если сравнить потенциалы цинка и магния с железом, они имеют более отрицательные потенциалы. Но тем не менее корродируют они медленнее вследствие образования на поверхности защитной оксидной пленки, которая защищает металл от дальнейшей коррозии. Образование такой пленки называют пассивацией металла. У алюминия ее усиливают анодным окислением (анодирование). При добавлении небольшого количества хрома в сталь на поверхности металла образуется оксидная пленка. Содержание хрома в нержавеющей стали — более 12 процентов.
Система холодного цинкования
Система холодного цинкования предназначена для усиления антикоррозионных свойств комплексного многослойного покрытия. Система обеспечивает полную катодную (или гальваническую) защиту железных поверхностей от коррозии в различных агрессивных средах
Преимущества системы холодной оцинковки по сравнению со способом горячей гальванизации:
1. Простота и меньшая трудоемкость технологии нанесения защитного цинкового покрытия. Для нанесения покрытия не требуется специальное оборудование.
2. Возможность антикоррозионной защиты металлоконструкций любых размеров, как в заводских так и в полевых условиях.
3. Возможность исправления непосредственно на месте абразивных повреждений покрытия и дефектов, возникающих при сварке металлоконструкций.
4. Экологически чистый процесс нанесения покрытия: нет необходимости производить работы в горячем цеху.
5. Создание на поверхности железа гибкого слоя цинка (не образующего микротрещин при изгибании металлоизделия).
Система холодного цинкования применяется во всех видах промышленности и в быту, где требуется надежная и долговечная защита железных поверхностей от коррозии.
Помимо использования в качестве грунтовочного слоя в комплексном многослойном покрытии система холодной оцинковки может применяться как самостоятельное антикоррозийное покрытие металлических поверхностей.
Газотермическое напыление
Для борьбы с коррозией используют также методы газотермического напыления.
С помощью газотермического напыления на поверхности металла создается слой из другого металла/сплава, обладающий более высокой стойкостью к коррозии (изолирующий) или наоборот менее стойкий (протекторный). Такой слой позволяет остановить коррозию защищаемого металла.
Термодиффузионное цинковое покрытие (ГОСТ 9.316-2006). Для эксплуатации металлоизделий в агрессивных средах, необходима более стойкая антикоррозионная защита поверхности металлоизделий. Термодиффузионное цинковое покрытие является анодным по отношению к черным металлам и электрохимически защищает сталь от коррозии. Оно обладает прочным сцеплением (адгезией) с основным металлом за счет взаимной диффузии железа и цинка в поверхностных интерметаллитных фазах, поэтому не происходит отслаивания и скалывания покрытий при ударах, механических нагрузках и деформациях обработанных изделий.
Ржавчина
Ржавчиной, как правило, называют продукт коррозии только железа и его сплавов, таких как сталь. Многие другие металлы тоже подвергаются коррозии, но именно оксиды железа обычно называют ржавчиной.
Содержание
Химические реакции
Причины ржавления
Если железо, содержащее какие-либо добавки и примеси (например, углерод), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций. Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе (слой пассивации) защищает основную массу железа от дальнейшего окисления. Превращение же пассивирующего слоя оксида железа в ржавчину является результатом комбинированного действия двух реагентов, как правило, кислорода и воды. Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы.
Происходящие реакции
Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду. Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановление кислорода:
Поскольку при этом образуются гидроксид-анионы, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
Следующая окислительно-восстановительная реакция происходит в присутствии воды и имеет решающее значение для формирования ржавчины:
4 Fe 2+ + O2 → 4 Fe 3+ + 2 O 2−
Кроме того, следующие многоступенчатые кислотно-щелочные реакции влияют на ход формирования ржавчины:
Fe 2+ + 2 H2O ⇌ Fe(OH)2 + 2 H + Fe 3+ + 3 H2O ⇌ Fe(OH)3 + 3 H +
что приводит к следующим реакциям поддержания баланса дегидратации:
Из приведённых выше уравнений видно, что формирование продуктов коррозии обусловлено наличием воды и кислорода. С ограничением растворённого кислорода на передний план выдвигаются железо (II)-содержащие материалы, в том числе FeO и чёрный магнит (Fe3O4). Высокая концентрация кислорода благоприятна для материалов с трёхвалентным железом, с номинальной формулой Fe(OH)3-xOx/2. Характер коррозии меняется со временем, отражая медленные скорости реакций твёрдых тел.
Более того, цвет ржавчины можно использовать для проверки наличия ионов Fe2+, которые меняют цвет ржавчины с жёлтого на синий.
Предотвращение ржавления
Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали образуется пассивирующий слой оксида хрома (III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Гальванизация
Хорошим подходом к предотвращению ржавчины является метод гальванизации, который обычно заключается в нанесении на защищаемый объект слоя цинка либо методом горячего цинкования, либо методом гальванотехники. Цинк традиционно используется, потому что он достаточно дёшев, обладает хорошей адгезией к стали и обеспечивает катодную защиту на стальную поверхность в случае повреждения цинкового слоя. В более агрессивных средах (таких, как солёная вода), предпочтительнее кадмий. Гальванизация часто не попадает на швы, отверстия и стыки, через которые наносилось покрытие. В этих случаях покрытие обеспечивает катодную защиту металла, где оно выступает в роли гальванического анода, на который прежде всего и воздействует коррозия. В более современные покрытия добавляют алюминий, новый материал называется цинк-алюм. Алюминий в покрытии мигрирует, покрывая царапины и, таким образом, обеспечивая более длительную защиту. Этот метод основан на применении оксидов алюминия и цинка, защищающих царапины на поверхности, в отличие от процесса оксидизации, как в случае применения гальванического анода. В некоторых случаях при очень агрессивных средах или длительных сроках эксплуатации применяются одновременно и гальванизация цинком, и другие защитные покрытия, чтобы обеспечить надёжную защиту от коррозии.
Катодная защита
Катодная защита является методом, используемым для предотвращения коррозии в скрытых под землёй или под водой структурах путём подачи электрического заряда, который подавляет электрохимические реакции. Если её правильно применять, коррозия может быть остановлена полностью. В своей простейшей форме это достигается путём соединения защищаемого объекта с протекторным анодом, в результате чего на поверхности железа или стали происходит только катодный процесс. Протекторный анод должен быть сделан из металла с более отрицательным электродным потенциалом, чем железо или сталь, обычно это цинк, алюминий или магний.
Лакокрасочные и другие защитные покрытия
От ржавчины можно предохранять с помощью лакокрасочных и других защитных покрытий, которые изолируют железо из окружающей среды. Большие поверхности, поделённые на секции, как например, корпуса судов и современных автомобилей, часто покрывают продуктами на основе воска. Такие средства обработки содержат также ингибиторы коррозии. Покрытие стальной арматуры бетоном (железобетон) обеспечивает некоторую защиту стали в среде с высоким pH. Однако коррозия стали в бетоне всё ещё является проблемой.
Покрытие слоем металла
Воронение
Снижение влажности
Ржавчины можно избежать, снижая влажность окружающего железо воздуха. Этого можно добиться, например, с помощью силикагеля.
Ингибиторы
Ингибиторы коррозии, как, например, газообразные или летучие ингибиторы, можно использовать для предотвращения коррозии в закрытых системах. Некоторые ингибиторы коррозии чрезвычайно ядовиты. Одним из лучших ингибиторов выступают соли технециевой кислоты.
Экономический эффект
Ржавчина вызывает деградацию изделий и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстрому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое поеданием ржавчиной. Это явление стало причиной разрушения моста через реку Мианус (штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главной причиной разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту. Погибли 46 водителей и пассажиров, находившихся в то время на мосту.
Мост Кинзу в штате Пенсильвания был снесён смерчем в 2003 году в значительной степени потому, что центральные опорные болты, соединяющие сооружение с землёй, проржавели, из-за чего мост держался лишь под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские трудности. Это один из наиболее распространённых отказов железобетонных мостов.
Ржавчина
Ржа́вчина является общим термином для определения оксидов железа. В разговорной речи этот термин применяется к красным окислам, образующимся в результате реакции железа с кислородом в присутствии воды или влажного воздуха. Есть и другие формы ржавчины, например, продукт, образующийся в результате реакции железа с хлором при отсутствии кислорода. Такое вещество образуется, в частности, в арматуре, используемой в подводных бетонных столбах, и называют его зелёной ржавчиной. Несколько видов коррозии различимы визуально или с помощью спектроскопии, они формируются при разных внешних условиях. [1] Ржавчина состоит из гидратированного оксида железа(III) Fe2O3·nH2O и метагидроксида железа (FeO(OH), Fe(OH)3). При наличии кислорода и воды и достаточном времени любая масса железа в конечном итоге преобразуется полностью в ржавчину и разрушается. Поверхность ржавчины не создаёт защиту для нижележащего железа, в отличие от образования патины на медной поверхности.
Ржавчиной как правило называют продукт коррозии только железа и его сплавов, таких как сталь. Многие другие металлы тоже подвергаются коррозии, но именно оксиды обычно не называют ржавчиной.
Содержание
Химические реакции
Причины ржавления
Если железо, содержащее какие-либо добавки и примеси (например, чугун), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций. Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе (слой пассивации) защищает основную массу железа от дальнейшего окисления. Превращение же пассивирующего слоя оксида железа в ржавчину является результатом комбинированного действия двух агентов, как правило, кислорода и воды. Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы. [2]
Происходящие реакции
Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду. [3] Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановления кислорода:
Поскольку при этом образуются ионы гидроксидов, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
Следующая окислительно-восстановительная реакция происходит в присутствии воды и имеет решающее значение для формирования ржавчины:
4 Fe 2+ + O2 → 4 Fe 3+ + 2 O 2−
Кроме того, следующие многоступенчатые кислотно-щелочные реакции влияют на ход формирования ржавчины:
Fe 2+ + 2 H2O ⇌ Fe(OH)2 + 2 H + Fe 3+ + 3 H2O ⇌ Fe(OH)3 + 3 H +
что приводит к следующим реакциям поддержания баланса дегидратации:
Из приведённых выше уравнений видно, что формирование продуктов коррозии обусловлено наличием воды и кислорода. С ограничением растворённого кислорода на передний план выдвигаются железо(II)-содержащие материалы, в том числе FeO и чёрный магнит (Fe3O4). Высокая концентрация кислорода благоприятна для материалов с трёхвалентным железом, с номинальной формулой Fe(OH)3-xOx/2. Характер коррозии меняется со временем, отражая медленные скорости реакций твёрдых тел.
Более того, цвет ржавчины можно использовать для проверки наличия ионов Fe2+, которые меняет цвет ржавчины с жёлтого на синий.
Предотвращение ржавления
Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали формируется пассивирующий слой оксида хрома(III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Гальванизация
Хорошим подходом к предотвращению ржавчины является метод гальванизации, который обычно заключается в нанесении на защищаемый объект слоя цинка либо методом горячего цинкования, либо методом гальванотехники. Цинк традиционно используется, потому что он достаточно дёшев, обладает хорошей адгезией к стали и обеспечивает катодную защиту на стальную поверхность в случае повреждения цинкового слоя. В более агрессивных средах (таких, как солёная вода), предпочтительнее является кадмий. Гальванизация часто не попадает на швы, отверстия и стыки, через которые наносилось покрытие. В этих случаях покрытие обеспечивает катодную защиту металла, где оно выступает в роли гальванического анода, на который прежде всего и воздействует коррозия. В более современные покрытия добавляют алюминий, новый материал называется цинк-алюм. Алюминий в покрытии мигрирует, покрывая царапины и, таким образом, обеспечивая более длительную защиту. Этот метод основан на применении оксидов алюминия и цинка, защищающих царапины на поверхности, в отличие от процесса оксидизации, как в случае применения гальванического анода. В некоторых случаях при очень агрессивных средах или длительных сроках эксплуатации применяются одновременно и гальванизация цинком, и другие защитные покрытия, чтобы обеспечить надёжную защиту от коррозии.
Катодная защита
Катодная защита является методом, используемым для предотвращения коррозии в скрытых под землёй или под водой структурах путём подачи электрического заряда, который подавляет электрохимические реакции. Если её правильно применять, коррозия может быть остановлена полностью. В своей простейшей форме это достигается путём соединения защищаемого объекта с протекторным анодом, в результате чего на поверхности железа или стали происходит только катодный процесс. Протекторный анод должен быть сделан из металла с более отрицательным электродным потенциалом, чем железо или сталь, обычно это цинк, алюминий или магний.
Лакокрасочные и другие защитные покрытия
От ржавчины можно предохранять с помощью лакокрасочных и других защитных покрытий, которые изолируют железо из окружающей среды. История красок для нанесения на ржавчину насчитывает 50 лет, когда в Англии была изобретена краска Hammerite. Большие поверхности, поделённые на секции, как например, корпуса судов и современных автомобилей, часто покрывают продуктами на основе воска. Такие средства обработки содержат также ингибиторы от коррозии. Покрытие стальной арматуры бетоном (железобетон) обеспечивает некоторую защиту стали в среде с высоким рН. Однако коррозия стали в бетоне всё ещё является проблемой.
Покрытие слоем металла
Воронение
Снижение влажности
Ржавчины можно избежать, снижая влажность окружающей железо атмосферы. Этого можно добиться, например, с помощью силикагеля.
Ингибиторы
Ингибиторы коррозии, как, например, газообразные или летучие ингибиторы, можно использовать для предотвращения коррозии в закрытых системах.
Экономический эффект
Ржавчина вызывает деградацию инструментов и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое «поеданием ржавчиной». Это явление стало причиной разрушения моста через реку Мианус (штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главным фактором разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту. Погибли 46 водителей и пассажиров, находившихся в то время на мосту.
Мост Кинзу в штате Пенсильвания была снесён торнадо в 2003 году в значительной степени потому, что центральные базовые болты, соединяющие конструкцию с землёй, проржавели, предоставив мосту возможность держаться просто под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские проблемы. Это один из наиболее распространённых отказов железобетонных мостов.