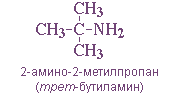к какому ряду относятся амины состава
К какому ряду относятся амины состава
— продукты замещения одного, двух или трех атомов водорода в молекуле аммиака NH3 на углеводородные радикалы.
Классификация
I. По числу углеводородных радикалов в молекуле амина:
— первичные амины R-NH2
— вторичные амины R-NH-R’
II. По строению углеводородного радикала:


Предельные первичные амины
Номенклатура
Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы NH2. Аминогруппа при этом рассматривается как заместитель, а ее местоположение указывается цифрой в начале названия. Например:
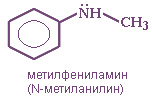
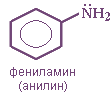
Анилин (фениламин) C6H5NH2 в соответствии с этим способом называется
Гомологический ряд предельных аминов
Изомерия
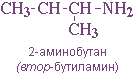
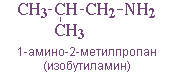
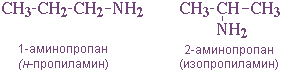
— положения аминогруппы, начиная с С3H7NH2:
— изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте:
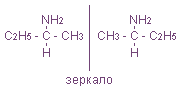
Возможна оптическая изомерия, начиная с С4H9NH2:
Оптические (зеркальные) изомеры
— пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение (как левая и правая руки).
Физические свойства
Низшие амины хорошо растворимы в воде, с ростом углеводородного радикала растворимость аминов падает. Амины образуются при гниении органических остатков, содержащих белки. Ряд аминов образуется в организмах человека и животных из аминокислот
Химические свойства
Амины, как и аммиак, проявляют ярко выраженные свойства оснований, что обусловлено наличием в молекулах аминов атома азота, имеющего неподеленную пару электронов.
1. Взаимодействие с водой
Растворы аминов в воде имеют щелочную реакцию среды.
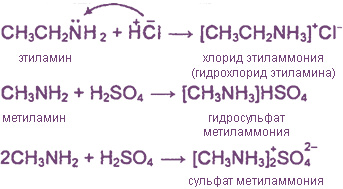
2. Взаимодействие с кислотами (образование солей)
Амины выделяются из их солей при действии щелочей:
4. Реакция с азотистой кислотой
(отличие первичных аминов от вторичных и третичных)
Под действием HNO2 первичные амины превращаются в спирты с выделением азота:
Способы получения
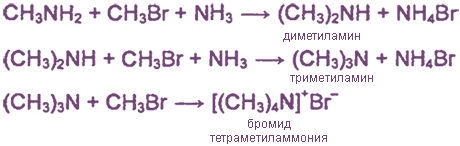
1. Взаимодействие галогеналканов с аммиаком
Обычно реакция идет дальше и образуется смесь первичных, вторичных, третичных аминов и соль четвертичного аммониевого основания:
2. Взаимодействие спиртов с аммиаком
(Практически в этих реакциях образуется смесь первичных, вторичных, третичных аминов и соли четвертичного аммониевого основания.)
Амины. Свойства аминов.
Амины – это органические соединения, в которых атом водорода (может и не один) замещен на углеводородный радикал. Все амины делят на:
В зависимости от типа радикала амины могут быть:
Алифатические предельные амины.
Строение аминов.
Элекронодонорные заместители повышают электронную плотность на атоме азота и усиливают основные свойства аминов, по этой причин вторичные амины являются более сильными основаниями, чем первичные, т.к. 2 радикала у атома азота создают большую электронную плотность, чем 1.
В третичных атомах играет важную роль пространственный фактор: т.к. 3 радикала заслоняют неподеленную пару азота, к которой сложно «подступиться» другим реагентам, основность таких аминов меньше, чем первичных или вторичных.
Изомерия аминов.
Для аминов свойственна изомерия углеродного скелета, изомерия положения аминогруппы:
Как называть амины?
В названии обычно перечисляют углеводородные радикалы (в алфавитном порядке) и добавляют окончание –амин:
Физические свойства аминов.
Первые 3 амина – газы, средние члены алифатического ряда – жидкости, а высшие – твердые вещества. Температура кипения у аминов выше, чем у соответствующих углеводородов, т.к. в жидкой фазе в молекуле образуются водородные связи.
Амины хорошо растворимы в воде, по мере роста углеводородного радикала растворимость падает.
Получение аминов.
1. Алкилирование аммиака (основной способ), который происходит при нагревании алкилгалогенида с аммиаком:
Если алкилгалогенид в избытке, то первичный амин может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин:
2. Восстановление нитросоединений:
Используют сульфид аммония (реакция Зинина), цинк или железо в кислой среде, алюминий в щелочной среде или водород в газовой фазе.
3. Восстановление нитрилов. Используют LiAlH4:
4. Ферментатичное декарбоксилирование аминокислот:
Химические свойства аминов.
Все амины – сильные основания, причем алифатические более сильные, чем аммиак.
Водные растворы имеют щелочной характер:
Амины реагируют с кислотами, образуя соли:
Соли – твердые вещества, хорошо растворимы в воде и плохо растворимы в неполярных жидкостях. При реакции с щелочами выделяются свободные амины:
2. Образование комплексных соединений с переходными металлами:
3. Реакция с азотистой кислотой, которая образуется по следующей схеме:
4. Сгорание аминов. В результате образуется углекислый газ, азот и вода:
Применение аминов.
Низшие алифатические амины используют для синтеза лекарственных средств, пластмасс и пестицидов.
К какому ряду относятся амины состава
Амины – азотсодержащие органические вещества, производные аммиака (NH3), в молекулах которых один или несколько атомов водорода замещены на углеводородный радикал (- R или – CnH2n+1)
Рис. 1 Шаростержневая модель молекулы аммиака
I. Классификация аминов
Первичный амин – это амин, в котором атом азота образует одну связь с углеводородным радикалом и две с атомами водорода.
Вторичный амин – это амин, в котором атом азота образует две связи с углеводородными радикалами и одну с атомом водорода.
Третичный амин – это амин, в котором атом азота образует три связи с углеводородными радикалами.
 |  |  |
пирролидин пиперидин пиперазин
Рис. 2. Циклические амины
Рис. фениламин (анилин)
Подобно многоатомным спиртам, существуют и амины, имеющие несколько аминогрупп:
II. Нахождение аминов в природе
Амины широко распространены в природе, так как образуются при гниении живых организмов. Например, с триметиламином вы встречались неоднократно. Запах селедочного рассола обусловлен именно этим веществом. Обиходное словосочетание “трупный яд”, встречающиеся в художественной литературе, связано с аминами.
III. Номенклатура аминов
1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.
Различные радикалы перечисляются в алфавитном порядке.
IV. Изомерия аминов
1. Структурная изомерия
2. Пространственная изомерия
Возможна оптическая изомерия, начиная с С4H9NH2:
V. Получение аминов
Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин.
1. Восстановление нитросоединений
2. Другие способы
1). Промышленный
2). Лабораторный: Действие щелочей на соли алкиламмония
(получение первичных, вторичных, третичных аминов):
3). Действием галогеналканов на первичные алифатические и ароматические амины
Gолучают вторичные и третичные амины, в том числе, смешанные.
VI. Физические свойства аминов
Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).
Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, а н-гексиламин – при 133 °С).
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.

Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
VII. Свойства аминов
1. Основные свойства
Для аминов характерны основные свойства, которые обусловлены наличием не поделённой электронной пары на атоме азота
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
Анилин с водой не реагирует и не изменяет окраску индикатора.
Видео-опыт: “Изучение среды раствора анилина”
1. Взаимодействие с кислотами (донорно-акцепторный механизм):
Соли неустойчивы, разлагаются щелочами:
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
2. Реакции окисления
Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны.
3. Особые свойства анилина
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
1). Свойства бензольного кольца
Действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях:
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:
Видео-опыт: “Бромирование анилина”
2). Свойства аминогруппы
VIII. Применение
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Амины
Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.