к каким водам мягким или жестким относится колодезная и ключевая вода
К каким водам мягким или жестким относится колодезная и ключевая вода
Жёсткость воды – совокупность ее химических и физических свойств, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния.
По величине общей жёсткости различают:
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л).
По величине общей жёсткости различают воду:
У одного и того же водоисточника жесткость воды может меняться в течение года. Например, весной, в период паводка, жесткость воды, особенно в поверхностных источниках, уменьшается. А жарким летом в связи с повышенным испарением воды с поверхности водоема, а так же из-за редких дождей жесткость воды, наоборот, увеличивается.
В подземных источниках жесткость воды практически не меняется в течение года, и, как правило, очень высокая (до 80-100 мг-экв/л).
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при пользовании мылом. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т.п. В то же время, использование слишком мягкой воды может приводить к коррозии труб. В этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная жёсткость.
В различных информационных источниках можно встретить информацию, что жесткая вода способствует образованию камней в мочеполовой системе, а мягкая увеличивает риск сердечно-сосудистых заболеваний. Многие люди отмечают, что умываясь водой с повышенном содержанием солей, кожа лица становится суше. Однако, достоверных клинических исследований о вреде такой воды на организм человека не существует. Поэтому, вероятнее всего, потребление и использование в быту жёсткой или мягкой воды не является опасным для здоровья.
А вот бытовой технике или водопроводной системе жесткая или мягкая вода может нанести существенный вред.
Нередки случаи, кода чайник или стиральная машина выходят из строя в связи с использованием жесткой воды. Жёсткая вода вызывает появление осадка (накипи) на нагревательных элементах бытовых приборов, стенках котлов, в трубах. Особенно часто это наблюдается при использовании для бытовых и хозяйственных нужд подземных водоисточников.
В то же время, использование слишком мягкой воды может привести к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная жёсткость.
Вкусовые качества воды тоже значительно отличаются друг от друга именно из-за отсутствия или наличия в ней тех или иных солей.
Вот почему родниковая или минеральная вода нам часто очень нравится – она более насыщена солями.
Способы устранения жесткости воды:
Термоумягчение.
Самый доступный и наиболее часто используемый в быту способ. Основан на кипячении воды. В результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи.
Реагентное умягчение.
Метод основан на добавлении в воду различных реагентов, например, кальцинированной соды, гашёной извести или ортофосфата натрия. Последний, часто входит в состав бытовых средств, которые мы используем для предотвращения образования накипи в стиральных, посудомоечных машинах или других бытовых приборах.
Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдаёт ионы натрия или водорода.
Этот метод используется в промышленности.
Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод является дорогостоящим.
Обратноосмотические фильтры часто применяются нами в быту.
Такая вода становится практически дистиллированной.
Электродиализ
Основан на удалении из воды солей под действием электрического поля.
Дистилляция – полностью очищает воду от солей.
Часто, для смягчения воды в быту применяются механические фильтры.
Что такое жесткость воды и как ее определить
Жесткость в питьевой воде
Под термином жесткость воды понимается количество растворенных и нерастворенных солей, присутствующих в природных водных залежах. Водица может быть слишком мягкой или слишком жесткой. Вредны оба варианта. Недостаток солей нарушает водно-щелочной баланс в организме, избыток вызывает множественные заболевания важных органов: сердца, почек, кожи, печени. При переизбытке солей жидкость имеет горьковато-металлический вкус, может быть мутной, с разными цветовыми оттенками.
Какие соли обуславливают жесткость природной воды, откуда они берутся
После естественного испарения или после принудительного выпаривания водного раствора соли становятся видимыми, остаются в сосуде. Именно они образуют отложения на дне и стенках посуды, чайников, санприборов. По жесткости воды легко определить, какая соль в ней явственнее присутствует. Примеси магния труднее растворяются, придают напиткам вкус горечи.
От чего зависит присутствие соли жесткости в воде
Степень жёсткости для питьевой воды определяется типом и количеством водных солей. В разной местности показатели различные. Соли проникают в водоносные пласты, вымываясь из залежей горных пород: известняков, гипсов, доломитов.
Показатели жёсткости воды являются величинами переменными, они зависят от разных факторов:
У вод, лежащих близко к поверхности и залегающих на глубине, параметры разные. Они выше там, где водный поток проходит через слои известняков. Весной, при обилии талых потоков, при их попадании в водоемы и при просачивании в подземные водные пласты, количество солей снижается. Зимой концентрация выше.
Классификация воды с солями жесткости
Какие соли жесткости присутствуют в воде? Различают общую, постоянную и временную жёсткость:
При очистке принимаются во внимание все типы: Жо, Жк, Жнк. Предельно допустимая концентрация питьевой воды по жесткости (кратко: ПДК) обычно устанавливается для общей Жо.
Нормы жесткости для воды
Нормирование определяется документами стандартизации: ГОСТ, СанПиН, ТУ. Точные данные получают, проводя испытания проб в аккредитованных лабораториях, в санэпидстанциях. Для фиксирования лабораторных показаний приняты международные единицы измерения жесткости воды:
Измеряемая единица жесткости воды 1°Ж равна 1 мг-экв/л и равна 1/2 миллимоля на литр. Допустимые значения для ионов кальция и магния разные: для Ca2+1°Ж=20,04, для Mg2+1°Ж=12,16 мг/л (примечание: эти показатели вставляются в расчетную формулу, см. далее по тексту*).
По структуре вода может быть мягкой, средней, жесткой. Мягкой считается дистиллированная, кипяченая, дождевая, талая водичка. Жидкость средней жёсткости поступает из централизованных водопроводов. Артезианская и родниковая водица тоже отличаются средними показателями. К сильножесткой относится вододобыча из соленых водоемов, нуждающаяся в опреснении. В таблице показаны концентрации солей в разных размерных единицах.
Предельно допустимое содержание солей жесткости в воде
| Степень жесткости воды | Показатель в мг-экв/л | Показатель в °Ж | Показатель в ppm |
| Слишком мягкая | до 1,5 | до 1-1,5 | 0-70 |
| Мягкая | 1,5-4 | 1,6-4 | 71-140 |
| Среднежёсткая | 5-8 | 5-12 | 141-210 |
| Сильножёсткая | 9-12 | 13-22 | 211-320 |
| Сверхжёсткая | свыше 12 | 23-34 | 321-530 |
Нормы жесткости для питьевой воды
В СанПиН указаны вариативные величины, в зависимости от применения водных растворов. Жесткость воды по ГОСТУ также регламентируется в зависимости от типа и назначения жидкостей:
Если в воде солей жесткости больше, чем предписано стандартами, нужно её очистить до допустимых показателей. В табличке указаны степени солевой концентрации по шкале жёсткости с показателями в промилле.
Шкала жесткости
| Концентрация солей | Величина в ppm (в промилле или мг/л) |
| Представляющая опасность для жизни | свыше 500 |
| Предельно допустимая | 500 |
| Средний показатель вод, добываемых из природныхводоемов | 400 |
| Допустимое значение воды, подающейся из водопровода | 300 |
| После прохождения угольных фильтров | 170 |
| После очистки системой обратного осмоса | 0-50 |
Нормы жесткости для технической воды
ГОСТ по определению жесткости в воде подскажет, какие параметры допустимы:
Раздельно нормируется питьевая вода по жесткости разных категорий: дистиллированная, сетевая, разливная. Для солей железа показатели рассчитываются отдельно.
Как определить жесткость воды
Определить жесткость воды в можно как в лаборатории, так и в домашних условиях. Наличие солей жесткости можно определить визуально:
Повышенная жесткость питьевой воды может причинить ущерб здоровью и нагревательным приборам. Не зная точных показателей концентрации солей, сложно рассчитать дозу средств от накипи для стирально-сушильных агрегатов или запрограммировать на чистку кофемашину. Трудно обеспечить комфортное обитание рыбкам в аквариуме или правильно выбрать фильтры очистки. Помимо визуальной оценки лучше использовать более точные измерительные методы определения жесткости питьевой и технической воды.
Измерение жесткости воды
Перед употреблением в пищу, перед поливом огорода, перед подачей в трубопроводы или перед техническим применением воды для производственных процессов полезно проверить наличие солей жесткости. Такая проверка снимет претензии потребителей к водоснабжающим компаниям, продлит срок службы дорогого промышленного оборудования.
Для измерения жесткости воды используют бытовые и профессиональные приборы:
Полезно заказать исследование в лаборатории, чтобы получить точные результаты с подтверждающей документацией. Тогда не придется думать, чем определить жесткость воды, не нужно покупать измерительные приборы или рассчитывать показатели по косвенным параметрам, используя формулы.
Как определить жесткость воды по формуле
Определить жесткость воды можно по формуле. Для определения общих показателей нужно выполнить расчет:
Жо = [Ca 2+ ] + [Mg 2+ ] = (m(Ca 2+ ))/(Э(Ca 2+ ) x V(H2O)) + (m(Mg 2+ ))/(Э(Mg 2+ ) x V(H2O)),
Далее вычисляют временную или постоянную жёсткость. Рассчитанную величину вычитают из Жо и получают значения всех трёх категорий Ж.
Карбонатная Жк вычисляется по формуле:
Как понизить жесткость в питьевой воде
Понизить жесткость питьевой воды можно бытовыми способами и с помощью профессионального оборудования. Для умягчения водных составов в быту применяют простые и доступные методы: кипячение, отстаивание, заморозка с оттаиванием. Используют дистилляты и бытовые фильтры.
Для загородных домов и промышленного умягчения используют профессиональные установки солеочистки:
На сайте компании Diasel можно купить любые фильтры для удаления из воды солей жесткости. Мы продаем комплектующие к установкам обратного осмоса, соберем для вас комплексные линии очистки, предоставим реагенты для снижения уровня безопасности основного жизненного напитка. Гарантируем консультации по любым вопросам, помощь по монтажным работам, текущему и сервисному обслуживанию. С нашими профессиональными установками жесткость воды всегда будет в норме.
Жесткость воды — единицы измерения и способы умягчения
Жесткость воды – это количество растворимых и нерастворимых солей, в основном кальция и магния, присутствующих в природной воде. Чем их больше, тем выше жесткость. Из-за переизбытка солей образуются шлаки в системе водоснабжения, быстро выходят из строя приборы, сантехника, гидрооборудование.
Для точного определения жесткости воды, (количество растворенных солей жесткости, концентрации железа, серы, магния, кальция и тд.) делаются лабораторные исследования (например в СЭС) методом химического анализа или с применением специальных приборов. В домашних условиях жесткость воды определяется с помощью тест-полосок или тестеров.
Обычная вода состоит не только из атомов водорода и кислорода, в ней так же присутствует большое количество различных примесей. Именно наличие примесей определяет жесткость воды, а единицы измерения (°Ж — градус жёсткости) показывает, насколько этот показатель превышает допустимые нормы.

О том, как определить уровень жесткости водопроводной воды, а также о методах борьбы с большим содержанием примесей будет подробно рассказано в данной статье.
Жёсткая и мягкая вода — в чём разница
На количество соли в воде влияет наличия растворённых в ней элементов кальция и магния. Значительно повысить этот показатель может также наличие гидрата железа, содержание которого в артезианских водах бывает избыточным.
В том случае, когда таких примесей содержится незначительное количество, её называют «мягкой». Этот показатель обычно разделяется на 3 категории:

В большинстве случаев она может получиться и в результате длительного кипячения или добавления специальных химических реагентов.
Средняя — встречается наиболее часто в водопроводных системах, а также в родниковой и артезианской воде.
Жёсткая — к данной категории относится морская, океанская, а также вода вытекающая из пластов породы богатой минеральными отложениями. В ней может быть растворено большое количество солей. Если брать в процентном соотношении, то соленость может достигать до 33% от общего объема.
Рассмотрим разновидности жёсткости
Этот показатель принято разделять на следующие категории.
Для того чтобы точно определить этот показатель, необходимо знать какими единицами измерения это можно сделать.
Единицы измерения жёсткости
Для правильного подсчёта уровня жёсткости необходимо определить концентрацию катионов кальция и магния. В настоящее время этот показатель определяется в следующих единицах измерения:
Следует отметить, что в нашей стране выражение общей жёсткости моль/м3 стало использоваться только с 1952 года. До этого времени расчёты осуществлялись в градусах, которые были равны современному немецкому градусу.
С 2014 года в России действует международный стандарт подсчёта жёсткости, который выражается в градусах (°Ж). Один градус равен 1/2 миллимоля на литр жидкости, поэтому подсчитать уровень концентрации вещества в жидкости не составит большого труда.
Причины появления жёсткости воды

При необходимости снизить концентрацию ионов калия и магния, можно применить различные методы уменьшения количества солевых примесей.
Методы устранения жёсткости
Для борьбы с чрезмерным содержанием солей применяются следующие методы:
Любой из предложенных способов умягчения воды позволяет справиться с высоким уровнем этого показателя, но для очистки от солей питьевой воды химический способ обычно не применяется.
Как влияет жёсткость на качество воды
Жёсткость питьевой воды влияет, прежде всего, на её вкусовые качества. Порог вкуса ионов кальция находящихся в питьевой воде составляет 2-6 мг-экв/л. Порог вкуса для ионов магния значительно ниже, поэтому самой приятной на вкус питьевой водой считается та, в которой этот показатель равен от 1,6 до 3 мг-экв/л.
В некоторых случаях вода с жёсткостью до 10 мг-экв/л может использоваться в качестве питьевой, но длительное её употребление может негативно влиять на здоровье человека. Слишком жёсткая вода нежелательна для применения в устройствах нагрева жидкости. Электрические чайники, бойлеры, стиральные и посудомоечные машины обязательно имеют в своей конструкции ТЭН, который в кратчайшие сроки «обрастает» отложениями, и процесс нагрева жидкости осуществляется менее эффективно.
Длительная эксплуатация электро нагревателя со значительным слоем накипи приводит к перегреву элемента и выходу его из строя. К счастью, для очистки от накипи достаточно растворить 2 пакетика лимонной кислоты в 1 литре воды и хорошо прокипятить чайник или любой другой водонагреватель. После чего следует тщательно промыть прибор и использовать его далее по назначению.
Конспект урока по химии «Жёсткость воды»
Описание разработки
Цели урока:
Образовательная: изучить природу жёсткости воды и способы её устранения.
развивающая: специальные умения проводить эксперимент, записывать уравнения, лежащих в основе устранения жёсткости воды, ключевые компетенции коммуникативную и разрешения проблем
Воспитательная: расширить кругозор учащихся.
Оборудование и реактивы: раствор мыла, СаCl2, MgSO4, Ca(HCO3)2, Na2CO3, спиртовка, пробирки, стиральный порошок, уксусная кислота, калгон, образцы тканей.
Ход урока.
I. Актуализация знаний.
Контроль по ранее изученной теме “Магний и кальций, их соединения”.
1. Какие соединения кальция и магния и в каком виде встречаются в природе?
2. Какие соединения кальция используются в технике и в быту?
II. Изложение нового материала.
Кальций и магний не только входят в состав различных соединений. Ионы кальция и магния также содержатся в обыкновенной воде. Повышенное содержание Са 2+ и Mg 2+ придаёт воде отрицательное качество, называемое жёсткостью.
Постановка цели: изучить природу жёсткости воды и способы её устранения.
Причины, вызывающие жёсткость воды. Отрицательное значение жёсткой воды.
Содержащиеся в природе нерастворимые в воде карбонаты магния и кальция под воздействием воды и присутствующего в воздухе углекислого газа способны превращаться в гидрокарбонаты, которые хорошо растворяются в воде(Ж-карбонатная или временная)
Этот процесс широко осуществляется в природных условиях, приводя к выносу размываемых известняков поверхностные воды, а затем – в моря и океаны.
В природные воды переходят и содержащиеся в земной коре растворимые соли СаCl2, CaSO4, MgCl2, MgSO4. (Ж-некарбонатная или постоянная)
В жесткой воде плохо развариваются продукты питания, так как катионы кальция с белками пищи образуют нерастворимые соединения. Постоянное употребление жесткой воды может привести к отложению солей (мочекаменная болезнь) в организме человека. В такой воде плохо завариваются чай, кофе. В ней труднее развариваются многие продукты, их питательная ценность уменьшается. Жёсткая вода непригодна для многих технических целей. Из-за образования накипи непригодна для использования в паровых котлах, вредна для металлических конструкций, трубопроводов. В жесткой воде плохо мылится мыло и возрастает его расход. Жёсткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при крашении.
Приведённые примеры указывают на необходимость удаления из воды солей кальция и магния.
Способы устранения Ж (учащиеся выполняют КОЗ, используя информацию параграфа 37, заполняют таблицу-письменная коммуникация)
Тема: «Жесткость воды и способы ее устранения»
Аспект: письменная коммуникация
Стимул: Если вы успешно справитесь с заданием, то узнаете о видах жёсткости и способах её устранения.
Группы предоставляют отчет в любой форме
Способы устранения жёсткости воды.
Временную (карбонатную) жёсткость устраняют:
При длительном кипячении растворимые Са(НСО3)2 и Mg(НСО3)2 переходят в нерастворимые соединения и выпадают в осадок. Поэтому карбонатную жёсткость называют также временной жёсткостью. Количественно временную жёсткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при её кипячении в течение часа. Жёсткость, остающаяся после такого кипячения, называется постоянной.
2. Добавлением гашёной извести.
Постоянную (некарбонатную) жёсткость устраняют добавлением соды Na2CO3.
В целях одновременного устранения обоих видов жёсткости применяют смесь гашёной извести и соды – содово-известковый метод.
III. Подведение итогов урока.
Учащиеся отвечают на вопросы учителя.
1. К каким водам – мягким или жестким относится колодезная и ключевая вода? (Средней жесткости)
2. Почему колодезная вода, как правило, вкусная, а дождевая нет? (Вкус колодезной воды придают содержащие в ней различные вещества)
3. Почему до изобретения антифриза в системы охлаждения двигателей заливали дистиллированную воду, а не воду из-под крана? (В воде из-под крана содержатся гидрокарбонаты кальция и магния, то при повышении температуры будут превращаться в нерастворимые карбонаты и оседать на стенках системы, тем самым, ухудшая теплоотдачу двигателя)
4. Иногда для приготовления продуктов используют горячую воду из крана. Возможно ли это (Нет, ее смягчают содой для уменьшения отложения на стенках труб нерастворимых карбонатов
5. Для устранения жёсткости воды иногда применяют ортофосфат натрия. На чём основано применение этой соли? Ответ подтвердите, составив соответствующие уравнения реакций.
IV. Задание на дом
Содержимое разработки
Урок по теме «Жесткость воды и способы ее устранения»
Цели урока:
Образовательная: изучить природу жёсткости воды и способы её устранения.
развивающая: специальные умения проводить эксперимент, записывать уравнения, лежащих в основе устранения жёсткости воды, ключевые компетенции коммуникативную и разрешения проблем
Воспитательная: расширить кругозор учащихся.
Оборудование и реактивы: раствор мыла, СаCl2, MgSO4, Ca(HCO3)2, Na2CO3, спиртовка, пробирки, стиральный порошок, уксусная кислота, калгон, образцы тканей.
I. Актуализация знаний.
Контроль по ранее изученной теме “Магний и кальций, их соединения”.
1. Какие соединения кальция и магния и в каком виде встречаются в природе?
2. Какие соединения кальция используются в технике и в быту?
II. Изложение нового материала.
Кальций и магний не только входят в состав различных соединений. Ионы кальция и магния также содержатся в обыкновенной воде. Повышенное содержание Са 2+ и Mg 2+ придаёт воде отрицательное качество, называемое жёсткостью.
Постановка цели: изучить природу жёсткости воды и способы её устранения.
Причины, вызывающие жёсткость воды. Отрицательное значение жёсткой воды.
Содержащиеся в природе нерастворимые в воде карбонаты магния и кальция под воздействием воды и присутствующего в воздухе углекислого газа способны превращаться в гидрокарбонаты, которые хорошо растворяются в воде(Ж-карбонатная или временная)
СаСО3 + СО2 + Н2О 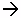
MgСО3 + СО2 + Н2О 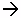
Этот процесс широко осуществляется в природных условиях, приводя к выносу размываемых известняков поверхностные воды, а затем – в моря и океаны.
В природные воды переходят и содержащиеся в земной коре растворимые соли СаCl2, CaSO4, MgCl2, MgSO4. (Ж-некарбонатная или постоянная)
В жесткой воде плохо развариваются продукты питания, так как катионы кальция с белками пищи образуют нерастворимые соединения. Постоянное употребление жесткой воды может привести к отложению солей (мочекаменная болезнь) в организме человека. В такой воде плохо завариваются чай, кофе. В ней труднее развариваются многие продукты, их питательная ценность уменьшается. Жёсткая вода непригодна для многих технических целей. Из-за образования накипи непригодна для использования в паровых котлах, вредна для металлических конструкций, трубопроводов. В жесткой воде плохо мылится мыло и возрастает его расход. Жёсткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при крашении.
Приведённые примеры указывают на необходимость удаления из воды солей кальция и магния.
Способы устранения Ж (учащиеся выполняют КОЗ, используя информацию параграфа 37, заполняют таблицу-письменная коммуникация)
Тема Жесткость воды и способы ее устранения
Аспект: письменная коммуникация
Стимул: Если вы успешно справитесь с заданием, то узнаете о видах жёсткости
и способах её устранения.
1 Задание: Заполнить таблицу (используй текст параграфа 37 )
Жесткость воды и способы ее устранения




