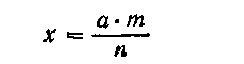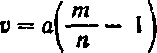что значит 1 20 как развести
Как развести бензин для бензопилы
Почему нужно смешивать масло и бензин
Для нормальной работы любому двигателю внутреннего сгорания нужны, как минимум, две вещи:
В первую очередь, масло нужно для того, чтобы исключить так называемое «сухое» трение металла о металл. Из-за него контактирующие детали подвергаются критическому износу — появляются задиры, царапины, уменьшается компрессия, снижается ресурс. Также масло нужно для уплотнения зазоров.
Почему же нужно смешивать масло с топливом для бензопилы?
Это требование напрямую связано с особенностями устройства и принципом работы двухтактных двигателей, которыми оснащается данный инструмент.
Смазка деталей кривошипно-шатунного механизма и цилиндропоршневой группы здесь выполняется исключительно за счёт масла, находящегося в горючем. Благодаря особому устройству двигателя, топливовоздушная смесь попадает не только в камеру сгорания, но и в картер, где находится коленвал с шатуном. Таким образом, смазываются все трущиеся детали.
Соотношение количества масла и бензина для топливной смеси
Чтобы двухтактный двигатель бензопилы работал в оптимальном для него режиме, масло с бензином необходимо смешивать в определённых пропорциях. Они обычно указываются в инструкции к инструменту, а также на упаковках со смазкой. Рассмотрим вкратце, что будет, если рекомендуемых соотношений не соблюдать, или нарушать их по ошибке (незнанию).
Если масла добавить в бензин слишком мало, его концентрации не хватит для эффективной смазки трущихся деталей. Двигатель будет издавать звенящие звуки, чрезмерно греться, и быстро выйдет из строя. Много масла — тоже плохо, так как излишки не смогут полноценно сгорать. Это приведёт к образованию нагара на стенках цилиндра и поршне, загрязнению свечи зажигания, выхлопной системы. Также упадёт мощность, повысится расход топлива, и во время работы будет наблюдаться чрезмерная дымность выхлопа.
Чтобы этих проблем избежать, масло с бензином надо смешивать в рекомендуемых производителем пропорциях. Указываются они в виде соотношений — 1:50, 1:40, 1:25 и так далее. Любая из этих пропорций говорит о том, сколько масла нужно лить на объём топлива. Например, для приготовления смеси по пропорции 1:25 понадобится 1 литр масла на 25 литров бензина.
Важно не перепутать! Довольно часто указанные пропорции воспринимаются пользователями наоборот. К примеру, 1:50 понимается, как на 1 литр бензина 50 миллилитров масла. Это грубая ошибка, которая приведёт к повышенной концентрации масла в горючем. На самом деле при таком соотношении на 1 литр масла нужно всего 20 миллилитров масла.
Как не запутаться в пропорциях? Ведь мало кому надо готовить 50, или даже 25 литров топливной смеси для бензопилы. Тем более, что хранить смешанный с маслом бензин долго нельзя. Обычно готовят столько, сколько потребуется на день-два. А с учётом небольшого расхода бензопилы это 1-5 литров.
Есть три способа, как правильно развести бензин для бензопилы в небольших объёмах:
Теперь кратко о том, почему у разных производителей отличаются пропорции и нет какого-то единого стандарта. На это есть, как минимум, три причины. Во-первых, разные характеристики масел и бензина. Во-вторых, качество сборки двигателей (технологии, материалы) тоже отличается. В-третьих, режим эксплуатации инструмента. К примеру, для обкатки бензопил некоторых производителей рекомендуется добавлять в смесь на 20% больше масла.
Пошаговая инструкция по заправке
Для приготовления топливной смеси и заправки бензопилы понадобится:
Для измерения объёмов можно использовать ёмкость, которыми обычно комплектуются бензиновые инструменты. Также можно купить специальные фирменные канистры с отделами и мерными приспособлениями.
Вопреки гуляющему по Сети мнению, нет разницы, что первое заливать в ёмкость для приготовления смеси — бензин или масло. Главное, не забудьте тщательно перемешать. Вот чего на самом деле не стоит делать, так это готовить топливную смесь непосредственно в топливном баке бензопилы.
Калькулятор спирта для разведения
Чтобы можно было приготовить наливки или настойки из собранного урожая, со своего сада или из купленных ягод и фруктов, применяя свой рецепт, нужно знать технологию и пропорции разбавления спирта, чтобы получить напиток приятного вкуса и определенной крепости. Раньше было принято разводить спирт, что называется «на глазок». Можно высчитывать соотношения спирта и воды с помощью специальных формул, но эти технологии постепенно отходят на второй план. В наше время, особенно с приходом интернета, появились возможности не искать руководство для приготовления напитков, а просто воспользоваться готовыми таблицами или выбрать калькулятор разбавления спирта водой, где соблюдены необходимые пропорции и который можно найти в варианте онлайн использования, на многочисленных сайтах в сети.
Простота использования калькулятора, позволяет любому, кто заинтересован в приготовлении домашних напитков, настоек или наливок, используя свой рецепт, вычислить количество добавляемой воды в спирт, для получения напитков с определенной крепостью.
Все, что необходимо сделать для того, чтобы узнать цифру, необходимую для вашего случая, это ввести в калькулятор известные значения.
Калькулятор спирта
Вводимые цифры для расчета крепости получаемого напитка
Для вычисления получаемой итоговой крепости, этих трех составляющих достаточно, для работы на онлайн калькуляторе и получения необходимой пропорции.
Калькулятор рассчитывает состав, исходя из формулы X=NP/M-P
Важно помнить о том, что сначала необходимо набрать нужное количество воды. Только в воду следует добавить необходимый объем спирта, а не наоборот. Это следует делать для того, чтобы не возникло химической реакции при смешивании.
Разбавление спирта водой
В домашних условиях приготовить напиток, используя свой традиционный рецепт проще всего именно из хорошего спирта, разбавленного водой. Это всем известный способ, который часто называют «холодным» способом. Стоит упомянуть и то, что этот способ используют и на заводах изготавливающих спиртные напитки. Иногда для разведения используется водка, крепостью 40 градусов, но тогда получаемый результат может по крепости не соответствовать тому, что предполагалось получить в итоге.
Спирт бывает различной очистки и тут тоже нужно знать некоторые нюансы
Важно помнить о том, что развести спирт обычной водопроводной водой не получится. В результате такого разведения возможно появление осадка, раствор мутнеет, потому что вода содержит примеси.
Иногда требуется разбавить спирт для получения домашней водки, крепостью примерно в 40 градусов. Для этого на стакан спирта, потребуется 280 мл воды. Если объем больше, значит, добавляем больше воды, но пропорции сохраняются.
Калькулятор для расчета соотношения воды и спирта для получения 40-ка градусного напитка, удобен в применении, но иногда можно воспользоваться таблицей, с более точными значениями. Эта таблица известна под названием Фертмана.
Таблица разведения спирта
| П/Д | 95 | 90 | 85 | 80 | 75 | 70 | 65 | 60 | 55 | 50 |
| 90 | 6.5 | |||||||||
| 85 | 13.2 | 6.5 | ||||||||
| 80 | 20.8 | 13.9 | 6.9 | |||||||
| 75 | 29.6 | 21.9 | 14.6 | 7.3 | ||||||
| 70 | 39.2 | 31.1 | 23.2 | 15.5 | 7.7 | |||||
| 65 | 50.2 | 41.5 | 33.1 | 24.6 | 16.5 | 8.3 | ||||
| 60 | 62.8 | 53.6 | 44.6 | 35.5 | 26.6 | 17.7 | 8.9 | |||
| 55 | 78.1 | 67.9 | 57.8 | 48.2 | 38.4 | 28.5 | 19.1 | 9.6 | ||
| 50 | 96.1 | 84.8 | 73.8 | 63.1 | 52.5 | 41.8 | 31.2 | 20.7 | 10.5 | |
| 45 | 117.5 | 105.2 | 93.5 | 81.3 | 69.6 | 57.9 | 46.1 | 34.6 | 22.8 | 11.5 |
| 40 | 144.5 | 130.9 | 117.4 | 104.1 | 90.9 | 77.5 | 64..4 | 51.6 | 38.6 | 25.5 |
П – крепость после разбавления
Д – крепость до разбавления
Расчеты при приготовлении водных растворов
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOH2O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10H2O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10H2O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10H2O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (NH4)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:
Теперь можно подсчитать, сколько нужно взять 20%-ного рас* твора, чтобы получить 2 л 5%-ного раствора.
Полученную массу раствора можно пересчитать на объем его. Для этого массу раствора делят на его плотность (плотность 20%-ного раствора равна 1.1149 г/см3), т. е.
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000—462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5’—-требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора. Пусть с — количество раствора, m%—концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 • 5H2O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего —0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
В данном случае Mi = 249,68; АСu = 63,54; следовательно, для приготовления 100 мл раствора, 1 мл которого содержал бы 1 мг меди (Т = 0,001 г/мл), нужно взять
Навеску соли переносят в мерную колбу емкостью 100 мл и добавляют воду до метки. Другие растворы готовят соответствующим разбавлением приготовленного.
Эмпирические растворы. Концентрацию этих растворов чаще всего выражают в г/л или г/мл. Для приготовления эмпирических растворов применяют очищенные перекристаллизацией вещества или реактивы квалификации ч. д. а. или х. ч.
Пример. Нужно приготовить 0,5 л раствора CuSO4, содержашего Cu 10 мг/мл. Для приготовления раствора применяют CuSO4 • 5H2O.
Чтобы подсчитать, сколько следует взять этой солн для приготовления раствора заданного объема, подсчитывают, сколько Cu должно содержаться в нем. Для этого объем умножают на заданную концентрацию, т. е.
500*10 = 5000 мг, или 5,0000 г
После этого, зная молекулярный вес соли, подсчитывают нужное количество ее:
На аналитических весах отвешивают в бюксе точно 19,648 г чистой соли, переводят ее в мерную колбу емкостью 0,5 л. Растворение проводят, как указано выше.
Расчет проверки соотношения 1:20 показать при разборе рецепта
Достоинства порошков
1.Порошки содержат лекарственные вещества в тонко измельченном состоянии и поэтому форма имеет большую поверхность соприкосновению с тканями организма, следовательно, обладает высоким фармакологическим эффектом
2.Относительная простота приготовления
3.Удобство приема
4. Портативность. Порошки легко транспортируются по сравнению с другими лекарственными формами, например с ЖЛФ
5. Точность дозировки, следовательно в форму можно вводить ядовитые и сильнодействующие вещества
6. Легкость дозировки
7. Универсальность состава. В порошки входят лекарственные средства органического, неорганического, растительного синтетического происхождения, они могут включать в свой состав небольшое количество жидких компонентов, вязкие жидкости ( настойки, экстракты, деготь, ихтиол)
8. Лекарственные вещества в порошках не подвергаются растворению, нагреванию, действия которых могут отрицательно влиять на терапевтическую активность веществ
9. Стойкость при хранении Срок годности порошков 10 дней
Недостатки порошков
1. Медленное действие по сравнению с ЖЛФ, т.к. в порошках вещества прежде чем всасаться должны раствориться
2. При приеме порошки могут неравномерно распределиться по слизистой оболочке и может наблюдаться местное раздражение
ü Терять кристаллизационную воду ( магния сульфат, натрия сульфат)
ü Быстрее поглащать влагу из воздуха, что приводит к отсыреванию порошкообразной смеси. Такие вещества называются гигроскопичными( анальгин, экстракт красавки, алкалоиды)
ü Приобретать посторонний запах. т.к. увеличивается адсорбция пахучих веществ
Данный недостаток можно преодалеть упаковав порошки в вощенные, парафинированные, пергаментные капсулы.
4. Неудобство приема порошков с пахучими веществами, с красящими веществами. Для преодаления данного недостатка порошки отпускают в желатиновых капсулах с крыжечкой, при этом полностью коррегируется данный недостаток
Требования к порошкам
1. Должны обладать свойством сыпучести и легко дозироваться
2. Должны быть однородными, т.е. лекарственные вещества должны быть равномерно распределены друг в друге. Согласно ГФХ1 пр ирассмотрении невооруженным глазом не должно быть видно крупных кристаллов, блестков, порошки должны иметь однородную окраску
3. Должны быть устойчивы при хранении, не отсыревать и нерасслаиваться
4. Отклонения допустимые массе порошков должны укладываться в норму допустимых отклонений
Масса порошка Отклонение в %
5. К некоторым порошкам предъявляется требование стерильности ( порошки для новорожденных, порошки, наносимую на раневую поверхность)
6. Порошки должны иметь цвет, запах, вкус, соответствующий входящим в их состав ингредиентов
Классификация порошков – самостоятельная работа
Порошки можно разделить по
Стадии приготовления порошков
Изготовление порошков включает несколько технологических операций
1. Подготовительные – сушка, измельчение, просеивание
2. Основные – смешивание, дозирование, упаковка, оформление
Характеристика данных операций- самостоятельная работа
Правила выписывания рецептов на порошки
1. Недозированные порошки. Врач перечисляет лекарственные вещества, указывая их массу
2. Дозированные порошки
А) Разделительный способ
Б) Распределительный способ
Приготовление простых порошков – самостоятельная работа
Приготовление сложных порошков
Сложные порошки— порошки, состоящие из двух или нескольких измельченных лекарственных веществ, а также смеси этих веществ с густыми или жидкими веществами, при этом такие смеси должны сохранять основное свойство сыпучести.
Сложные порошки могут быть дозированными и недозированными
Основное значение при приготовлении сложных порошков имеет точное взвешивание всех входящих с состав порошка веществ и достижение однородности смеси
Стадии приготовления порошков
1. Расчеты. Фармацевт делает расчеты на обратной стороне паспорта.
2. Подбор ступки в зависимости от общей массы порошка. Ступка подбирается таким образом, чтобы общая масса порошка была близка к оптимальной загрузки ступки, но не превышала максимальную загрузку. Для каждой ступки имеется свой номер в зависимости от максимальной загрузки. Показать таблицу.
3. Отвешивание, измельчение лекарственных веществ
4. Поверка массы на однородность
5. Упаковка порошков, если порошок недозированный.
Развешивавние порошкообразной массы на отдельные дозы ( если порошок дозированный), упаковка каждой дозы и всего порошка
6. Оформление лекарственной формы, заполнение документации.
Правила приготовления сложных порошков
1.В первую очередь в ступку помещают:
А) вещество индифферентное терапевтическом отношении, вещество общего списка
Б) вещество выписанное в большем количестве
В) кристаллическое вещество
Г) тяжеловестное вещество ( цинка оксид, висмута нитрат основной)
Д)Труднопорошкуемое вещество т.к. для его измельчения необходимо использовать жидкую фазу – спирт этиловый
Е) в состав порошка входят вещества одного списка, выписанные в одинаковых количествах, близкие по свойствам, то в первую очередь в ступку помещают вещество, имеющее меньшие потери при затирании пор ступки Показать таблицу потерь веществ при затирании пор ступки.При растирании первого вещества происходит потери данного вещества, т.к. часть вещества идет на затирания пор ступки
2. После затирания пор ступки вещества, идет смешивания порошков, их помещают в ступку по основному правилу смешивания – от меньших количеств к большим.
3. При добавление второго вещества необходимо учесть соотношение 1:20, если это соотношение не выдерживается, часть вещества из ступки отсыпают на капсулу и добавляют ее в конце приготовления порошков. Если не учтено соотношение, сложно добиться однородности смешивания порошков, что может ухудшить их дозирование
Расчет проверки соотношения 1:20 показать при разборе рецепта
4. Лекарственные вещества, содержащие кристаллизационную воду
помещают в теплую ступку в первую очередь и измельчают до полного испарения воды.
5. Легковесные вещества ( тальк, крахмал, ликоподий), отвешивают в последнюю очередь, осторожно перемешивая порошкообразную массу.
6. Жидкие компоненты добавляются в последнюю очередь
7. Смешивание следует проводить при частом собирании порошка со стенок ступки и пестика пластинкой в центр ступки.
8. Однородность порошкообразной смеси зависит от длительности смешивания, поэтому, чем больше масса порошка, тем длительнее должно быть смешивание.
9. После смешивания порошки проверяют на однородность. При этом собирают порошок в центр ступки, слегка надавливают пестиком. При рассмотрении порошка невооруженным глазом не должно быть видно крупных кристаллов, блесков, посторонних вкраплений, вещества должны быть хорошо измельчены, порошок должен иметь однородную окраску. Затем порошок отпускается общей массой или дозируется
11. Порошки отпускают в пакетах или в стеклянных банках. Этикетка:»Внутреннее. Порошки». «Наружное», «Беречь от детей», «Хранить в прохладном месте», «Хранить в защищенном от света месте»