что такое узелковый артрит
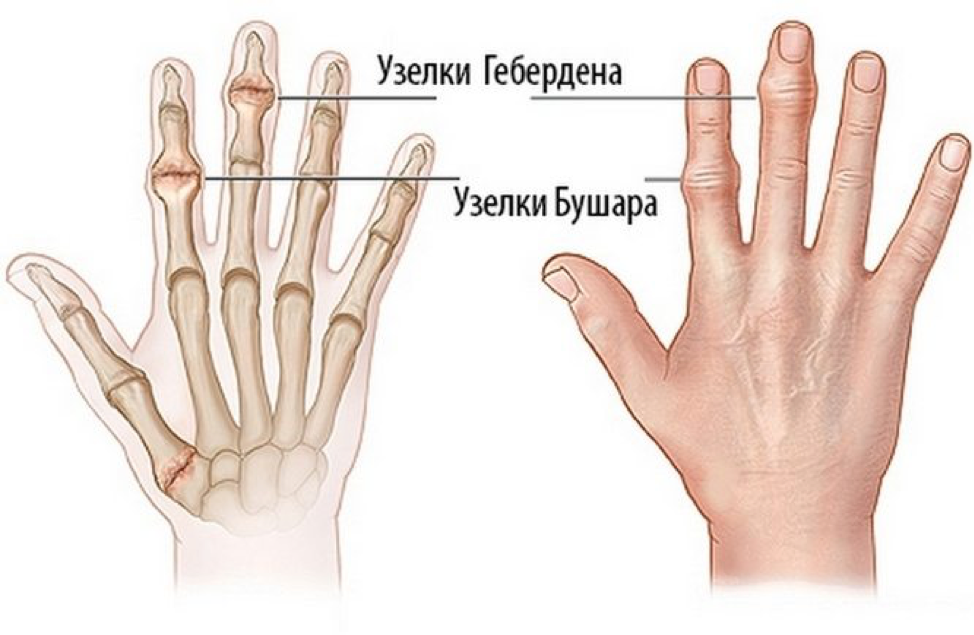
Узелки Бушара и Гебердена – это не только эстетичность, но и здоровье суставов рук.
Что такое узелки Гебердена и Бушара?
Лучше всего узелки Бушара заметны на указательном и среднем пальцах. Реже они встречаются на безымянных пальцах и мизинцах. На больших пальцах их не бывает никогда.
Причины образования узелков Бушара
Узелки гебердена на пальцах рук образуются на фоне остеоартроза.
Узелки Бушара появляются и вследствие таких факторов, как:
Причины и лечение узелков Гебердена всегда связаны с основным заболеванием – остеоартрозом пальцев рук.
Стадии образования узелков Гебердена на пальцах рук
Точнее всего установить стадию разрастания узелков можно при помощи рентгеноскопии:
Изменения в составе крови, мочи отсутствуют на любой стадии.
Лечение узелков Гебердена и Бушара
В лечении узелков Гебердена и Бушара, в основном, применяются консервативные методики. Если лекарства, физиотерапия и гимнастика не дают должного эффекта и болезнь прогрессирует, показаны местные инъекции кортикостероидов. Хирургическое лечение узелков Гебердена на пальцах проводится крайне редко, при практически полной неподвижности сустава или постоянном травмировании мягких тканей.
Несмотря на припухлость и покраснение кожи на узелками Бушара, эта проблема носит, скорее, эстетический характер. При отсутствии неудобств для пациента лечение узелков Гебердена не проводится. Врачи, как правило, назначают хондропротекторы и поддерживающую гимнастику.
Различий в том, как лечить узелки Гебердена и как лечить узелки Бушара нет.
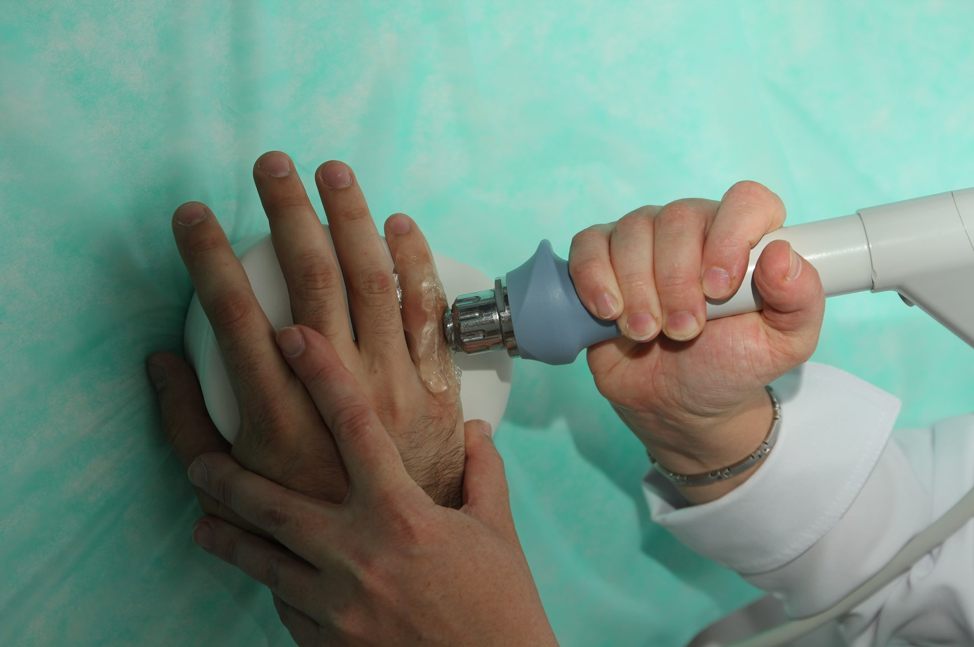
Физиотерапевтическое лечение узелков Гебердена
При незначительных симптомах болезни физиотерапия проводится курсами в качестве профилактической меры. Она призвана замедлить прогрессирование остеоартрита. Физиотерапевтические методики позволяют снять воспаление, предотвратить атрофию мышц и разгрузить суставы, улучшить метаболизм в тканях.
Физиотерапия – один из эффективных методов в лечении узелков Бушара
Если узелки Гебердена на пальцах рук начинают причинять пациенту боль и дискомфорт, применяется:
Массаж при узелках Гебердена
Массаж узелков Бушара при остеоартрозе можно проводить самостоятельно, если суставы не воспалены. Для процедуры можно использовать лекарственные мази и эфирные масла, массажное или оливковое масло.
Массаж помогает бороться с узелками Бушара
Начните массаж с легкого поглаживания рук и круговых растираний. Затем начинайте мягкими, растирающими движениями массировать кисть от запястья к костяшкам, продавливая большим пальцем межпястное пространство.
ЛФК при узелках Бушара
Лечебная гимнастика для кистей рук, запястий и предплечий позволяет замедлить разрастание остеофитов и сохранить функциональность межфаланговых суставов. ЛФК улучшает микроциркуляцию крови в тканях, помогает уменьшить боль и неэстетичные изменения пальцев.
Как избавиться от узелков Гебердена и сохранить гибкость пальцев? Ежедневно уделяйте хотя бы 25-30 минут следующим простым упражнениям:
Перед выполнением упражнений можно разогреть руки в теплой ванночке или потерев друг о друга. По окончании разминки легко потрясите кистями, чтобы расслабить мышцы. Также полезно при лечении узелков Гебердена лепить из пластилина и выполнять другие упражнения на мелкую моторику, не связанные с постоянным напряжением пальцев (т.е., от продолжительного шитья и вышивки лучше отказаться).
Лекарственные препараты для лечения узелков Бушара
Медикаментозное лечение узелков Гебердена и Бушара включает средства для наружного применения (мази, гели, кремы, препараты для лекарственного электро- и фонофореза, компрессов), хондропротекторы и растворы для местных инъекций. Системное лечение (таблетки, в/м инъекции) показано лишь в тех случаях, когда узелки возникают на фоне полиартроза (т.е., артроза 4 и более суставов).
Применение медикаментов – основной метод лечения узелков Гербердена и Бушара
Хондропротекторы
Хондропротекторы призваны компенсировать дегенеративные изменения в хрящевой ткани. Они помогают сохранить эластичность хряща, способствуют росту здоровых, полноценных хрящевых клеток, препятствуют их разрушению вследствие стрессов.
Лечение узелков Гебердена хондропротекторами длится от 3 до 6 месяцев, повторяют его не ранее, чем через 3-4 месяца (не чаще 2 раз в год).
К хондропротективным препаратам относятся: артракам, артравил, алфлутоп (в т.ч. для местных инъекций), дона, артифлекс, мукосат, протекон, артифлекс и другие.
Принимать хондропротективные средства в виде таблеток, капсул или порошка следует натощак или во время приема пищи, в зависимости от рекомендаций производителя.
Спазмолитики и сосудорасширяющие средства
Когда руки скованы мышечным спазмом, врач может назначить мази с разогревающими, раздражающими и обезболивающими компонентами, а также средства-миорелаксанты. Из группы спазмолитиков назначают папаверин мазь, бутадион.
Сосудорасширяющие препараты (такие как трентал, теоникол, циннаризин, актовегин, никотиновая кислота и другие) помогают улучшить и закрепить действие хондропротекторов.
Противовоспалительные средства
НПВС для лечения узелков Гебердена и Бушара применяются местно, например: артрадол, вольтарен гель, ибупрофен гель, индометациновая и бутадионовая мази, долгит и фастум гель. Нестероидные средства втирают как минимум 10 раз в день непосредственно в артрозный узелок.
Также можно делать примочки (а также “варежки”) с бишофитом или медицинской желчью.
При сильных болевых ощущения применяют препараты с гидрокортизолом.
Основы питания при узелках Гебердена
Правильное питание помогает сдержать рост краевых остеофитов, хоть и не является главным терапевтическим фактором.
Если у Вас появляются узелки Бушара, крайне полезно употреблять:
Заботьтесь о своих суставах, и всего Вам доброго!
Ревматоидный артрит
Ревматоидный артрит – тяжелое, с трудом поддающееся лечению заболевание. Причины развития его установлены не полностью, тем не менее, при проведении правильно назначенного комплексного лечения качество жизни пациента может быть вполне удовлетворительным. Но это при условии неукоснительного выполнения больным всех рекомендаций лечащего врача.
Специалисты клиники «Парамита» в Москве имеют большой опыт в лечении ревматоидного артрита.
Что такое ревматоидный артрит
Ревматоидный артрит (РА) – хроническое системное прогрессирующее заболевание, проявляющееся в виде воспаления в основном мелких суставов. Связано оно не с инфекцией, а с поломкой иммунной системы. Поражается соединительная ткань, поэтому данное заболевание называется системным. Патологический процесс часто распространяется и внутренние органы (сердце, сосуды, почки) – это внесуставные проявления болезни.
Всего в мире ревматоидным артритом болеет около 1% населения. Заболеть можно в любом возрасте, но чаще это случается в 35 – 55 лет у женщин и немного позже (в 40 – 60 лет) у мужчин. Ревматоидный артрит у женщины диагностируют в три раза чаще, чем мужчины.
Причины
Точные причины начала данного заболевания не установлены. Но известны основные причинные факторы:
В результате целого комплекса причин клетки синовиальной оболочки начинают выделять воспалительные цитокины – белковые молекулы, инициирующие и поддерживающие воспаление. Развивается длительно протекающий воспалительный процесс, происходит разрушение хрящевой и костной суставной ткани, деформация конечности. Хрящевая ткань заменяется соединительной, появляются костные разрастания, нарушается функция сустава. Очень часто причиной развивающегося аутоиммунного поражения суставов является герпетическая инфекция – вирусы простого герпеса 1, 2 типа, цитомегаловирус, вирус Эпштейна – Барр (вызывает мононуклеоз) и другие возбудители, например, микоплазмы.
Предрасполагающие (запускающие, триггерные) факторы:
Симптомы
Заболевание протекает волнообразно, в виде периодов обострений (рецидивов) и ремиссий.
Как начинается ревматоидный артрит
Начало в большинстве случаев подострое и имеет связь с перенесенной инфекцией, переохлаждением, травмой или нервным перенапряжением, беременностью, родами.
В большинстве случаев при ревматоидном артрите поражается сначала небольшое количество суставов стоп и кистей. На ранней стадии могут также поражаться коленные суставы. Поражения симметричны. При подостром течении первые признаки нарушений появляются через несколько недель, при медленном, хроническом – через несколько месяцев.
Острое начало, высокая активность патологического процесса и системные проявления характерны для ювенильного ревматоидного артрита у детей и подростков. Он может начинаться с высокой температуры, изначального поражения сразу нескольких суставов и признаков поражения внутренних органов.
Симптомы разгара заболевания
Ревматоидный артрит сопровождается признаками общей интоксикации. Это слабость, недомогание, небольшое повышение температуры тела, головные боли. Нарушается аппетит, больной теряет массу тела.
Суставной синдром. Поражаются сначала мелкие суставы кисти (число их увеличивается), а затем и крупные суставы (плечевые, коленные). Они опухают, становятся очень болезненными, постепенно теряют свою функцию, обездвиживаются. Длительное обездвиживание приводит к выраженной атрофии (уменьшению в объеме) мышц. Ревматоидный артрит характеризуется также тем, что поражения разных суставов могут быть неодинаковыми: в одних могут преобладать признаки воспаления (отек), в других – пролиферации (разрастания соединительной ткани с деформацией и нарушением функции).
Появляются подкожные ревматоидные узелки – небольшие, умеренно плотные, безболезненные образования, располагающиеся на поверхности тела, чаще всего на коже локтей.
Поражается периферическая нервная система. Из-за поражения нервов больные ощущают онемение, жжение, зябкость в конечностях.
При ревматоидном васкулите происходит поражение различных мелких и частично средних кровеносных сосудов. Часто это проявляется в виде точечных очагов некроза в области ногтей или безболезненных язв в области голени. Иногда васкулит может проявляться в виде микроинфарктов.
Когда нужно срочно обращаться за медицинской помощью
К врачу следует обращаться при появлении следующих симптомов:
Локализации процесса
При ревматоидном артрите вначале обычно поражаются мелкие суставы кистей, пальцев рук и стоп. Внешний вид верхних х конечностей:
Подробнее про артрит суставов пальцев читайте здесь.
Что такое узелковый артрит
Могут. Это так называемый серонегативный ревматоидный артрит.
Зачем и как часто надо делать общий и биохимический анализ крови?
Анализы крови выполняются для оценки активности ревматоидного артрита, а также позволяют выявить побочные эффекты проводимого лечения при их развитии. Если лечение базисными препаратами (метотрексатом, лефлуномидом, сульфасалазином, гидроксихлорохином) назначено впервые, анализы крови надо сделать в течение 2-3 недель, а далее ежемесячно в течение первых трех месяцев, затем 1 раз в 2 месяца в течение полугода и далее 1 раз в 3 месяца еще в течение 6-9 месяцев. Если терапия не меняется и нет признаков обострения болезни можно делать анализы крови 1 раз в 6 месяцев.
Лечение ревматоидного артрита Когда нужно начинать лечение ревматоидного артрита?
Лечение ревматоидного артрита необходимо начинать сразу же после установления диагноза, оптимально в первые 3 месяца от появления первых симптомов.
Кто назначает лечение ревматоидного артрита?
Лечение ревматоидного артрита назначается и контролируется ревматологом, который владеет полной информацией о болезни и ее рисках, методах оценки заболевания, терапевтической цели и возможных средствах ее достижения, разработке плана лечения и соотношении польза/риск для индивидуальной терапии.
Какова цель лечения ревматоидного артрита?
Лечение ревматоидного артрита направлено на достижение и поддержание ремиссии или низкой активности заболевания у каждого пациента.
Как часто нужно ходить к ревматологу, чтобы оценить эффективность лечения?
В первый год лечения требуется частый мониторинг (каждые 1-3 месяца). Ревматологом будет проведена коррекция лечения, если нет улучшения в течение 3 месяцев или цель лечения не достигнута через б месяцев после его начала.
Что такое базисная терапия?
Базисная терапия — основа медикаментозного лечения ревматоидного артрита. Она влияет на саму суть болезни, предотвращает прогрессирование заболевания и инвалидизацию. В настоящее время без применения базисных лекарственных средств лечение ревматоидного артрита невозможно.
Какие лекарственные средства используются для базисной терапии?
Золотым стандартом базисной терапии при ревматоидном артрите является метотрексат. При его непереносимости назначают лефлуномид, сульфасалазин, гидроксихлорохин. Это так называемые средства синтетической базисной терапии. Базисную терапию назначает и контролирует ревматолог.
На что надо обратить внимание при лечении базисными лекарственными средствами?
При назначении базисных лекарственных средств необходимо проводить клинический и лабораторный мониторинг каждого пациента для раннего выявления признаков реализации побочных эффектов проводимого лечения. Женщинам репродуктивного возраста на фоне приема базисных препаратов необходима контрацепция.
Что такое биологическая терапия?
Биологические лекарственные средства способны действовать избирательно на определенные компоненты воспалительного процесса. В большинстве случаев эти лекарственные средства представляют собой моноклональные антитела к провоспалительным цитокинам (веществам, вызывающим воспаление), таким какФНОа, интерлейкин-6.
Когда назначается биологическая терапия?
Показания к назначению биологической терапии определяет ревматолог, например, биологическая терапия назначается при недостаточной эффективности синтетической базисной терапии.
Какие лекарственные средства биологической терапии у нас есть? Как давно они применяются?
Биологические лекарственные средства начали применяться в ревматологии в 1998 году. С тех пор накоплен значительный опыт лечения данными препаратами. В настоящее время у нас зарегистрированы для лечения ревматоидного артрита: инфликсимаб, адали- мумаб, этанерцепт, ритуксимаб и тоцилизумаб. Эти лекарственные средства назначаются ревматологом и вводятся в специализированных отделениях, где врачи имеют соответствующий опыт.
Является ли биологическая терапия эффективной?
Биологическая терапия высоко эффективна. Большинство пациентов отмечают значительное улучшение самочувствия. Кроме сим- птом-модифицирующего действия, биологическая терапия обладает патогенетическим (базисным) действием, существенно улучшает прогноз заболевания.
Надо ли принимать метотрексат, если про-водится лечение биологическими лекар-ственными средствами?
Обычно синтетическая базисная терапия сохраняется. Чаще всего нет необходимости в приеме нестероидных противовоспалительных средств. Также на фоне биологической терапии вероятно снижение дозы глюкокортикоидов или их полная отмена.
При использовании тоцилизумаба допускается отказ от синтетических базисных препаратов (метотрексата, сульфасалазина и др.).
Какое значение имеют нестероидные про-тивовоспалительные средства в лечении ревматоидного артрита?
НПВС являются симптом-модифицирующими препаратами, они не влияют на процессы формирования и прогрессирования костно-хрящевой деструкции (разрушения кости и хряща). Их основное назначение — устранение субъективных болезненных ощущений, связанных с воспалением.
Как часто надо принимать нестероидные противовоспалительные средства и можно ли их вообще не использовать?
При ревматоидном артрите нестероидные противовоспалительные препараты (НПВС) принимают «по требованию», это значит, при болях. Чем реже пациент принимает эти лекарственные средства, тем меньше активность заболевания и, вероятно, базисная терапия подобрана верно. В случае постоянного болевого синдрома и необходимости принимать нестероидные противовоспалительные средства практически ежедневно необходимо обратиться к ревматологу для коррекции базисной терапии.
Как и для чего назначаются глюкокортикоиды?
Можно ли отменять гормоны самостоятельно при улучшении самочувствия?
Самостоятельно изменять дозировки глюкокортикоидов и режим приема препаратов нельзя. Действительно, при достижении эффекта, обычно начинают снижать дозу глюкокортикоидов, иногда до полной отмены. Но схему снижения должен предложить врач. Следует знать, что чем меньше доза и чем длительнее время приема глюкокортикоидов, тем медленнее необходимо снижать дозировку. Нельзя пропускать прием препарата.
Для чего вводить глюкокортикоиды в сустав?
Глюкокортикоиды могут вводиться внутрисуставно или периартикулярно (в ткани, окружающие сустав). Преимущество этой терапии состоит во введении препаратов непосредственно в очаг воспаления. Показанием для локальной терапии является необходимость быстро подавить активный воспалительный процесс в суставах в начале заболевания или при выраженном обострении.
Однако вводить глюкокортикоиды в один и тот же сустав можно не чаще 3 раз в год. Также не вводят препараты в сустав, в котором нет воспаления (отсутствует повышение температуры над суставом, припухлость). Если возникает потребность в более частых введениях глко- кортикоидов в сустав, необходимо пересмотреть базисную терапию. Необходимо помнить, что локальная терапия ни в коем случае не является эквивалентом базисного лечения, а назначается и проводится ревматологом в качестве дополнения к системной базисной и противовоспалительной терапии по строгим показаниям.
Какой диеты следует придерживаться при ревматоидном артрите?
Необходимо придерживаться сбалансированной диеты с включением в пищу полинена- сыщенных жирных кислот, фруктов и овощей, а также достаточного количества белка и кальция (мясо, рыба, молочные продукты). При ожирении надо придерживаться гипокалорий- ной диеты. Целесообразно отказаться от приема алкоголя и курения.
Полезно ли движение при ревматоидном артрите?
Движение в рамках повседневной жизни, лечебной физкультуры и активного досуга является залогом хорошего функционального прогноза, предотвращает анкилоз суставов, а также потерю мышечной и костной ткани.
Полезна ли физиотерапия при ревматоидном артрите?
Физиотерапевтические процедуры не влияют на прогрессирование болезни, а являются лишь дополнением к медикаментозному лечению. В период обострения заболевания физиотерапия не рекомендуется, а тепловые процедуры (озокерит, парафинолечение и др.) могут вызвать обострение ревматоидного артрита.
Совместима ли синтетическая базисная терапия с беременностью?
Планирование беременности при ревматоидном артрите должно согласовываться с ревматологом и гинекологом. Оптимально планировать беременность при достижении ремиссии или низкой активности заболевания. Зачатие возможно через 12 месяцев после отмены метотрексата, через 24 месяца после отмены лефлуномида. Допускается прием сульфасалазина до и во время беременности.
Совместима ли беременность с лечением биологическими препаратами?
Во время лечения и мужчинам, и женщинам необходимо соблюдать контрацепцию. Зачатие возможно через б месяцев после отмены биологической терапии.
Внесуставные (системные) проявления ревматоидного артрита
В клиническом разборе обсуждаются системные, или внесуставные проявления (ревматоидные узелки, интерстициальное заболевание легких, поражение почек, ревматоидный васкулит и др.), которые встречаются по крайней мере у трети больных РА и должны учитываться при выборе тактики лечения. От системных проявлений РА следует отличать ассоциированные заболевания (сердечно-сосудистые осложнения на фоне ускоренного прогрессирования атеросклероза, венозные тромбоэмболические осложнения, анемия, психические расстройства), в основе которых лежит персистирующее воспаление, и осложнения медикаментозной терапии, например, интерстициальное поражение легких, вызванное метотрексатом, или различные варианты лекарственной нефропатии
С.В.Моисеев. В отличие от системной красной волчанки (СКВ), системной склеродермии, системных васкулитов и многих других аутоиммунных ревматических болезней, ревматоидный артрит (РА) считают заболеванием, преимущественно поражающим суставы. При этом внесуставные, или системные проявления РА в определенной степени игнорируются или по крайней мере недооцениваются [1]. Например, в рекомендациях Американской коллегии ревматологов (ACR) и Европейской антиревматической лиги (EULAR) 2010 года указано, что РА – это хроническое воспалительное заболевание, характеризующееся опуханием, болезненностью и деструкцией синовиальных суставов, а предложенные классификационные критерии РА включают в себя только признаки поражения суставов, длительность заболевания, наличие аутоантител и лабораторных признаков воспаления [2]. Конечно, можно согласиться с экспертами, что системные проявления РА не повышают точность диагноза, а скорее затрудняют его, требуя исключения многих других аутоиммунных заболеваний. Однако системные проявления не обсуждаются и в рекомендациях EULAR 2016 г. по лечению РА, которые предполагают выбор стратегии терапии только на основании динамики «суставных» индексов [3]. Более того, неблагоприятные прогностические факторы, приведенные в данных рекомендациях (высокие уровни острофазных белков и значения счета опухших суставов, наличие ревматоидного фактора и/или антител к цитруллинированным белкам, ранние эрозии, неэффективность по крайней мере двух базисных противовоспалительных препаратов), не включают в себя какие-либо системные проявления, такие как поражение легких, периферическую невропатию, амилоидоз почек или ревматоидный васкулит, которые, несомненно, ухудшают прогноз и влияют на тактику лечения [4].
Еще в середине прошлого века академик Е.М. Тареев писал: «участие внесуставных систем при ревматоидном артрите может быть даже более значительным, чем при ревматизме, поэтому нельзя представлять рев матоид как заболевание будто бы только суставов», а «изучение этого заболевания, несомненно, задерживалось необоснованным узким взглядом на болезнь как на местное заболевание суставов» [5,6]. Несколько позднее Е.М. Тареев и В.А. Насонова первыми в нашей стране описали поражение легких при РА в виде «своеобразно протекавшей интерстициальной пневмонии и гранулематоза». В клинике Е.М. Тареева активно изучались и другие внесуставные проявления РА, в частности поражение почек и амилоидоз (академик Н.А. Мухин, В.В. Сура).
П.И. Новиков. В литературе нет четкого определения внесуставных проявлений РА. Обычно к ним относят только поражение различных органов и тканей в рамках основного аутоиммунного процесса. Например, в российских клинических рекомендациях по ревматологии под редакцией академика Е.Л. Насонова 2017 г. выделены следующие внесуставные проявления РА [7]:
Хотя этот список представляется достаточно исчерпывающим, он не включает в себя поражение почек, которое может наблюдаться не только в рамках ревматоидного васкулита. Серьезным осложнением РА остается АА-амилоидоз, хотя сегодня он встречается значительно реже в результате современной базисной противовоспалительной терапии, которую рекомендуют назначать всем больным РА. Отдельную проблему представляют различные заболевания, ассоциированные с РА, такие как ишемическая болезнь сердца, связанная с ускоренным развитием атеросклероза, тромбоэмболические осложнения, анемия, депрессия и другие психоневрологические нарушения. В зарубежной литературе эти состояния нередко относят к системным проявлениям РА, хотя они не являются специфичными для РА и связаны с хроническим персистирующим воспалением, наблюдающемся при любом аутоиммунном заболевании [8]. Это не снижает важность их изучения, так как сегодня больные РА чаще умирают не от прямых последствий заболевания, а от сердечно-сосудистых осложнений [9]. Особо следует выделить осложнения лекарственной терапии, которые иногда бывает трудно дифференцировать от внесуставных проявлений РА, например, интерстициальное поражение легких, вызванное метотрексатом, или лекарственную нефропатию. Многочисленные осложнения (остеопороз, катаракта, атрофия мышц, гипергликемия и др.) вызывают глюкокортикостероиды, которые к тому же обладают и атерогенным действием. Применение любых иммуносу прессивных препаратов сопровождается увеличением риска развития инфекционных осложнений.
В.В. Рамеев. Развитие АА-амилоидоза (вторичного, реактивного) при РА отражает персистирование воспаления на фоне недостаточно эффективной терапии, что патогенетически сближает его с сердечно-сосудистыми исходами или анемией, риск которых, как указано выше, при иммуновоспалительных заболеваниях также повышен. Отложения амилоида при АА-амилоидозе состоят в основном из сывороточного амилоидного белка (SАА), который является одним из основных белков острой фазы воспаления. SAA синтезируется гепатоцитами под действием провоспалительных цитокинов, в частности интерлейкина (ИЛ)-6 [10]. В прошлом AA-амилоидоз занимал первое место в структуре амилоидоза, однако сегодня он уступает AL-амилоидозу, что в значительной степени связано с успехами в лечении РА и других ревматических заболеваний.
С.В. Моисеев. Как часто встречаются внесуставные проявления у больных РА? Какое влияние они оказывают на прогноз?
Н.М. Буланов. Внесуставные проявления наблюдаются у 20-40% больных РА, в том числе тяжелые – у 1-20% [11,12]. По данным когортного исследования ERAS, в рамках которого 1429 больных РА наблюдали в течение в среднем 9 лет, наиболее частыми внесуставными проявлениями заболевания были ревматоидные узелки (32%), синдром Шегрена (10%), феномен Рейно (10%) и поражение легких (5%), реже встречались васкулит (3%), нейромиопатии (1%) и синдром Фелти ( Л.А. Акулкина. Поражение бронхолегочной системы при РА проявляется интерстициальными изменениями легочной ткани, бронхиолитом, бронхоэктазами, васкулитом легочных сосудов, интрапаренхиматозными ревматоидными узлами [19]. ИЗЛ – это наиболее распространенный вариант поражения легких, ассоциированный с повышенной смертностью. Клинически явное ИЗЛ отмечается у 2-10% пациентов с РА, тогда как у 33-61% больных выявляют признаки ИЗЛ при отсутствии респираторной симптоматики [20,21]. В отдельных случаях поражение легких может предшествовать появлению симптомов артрита. К факторам, ассоциировавшимся с развитием РА-ИЗЛ, относят старший возраст, мужской пол, курение, антитела к цитруллинированным пептидам (АЦЦП) и IgM-ревматоидный фактор (РФ), а также активность суставного процесса [22,23]. Cимптомы РА-ИЗЛ неспецифичны и включают в себя одышку при физической нагрузке, повышенную утомляемость и малопродуктивный кашель [24]. При наличии выраженного суставного синдрома, ограничивающего физическую активность пациента, клинические проявления заболевания легких могут отсутствовать вплоть до развития тяжелых вентиляционных нарушений. В связи с преимущественным поражением нижних долей легких наиболее частым аускультативным феноменом (72-100%) является симметричная двусторонняя крепитация в базальных отделах [21]. При функциональном исследовании характерен рестриктивный паттерн вентиляционных нарушений (5-25% пациентов с РА) и снижение диффузионной способности легких (20-45%) [25]. Главный метод диагностики РА-ИЗЛ – компьютерная томография высокого разрешения (КТВР) органов грудной клетки, которую следует всегда проводить при подозрении на наличие поражения легких. Наиболее частыми пат тернами РА-ИЗЛ (до 70%) являются обычная интерстициальная пневмония (ОИП) и неспецифическая интерстициальная пневмония (НСИП) [19]. Для ОИП типично наличие двусторонних ретикулярных изменений, зон «сотового легкого» в периферических субплевральных отделах легких с преобладанием в нижних долях (рис. 1). НСИП характеризуется наличием симметричных уплотнений по типу «матового стекла», умеренных ретикулярных изменений, расположенных на периферии, с относительной сохранностью субплевральных отделов, также с преобладанием в нижних долях. Реже при РА-ИЗЛ выявляют организующую (ОП) и лимфоцитарную пневмонии (ЛИП) [26]. Дифференциальный диагноз РА-ИЗЛ проводят с инфекционными осложнениями, лекарственным поражением легких, застойными явлениями в малом круге при левожелудочковой сердечной недостаточности. Метотрексат-индуцированное поражение легких отмечается у 1% пациентов, получающих терапию данным препаратом, и может имитировать НСИП, но, в отличие от РА-ИЗЛ, чаще имеет острое либо подострое течение и хронологическую связь с началом лекарственной терапии [27].
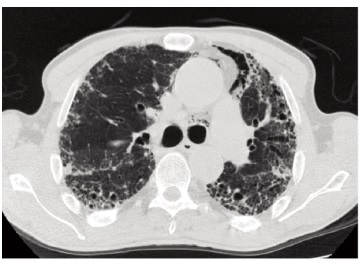
М.Ю. Бровко. Иммуносупрессивная терапия глюкокортикостероидами и цитоста тическими препаратами (микофенолата мофетилом, лефлуномидом, метотрексатом) составляет основу лечения РА-ИЗЛ. ГИБП, в частности ритуксимаб или ингибиторы ФНО-α, могут быть использованы в случае рефрактерного течения заболевания [19]. В целом, эффективность иммуносупрессивной терапии выше у пациентов с воспалительными паттернами ИЗЛ, такими как клеточный вариант НСИП и ОП. И наоборот, фиброзирующие подтипы ИЗЛ, особенно ОИП, могут иметь непрерывно прогрессирующее течение, сходное с идиопатическим легочным фиброзом, и средней продолжительностью жизни 3-4 года [28]. В настоящее время активно изучается эффективность антифибротической терапии в лечении прогрессирующих фиброзирующих форм РА-ИЗЛ. Завершенное в 2019 г. многоцентровое рандомизиро ванное клиническое исследование INBUILD показало, что нинтеданиб по сравнению с плацебо замедляет прогрессирование легочного поражения в данной группе пациентов [29].
Н.В. Чеботарева. Возможные варианты поражения почек при РА включают в себя гломерулонефрит, ААамилоидоз, ревматоидный васкулит и различные формы лекарственной нефропатии (табл. 1) [30]. В отличие от СКВ, хронический гломерулонефрит при РА встречается редко, в то время как частота АА-амилоидоза при этом заболевании, наоборот, выше, чем при СКВ. В прошлом важную роль в этиологии поражения почек у больных РА играли нефротоксичные лекарственные средства, такие как D-пеницилламин, циклоспорин, препараты золота, нестероидные противовоспалительные препараты (НПВП). В последние годы широкое применение более безопасных БПВП, в том числе метотрексата, лефлуномида и сульфасалазина, а также ГИБП привело к снижению доли лекарственной нефропатии в структуре поражения почек у больных РА. Тем не менее, многие пациенты с РА по-прежнему нередко принимают НПВП, которые могут вызвать интерстициальный нефрит. Кроме того, более ранняя и агрессивная базисная терапия привела к снижению частоты АА-амилоидоза у пациентов с РА, хотя он остается одним из основных вариантов нефропатии при этом заболевании. Например, в клинике им. Е.М. Тареева АА-амилоидоз при гистологическом исследовании почечных биоптатов был диагностирован у 41% больных РА с нефропатией. Сходные данные приводят и некоторые другие авторы [31]. Развитие АА-амилоидоза ассоциировалось с большей длительностью заболевания (>15 лет) и недостаточным контролем воспаления, характеризовавшимся стойким повышением уровня СРБ (>15 мг/л) [32]. Другим частым вариантом поражения почек при РА является мезангиопролиферативный гломерулонефрит, реже встречаются другие формы нефропатии, в том числе мембранозный гломерулонефрит, болезнь минимальных изменений, фокальный сегментарный гломерулосклероз.
| Гломерулонефрит |
| — Мезангиопролиферативный гломерулонефрит |
| — IgA-нефропатия |
| — Мембранозный гломерулонефрит (медикаментозный и немедикаментозный |
| — Болезнь минимальных изменений |
| — Фокальный сегментарный гломерулосклероз |
| Интерстициальный нефрит |
| — НПВП |
| Папиллярный некроз |
| — Лекарства |
| Ревматоидный васкулит |
| ХБП, обусловленная сердечно-сосудистыми заболеваниями |
| — Пожилой возраст |
| — Артериальная гипертония |
| — Сахарный диабет |
Клинические проявления поражения почек включают в себя протеинурию, изменения мочевого осадка и/или снижение расчетной скорости клубочковой фильтрации. Нарастающая протеинурия с развитием нефротического синдрома, не сопровождающаяся изменениями мочевого осадка и артериальной гипертонией, наблюдается при амилоидозе почек, а также при мембранозной нефропатии, в то время как мезангиопролиферативный гломерулонефрит при РА обычно характеризуется легким течением и редким развитием нефротического синдрома и хронической почечной недостаточности [30]. Следует отметить, что изменения в моче и клинические симптомы не позволяют надежно предсказать тип поражения почек при РА, поэтому пациентам с необъяснимыми протеинурией и хронической болезнью почек показана биопсия почки.
Несмотря на относительную редкость развития хронического гломерулонефрита и АА-амилоидоза, ХБП встречается более чем у половины больных РА, а частота ее превышает таковую в общей популяции [33]. Например, в недавно опубликованном ретроспективном исследовании, проведенном в Японии, исходно ХБП была выявлена у 24,5% из 1077 больных РА, в том числе снижение расчетной скорости клубочковой фильтрации (рСКФ) 2 – у 20,6%, протеинурия – у 8,0%, снижение рСКФ и протеинурия – у 4,1% [34]. Кумулятивная частота развития ХБП и дисфункции почек в течение 10 лет достигла 62,5% и 49,9%, соответственно. Hickson и соавт. наблюдали развитие дисфункции почек в течение 20 лет у 25,1% из 739 больных РА без исходного снижения рСКФ 2 [35]. Важную роль в развитии ХБП при РА играют сердечно-сосудистые заболевания и сахарный диабет, а также возраст. По данным United States Renal Data System (USRDS), причинами поражения почек у 3754 больных РА с терминальной хронической почечной недостаточностью в 33,5% случаев был сахарный диабет, а в 30,6% – артериальная гипертония, в то время как совокупная доля амилоидоза, васкулита и анальгетической нефропатии составляла всего 10,0% [36]. Как и в общей популяции, ХБП у больных РА ассоциируется с увеличением риска сердечно-сосудистых исходов и смерти [37].
Важное значение для профилактики развития и прогрессирования АА-амилоидоза и хронического гломерулонефрита у больных РА имеет адекватная базисная терапия, обеспечивающая стойкое подавление воспалительной активности. В когортном исследовании у 20757 американских ветеранов войн с РА терапия ГИБП, начатая у 4617 пациентов, ассоциировалась с достоверным снижением риска развития ХБП и замедлением снижения рСКФ [38]. При лекарственной нефропатии в первую очередь следует отменить лекарственный препарат, вызвавший поражений почек. Наличие ХБП следует учитывать при выборе противовоспалительных препаратов и их доз. Например, метотрексат и НПВП противопоказаны больным с клиренсом креатинина ≤30 мл/мин, а дозу тофацитиниба следует снизить до 5 мг один раз в день у пациентов с клиренсом креатинина ≤50 мл/мин [30]. В то же время коррекция доз ГИБП, в том числе ингибиторов ФНО-α, ритуксимаба, абатацепта, тоцилизумаба и сарилумаба, у пациентов с ХБП не требуется.
П.И. Новиков. Ревматоидный васкулит, который поражает сосуды небольшого и среднего диаметра практически любых органов, – это нечастое внесуставное проявление РА, которое наблюдается у 2-3% больных [39,40]. В последние годы частота ревматоидного васкулита снизилась, по-видимому, на фоне более ранней и агрессивной терапии РА [12]. К факторам риска развития ревматоидного васкулита относят мужской пол, серопозитивность, длительное и более тяжелое течение РА, в том числе наличие ревматоидных узелков и эрозий суставных поверхностей, а также оперативные вмешательства на суставах [19]. У 90% больных ревматоидным васкулитом развивается поражение кожи: дигитальные инфаркты, незаживающие язвы, пальпируемая пурпура, гангренозная пиодермия. К характерным проявлениям васкулита относят также поражение периферической нервной системы (сенсорная и/или двигательная полиневропатия, множественный мононеврит) и органа зрения (склерит, эписклерит, язвенный кератит, васкулит сосудов сетчатки), реже встречается поражение других органов, в том числе легких, почек, желудочно-кишечного тракта, сердца. Примером ревматоидного васкулита у мужчины с тяжелым серопозитивным РА может служить следующее наблюдение.
Т.П. Шевцова. Пациент Б., 44 лет, госпитализирован в клинику им. Е.М. Тареева в июне 2016 года. В течение 4 лет страдает серопозитивным РА с поражением суставов кистей, коленных и голеностопных суставов. Перенес эписклерит. В течение короткого времени принимал метилпреднизолон в дозе 24 мг. Предпри ни м а лись попытки лечения метотрексатом и лефлуномидом, однако оба БПВП были отменены из-за плохой переносимости. В течение 3 мес лихорадка, нарастающая слабость и онемение в дистальных отделах конечностей. При обследовании в клинике резкое снижение силы в конечностях, ревматоидный узелок в области левого локтевого сустава, опухание и деформация суставов кистей, сетчатое ливедо. СОЭ 84 мм/ч, СРБ 47 мг/л, резкоположительные РФ и АЦЦП. Криоглобулины не определялись. Отмечалась небольшая протеинурия (0,5 г/сут) при отсутствии изменений мочевого осадка. При рентгенографии кистей выявлены выраженный склероз, снижение высоты суставных щелей, максимально выраженное в проксимальных межфаланговых суставах, остеопороз в диафизах, вывихи пястно-фаланговых суставов с признаками разрушения суставных поверхностей. На компьютерных томограммах легких определялись немногочисленные очаги размером до 6 мм и небольшой левосторонний выпот. Пациент консультирован неврологом, который расценил имеющиеся неврологические нарушения как проявления множественного неврита в рамках основного заболевания. Диагно стирован серопозитивный РА высокой степени активности с системными проявлениями в виде ревматоидного васкулита (множественные невриты, плеврит, эписклерит, сетчатое ливедо), поражения легких, ревматоидных узелков. Больному проводилась терапия метилпреднизолоном в сверх-высоких дозах внутривенно (3 г) и внутрь (40 мг) и циклофосфамидом внутривенно, которая привела к значительному уменьшению воспалительной активности и увеличению силы в конечностях.
Несмотря на отсутствие типичного поражения кожи и гистологического подтверждения, диагноз ревматоидного васкулита не вызывал сомнения, учитывая наличие характерных неврологических нарушений (множественного мононеврита) и эписклерита в анамнезе. Другие причины васкулита, в частности криоглобулинемия, выявлены не были. Обращали на себя внимание высокие титры аутоантител, тяжелое и неконтролируемое (пациент фактически не получал БПВП) течение заболевания с выраженными деструктивными изменениями суставов, которые, как указано выше, являются факторами риска развития ревматоидного васкулита. У пациентов с изолированным поражением кожи, проявляющимся небольшими инфарктами околоногтевого ложа, возможна терапия стандартными БПВП, однако в более тяжелых случаях, особенно при наличии поражения периферической нервной системы, почек и других органов, пациентам с ревматоидным васкулитом показана терапия высокими дозами глюкокортикостероидов и циклофосфамидом. Возможно также назначение ритуксимаба, учитывая положительный опыт его применения при АНЦА-ассоциированных и криоглобулинемическом васкулитах. По данным французского регистра AIR, лечение ритуксимабом позволило достичь полной ремиссии ревматоидного васкулита у 71% из 17 пациентов через 6 мес и у 82% через 12 мес [41]. Описаны также случаи успешного применения абатацепта и тоцилизумаба при этом состоянии 43.
С.В. Моисеев. Яркие системные проявления (лихорадка, кожная сыпь, миалгии и др.) в сочетании с серонегативным артритом наблюдаются при болезни Стилла взрослых, которая в Международной классификации болезней Х пересмотра отнесена к «другим ревматоидным артритам». В чем сходство и отличия между этим заболеванием и «классическим» РА?
П.И. Новиков. Основные клинические проявления болезни Стилла взрослых включают в себя высокую лихорадку (60-100% больных), артралгии и артриты с поражением мелких и крупных суставов (70-100%) и преходящие розовые макулопапулярные высыпания на проксимальных частях конечностей и туловище, возникающие на высоте лихорадки (60-80%) [45,46]. Реже встречаются миалгии, периферическая лимфаденопатия, увеличение печени и селезенки, плеврит, перикардит, снижение массы тела, боль в животе. Появлению первых симптомов может предшествовать боль в горле. В анализах крови определяются повышение СОЭ и концентрации СРБ, нейтрофильный лейкоцитоз, а также анемия и тромбоцитоз, повышение активности аминотрансфераз, однако РФ, АЦЦП и другие ауто антитела отсутствуют. Классификационные критерии болезни Стилла, предложенные М. Yamaguchi и соавт. еще в 1992 г., приведены в табл. 2 [47]. В части случаев болезнь Стилла взрослых заканчивается выздоровлением или, наоборот, характеризуется рецидивирующим течением, однако у 40% пациентов наблюдается персистирующий полиартрит, в том числе эрозивный, который клинически трудно дифференцировать от РА. Важную роль в патогенезе болезни Стилла играет аутовоспаление, пусковым механизмом которого считают образование инфламмасомы, в состав которой входят криопирин или другие родственные белки, вспомогательный белок ASC и прокаспаза-1, превращающаяся в активную каспазу-1. Последняя вызывает активацию провоспалительных цитокинов ИЛ-1b и ИЛ-18, индуцирующих выделение других цитокинов, в том числе ИЛ-6, ИЛ-8 и фактора некроза опухоли (ФНО)-α. В отличие от наследственных аутовоспалительных заболеваний, таких как криопирин-ассоциированный периодический синдром, у пациентов с болезнью Стилла не обнаружены какие-либо специфические мутации генов. Бóльшая длительность обострений и возможность деструктивных изменений суставов также сближают болезнь Стилла взрослых с аутоиммунными заболеваниями, прежде всего РА [45]. Основа лечения болезни Стилла взрослых – глюкокортикостероиды, которые обычно сочетают со стандартными БПВП, оказывающими стероидосберегающее действие [48]. При неэф фективности глюкокортикостероидов или развитии стероидозависимости могут быть использованы ГИБП, в частности ингибиторы рецепторов ИЛ-6 [49]. Эффективность нового препарата этой группы – сарилумаба в лечении болезни Стилла взрослых иллюстрирует следующее наблюдение.
| Большие критерии | Малые критерии | Критерии исключения |
|---|---|---|
| Примечание: необходимо наличие по крайней мере 5 критериев, в том числе по крайней мере 2 больших | ||
| Лихорадка (39°С и более) ≥1 недели Артралгии или артрит ≥2 недель Типичная сыпь Лейкоцитоз ≥10000 в мм 3 и ≥80% полиморфноядерных лейкоцитов | Боль в горле Периферическая лимфаденопатия Увеличение печени или селезенки Повышение активности аминотрансфераз Отсутствие антинуклеарных антител и ревматоидного фактора | Инфекции Злокачественные опухоли (в основном лимфома) Другие ревматические заболевания, в частности системные васкулиты |
Н.Е. Никуленкова. Пациент П., 27 лет. В мае 2016 года после укуса пчелы появились лихорадка до 39оС, боли в горле, боли в суставах кистей, локтевых и голеностопных суставах, миалгии, увеличение селезенки. При обследовании во Владимирской областной клинической больнице выявлены нейтрофильный лейкоцитоз (16 × 109/л), увеличение СОЭ (42 мм/ч) и содержания СРБ (76 мг/л). Активность аминотрансфераз была в пределах нормы. Антитела к ДНК, антинуклеарный фактор, антитела к цитоплазме нейтрофилов, РФ и АЦЦП не обнаружены. Диагно стирован серонегативный ревматоидный артрит с системными проявлениями (болезнь Стилла). На фоне терапии преднизолоном в стартовой дозе 60 мг/сут состояние быстро нормализовалось.
В октябре 2017 года через 5 мес после отмены глюкокортикостероидов развился рецидив заболевания, проявлявшийся лихорадкой, полиартритом, макулопапулезной сыпью, миалгиями, болями в горле. При обследовании обращали на себя внимание выраженный лейкоцитоз (34 × 109/л) со сдвигом лейкоцитарной формулы влево, увеличение СОЭ и содержания СРБ. При трепанобиопсии костного мозга данных за гематологическое заболевание нет. Аутоантитела не обнаружены. Возобновлена терапия метилпреднизолоном в дозе 24 мг/сут, назначен метотрексат в дозе 10 мг/нед, который вскоре пришлось отменить из-за развития пневмонии. В течение нескольких месяцев состояние оставалось удовлетворительным, однако с апреля 2018 год вновь ухудшение состояния, в связи с чем проводилась терапия метилпреднизолоном в дозе 24 мг/сут и метотрексатом в дозе 25 мг/нед. Неоднократные попытки снижения доз иммуносупрессивных препаратов сопровождались возобновлением лихорадки, кожных высыпаний, полиартрита, повышением СОЭ и уровня СРБ, в связи с чем в августе 2019 года начато лечение сарилумабом в дозе 200 мг подкожно каждые 2 недели, которое привело к быстрому улучшению состояния. В течение 4 мес состояние удовлетворительное, лихорадки нет, боли в суставах не беспокоят, СОЭ и концентрация СРБ нормализовались. Доза метилпреднизолона снижена до 4 мг/сут, а метотрексата – до 10 мг/нед.
В представленном наблюдении диагноз болезни Стилла не вызывал сомнения, учитывая наличие практически всех больших и малых классификационных критериев, включая серонегативный полиартрит, и отсутствие других ревматических и гематологических заболеваний или инфекций. Хотя первоначально лечение глюкокортикостероидами было эффективным и позволяло достичь достаточно длительных ремиссий, тем не менее, в последующем на протяжении примерно одного года наблюдалось непрерывно рецидивирующее течение заболевания несмотря на постоянную терапию глюкокортикостероидами и метотрексатом в терапевтической дозе. Применение сарилумаба быстро привело к улучшению состояния пациента и нормализации лабораторных показателей воспаления и позволило снизить дозы иммуносупрессивных препаратов. Выбор сарилумаба для лечения пациента определялся установленной ролью ИЛ-6 в развитии воспалительного ответа при ревматических заболеваниях. ИЛ-6 вызывает продукцию печенью различных острофазных белков, которые усиливают иммунный ответ путем выделения провоспалительных цитокинов, активации комплемента и стимуляции хемотаксиса нейтрофилов [50]. Персисти рование воспаления, сопровождающегося увеличением секреции SAA, создавало угрозу развития АА-амилоидоза. Кроме того, ИЛ-6 вызывает лихорадку и секрецию гепцидина, участвующего в регуляции обмена железа. Повышенную продукцию этого белка считают причиной развития анемии при хронических заболеваниях.
П.И. Новиков. Сарилумаб – это человеческое IgG1 моноклональное антитело, которое взаимодействует с растворимыми и мембранными рецепторами ИЛ-6 [51]. Эффективность и благоприятный профиль безопасности сарилумаба в комбинации со стандартными БПВП или в виде монотерапии подтверждены в двойных слепых, рандомизированных, плацебо-контролируемых исследованиях MOBILITY, TARGET и MONARCH у пациентов с активным РА, не ответивших на стандартные БПВП и/или ингибиторы ФНО-α [5254]. В этих исследованиях применение сарилумаба по сравнению с плацебо привело к уменьшению симптомов, улучшению физической функции и замедлению прогрессирования структурных изменений суставов у больных РА высокой или умеренной степени активности. В исследовании MOBILITY лечение сарилумабом вызывало значительное снижение уровней биомаркеров тканевой деструкции, деградации хряща и синовиального воспаления (p С.В. Моисеев. Системные, или внесуставные проявления (ревматоидные узелки, интерстициальное заболевание легких, поражение почек, ревматоидный васкулит и др.) часто встречаются у больных РА, могут быть причиной ухудшения функциональной активности и инвалидизации, а иногда и смерти пациентов и, соответственно, должны учитываться при выборе тактики лечения. От системных проявлений РА следует отличать ассоциированные заболевания (сердечно-сосудистые осложнения на фоне ускоренного прогрессирования атеросклероза, венозные тромбоэмболические осложнения, анемия, психические расстройства), в основе которых лежит персистирующее воспаление, и осложнения медикаментозной терапии, например, интерстициальное поражение легких, вызванное метотрексатом, или различные варианты лекарственной нефропатии.