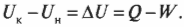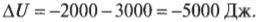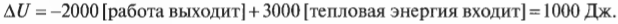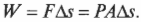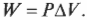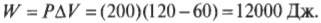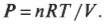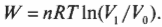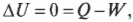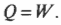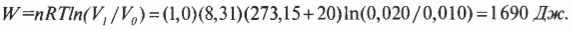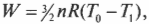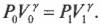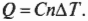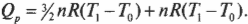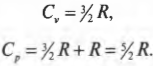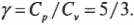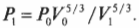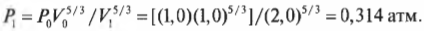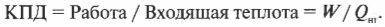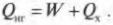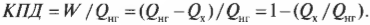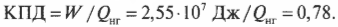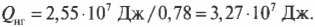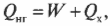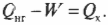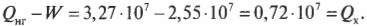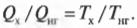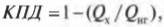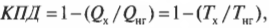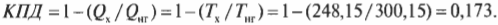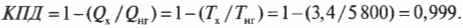что такое тепловая энергия кратко
Технология. 6 класс
Тепловая энергия
Необходимо запомнить
Тепловая энергия является одним из главных видов энергии, необходимых в жизни и деятельности людей.
Тепловая энергия – это энергия, которая связана с поступательным и колебательным движением молекул веществ. Скорость движения молекул определяет величину температуры того или иного тела.
Тепловая энергия может выделяться в результате механического воздействия (трения), химической реакции горения или ядерной реакции деления или слияния ядер атомов.
Виды энергии
Тепловая энергия солнца
Тепловую энергию солнца можно применять для нагрева воды, обогрева и охлаждения помещений.
В 1897 году Франк Шуман, американский изобретатель, инженер и пионер по использованию солнечной энергии, построил небольшой демонстрационный солнечный двигатель, принцип работы которого заключался в том, что солнечный свет отражался на квадратные контейнеры, заполненные эфиром, температура кипения которого меньше, чем воды. Внутри контейнеров были черные трубы, которые приводили в движение паровой двигатель. В 1908 году Шуман основал компанию Sun Power Company, которая должна была строить большие установки на солнечной энергии. Затем Шуман построил полномасштабный паровой двигатель, который работал на воде под низким давлением. Это дало ему возможность 1912 года запатентовать целую систему с солнечным двигателем.
Между 1912 и 1913 годами Шуман построил первую в мире геотермальную электростанцию в городе Маади, Египет. Двигатель шумановской электростанции перекачивал более 22 000 литров воды за минуту с реки Нил на близлежащие хлопковые поля.
НАШИ ПАРТНЁРЫ
© Государственная образовательная платформа «Российская электронная школа»
тепловая энергия
тепловая энергия: Энергетический ресурс, при потреблении которого изменяются термодинамические параметры теплоносителей (температура, давление).
[Федеральный закон от 27 июля 2010 г. № title=»О теплоснабжении» «О теплоснабжении» [2], статья 2, определение 1]
3.3 тепловая энергия: Энергия, равная сумме выраженного в единицах энергии количества теплоты, переданного потребителю, и энергии, затраченной на подогрев разбираемого потребителем нагретого теплоносителя (тепловую энергию рассчитывают по уравнениям термодинамики с использованием значений массового расхода теплоносителя и его энтальпий).
Смотри также родственные термины:
3.1 тепловая энергия теплоносителя: Энергия теплоносителя, представляющая собой его энтальпию, связанную с температурой, давлением и массой теплоносителя.
Полезное
Смотреть что такое «тепловая энергия» в других словарях:
тепловая энергия — Физическая мера количества энергии, поглощаемой или испускаемой молекулярной структурой на единицу массы. [http://www.oceanographers.ru/index.php?option=com glossary&Itemid=238] Тематики океанология EN heat energy … Справочник технического переводчика
Тепловая энергия — Тепловая энергия форма энергии, связанная с движением атомов, молекул или других частиц, из которых состоит тело. Тепловая энергия неточный термин. Теплота, как и работа является не ви … Википедия
Тепловая энергия — 1) тепловая энергия энергетический ресурс, при потреблении которого изменяются термодинамические параметры теплоносителей (температура, давление);. Источник: Федеральный закон от 27.07.2010 N 190 ФЗ (ред. от 25.06.2012) О теплоснабжении … Официальная терминология
тепловая энергия — šiluminė energija statusas T sritis fizika atitikmenys: angl. heat energy; thermal energy vok. thermische Energie, f; Wärmeenergie, f rus. тепловая энергия, f pranc. énergie calorifique, f; énergie thermique, f … Fizikos terminų žodynas
тепловая энергия — šiluminė energija statusas T sritis Energetika apibrėžtis Atomų ir molekulių betvarkio judėjimo energija. Šį judėjimą apibūdina medžiagos temperatūra. atitikmenys: angl. thermal energy vok. Wärmeenergie, f rus. тепловая энергия, f pranc. énergie… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Тепловая энергия теплоносителя — Тепловая энергия теплоносителя: энергия теплоносителя, представляющая собой его энтальпию, связанную с температурой, давлением и массой теплоносителя. Источник: ГОСУДАРСТВЕННАЯ СИСТЕМА ОБЕСПЕЧЕНИЯ ЕДИНСТВА ИЗМЕРЕНИЙ. МЕТРОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ … Официальная терминология
Тепловая энергия, полученная абонентом — Тепловая энергия, полученная абонентом: разность тепловых энергий теплоносителя: тепловой энергии теплоносителя, поступившей к абоненту, и тепловой энергии теплоносителя, возвращенной абонентом. Источник: ГОСУДАРСТВЕННАЯ СИСТЕМА ОБЕСПЕЧЕНИЯ… … Официальная терминология
тепловая энергия океана — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN ocean thermal energy … Справочник технического переводчика
тепловая энергия, передаваемая пару при промежуточном перегреве — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN resuperheating energy … Справочник технического переводчика
Глава 15. Тепловая энергия и работа: начала термодинамики
Каждому, кому когда-либо приходилось работать летом на открытом воздухе, хорошо известны понятия “тепло” и “работа”, связь между которыми изучает термодинамика. В данной главе, наконец-то, встречаются эти два незабвенных понятия, о которых подробно рассказывается в главе 8 (о работе) и в главе 13 (о тепле, теплоте и тепловой энергии). В термодинамике имеется три закона, а точнее начала, которые также важны для термодинамики, как и законы Ньютона для механики. Кроме того, уж в одном отношении они даже превосходят законы Ньютона, а именно в том, что в термодинамике имеется еще и нулевой закон, который чаще называют нулевым началом термодинамики. В этой главе рассказывается о термодинамическом равновесии (нулевое начало), сохранении энергии (первое начало), о тепловых потоках (второе начало) и недостижимости абсолютного нуля (третье начало). Итак, самое время обратиться к термодинамике.
Стремимся к тепловому равновесию: нулевое начало термодинамики
Основные законы термодинамики начинаются с нулевого начала. Возможно, эта нумерация покажется странной, ведь мало какой набор вещей из повседневной жизни начинается подобным образом (“Будь осторожен на нулевой ступеньке…”), но, знаете ли, физикам нравятся их традиции. Так вот, нулевое начало термодинамики гласит, что два тела находятся в тепловом равновесии, если они могут передавать друг другу теплоту, но не делают этого. (В русскоязычной научной литературе нулевое начало термодинамики называют также общим началом термодинамики. — Примеч. ред.)
Например, если у вас и у воды в плавательном бассейне, в котором вы находитесь, одна и та же температура, то никакое тепло от вас к воде или от воды к вам не передается (хотя такая передача возможна). Ваше тело и бассейн находятся в тепловом равновесии. Однако, если вы прыгнете в бассейн зимой, проломив при этом его ледяную корку, то первое время вряд ли будете в тепловом равновесии с его водой. Впрочем, вы и не захотите этого. (Не пытайтесь проделать этот физический опыт дома!)
Чтобы обнаружить тепловое равновесие (особенно в замерзших бассейнах, куда вы собираетесь прыгнуть), надо использовать термометр. Измерьте с его помощью температуру воды в бассейне, а затем — свою температуру. Если обе температуры совпадают (другими словами, наблюдается тепловое равновесие: ваше — с термометром, а термометра — с водой в бассейне), то в таком случае вы находитесь в тепловом равновесии с водой бассейна.
Использование термометра показывает: два тела, находящиеся в тепловом равновесии с третьим, также находятся в тепловом равновесии друг с другом; вот вам еще одна формулировка нулевого начала.
Кроме всего прочего, нулевое начало содержит идею, что температура — это индикатор теплового равновесия. То, что два тела, упомянутые в нулевом законе, находятся в тепловом равновесии с третьим, дает все нужное дая задания температурной шкалы, например шкалы Кельвина. Ну а с физической точки зрения нулевой закон устанавливает точку отсчета, утверждая, что между двумя телами, имеющими одинаковую температуру, тепловой поток в целом отсутствует.
Сохраняем энергию: первое начало термодинамики
Первое начало термодинамики — это, попросту говоря, закон сохранения энергии. Он утверждает, что энергия никуда не исчезает. Когда системой поглощается или высвобождается тепловая энергия \( Q \) , а сама система выполняет над окружающими телами работу \( W \) (или, наоборот, окружающие тела выполняют работу над ней), то внутренняя энергия системы, имевшая начальное значение \( U_н \) , становится равной \( U_к \) следующим образом:
В главе 8 немало говорится о сохранении механической энергии. Там показано, что общая механическая энергия (сумма потенциальной и кинетической энергии) сохраняется. Чтобы утверждать такое, надо было работать с системами, где энергия не тратится на нагревание, — например, когда отсутствует трение. Теперь все изменилось. Тепловая энергия, наконец-то, учитывается нами (как вы, вероятно, поняли из рассуждений), и теперь общую энергию системы можно рассматривать с учетом передачи тепловой энергии, проделанной работы и внутренней энергии системы.
Польза первого начала термодинамики состоит в том, что оно связывает все три основные величины: тепловую энергию, работу и внутреннюю энергию. Зная две из них, всегда можно определить третью.
Применяем закон сохранения энергии
Величина передаваемой тепловой энергии \( Q \) является положительной или отрицательной, когда система, соответственно, поглощает или высвобождает тепловую энергию. Величина работы \( W \) является положительной или отрицательной, когда работа, соответственно, выполняется системой над окружающими телами или окружающими телами над системой.
Новички часто путаются, пытаясь определить, являются ли значения каждой из величин положительными или отрицательными. Чтобы не запутаться, при работе с первым началом термодинамики рекомендуется исходить из общей идеи сохранения энергии. Допустим, что мотор выполняет над окружающими телами работу в 2000 Дж, высвобождая при этом 3000 Дж тепловой энергии. Насколько меняется его внутренняя энергия? В данном случае известно, что мотор выполняет над окружающими телами работу в 2000 Дж, поэтому ясно, что его внутренняя энергия уменьшается на 2000 Дж. Кроме того, выполняя работу, он еще высвобождает 3000 Дж тепловой энергии, так что внутренняя энергия мотора уменьшается еще на 3000 Дж.
Значения работы и передаваемой тепловой энергии следует считать отрицательными. Тогда в предыдущем примере получим такое изменение внутренней энергии:
Внутренняя энергия системы уменьшается на 5000 Дж, что определенно имеет смысл, ведь система выполняет над окружающими телами работу в 2000 Дж и высвобождает 3000 Дж тепловой энергии. С другой стороны, а что если система, выполняя над окружающими телами работу в 2000 Дж, поглощает 3000 Дж их тепловой энергии? В таком случае получилось бы 2000 Дж входящей и 3000 Дж исходящей энергии. Теперь понятно, какими должны быть знаки:
В данном случае общее изменение внутренней энергии системы равно +1000 Дж. Отрицательное значение работа принимает, когда она выполняется над системой окружающими телами. Например, система поглощает 3000 Дж, в то время как окружающие тела выполняют над ней работу в 4000 Дж. Это значит, что внутренняя энергия системы увеличивается на 3000 Дж + 4000 Дж = 7000 Дж. А если нужно все просчитать, то воспользуйтесь следующей формулой:
а затем обратите внимание, что поскольку окружающие тела выполняют работу над системой, значение \( W \) считается отрицательным. Таким образом, получаем:
Изучаем изобарические, изохорические, изотермические и адиабатические процессы
В этой главе рассматриваются процессы, при анализе которых приходится работать с такими параметрами, как объем, давление, температура и энергия. Причем полученные результаты очень сильно зависят от того, как эти величины меняются. Например, если газ выполняет работу, сохраняя свой объем постоянным, то этот процесс будет отличаться от того, при котором остается постоянным не объем, а давление газа.
В термодинамике обычно рассматривают четыре стандартных режима, которые отличаются постоянством одного из вышеперечисленных параметров (давление, объем, температура и энергия).
Обратите внимание, что изменения в процессах, описанных в последующих разделах, называются квазистатическими, т.е. эти изменения проходят достаточно медленно, позволяя давлению и температуре оставаться одинаковыми в любом месте системы.
Постоянное давление: изобарический процесс
Процесс, в котором давление остается постоянным, называется изобарическим (“барический” означает “относящийся к давлению”). На рис. 15.1 показан цилиндр с поршнем, поднимаемым некоторым количеством газа, когда этот газ нагревается. Объем газа меняется, но утяжеленный поршень сохраняет давление постоянным.
Какую работу выполняет система при расширении газа? Работа равна произведению \( F \) на \( s \) , означающих, соответственно, силу и перемещение. Кроме того, сила равна произведению \( P \) на \( A \) , означающих, соответственно, давление и площадь. Это значит, что:
Но произведение площади \( A \) и перемещения \( s \) равно изменению объема \( \Delta\!V \) . Таким образом:
Изобарический процесс можно показать в виде графика (как на рис. 15.2), на котором видно, что объем меняется, в то время как давление остается постоянным. Так как \( W=P\Delta\!V \) , то работа — это площадь, ограниченная графиком.
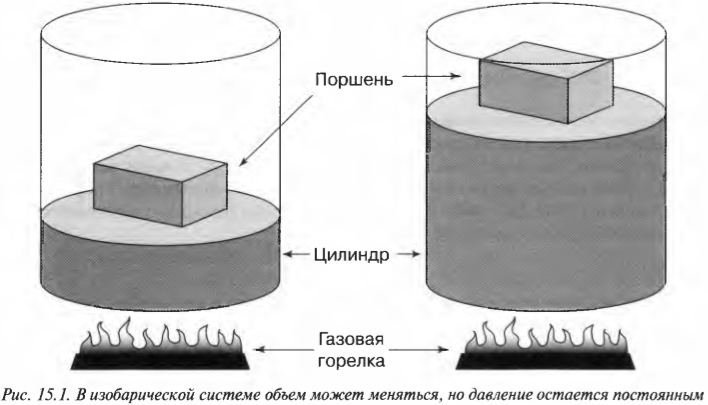
Допустим, имеется 60 м 3 идеального газа под давлением в 200 Па (см. главу 2), который нагревается до тех пор, пока он не расширится до объема в 120 м 3 ( \( PV= nRT \) , где \( n \) , \( R \) и \( Т \) означают, соответственно, количество молей, универсальную газовую постоянную (8,31) и температуру; см. главу 14). Какую работу выполняет газ? Все, что вам нужно, — это подставить в формулу численные значения:
Расширяясь при постоянном давлении, газ выполняет работу в 12000 Дж.
Постоянный объем: изохорический процесс
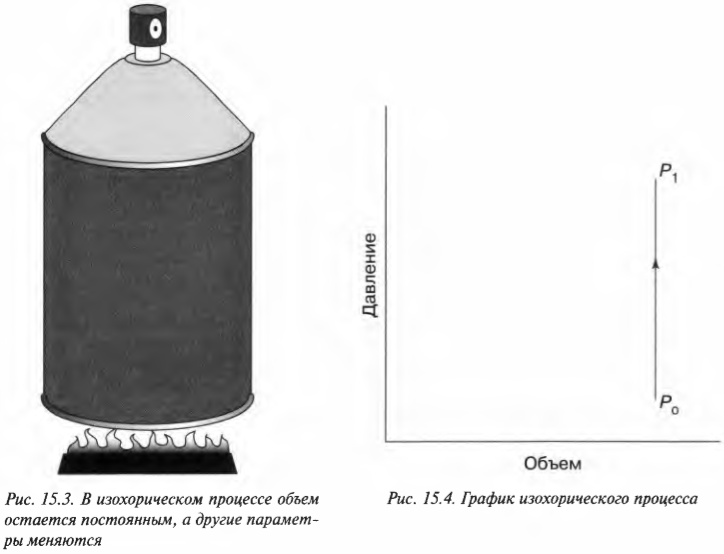
А что если давление в системе не постоянно? В конце концов, не так уж и часто попадаются устройства с утяжеленным поршнем, как на рис. 15.1. Чаще всего приходится иметь дело с простым замкнутым сосудом, как на рис. 15.3, где показан баллончик с дезодорантом, кем-то неосторожно брошенный в огонь. В этом случае объем остается постоянным, а такой процесс называется изохорическим. По мере того как газ внутри баллончика нагревается, его давление возрастает, но объем остается постоянным (если, конечно, баллончик не взорвется).
Какая работа выполняется с баллончиком распылителя? Посмотрите на график (рис. 15.4). В данном случае объем постоянный, поэтому \( Fs \) (произведение силы и перемещения) равно нулю. Никакая работа не выполняется — площадь под графиком равна нулю.
Постоянная температура: изотермический процесс
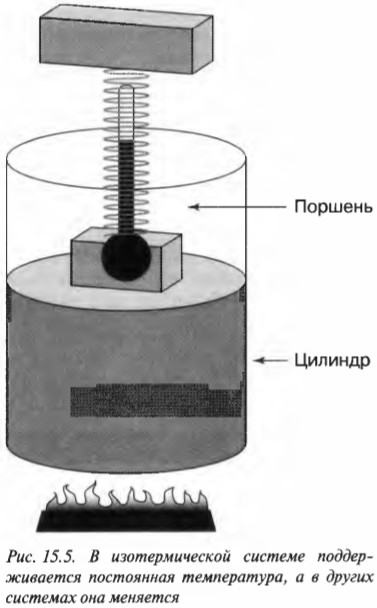
В изотермическом процессе температура остается постоянной, в то время как другие величины меняются. Посмотрите, какой замечательный аппарат показан на рис. 15.5. Этот аппарат специально предназначен для того, чтобы сохранять температуру газа постоянной, причем даже при подъеме поршня. При добавлении к системе (или отводе от системы) тепловой энергии поршень медленно поднимается (или медленно опускается) таким образом, чтобы произведение давления и объема сохранялось постоянным. Так как \( PV= nRT \) (см. главу 14), то температура также остается постоянной.
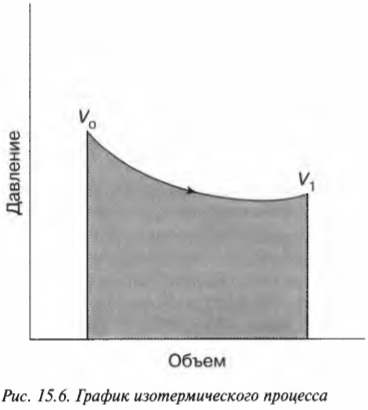
Эту формулу иллюстрирует график, показанный на рис. 15.6.
Выполненную работу “показывает” область, лежащая под графиком. Но какова же площадь этой области? Выполненная работа определяется следующей формулой, где \( ln \) — натуральный логарифм, \( R \) — газовая постоянная (8,31), \( V_1 \) и \( V_0 \) означают, соответственно, конечный и начальный объем:
Так как при изотермическом процессе температура остается постоянной, а внутренняя энергия идеального газа равна \( (3/2)nRT \) (см. главу 14), то эта энергия не меняется. Таким образом:
Работа, выполняемая газом, равна 1690 Дж. Изменение его внутренней энергии равно 0 Дж, как всегда при изотермическом процессе. А так как \( Q=W \) , то добавляемая к газу тепловая энергия также равна 1690 Дж.
Постоянная энергия: адиабатический процесс
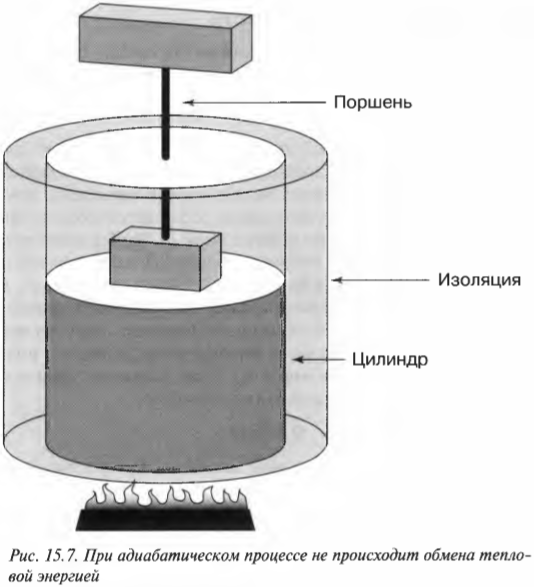
При адиабатическом процессе общая тепловая энергия системы остается постоянной. Посмотрите на рис. 15.7, где показан цилиндр, окруженный изоляционным материалом. Тепловая энергия из системы никуда не уходит, поэтому если происходит изменение, то оно является адиабатическим.
Вычисляя работу, выполняемую при адиабатическом процессе, вы можете сказать, что \( Q \) = 0, таким образом:
Так как внутренняя энергия \( U \) идеального газа равна \( (3/2)nRT \) (см. главу 14), то выполняется работа:
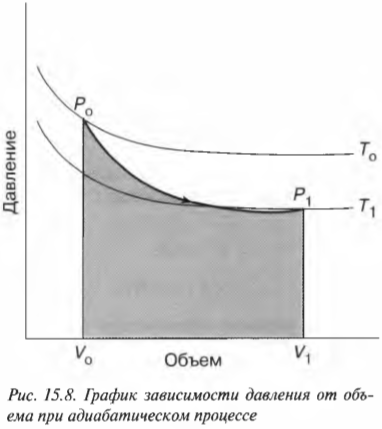
где \( T_0 \) и \( T_1 \) означают, соответственно, начальную и конечную температуру. Таким образом, если газ выполняет работу, то это происходит благодаря изменению температуры — при падении температуры газ выполняет работу над окружающими телами. На рис. 15.8 показан график зависимости давления от объема при адиабатическом процессе. Адиабатическая кривая, показанная на этом рисунке, так называемая адиабата, отличается от изотермических кривых, так называемых изотерм. Работа, выполненная, когда общая тепловая энергия системы постоянна, — это область под адиабатой (см. рис. 15.8).
Вычисляем удельную теплоемкость
Начальные значения давления и объема можно так связать с их конечными значениями по следующей формуле:
Как найти \( C \) ? Надо вычислить две разные величины: \( C_\mathrm
\) (при постоянном давлении) и \( C_\mathrm
Теперь вы имеете молярные удельные теплоемкости идеального газа. Нужное вам отношение \( \gamma \) равно отношению этих двух формул:
Связать давление и объем в любых двух точках адиабаты (см. предыдущий раздел об адиабатическом процессе) можно таким образом:
Например, если сначала 1 л газа находился под давлением 1 атм, а после адиабатического изменения (когда обмена тепловой энергией нет), объем газа стал 2 л, то каким должно быть новое давление \( P_1 \) ? Путем простой алгебраической операции деления на \( V_1^ <5>\) оставляем в левой части равенства только \( P_1 \) и получаем:
Подставив в эту формулу численные значения, получим:
Итак, новое давление должно быть равно 0,314 атмосферы.
Передаем тепловую энергию: второе начало термодинамики
Формально говоря, второе начало термодинамики гласит, что тепловая энергия естественно переходит из тела с более высокой температурой в тело с более низкой температурой, но не в обратном направлении.
Это начало, конечно же, появилось в результате простых наблюдений: приходилось ли вам когда-либо видеть, чтобы тело само становилось холоднее окружающих его тел, если только другое тело не проделало над ним определенной работы? Путем определенной работы можно заставить теплоту переходить из тела, когда естественно ожидать перехода тепловой энергии в тело (вспомните холодильники или кондиционеры), но такое явление само по себе не происходит.
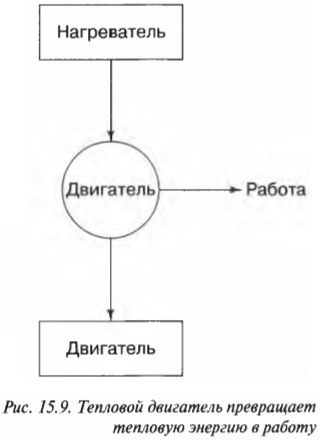
Заставим тепловую энергию работать: тепловые двигатели
Имеется много способов заставить тепловую энергию работать. Возможно, у вас имеется, например, паровая машина с котлом и поршнями или атомный реактор, производящий перегретый пар, который может вращать турбину. Двигатели, выполняющие работу благодаря источнику тепловой энергии, называются тепловыми. Как они это делают, можно увидеть на рис. 15.9. Тепловая энергия идет от нагревателя к двигателю, который выполняет работу, а неизрасходованная тепловая энергия отправляется в холодильник. Им может быть, например, окружающий воздух или наполненный водой радиатор. Если температура холодильника меньше температуры нагревателя, то тепловой двигатель может работать — хотя бы теоретически.
Оцениваем эффективность работы: КПД теплового двигателя
Тепловая энергия, подаваемая нагревателем, обозначается как \( Q_ <нг>\) , а отправляемая в холодильник (см. предыдущий раздел) — как \( Q_<\mathrm
Когда вся входящая тепловая энергия превращается в работу, КПД равен 1. Если никакая входящая тепловая энергия не превращается в работу, КПД равен 0. Часто КПД выражается в виде процентов, поэтому только что названные значения можно представить как 100% и 0%. Поскольку общая энергия сохраняется, то тепловая энергия, входящая в двигатель, должна быть равна сумме выполняемой работы и тепловой энергии, отправляемой в холодильник, то есть:
Это значит, что для записи КПД достаточно использовать \( Q_ <нг>\) и \( Q_<\mathrm
Допустим, что имеется тепловой двигатель с КПД, равным 78%. Этот двигатель производит работу величиной 2,55·10 7 Дж. Сколько тепловой энергии он использует, а сколько выбрасывает? Известно, что \( W \) = 2,55·10 7 Дж и
Количество входящей тепловой энергии равно 3,27·10 7 Дж. А сколько тепловой энергии \( Q_<\mathrm
Подставив в эту формулу численные значения, получим:
Количество тепловой энергии, отправляемое в холодильник, равно 0,72·10 7 Дж.
Как сказал Карно: нельзя все тепло превратить в работу
Зная работу и КПД теплового двигателя, можно вычислить количество входящей и исходящей тепловой энергии (тут нам, конечно, поможет закон сохранения энергии, связывающий друг с другом работу, входящую и исходящую тепловую энергию; см. главу 8). А как насчет создания тепловых двигателей со 100%-ным КПД? С точки зрения производительности было бы прекрасно превращать в работу всю тепловую энергию, какая поступает в тепловой двигатель, но это невозможно. Кроме того, в реально работающих тепловых двигателях неизбежны определенные потери, например, из-за трения поршней в паровом двигателе. В XIX веке эту проблему изучал один инженер, которого звали Сади Карно, и он пришел к выводу: в сущности, лучшее, что можно сделать, — это попытаться изобрести двигатель, не имеющий таких потерь.
А если в двигателе нет потерь, то система будет возвращаться в то же состояние, что и перед началом процесса. Такой процесс называется обратимым. Например, если тепловой двигатель тратит энергию на преодоление трения, то обратимым процесс назвать нельзя, так как он не заканчивается в том же состоянии, в каком был сначала. При каких условиях работы тепловой двигатель будет иметь самый высокий КПД? Когда работа двигателя обратима (т.е. в системе нет потерь). Сегодня физики называют это принципом Карно. Итак, принцип Карно гласит, что ни у одного необратимого двигателя не будет такого же высокого КПД, как у обратимого, а все обратимые двигатели, работающие в промежутке между одинаковыми максимальными и одинаковыми минимальными температурами, имеют один и тот же КПД.
Построение двигателя Карно
А так как КПД теплового двигателя вычисляется по следующей формуле:
то получается такая формула для вычисления КПД двигателя Карно:
где температура выражается в кельвинах.
В этой формуле показан максимально возможный КПД теплового двигателя. И лучшего результата достичь нельзя. А как гласит третье начало термодинамики (в последнем разделе этой главы), абсолютного нуля достичь нельзя, т.е. \( T_ <х>\) никогда не будет равна нулю, следовательно, невозможно получить тепловой двигатель со 100%-ным КПД.
Используем формулу Карно
Итак, КПД такой машины Карно равен всего 17,3%. Результат, скажем, не очень. А теперь представим, что в качестве нагревателя используется поверхность Солнца (примерно 5800 К), а в качестве холодильника — межзвездное пространство (примерно 3,4 К), совсем как в научно-фантастических рассказах. Тогда совсем другое дело:
Итак, в таких научно-фантастических условиях для машины Карно можно получить КПД, равный 99,9% и близкий к теоретически максимальному значению.
Охлаждаемся: третье (и абсолютно последнее) начало термодинамики
Третье начало термодинамики достаточно просто формулируется: нельзя достичь абсолютного нуля с помощью любого процесса, состоящего из конечного числа этапов, к нему можно лишь бесконечно приближаться. Иначе говоря, никогда нельзя достичь абсолютного нуля. Каждое действие по понижению температуры физического тела до абсолютного нуля может немного приблизить к цели, но достигнуть ее нельзя, если не выполнить бесконечного числа действий, что невозможно.
Странные явления вблизи абсолютного нуля
Хотя до абсолютного нуля нельзя добраться с помощью какого-либо известного конечного процесса, но к нему можно приблизиться. Причем, имея очень дорогое оборудование, вблизи абсолютного нуля можно столкнуться с множеством странных физических явлений и фактов. Один мой приятель изучает поведение жидкого гелия при очень низких температурах. Например, гелий становится таким эксцентричным, что может самостоятельно выбраться из любого сосуда, в котором он находится. За открытие и исследования этого явления сверхтекучести гелия и некоторые другие наблюдения кое-кто получил Нобелевскую премию. Везет же людям!
(Сверхтекучесть жидкого гелия-4 была открыта в 1938 году П. Л. Капицей, за что он был удостоен Нобелевской премии по физике за 1978 год. Теория сверхтекучего гелия-Н была разработана Л. Д. Ландау, за что он был удостоен Нобелевской премии по физике за 1962 год. — Примеч. ред.)