что такое старческое сердце
Что такое старческое сердце
В пожилом и старческом возрасте сопутствующие заболевания прежде всего касаются сердечно-сосудистой системы. Влияние друг на друга изменений, связанных с естественными процессами старения, образом жизни и хроническими заболеваниями, затрудняет идентификацию собственно возрастных изменений. С возрастом в тканях сердца меняется концентрация и активность факторов роста, таких как ангиотензин II, эндотелии, трансформирующий фактор роста (TGF-B), фактор роста фибробластов (FGF) и инсулиноподобный фактор роста (IGF).
Эти факторы влияют как на функции клеток миокарда и сосудов, так и на межклеточный матрикс. Миоциты и проводящие пути постепенно замещаются жировой и фиброзной тканью, и, как следствие, возникает предрасположенность к аритмиям и формированию ригидного сердца. Изменение концентрации эластина, коллагена и кальция влечет за собой уплотнение клапанов и стенок крупных сосудов с потерей их эластичности. В результате стенки крупных артерий утолщаются, особенно их эндотелиальный слой. Для пожилых людей характерна угасающая реакция на катехоламины с ослаблением В-адренэргической стимуляции сосудистого русла и сердца, что ограничивает максимальную частоту сердечных сокращений.
Суммарным итогом этих эффектов становится увеличение с возрастом постнагрузки на сердце, проявляющееся небольшой систолической гипертензией в покое. У здоровых индивидуумов подобные сосудистые изменения в значительной степени компенсируются возрастными изменениями архитектоники и сократительной способности сердца, что позволяет сердцу при старении сохранять нормальный ударный объем, несмотря на уменьшение эластичности аорты.
Заболевания коронарных артерий повсеместно распространены среди пожилых людей и ограничивают способность коронарного кровотока к саморегуляции. Для пациентов с коронарной болезнью характерно стойкое поражение артерий сердца, что при повышенной активности миокарда может ускорить развитие несостоятельности сердца как насоса. Из-за снижения адаптационных потенциалов кардиоваскулярной системы повышенная нагрузка способна провоцировать ишемические нарушения скрытого или явного характера.
Многие эффекты, обусловленные старением сердца, функционально менее значимы по сравнению с эффектами вызванными старением сосудов. Повышающееся с возрастом сопротивление магистральных сосудов эластического типа нарушает работу желудочков, снижает желудочковую фракцию выброса и замедляет скорость аортального кровотока даже при отсутствии у пожилых людей сердечной недостаточности.
В результате уменьшается максимальная частота сердечных сокращений, минутный объем крови, фракция выброса и потребление кислорода, при этом конечно-систолический и конечно-диастолический объемы увеличиваются.
Пожилые травматологические пациенты реагируют на гиповолемию не так, как более молодые пострадавшие. Вместо увеличения частоты сердечных сокращений и сердечного выброса у них повышается системное сосудистое сопротивление, что может проявиться дезориентирующими врача показателями кровяного давления.
Наряду с этим снижение давления при исходной гипертензии может маскировать гиповолемию до тех пор, пока не будут исчерпаны все компенсаторные механизмы. Кажущееся нормальным кровяное давление у пожилых больных с травмой может фактически соответствовать глубокому шоку, что подтверждает лабораторная оценка перфузии (повышение уровня молочной кислоты и дефицит основного обмена) и ранний инвазивный мониторинг.
В серии наблюдений установлено, что более 50% больных перенесли скрытый кардиогенный шок и имели в дальнейшем неблагоприятные исходы. Наконец, у пациентов с заболеваниями сердечно-сосудистой системы отмечается повышенная частота посттравматических осложнений кардиогенного характера. Gallagher в ретроспективном исследовании с использованием модифицированной шкалы риска сердечных осложнений показал, что в отношении возникновения посттравматических сердечных осложнений у больных с высокой степенью риска прогностическая ценность положительного результата (PPV) составляет 76%.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
«Старческий» порок сердца: истина и мифы
Что скрывается за диагнозом «атеросклеротический стеноз устья аорты»? Каков механизм развития аортального стеноза? Есть ли разница в лечебной тактике в России и за рубежом? Рисунок 1 Многим терапевтам и кардиологам
Что скрывается за диагнозом «атеросклеротический стеноз устья аорты»?
Каков механизм развития аортального стеноза?
Есть ли разница в лечебной тактике в России и за рубежом?
 |
| Рисунок 1 |
Многим терапевтам и кардиологам хорошо известен такой нередко встречающийся клинический феномен: у пожилого человека без ревматического анамнеза при выслушивании сердца определяется грубый систолический шум над аортальными точками. Зачастую его практически никак не трактуют и в диагнозе не отражают. Но иногда в попытке объяснить подобную аускультативную картину врач все же выносит примерно такой вердикт: «атеросклеротический стеноз устья аорты». Но нельзя забывать, что диагноз — это формула для лечения, и от того, насколько правильно он будет сформулирован, во многом зависит дальнейшая тактика. Это касается любого диагноза, и данного — в частности. Именно поэтому следует серьезно разобраться не только и не столько в правомочности термина «атеросклеротический стеноз», сколько в том, что же в действительности скрывает за собой «неревматический» систолический шум на основании сердца.
В СССР традиционно рассматривались три основные причины приобретенного аортального стеноза: 1) ревматизм, 2) инфекционный эндокардит и 3) атеросклероз. Именно эта триада, и, как правило, именно в таком порядке перекочевывала из руководства в руководство, из одного учебника в другой до середины настоящего десятилетия, тогда как другим предпосылкам отводилось место в графе «и прочие». Большинство авторов после описания ревматического и «септического» эндокардитов в той или иной форме упоминают атеросклероз, который обычно в преклонном возрасте может привести к формированию кальцинированного стеноза аортального клапана [1].
Между тем за рубежом уже более 30 лет придерживаются иной точки зрения. Она последовательно рассматривается в англоязычных источниках, вышедших в свет в 60-е, 70-е и 80-е годы, и последнее десятилетие исключением не является. Согласно мнению западных исследователей, аортальный стеноз у взрослых может быть результатом: 1) кальцификации и дистрофических изменений нормального клапана, 2) кальцификации и фиброза врожденного двустворчатого аортального клапана или 3) ревматического поражения клапана, причем первая ситуация является наиболее частой причиной аортального стеноза [2].
Итак, налицо очевидная разница в подходах к этой проблеме в России и за рубежом. «Точкой пересечения» был и остается лишь ревматизм, тогда как отечественная и зарубежная школы «дополняют» его каждая двумя разными этиологическими формами: первая — инфекционным эндокардитом и атеросклерозом, вторая — идиопатическим кальцинозом и кальцификацией врожденного порока (чаще двустворчатого клапана). Но следует учитывать, что существуют две оговорки. Во-первых, изолированный кальциноз как трикуспидального, так и бикуспидального аортального клапана — по сути есть один и тот же процесс, наблюдающийся лишь в разных временных диапазонах. Во-вторых, инфекционный эндокардит работами современных авторов фактически исключен из списка существенных причин аортального стеноза. Таким образом, по большому счету остаются два состояния, определяющие диагностические, лечебные и методологические разночтения: атеросклероз и идиопатический кальциноз. Принципиальная разница между этими двумя патологическими состояниями станет понятна после более детального рассмотрения сенильного кальциноза устья аорты как самостоятельной нозологической формы.
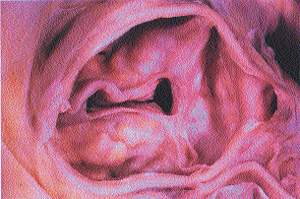
В 1904 году в журнале «Архив патологической анатомии» 28-летний немецкий врач Иоганн Георг Менкеберг описал два случая стеноза устья аорты со значительным обызвествлением клапанов [3]. Он предложил рассматривать изменения в створках как дегенеративные, как результат изнашивания тканей с последующим их «склерозом» и обызвествлением. Обнаружив, по-видимому, что-то подобное тому, что изображено на рис. 1, он изобразил в своей статье деформированный клапан, в котором на фоне жировой дегенерации расположено множество известковых депозитов (рис. 2). Его правота будет подтверждена спустя много лет, что найдет отражение в самом термине «дегенеративный кальцинированный аортальный стеноз». Но в начале века статья И. Г. Менкеберга существенного резонанса не вызвала. И лишь через полтора десятка лет она станет объектом внимания и ляжет в основу жарких дискуссий, ведущихся на протяжении долгого времени. Морфогенез порока также вызвал много споров.
 |
| Рисунок 2 |
С менкеберговской гипотезой конкурировали в основном две теории: атеросклеротического поражения и поствоспалительного кальцинирования.
В нашей стране основное значение приобрела атеросклеротическая гипотеза. Считается, что детальное изучение «атеросклероза аортального клапана» в динамике развития «атеросклеротического порока» было выполнено профессором А. В. Вальтером в конце 40-х годов. Он описывал интенсивную липоидную инфильтрацию фиброзного пласта клапана на уровне замыкательной линии и на дне синусов Вальсальвы, причем отложение липоидов он наблюдал также на синусовой поверхности створок в небольших утолщениях субэндотелиального слоя. Далее имела место петрификация липоматозных очагов. Известковые массы раскалываются, что исследователь объяснял подвижностью створок, а образовавшиеся трещины заполняются плазменными белками и новыми порциями липоидов, в которых снова откладывается кальций. Раскалывание петрификатов продолжается, а вслед за этим продолжается и кальцинирование клапана. Фиброзное кольцо становится ригидным, створки твердыми и малоподвижными. Развивается аортальный стеноз [4].
Думается, в 1948 году опубликования этих данных было достаточно для обоснования атеросклеротической гипотезы, хотя критического осмысления требует даже сама идея «раскалывания» петрифицированных масс: если бы оно имело место, вероятно, в значительной степени возросла бы частота микроэмболических осложнений. Сегодня же, когда знания об атерогенезе куда более обширны, представляется возможным выдвинуть минимум два контраргумента теории А. В. Вальтера.
Черту под этими рассуждениями можно подвести выдержкой из статьи об атеросклерозе профессора Вашингтонского университета Э. Бирмана: «С атеросклерозом не следует путать локальное кальцифицирующее поражение клапана аорты, когда с возрастом происходит постепенное накопление кальция на аортальной поверхности клапана» [8].
Поствоспалительная гипотеза, распространенная в основном на Западе, предлагала искать связь кальцинирования с перенесенным когда-то инфекционным эндокардитом, или, что еще более вероятно, латентным ревмокардитом. Так, одни исследователи указывают на наличие в кальциевых конгломератах микробных агентов [9]. Другие публикуют сообщение о результатах гистологического исследования 200 обызвествленных аортальных клапанов, в 196 из которых обнаружены признаки ревматического поражения [10]. Сейчас сложно дать объективную оценку таким данным, но, вероятно, это были секционные находки у людей не столь пожилых и без выраженных известковых отложений. Именно к таким выводам приходишь, изучая мнение современных патологов, утверждающих, что у старых пациентов массивность петрификации всегда маскирует признаки, быть может, когда-то перенесенного ревматического эндокардита.
Однако наметившийся в первой половине века подход привел к формированию двух бытующих теперь за рубежом взглядов. Один из них предполагает, что ревматический вальвулит, даже не оставив стойких гранулематозных повреждений, делает клапан более ранимым в будущем, в значительной степени повышая риск структурной дегенерации [11] и позволяя рассматривать сенильный аортальный стеноз действительно как «дегенеративный», тогда как имеет место поствоспалительная дистрофия, постревматическая дегенерация; при этом перенесенное воспаление как бы детерминирует соединительнотканную деструктуризацию створок в пожилом и старческом возрасте, оказываясь своего рода предиктором кальцинирования клапанного аппарата аорты. Согласно другому взгляду, старческий кальцинированный стеноз является не столько результатом инфекционного эндокардита, сколько сам по себе может вызываться персистирующим в аортальных створках инфекционным возбудителем [12], то есть речь вообще идет о совершенно самостоятельной нозологической форме.
О своеобразности разбираемой патологии свидетельствует также и то, что все чаще появляются публикации об обнаружении в обызвествленных створках аортального клапана различных клеток костной ткани и даже элементов красного костного мозга [13].
Напоминание хорошо известных признаков аортального стеноза врачебной аудитории в данном случае не случайно. Дело в том, что у пожилых и старых пациентов доктора зачастую склонны объяснять наличие тех или иных жалоб скорее ишемической болезнью или общими инволютивными процессами в организме, нежели сформировавшимся «старческим» пороком сердца. Поэтому — коротко об основных особенностях этого заболевания.
 |
| Рисунок 3 |
Аортальный стеноз — один из самых длительно компенсируемых пороков из-за гипертрофии миокарда, столь сильно выраженной, как можно встретить при других заболеваниях сердца (рис. 3). В связи с этим значительно возрастает конечное диастолическое давление в левом желудочке, его наполнение (особенно при физической нагрузке и в условиях тахикардии) затрудняется, что постепенно приводит к повышению давления заклинивания легочной артерии. Развивающаяся при этом одышка, таким образом, на первых порах оказывается следствием первичной диастолической дисфункции левого желудочка, а в период декомпенсации — и систолической дисфункции. С повышенным тонусом миокарда в диастолу связано и нарушение его оксигенации. В то время как увеличение массы левого желудочка усиливает потребность миокарда в кислороде, сдавленные коронарные артерии удовлетворить ее не могут. Отсюда столь типичные для этой категории больных стенокардические боли. При этом, хотя стенокардия возникает у 70% больных с аортальным стенозом, лишь у половины из них имеется коронарный атеросклероз [2]. Третья частая жалоба — обмороки — является следствием снижения сердечного выброса, развивающегося в результате, с одной стороны, уменьшения диастолического наполнения желудочка, с другой — возрастающего градиента давления на уровне аортального клапана [14]. Эквивалентами синкопального состояния могут служить головокружения.
Среди осложнений сенильного стеноза следует отметить эмболии крошащимися известковыми массами (чаще всего коронарных, почечных и церебральных артерий), плохо переносимые и прогностически неблагоприятные аритмии (связанные как с ишемической миокардиопатией, так и с увеличением и дисфункцией левого предсердия) и изредка развивающиеся желудочно-кишечные кровотечения, связанные с ангиодисплазией правых отделов толстой кишки. При этом риск инфекционного эндокардита кальцинированных клапанов снижается в сравнении с изолированными аортальными стенозами ревматической этиологии.
При осмотре редко можно обнаружить что-то специфическое для дегенеративного стеноза у пожилых больных. В отличие от молодых пациентов, имеющих нередко «медленный и малый» пульс, у них даже при тяжелом стенозе в силу снижения эластичности артерий пульс может оставаться нормальным. Пальпаторно длительный приподнимающийся верхушечный толчок определяется в V межреберье несколько кнаружи от среднеключичной линии; нередко может пальпироваться систолическое дрожание. При аускультации первый тон может не изменяться, но в силу функционально-гемодинамических изменений нередко наблюдается его
 |
| Рисунок 4 |
ослабление. При этом второй тон, как правило, меняется, что особенно отчетливо фиксируется при длительном наблюдении за пациентом: пока кальциноз клапана не привел к стенозу, второй тон усилен (при этом в точке Боткина вслед за первым тоном иногда выслушивается систолический тон изгнания), затем из-за уменьшения подвижности створок ослаблен. Для аортального стеноза характерен грубый веретенообразный систолический шум, максимально выслушивающийся у левого края грудины и проводящийся на сонные артерии. При сенильном поражении этот шум имеет некоторые патогенетические особенности (рис. 4). Как видно из схемы, ревматический кальцинированный порок создает при систолическом изгнании гемодинамический эффект «струи», рождающий одни аускультативные феномены, а изолированный кальцинированный стеноз — эффект «спрея» с несколько другими гемодинамикой и нюансами выслушиваемой картины [15]. Так, при выраженной петрификации возникает симптом Галлавардена: высокочастотные компоненты шума проводятся в подмышечную область, имитируя шум митральной регургитации.
В диагностике клиницисту помогут рутинные инструментальные методики: ЭКГ (признаки гипертрофии и нарушения кровоснабжения миокарда левого желудочка, аритмии), рентгенография (кальциноз аортального клапана, изменение конфигурации сердца, признаки застоя в легких) и, конечно, ЭхоКГ (характер изменений в створках клапана, точная оценка степени стеноза и гипертрофии миокарда, измерение показаний внутрисердечной гемодинамики, нарушение локальной сократимости, фракция выброса, градиент давления между аортой и левым желудочком).
Лабораторные показатели, как правило, малоспецифичны и отражают экстракардиальную патологию.
Прогноз при изолированном дегенеративном аортальном стенозе определяется степенью сужения отверстия аортального клапана (см. табл.), но в целом, как правило, благоприятен. Это определяется длительной компенсацией с бессимптомным течением и медленной прогрессией из-за отсутствия комиссуральных сращений, как при ревматическом пороке. При этом следует помнить, что при появлении симптомов летальность и риск осложнений резко возрастает, а 15-20% больных умирают внезапно.
В России изучения этой нозологии как таковой не проводилось, а значит, практикующий врач не ориентирован на соответствующий диагностический поиск. При этом довольно редкое установление диагноза «атеросклеротический стеноз устья аорты» из-за непонимания истинной природы порока приводит к тому, что больному чаще назначают диету и холестеролснижающие средства, нежели направляют на консультацию к кардиохирургу. Но подобное «патогенетическое лечение» приводит лишь к прогрессированию петрифицированного стеноза. Консервативная же симптоматическая тактика вообще у больных аортальным стенозом малоэффективна, а кальцинированным — тем более. Вазодилатирующая и инотропная терапия требует большой осторожности, а назначения нитратов и диуретиков следует избегать.
Скорость прогрессирования стеноза устья аорты
Другими словами, отказ от трактовки сенильного кальцинированного стеноза устья аорты как «атеросклеротического» подведет российских кардиологов и терапевтов к формированию совершенно определенного взгляда на лечебные перспективы у таких пациентов. Единственно эффективным во всем мире признано хирургическое лечение либо путем протезирования аортального клапана (метод с наилучшими показателями отдаленной выживаемости), либо путем баллонной вальвулопластики. Второй метод имеет целый ряд существенных недостатков: большой риск осложнений и вероятность повторной обструкции, высокая интраоперационная летальность (>6%) и смертность в течение года (25%). Между тем именно этот вариант вмешательства остается основным у пожилых пациентов за рубежом; и вообще дегенеративный кальциноз стал основной причиной хирургического лечения при изолированном аортальном стенозе (51% случаев чрескожной баллонной вальвулопластики, тогда как кальциноз бикуспидального клапана и постревматическое поражение — соответственно 40 и 8% случаев). Причем возраст прооперированных больных нередко превышает 80 лет [16].
При написании последнего параграфа автор, разумеется, отдавал себе отчет в том, что проецировать зарубежную ситуацию на российскую действительность невозможно. Нередкая соматическая «запущенность» наших пациентов и стоимость кардиохирургической операции в ближайшее время не позволяют надеяться на какие-то кардинальные изменения в этом вопросе. Настоящая статья лишь подняла геронтологическую проблему, к обсуждению которой в нашей стране не обращались уже многие годы. И дело не столько в том, что 1999 год объявлен «годом пожилого человека» — отечественные медики должны располагать современной информацией и отказаться от устаревших формулировок и несуществующих диагнозов.
Хроническая сердечная недостаточность у лиц старшего возраста
Рассмотрены наиболее частые причины развития хронической сердечной недостаточности (ХСН) в старших возрастных группах, подходы к диагностике и особенности лечения ХСН у пожилых пациентов.
The most frequent reasons of chronic heart insufficiency (CHI) in groups of old age were considered, as well as the approaches to the diagnosis and treatment of chronic heart insufficiency especially in elderly patients.
Рост численности населения старших возрастных групп и существенное повышение распространенности хронической сердечной недостаточности (ХСН) при старении привели к тому, что большую часть пациентов с этой патологией в настоящее время составляют лица пожилого и старческого возраста. По образному выражению Michael W. Rich, ХСН в XXI веке стала «кардиогериатрическим синдромом» [1].
Считается, что физиологические изменения организма при старении могут предрасполагать к развитию ХСН [1, 2]. Так, из-за прогрессирующего снижения количества кардиомиоцитов и изменения соединительной ткани сердечной мышцы (в том числе накопления амилоида) с возрастом независимо от исходного уровня артериального давления (АД) происходит повышение жесткости миокарда и возникновение его умеренной физиологической гипертрофии с формированием диастолической дисфункции желудочков. А структурные изменения клапанов (фиброз и кальцификация) и нарушения возбудимости и проводимости, возникающие при уменьшении количества функционирующих клеток в синусовом узле и проводящей системе сердца, могут вызывать снижение систолической функции миокарда [3, 4]. Особое значение в развитии ХСН при старении имеют нарушения выделительной функции почек, которые приводят к снижению экскреции натрия и воды и развитию объемной перегрузки сосудистого русла [5, 6]. Почечная дисфункция имеется у 20% пожилых, в возрасте старше 80 лет клиренс креатинина может уменьшаться до 50 мл/мин и более даже без сопутствующей патологии [7].
Наиболее частыми причинами развития ХСН в старших возрастных группах являются ишемическая болезнь сердца (ИБС), артериальная гипертензия (АГ), их сочетание и сахарный диабет (СД) 2-го типа [8–11].
Хотя симптомы ХСН и данные объективного обследования у лиц старшего возраста часто изменены из-за возрастных изменений и коморбидной патологии, диагностические критерии заболевания для них не меняются [4, 12]. Однако особое значение для лечения таких больных приобретает выявление сопутствующих состояний и заболеваний, так как повышенная истощаемость и быстрый срыв компенсаторных механизмов организма при старении могут вызывать функциональную недостаточность не только той системы, которая поражена, но и других, в том числе способность влиять на клинику и течение сердечной недостаточности [1, 4]. За рубежом при сборе анамнеза жизни пациента особое внимание рекомендуется уделять таким сведениям, как условия проживания, данные об ухаживающих за больным лицах, информации о реакции госпитализируемого лица на чрезвычайные ситуации, и использовать специализированные опросники для выявления когнитивных нарушений [2]. Классические симптомы застойной систолической ХСН, как правило, появляются у пожилых в позднем периоде болезни. Резкое ограничение физической нагрузки и изменение образа жизни при старении приводит к уменьшению жалоб на одышку, учащенное сердцебиение [12]. Преобладают неспецифические жалобы (генерализованная слабость, усталость), характерные также и для симптомов физиологического старения [4]. В старческом возрасте встречаются атипичные признаки ХСН: появление когнитивных и эмоциональных нарушений (эпизоды бреда, раздражительность), изменения сна (как сонливость, так и бессонница), снижение аппетита [1, 13]. Наиболее чувствительным физикальным признаком сердечной недостаточности у пожилых является крепитация в базальных отделах, а самым специфичным объективным признаком — повышение венозного давления в яремной вене [12]. С учетом низкой специфичности жалоб и результатов клинического осмотра особое значение для лечения пожилых пациентов приобретают данные дополнительных исследований. Исследование натрийуретических пептидов для подтверждения и дифференциального диагноза ХСН (например, с первично легочными симптомами), определения прогноза и контроля эффективности лечения остается обязательным у лиц старшего возраста, однако считается, что его информативность (особенно у женщин) с возрастом уменьшается [14]. Из-за высокой распространенности гипотиреоза у пожилых и его влияния на течение ХСН, целесообразным считается определение уровня тиреотропного гормона [9, 11]. Анализ результатов инструментальных методов диагностики ХСН часто затруднен имеющимися возрастными изменениями и сопутствующей патологией. Необходимость дополнительных инвазивных методов диагностики для подтверждения коронарной патологии или клапанных нарушений у лиц старшей возрастной группы с сердечной недостаточностью определяется не паспортным возрастом, а индивидуальным состоянием, ожидаемой продолжительностью активной жизни, выгодами и рисками, связанными с вмешательством [9, 11].
Целями лечения ХСН у пациентов старших возрастных групп остаются контроль факторов риска, уменьшение симптомов, улучшение качества жизни, сокращение числа госпитализаций и, по возможности, улучшение прогноза [8, 9, 11]. Необходимым условием профилактики прогрессирования и декомпенсации сердечной недостаточности является эффективная терапия заболеваний, являющихся этиологическими факторами развития ХСН. Доказано, что адекватное медикаментозное лечение АГ и ИБС столь же эффективно для снижения симптомов и улучшения прогноза у пожилых, как и у более молодых пациентов [9, 15]. При терапии фибрилляции предсердий, являющейся предиктором высокого риска смертности у больных с ХСН, у больных старшего возраста предпочтителен контроль частоты сердечных сокращений (ЧСС) [16, 17]. Особое значение при этом приобретает антикоагулянтная терапия, так как риск развития тромбоэмболических осложнений у пожилых пациентов более значителен [18].
Хотя данные наблюдения 5314 лиц мужского пола в возрасте 65–92 лет в течение 20 лет свидетельствуют о том, что уровень толерантности к физическим нагрузкам является независимым предиктором смертности от всех причин у пожилых, а его повышение увеличивает выживаемость в этой популяции [19], результаты зарубежных исследований с физическими тренировками у пожилых пациентов с ХСН противоречивы. Большая часть имела благоприятный результат, но имеются и сообщения об отсутствии улучшения большинства показателей (толерантности к физической нагрузке, качества жизни, уровня нейрогормонов в крови, клинических проявлений ХСН). Отечественные публикации содержат данные об эффективности физической реабилитации у пациентов в возрасте от 60 до 84 лет с ХСН от II до IV функционального класса по критерям Нью-Йоркской ассоциации кардиологов (New York Heart Association, NYHA) в отношении замедления процессов ремоделирования миокарда, увеличения толерантности к физической нагрузке и улучшения качества жизни [20], но не позволяют сделать окончательных выводов о тактике выбора оптимального режима физических тренировок в зависимости от исходного состояния пациента, сопутствующих заболеваний, применяемой медикаментозной терапии, места и условий проведения занятий.
Общие рекомендации в отношении снижения в рационе соли и контроля количества принимаемой жидкости у пожилых пациентов с ХСН сохраняются. Сама ХСН может привести к прогрессированию пищевой недостаточности, что увеличивает риск проявлений старческой немощности, иммунодефицита и неблагоприятного прогноза [21]. Зарубежные авторы обращают внимание на связанные с финансовыми ограничениями и условиями жизни лиц старшего возраста такие неблагоприятные особенности их питания, как более частое употребление готовых продуктов и полуфабрикатов с высокой калорийностью и большим количеством натрия, что ухудшает течение сердечной недостаточности [7].
Существует ограниченное количество исследований, посвященных оптимальной медикаментозной терапии ХСН у пациентов старшего возраста (особенно 80 лет и более), но пока нет оснований предполагать, что фармакотерапия у них должна отличаться от рекомендованной в более молодом возрасте. Особое значение приобретает учет индивидуальных особенностей, сопутствующей патологии и возможности усваивать или переносить лекарственные препараты.
Благодаря данным крупных многоцентровых исследований, не возникает сомнений в значении ингибиторов ангиотензинпревращающего фермента (ИАПФ) при лечении ХСН у лиц пожилого возраста. Хотя в метаанализе исследований ИАПФ выживаемость при активной терапии была выше у тех, кому было менее 60 лет, однако активная терапия ИАПФ в любом возрасте имела сопоставимое влияние на комбинированную конечную точку (общая смертность и госпитализация). Хорошая переносимость высоких доз ИАПФ больными со средним возрастом 64 и 70 лет была продемонстрирована в исследованиях ATLAS и NETWORK, но ряд других работ выявил связь нарастания риска развития ухудшения функции почек при применении ИАПФ с возрастом, что клинически проявлялось гипотонией, азотемией, желудочно-кишечными симптомами, гиперкалиемией и лейкопенией [22]. Поэтому назначение ИАПФ у пожилых требует: тщательной оценки функции почек, начало терапии с меньших доз; более медленные темпы титрации препарата; отмену, при возможности, вазодилататоров; контроль уровня АД в положении лежа, сидя и стоя. Последнее связано с тем, что в пожилом и старческом возрасте при сочетании возрастных изменений сосудов (снижение эластичности крупных сосудов и повышение общего периферического сопротивления за счет уменьшения просвета мелких артерий) и нейрогуморальной регуляции (активация ренин-ангиотензин-альдостероновой системы и снижение эффективности бета-адренергической стимуляции) возникает выраженная лабильность АД с ортостатической гипотензией [4]. Антагонисты рецепторов ангиотензина II, хотя и не выявили преимуществ перед ИАПФ, лучше переносятся, что особенно значимо для повышения комплаентности у пациентов старшего возраста.
Основные рандомизированные исследования по применению блокаторов β-адренергических рецепторов при ХСН включали значительное количество пожилых пациентов. Изучение когорты из почти 12 000 больных (средний возраст 79 лет) показало, что их использование ассоциировано со значительным сокращением смертности от ХСН и смертности от всех причин [23]. Польза от назначения ретардной формы метопролола, карведилола и бисопролола у пожилых оказалась такой же, как и у более молодых пациентов. Анализ результатов применения этих же β-адреноблокаторов у лиц старческого возраста в ряде не очень больших исследований тоже не выявил значимого влияния возраста на сокращение смертности и уменьшение числа госпитализаций. Редким примером исследования, специально посвященного изучению пациентов 70 лет и старше с ХСН, является исследование SENIORS. Оно продемонстрировало уменьшение на фоне лечения β-адреноблокатором небивололом всех случаев смерти или госпитализации по поводу сердечно-сосудистых заболеваний независимо от фракции выброса [24]. Таким образом, назначение β-адреноблокаторов рекомендуется всем пациентам с ХСН, независимо от возраста. Их применение сопровождается улучшением долгосрочной выживаемости больных, а эффективность не зависит от наличия или отсутствия ИБС и АГ, но связана с большей исходной ЧСС. Беспокойство по поводу влияния β-адреноблокаторов на когнитивные функции больше основано на устных сообщениях, чем на строгих научных данных [7].
Хотя влияние мочегонных средств на прогноз при ХСН в серьезных плацебо-контролируемых исследованиях не изучено, эти препараты купируют симптомы легочного или системного застоя и широко используются в практике. Со старением эффективность ряда диуретиков снижается, например, уменьшается почечный клиренс фуросемида. Кроме того, наличие ХСН само по себе ограничивает абсорбцию фуросемида и буметанида. Меньше известно о влиянии старения и ХСН на результаты терапии тиазидными диуретиками. Считается, что применение мочегонных препаратов при физиологическом снижении функции почек у лиц старшего возраста может способствовать нарастанию электролитных нарушений и обострению ассоциированной с возрастом сопутствующей патологии [7]. Сама ХСН значительно усугубляет дефицит калия, характерный для пожилых из-за сокращения его количества в пищевом рационе, снижения эффективности реабсорбции калия в почках и уменьшения сухой массы тела, поэтому пациенты старших возрастных групп особенно склонны к гипокалиемии [25]. Недооцененными проблемами пожилых, усугубляемыми терапией диуретиками, являются задержка мочи и ее недержание. Факторами риска их развития являются возраст и терапия связанной со старением сопутствующей патологии. Значительная часть пациентов с легкими или умеренными симптомами недержания или задержки мочи предпочитает не сообщать об этом, если врач не спрашивает о мочеиспускании специально, предпочитая избегать приема диуретиков [26]. При проблемах с передвижением мочегонная терапия может нарушать повседневную активность больных старшего возраста, а выраженное уменьшение внутрисосудистого объема на фоне применения диуретиков при преимущественно диастолической дисфункции левого желудочка способно снизить сердечный выброс и вызвать гипотензию, к которой пожилые особенно чувствительны. Для уменьшения степени выраженности побочных эффектов терапии мочегонными средствами больных ХСН старшего возраста предлагается деление их дозы на несколько приемов или ее уменьшение при симптомах гипоперфузии или нарастании почечной недостаточности во время титровании доз блокаторов нейрогормонов; исключение приема диуретиков в конце дня во избежание никтурии; назначение минимальных доз мочегонных, необходимых для стабильного веса и симптоматики при длительном лечении, контроль функции почек и электролитного баланса при каждом изменении в терапии.
Е. А. Темникова, кандидат медицинских наук
ГБОУ ВПО ОмГМА МЗ РФ, Омск
