что такое соматическая мутация
Соматические мутации в опухоли
Мутация — любое изменение в молекуле ДНК либо структуре хромосом. Изменения, которые происходят в гаметах — половых клетках, называют герминальными, в любых других клетках организма — соматическими. Герминальные мутации передаются от родителей по наследству в виде генетических заболеваний. Соматические изменения не наследуются, а возникают в результате внешних воздействий (курения, радиоактивного излучения и других).
Доказано, что злокачественные опухоли в 90–95 % случаев возникают в результате соматических мутаций (спорадический рак). Наследственный рак, развивающийся в результате герминальных изменений, составляет 5–10 % от всех случаев заболевания.
Клеточные механизмы возникновения рака: протоонкогены и онкосупрессоры
Соматические мутации увеличивают шанс превращения здоровых клеток в раковые за счет активации онкогенов — генов, стимулирующих образование злокачественных опухолей. Онкогены образуются из обычных генов — протоонкогенов.
Деление клеток опухоли и разрастание опухолевой ткани тормозят антионкогены — гены-супрессоры. Протоонкогены и гены-супрессоры образуют систему стимуляции и подавления злокачественного процесса.
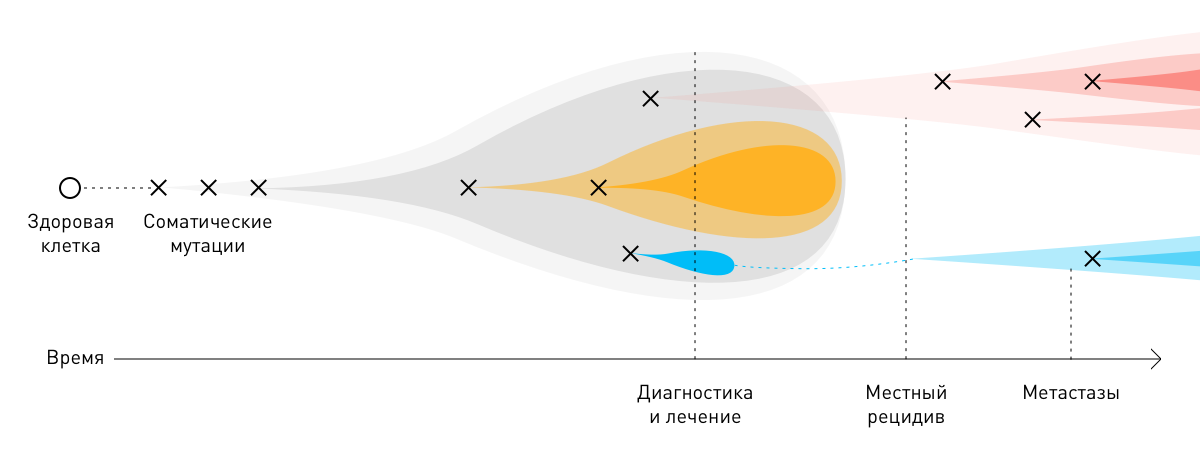
В подавляющем большинстве случаев раковые опухоли возникают из одной клетки в результате двух последовательных мутаций: первичной (герминальной) и вторичной (соматической). Для развития новообразования достаточно 3–6 таких повреждений. Вызванные ими изменения постепенно накапливаются в ДНК, вызывают неконтролируемое размножение пораженных клеток и образование атипичных тканей.
Драйверные соматические мутации и их использование для лечения злокачественных опухолей
В этиологии опухолей изменения в клетках вызывают ошибки копирования ДНК при делении — соматические драйверные мутации. В одних органах и тканях стволовые клетки делятся чаще, чем в других. В них злокачественные новообразования образуются чаще, чем в других структурах организма. По данным международного агентства по исследованию рака IARC, риск заболеть раком, а также выживаемость раковых клеток на 70–80 % зависят от интенсивности деления стволовых клеток и увеличиваются с возрастом.
Генетические маркеры опухолей (изменения в структуре белков в результате соматических драйверных мутаций) можно использовать как мишень и прицельно блокировать с помощью фармакологических препаратов. На этом принципе основан один из наиболее результативных современных методов лечения рака — таргетная терапия. Она позволяет:
Выявление драйверных соматических мутаций для диагностики злокачественных опухолей
Чем больше генетических маркеров известно, тем более адекватно подбирается лечение. Для выявления соматических мутаций при диагностике злокачественных опухолей используют следующие методики:
Целесообразность использования того или иного метода в каждом конкретном случае определяет врач.
Соматические мутации опухолей: влияние на диагностику и лечение
В процессе роста злокачественные новообразования приспосабливаются к факторам онкологического лечения — лучевой, химио- и иммунотерапии. Молекулы онкологических клеток, выжившие после того или иного лечебного этапа, нередко мутируют. Соматические мутации опухолей способствуют прогрессированию болезни и её более агрессивному (рецидивирующему и метастатическому) течению. Из-за индивидуальных различий на молекулярном уровне общеклинические стратегии лечения того или иного вида рака могут быть неэффективны для отдельных пациентов.
Чтобы максимально снизить риск рецидивов, улучшить качество жизни больных и увеличить её продолжительность, соматические мутации в опухолях в ответ на фармако- и химиотерапию необходимо учитывать. Для их выявления разработан инновационный метод исследования — молекулярное профилирование. Результаты этого вида диагностики позволяют врачу назначать наиболее оптимальное персонализированное лечение.
Соматические мутации и психические расстройства
Известно, что некоторые заболевания человека возникают в результате соматических мутаций, и данные многих исследований указывают на то, что соматические мутации могут частично объяснить склонность к психическим расстройствам. Такие мутации могут наблюдаться в различных тканях в течение раннего периода развития, включая периферические ткани (например, клетки крови), а также клетки головного мозга. Напротив, соматические мутации, возникающие после дифференцировки, существуют в ограниченной области одного типа ткани (например, мозга) и, таким образом, могут быть обнаружены только в этой ткани. Соматические мутации возникают из-за воздействия окружающей среды, включая воспаление и окислительный стресс (описанный ниже), а также из-за стохастических изменений во время развития.
В то время как полиморфизмы и варианты, передаваемые от предков, являются наследственными генетическими факторами, остальные три типа мутаций de novo и соматических мутаций, являются ненаследственными генетическими факторами. Тем не менее, все эти типа зародышевой линии и соматические варианты (мутации), вероятно, оказывают аддитивное влияние на отдельный фенотип. Например, исследования показали, что мутации зародышевой линии de novo и наследуемые варианты аддитивно влияют на риск развития расстройства аутистического спектра.
В принципе, мутации, которые приводят к эмбриональной летальности или тяжелым врожденным заболеваниям, не могут существовать в геноме зародышевой линии, хотя они могут существовать в виде соматических мутаций, что может привести к относительно менее серьезным физиологическим последствиям. Предыдущие исследования, касающиеся эпилептической энцефалопатии, показали, что одиночные соматические мутации PCDH19 приводят к менее тяжелой патологии, чем мутации de novo того же гена.
Полиморфизмы и варианты, передаваемые от предков и мутаций de novo, общих для монозиготных близнецов, способствуют наследуемости, оцененной в исследованиях близнецов. Тем не менее, соматические мутации, не разделяемые между монозиготными близнецами, не вносят непосредственного вклада в наследственность, но влияют на склонность к психическим расстройствам у пациентов, изменяя биологические пути, сходные с теми, на которые влияют мутации зародышевой линии. Соматические мутации могут вносить вклад в общую изменчивость ответственности, которая, как классически считается, связана с факторами окружающей среды.
Расчетная частота мутаций de novo составляет 1–1,5 × 10–8 на нуклеотид на поколение. Соматические мутации могут встречаться чаще, чем мутации de novo. При условии консервативной оценки 2,8 замещающих мутаций на клетку на клеточное деление и симметричных делений в развитии, 86 миллиардов нейронов прошло бы по крайней мере 36 делений, что привело бы к минимуму 100 однонуклеотидных вариантов (SNVs) в одном нейроне. Фактически, нейроны, вероятно, подвергаются гораздо большему количеству клеточных делений, и мутация в нервных тканях происходит через механизмы, отличные от ошибок репликации во время клеточного деления. Кроме того, могут возникать другие типы мутаций (например, структурные варианты), увеличивая количество мутационных событий сверх этой минимальной оценки.
Исследовательские группы опубликовали обзоры, которые систематизируют последние знания о соматических мутациях в человеческом мозге с нейропсихиатрической / нейробиологической точки зрения.
Одна нейрональная прогениторная клетка в коре плода имеет
1000–2500 соматических SNVs. Эти оценки основаны на секвенировании цельного генома (WGS) одноклеточных геномов после пролиферации клональных клеток или амплификации цельного генома (WGA). SNV в одном нейроне в префронтальной коре и зубчатой извилине увеличиваются на
40 в год соответственно. Скорость накопления в нейронах зубчатой извилины в два раза выше, чем в нейронах префронтальной коры, вероятно, из-за различий в скорости нейрогенеза. Некоторые мутации в отдельных нейронах также обнаруживаются в других областях мозга с различными аллельными фракциями. Предполагается, что аллельные фракции в определенных областях мозга коррелируют с моментом возникновения мутации, так что более крупные аллельные фракции могут отражать мутацию на более ранних стадиях развития. Исследователи предоставили оценку 5,1 SNV / день / отдельная клетка-предшественник во время нейрогенеза, 8,6 SNV / клетка / клетка-предшественник и 1,3 SNV / клетка / дочерняя клетка в раннем эмбрионе человека. Нейрогенез связан с более высокой частотой мутаций, чем в раннем эмбриогенезе, хотя частота нейрогенеза у взрослых в мозге человека активно обсуждается.
Наблюдаемые соматические мутации обогащены генами, связанными с нейроразвитием, и нитями, подвергающимися активной транскрипции. Большая длина нейрон-экспрессируемых генов может быть причиной мутационной восприимчивости. Соматические мутации в зрелых нейронах, вероятно, возникают во время активной транскрипции, тогда как соматические мутации в эмбриональных нейронах встречаются реже в геномных областях с гистоновыми метками мозга плода и эмбриональных стволовых клеток. Геномные участки, подверженные мутации, могут различаться в зависимости от стадии развития. Смещение соматических мутаций к генам нейроразвития в зрелых нейронах указывает на их отношение к психическим расстройствам.
Соматические мутации показали значительное пространственное разнообразие; некоторые мутации наблюдались в мозге, но не в печени, тогда как другие наблюдались в коре, но не в мозжечке.
Несколько исследовательских групп выявили соматическую анеуплоидию в мозге человека.
Мобильные элементы
Подвижные элементы занимают
Скорость соматической ретротранспозиции в мозге человека активно изучается. Исследователи наблюдали соматическую ретротранспозицию LINE-1 и Alu в объемной ткани, полученной из гиппокампа и хвостатого ядра человека. Соматическая ретротранспозиция была обнаружена с использованием секвенирования ретротранспозонов (RC-Seq), в котором ретротранспозоны в геноме были секвенированы в массовом порядке после захвата. Сайты вставки ретротранспозонов были идентифицированы фланкирующими геномными последовательностями. Авторы выявили 13 700 и 7700 предполагаемых соматических ретротранспозиций LINE-1 и Alu, соответственно, у трех индивидуумов ( Baillie et al., 2011).
Поскольку нервная ткань проявляет мало или вообще не обладает пролиферативной способностью, механизмы, лежащие в основе соматической мутации в мозге, должны отличаться от механизмов, связанных с раком. Исследования показали, что C> T- переходы составляют
80% соматических SNV в одиночных нейронах. Нейроны имеют характерные 5 мС в не-CpG-сайтах и относительно большее количество 5-гидроксиметилцитозина (5hmC), чем в других тканях. Более того, 5hmC является промежуточным продуктом при активном деметилировании 5mC до C, и предыдущие исследования показали, что этот процесс, включая восстановление базовой эксцизии, подвержен мутации. Тем не менее, одно исследование показало, что 5hmC был связан с
53% снижением частоты мутаций C> T в сайтах CpG по сравнению с 5mC.
Окислительный стресс
Окислительное повреждение не ограничивается мозгом, но на мозг приходится
1000 одноцепочечных разрывов на клетку в день. При окислительном повреждении образуется 8-оксогуанин, который иногда включает аденин в качестве неправильной комплементарной основы. Если системы репарации ДНК не могут восстановить исходную пару (гуанин и цитозин), неправильно введенный аденин включает тимин в качестве правильного комплементарного основания, что приводит к трансверсии C> A.
Ретранспозиция
Механизм, лежащий в основе ретротранспозиции в мозге человека, остается в значительной степени неизвестным. Однако, предполагается, что эпигенетическая модификация подавляет транскрипционную активность ретротранспозонов. Данные исследователей свидетельствуют о том, что воспалительный стресс в период развития плода вызывает соматическую ретротранспозицию, предполагают, что факторы окружающей среды приводят к соматической ретротранспозиции, вероятно, в результате нейровоспаления.
Соматические мутации при пороках развития мозга и нейродегенерации
Несколько исследований выявили соматические мутации в известных генах риска для определенных пороков развития головного мозга. Во многих случаях потенциальные соматические мутации были обнаружены в областях мозга, проявляющих местные анатомические изменения.
Корковая дисплазия с эпилепсией является еще одним примером порока развития головного мозга, вызванного соматическими мутациями, так идентифицировали соматические мутации в MTOR в пораженной области мозга у пациентов с кортикальной дисплазией II типа и эпилепсией. Они обнаружили предполагаемые соматические мутации с использованием WES на глубине 400–700 ×, подтвердив и количественно определив мутацию-кандидата с помощью TAS. Двенадцать из 77 пациентов имели соматические мутации в MTOR с аллельными фракциями от 1,3 до 12,6% в пораженных областях ( Lim et al., 2015).
Соматические мутации в GNAQ (c.548G> A, p.Arg183Glu) были зарегистрированы у пациентов с синдромом Стерджа-Вебера (редкое врожденное неврологическое расстройство, характеризующееся приступами, умственной отсталостью, церебральными пороками развития и другими симптомами).
Соматические мутации и психические расстройства ( посмертные исследования)
Психические расстройства часто связаны с меньшим количеством анатомических изменений, чем пороки развития головного мозга, что делает относительно трудным исследование соматических мутаций, связанных с этими патологическими состояниями. Длина теломер, как правило, варьируется в соматических клетках. Характерное уменьшение длины теломер наблюдается в гиппокампе у пациентов с большим депрессивным расстройством.
Соматические мутации и психические расстройства ( анализ переферической ткани)
Методики исследования ( валидация)
). Пиросеквенирование и секвенирование Сэнгера со многими клонами также можно использовать для расчета доли аллеля, хотя разрешение и чувствительность ниже, чем у ddPCR (пиропоследовательность,
5%). Однако, все эти методы демонстрируют трудности при обнаружении SNV в повторяющихся областях, включая ретротранспозоны, из-за сложности в ПЦР. TAS на сверхвысокой глубине (например, 10000 ×
) можно использовать в качестве альтернативного метода валидации, так как этот метод может обнаруживать соматические мутации с долями аллелей всего 0,1%. Тем не менее, существует вероятность систематических ошибок при использовании химии секвенирования, аналогичной исходной последовательности. Соматические CNV и ретротранспозоны в объемных тканях могут быть проверены с использованием КПЦР, хотя разрешение ограничено.
Стратегии секвенирования
Выбор целевого геномного региона является одним из наиболее важных вопросов. Хотя гены риска еще не определены для большинства психических расстройств, последние геномные исследования выявили несколько генов-кандидатов в качестве редких вариантов с сильным размером эффекта. Однако, если целевые гены неясны, требуются более комплексные методы, такие как WGS или WES. Выбор WGS, WES или TAS зависит от цели исследования, а также от конкретного расстройства.
Новые технологии секвенирования, включающие секвенирование с длительным считыванием, такие как PacBio / Sequel (Pacific Biosciences, Menlo Park, CA, USA) и MinION / PromethION (Oxford Nanopore Technology, Oxford, UK), были бы полезны для исследования структурных вариантов. и ретротранспозонов. Анализ CNV может быть выполнен с использованием микрочипов, но WGS с малой глубиной более чувствителен для обнаружения соматических CNV, а секвенсоры с длинным чтением полезны для обнаружения вариантов соматических структур, включая CNV.
Обнаружение кандидата
Ожидается, что аллельные доли соматических мутаций в нервной ткани будут низкими из-за низкой пролиферативной способности после дифференцировки. Это заметно контрастирует с раком, который характеризуется гиперпролиферацией и связан с соматическими мутациями, несущими большие аллельные фракции. Таким образом, высокочувствительный подход необходим для обнаружения соматических мутаций в мозге человека. Cibulskis et al. ( 2013) сообщили о чувствительности MuTect, хорошо известного инструмента обнаружения соматических мутаций с высокой чувствительностью и специфичностью, имитирующего различные случаи глубины секвенирования. Например, MuTect требует глубины последовательности 340 ×
Метод отбора проб
Одноклеточный анализ полезен для выявления соматических мутаций, которые возникают позже в развитии. Однако ложноположительные результаты индуцируются дезаминированием во время лизиса клеток, смещением амплификации и ошибками во время WGA. Каждый метод WGA (MDA, MALBAC или DOP-PCR) связан с преимуществами и недостатками. Предполагается, что линейное усиление с помощью транспозонной вставки (LIANTI), недавно предложенного метода WGA, уменьшает смещение усиления. Ложные срабатывания, указывающие на C> T из-за спонтанного дезаминирования C> U во время одноклеточной подготовки, могут быть уменьшены с помощью урацил-ДНК-гликозилазы. Перенос ядер соматических клеток (SCNT) нейронных ядер в энуклеированные ооциты также был предложен в качестве метода WGA.
Родословная нейронов: как носить в себе множество мутаций и выглядеть совершенно здоровым
Родословная нейронов: как носить в себе множество мутаций и выглядеть совершенно здоровым
Автор
Редактор
Статья на конкурс «био/мол/текст»: На протяжении долгой истории развития нейробиологии ученые придерживались догмы: мозг взрослого человека не подвержен изменениям. Однако в ходе нового исследования впервые было показано, что значительное количество мутаций присутствует в мозговом веществе абсолютно здоровых людей, причем чаще всего они обнаруживаются в генах, которые нейрон использует наиболее активно. Попробуем разобраться, как этим можно воспользоваться и чем это грозит.
Обратите внимание!
Эта работа опубликована в номинации «лучшее новостное сообщение» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Мутации: патология или норма?
Каждая клетка нашего тела была создана путем деления клеток-предшественниц, которые, в свою очередь, восходят в развитии к зиготе. Значит ли это, что общий путь развития всех клеток организма обеспечивает общность генетического материала? Нет, и виной тому — мутации (рис. 1).
Рисунок 1. «Древо развития» мутаций в организме человека. Нарушения, обнаруженные в коре головного мозга, часто встречаются и в периферических органах. Рисунок из [4].
Мутации — коварные преобразования ДНК, которые страшны тем, что могут возникать в клетках любых тканей многоклеточного организма и на любых стадиях его развития. Распространено мнение, что мутации опасны потому, что могут наследоваться потомством. Действительно, мутации, передающиеся по наследству, приводят к возникновению и развитию таких серьезных заболеваний нервной системы, как шизофрения, аутизм, болезнь Альцгеймера. Виной тому — приобретаемые детьми генетические нарушения половых клеток родителей. Однако существуют и другие, ненаследуемые мутации, которые возникают в соматических клетках человека на протяжении всей его жизни.
Большинство людей имеет определенное количество соматических мутаций. Известным примером следствий соматических мутаций является появление опухолевых клеток, для которых характерны генетические нарушения*. Однако далеко не всегда соматическая мутация приводит к развитию онкологических заболеваний. Часто изменения генома не выливаются в какие-либо серьезные заболевания и могут встречаться у полностью здоровых людей. До настоящего момента ученые точно не знали, накапливаются ли они в головном мозге в таком количестве, чтобы послужить причиной серьезных нарушений нервной системы.
По мере роста и взросления человека геномы нейронов его головного мозга накапливают существенные различия. К такому выводу пришли ученые Бостонской детской больницы (Boston Children’s Hospital) и Гарвардской медицинской школы (Harvard Medical School), опровергнув утверждение, что мозг взрослого человека не изменяется в течение жизни* [4, 5].
* — Последние годы оказались особенно урожайными на опровержения железобетонных нейробиологических догм. Как нам на радость разобрались с приговором «нервные клетки не восстанавливаются», описано в статье «Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить» [6]. — Ред.
Результаты недавнего исследования показали, что значительное количество соматических мутаций можно обнаружить в мозге полностью здоровых людей. Так, со временем геномы нейронов головного мозга человека начинают различаться — появляется мозаицизм. Это научное открытие позволит изучать роль соматических мутаций отдельных нейронов в развитии человека и ряда нервно-психических заболеваний.
Сколько мутаций может содержать в себе геном нейрона?
Ранее не было точно известно, способны ли соматические мутации, возникающие в нейронах головного мозга, провоцировать возникновение и развитие нейродегенеративных заболеваний. Для того чтобы установить истину, ученые решили изучить особую разновидность мутаций — однонуклеотидные варианты (single-nucleotide variants, SNVs). Эти нарушения могут возникнуть в нескольких или даже всего в одной клетке головного мозга. Исследователи проанализировали 36 нейронов, взятых из головного мозга трех умерших людей: 15-летней девушки, 17-летнего юноши и 42-летней женщины, которые не страдали нейродегенеративными заболеваниями.
Используя методы капиллярной цифровой полимеразной цепной реакции (digital PCR) и секвенирования геномов единичных клеток [7], ученые обнаружили, что каждый отдельный нейрон из трех образцов ткани мозга содержит в среднем от 1468 до 1580 однонуклеотидных вариантов (рис. 2). И если появление SNVs в опухолевых клетках связано преимущественно с ошибками при репликации ДНК, то нейронные мутации возникают в основном вследствие активной транскрипции генов.
Рисунок 2. Карта мутаций генома корковых нейронов одного человека. 136 нейронов головного мозга 17-летнего человека распределены по четырем группам (обозначены разными цветами), выделенным по одной или нескольким мутациям (буквами A-D обозначены 18 клональных соматических мутаций). Рисунок из [5].
Дополнительно ученые сравнили гены нервных клеток с генетическим материалом, взятым из других тканей — в частности, сердца и кожи. Этот анализ показал, что мутации в нейронах в целом совпадают с однонуклеотидными вариантами в других типах клеток, то есть такие мутации присутствуют и в нейронах, и в других частях организма человека. Более того, был установлен следующий интересный факт: в ряде случаев клетки коры мозга показывали более высокую степень родства не с соседними нейронами, а с другими клетками организма (например, кардиомиоцитами).
Также было проведено исследование нервных клеток, взятых из разных областей головного мозга, с целью обнаружения аналогичных мутаций. Полученные результаты позволили сделать предположение о происхождении нервных клеток.
«Генеалогическое древо» нейронов
Рисунок 3. «Родословное древо» человека из книги Э. Геккеля «Антропогения». Идея объединения всех живых существ в единое «древо» имеет более чем 150-летнюю историю. Рисунок с сайта vivovoco.astronet.ru.
Мутации возникают как за счет ошибок копирования ДНК, которые потенциально могут сопровождать каждый репликационный цикл, так и в результате иных мутационных процессов — например, под действием ультрафиолетового света. Закономерное следствие — каждая клетка организма может иметь свой собственный уникальный геном, который несет в себе информацию о происхождении и развитии клетки, воздействии на нее внешних факторов. Такие «записи» онтогенеза отдельных клеток позволят создать их «родословное древо».
В разных клетках происходят разные мутации, что обеспечивает несходство геномов. Кроме этого, мутационный профиль несет в себе долговременную память о происхождении и развитии каждой клетки. Информация, полученная при секвенировании геномов индивидуальных нейронов, может быть использована для декодирования всей картины развития человеческого мозга — для реконструкции своеобразного «генеалогического древа» нейронов. Этот подход позволит расширить знания о природе возрастных заболеваний и выявить различия между мозгом человека и мозгом других животных.
Основоположником генеалогии можно считать Чарльза Дарвина, который впервые изобразил филогенетическое древо живых организмов еще в 1837 году. В его основу легла идея о том, что все виды живых существ связаны друг с другом общим происхождением, подобно ветвям дерева, которые объединяет общий корень (рис. 3). Подобные мысли использовали при создании клеточной теории ученые Т. Шванн и М. Шлейден, определившие клетку как единый структурный элемент всех живых организмов. Наконец, более чем через 150 лет, в 2005 году, Д. Фрумкин и соавторы в своем исследовании показали, что соматические мутации присутствуют в клетках в достаточном количестве и могут быть использованы для воссоздания взаимосвязей всех клеток человека [8]. Таким образом, далеко не свежие идеи лежат в основе нового заключения о том, что каждый человек несет в себе собственное (клеточное) генеалогическое древо*.
* — Дерево — это красиво и понятно, дерево — это аллегория из мира эукариот. А как же работают биологи с прокариотическими дебрями, где схемы родственных связей не то что дерево не напоминают, даже лес для них простоват — сеть да и только? Об эволюционных перипетиях в разных мирах читайте: «Эволюция между молотом и наковальней, или как микробиология спасла эволюцию от поглощения молекулярной биологией» [9], «Карл Вёзе (1928–2012)» [10], «Вирусные геномы в системе эволюции» [11] и «Закинули археи эволюционный невод и вытянули. » [12]. — Ред.
Кристофер Уолш и другие сотрудники Гарвардской медицинской школы в результате исследования однонуклеотидных вариантов предложили подход к установлению происхождения нервных клеток человека [5]. Так, если в двух отдельно взятых нейронах присутствуют одни и те же мутации, то они с высокой долей вероятности происходят от одной клетки-предшественницы. В том случае, если совпадает лишь часть мутаций, пути развития нейронов в какой-то момент времени разошлись.
Сравнивая геномы нейронов и других клеток организма, можно сделать следующий вывод: если какая-то мутация присутствует и в головном мозге, и в других соматических клетках — она возникла на раннем этапе онтогенеза. Если же определенная мутация встречается лишь в некоторых нейронах, это говорит о том, что она появилась сравнительно недавно. Таким образом можно проследить «родословную» нейронов вплоть до конкретного дня эмбрионального развития.
«Движение — это смерть»
Выше упоминалось, что мутации, обеспечивающие различия геномов соматических клеток, могут быть вызваны многими факторами. Так, длительное время считалось, что основной причиной мутаций в клетках головного мозга являются ошибки репликации ДНК. Однако в результате настоящего исследования ученые установили, что нарушения возникают не во время деления клетки, а при экспрессии генов. Всем известный девиз «Движение — это жизнь» не работает в случае соматических мутаций нейронов. Исследователи установили, что каждый раз, когда гены нейронов нашего мозга начинают активно работать — запуская программу синтеза новых белков, — появляется определенный риск возникновения мутаций.
Ученые пришли к выводу о том, что мутации в головном мозге накапливаются с возрастом и могут быть причастны к развитию нейродегенеративных заболеваний. Получается, что любой человек, сколь бы здоровым он ни был, является носителем огромного количества соматических мутаций — своеобразных «факторов риска». Чем это реально может грозить и как этого избежать — покажет время и будущие исследования нейробиологов.