что такое синергизм антибиотиков
Синергизм и потенцирование антибиотиков
В последнее время антибиотики часто стали применять в комбинации с другими антибиотиками, а также с химиотерапевтическими веществами разных групп (сульфаниламиды, нитрофураны и др.).
Комбинации такого рода преследуют цели повышения противомикробного действия и ослабления отрицательного влияния их. При комбинированном назначении нескольких веществ с разным механизмом действия нарушают одновременно несколько звеньев метаболизма у возбудителей болезней, поэтому надежнее и быстрее вызывают гибель их. Усилить действие можно при сочетании вещества сильно, но кратковременно действующего, с умеренным по силе, но долго действующим. При этом первое вещество если не убивает, то переводит возбудителя болезни в анабиотическое состояние, а второе вещество мешает выйти ему из такого состояния. Кроме того, назначение комбинированных препаратов часто преследует цель улучшить резорбцию антибиотика микробной клеткой, ослабить выработку ферментов, инактивирующих антибиотик, продлить период пребывания антибиотика в микробной клетке или в организме животного, ослабить местное неблагоприятное влияние, понизить вирулентность микроба, повысить защитные реакции животного и т. д. При правильно составленной комбинации действие химиотерапевтических веществ на возбудителя болезни обычно усиливается, а неблагоприятное влияние на животных ослабевает.
При правильной комбинации двух и более веществ возможен синергизм (суммарное действие в одном направлении) или потенцирование (значительное повышение химиотерапевтического эффекта). При неправильной комбинации чаще всего бывает тот или иной антагонизм, сопровождающийся ослаблением лечебного действия препарата. Поэтому любые комбинации должны быть хорошо обоснованы экспериментально. Лучшими являются те, которые хорошо апробированы и часто используются. Фармацевтическая промышленность выпускает много подобных препаратов, и они описаны в монографии. По практические врачи могут и сами комбинировать вещества для изменения действия в желаемом направлении.
В. Ф. Грезнн, изучая действие пенициллина, стрептомицина, норсульфазола и сульфадимезина, установил, что в сочетании с другими лечебная эффективность этих препаратов значительно выше. Для достижения бактериостатического эффекта в отношении стафилококков достаточно брать пенициллина и стрептомицина в 35 раз, а норсульфазола и сульфадимизина в 1400 раз меньше, чем при применении каждого из них в отдельности. Результаты, полученные in vitro, подтверждены им при лечении кроликов со стафилококковой инфекцией, вызванной лекарственно-устойчивым возбудителем.
Аналогичные исследования проводил В. М. Подкопаев. По его данным, наиболее благоприятно при диспепсиях телят действуют препараты в следующих комбинациях: левомицетин с тетрациклином или стрептомицином; синтомицин с фуразолидоном, фурацилином, стрептомицином, полимиксином, тетрациклином, окситетрациклином и хлортетрациклином; мицерин с фуразолидоном, фурацилином и стрептомицином; тетрациклин с полимиксином, фуразолидоном; стрептомицин со стрептоцидом или со стрептоцидом и фуразолидоном. При комбинации тетрациклина со стрептомицином бактерицидность в отношении кишечной микрофлоры понижается.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Комбинированная антибиотикотерапия
Содержание
Комбинированная антимикробная терапия [ править | править код ]
Комбинированная антимикробная терапия применяется по строгим показаниям. При выборе комбинации препаратов необходимо учитывать возможные взаимодействия между ними, влияющие как на микро-, так и на макроорганизм. Препараты, действующие на разные мишени, могут усиливать или ослаблять антимикробную активность друг друга. Побочное действие комбинации антимикробных средств слагается из побочных эффектов отдельных препаратов, а иногда и превышает простую сумму их побочных эффектов. Например, ванкомицин сам по себе не оказывает выраженного нефротоксического действия, но, по некоторым данным, усугубляет нефротоксичность аминогликозидов (Farberand Moelle-ring, 1983).
Оценка взаимодействия антимикробных средств [ править | править код ]
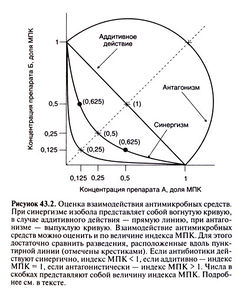
Существует два способа оценки взаимодействия антимикробных средств. В первом случае микроорганизмы высевают на жидкие питательные среды, содержащие разные сочетания последовательных двукратных разведений двух исследуемых препаратов, и инкубируют в течение 18—24 ч. Затем определяют МПК каждого антибиотика в отдельности и в присутствии другого препарата. Если МПК комбинации антибиотиков составляет не более 25% МПК каждого препарата в отдельности, антибиотики действуют синергично. Синергизм может быть обусловлен повышением чувствительности микроорганизма к одному препарату под действием другого. Если МПК комбинации антибиотиков равна половине МПК каждого из них в отдельности, это означает, что препараты действуют независимо друг от друга, а их эффект суммируется (аддитивное действие). Если МПК комбинации антибиотиков меньше, чем МПК каждого из них в отдельности, препараты действуют антагонистически (то есть ослабляют действие друг друга). При сравнении всех (а не только одинаковых) комбинаций двукратных разведений антибиотиков можно построить так называемые изоболы (рис. 43.2). Если антибиотики действуют синергично, изобола представляет собой вогнутую кривую, если аддитивно — прямую линию, если антагонистически — выпуклую кривую. Для каждой точки изоболы можно рассчитать индекс МПК — сумму концентраций, выраженных в долях МПК. Для двух антимикробных средств А и Б его рассчитывают следующим образом:
Индекс МПК = МПК А в присутствии Б/МПКА+МПК Б в присутствии А/МПКБ
В случае аддитивного действия индекс МПК равен единице, при синергизме он меньше 1, при антагонизме — больше. К сожалению, с помощью этого метода нельзя выявить синергичный бактерицидный эффект, так как определяются не МБК, а МПК.
Другой способ оценки взаимодействия препаратов заключается в построении кривых, описывающих динамику гибели микроорганизмов. Культуру микроорганизмов инкубируют в присутствии обоих антимикробных средств и каждого из препаратов в отдельности. Для оценки числа выживших микроорганизмов ее периодически пересевают. О синергизме говорят в том случае, если число бактерий в среде, содержащей комбинацию препаратов, как минимум в 100 раз меньше, чем в среде, содержащей наиболее активный из препаратов. Если число бактерий различается менее чем в 100 раз, говорят об индифферентном действии. Если же число бактерий в присутствии комбинации антимикробных средств больше, чем в присутствии наиболее активного из них, препараты действуют антагонистично.
В 1952 г. Джавиц и Ганнисон предложили простой способ оценки взаимодействия антимикробных средств, основанный на их свойствах (Jawetz and Gunnison, 1952). Авторы заметили, что бактериостатические антибиотики (например, тетрациклины, эритромицин, хлорамфеникол) часто действуют антагонистично по отношению к бактерицидным препаратам (таким, как β-лактамные антибиотики, ванкомицин, аминогликозиды), поскольку первые подавляют деление бактериальных клеток и синтез белка, необходимые для реализации действия большинства бактерицидных антибиотиков. С другой стороны, два бактерицидных препарата обычно действуют синергично. Так, препараты, подавляющие синтез клеточной стенки, и аминогликозиды проявляют синергизм в отношении многих видов бактерий. Исключение составляет рифампицин. Будучи бактерицидным препаратом, он индифферентно или даже антагонистически взаимодействует с другими бактерицидными антибиотиками in vitro. Клиническое значение этого явления не установлено, поскольку in vivo комбинации с рифампицином эффективны.
Показания к комбинированной антимикробной терапии [ править | править код ]
Назначение нескольких антимикробных средств оправдано в следующих случаях: 1) при эмпирической терапии (возбудитель не известен), 2) при лечении смешанных инфекций, 3) при необходимости усилить антимикробное действие в отношении определенного возбудителя, 4) в целях предупреждения лекарственной устойчивости.
Эмпирическая терапия [ править | править код ]
Это самый частый повод для назначения комбинации антимикробных средств. Чтобы правильно подобрать лечение, необходимо знать особенности инфекции, ее наиболее вероятных возбудителей, а также антимикробные спектры препаратов, которые могут применяться в данной ситуации. Если состояние больного тяжелое, антимикробная терапия должна быть направлена против всех возможных возбудителей. Для этого часто приходится назначать несколько препаратов. Например, при внебольничной пневмонии используют цефуроксим в сочетании с макролидами: первый активен в отношении грамотрицательных бактерий, а вторые — в отношении возбудителей атипичных пневмоний, например Mycoplasma pneumoniae. Но такое лечение не должно быть слишком длительным. В нем нет необходимости, если возбудитель уточнен или выяснилось, что инфекция вообще отсутствует. Комбинированная терапия недешева, увеличивает риск побочных эффектов, способствует развитию суперинфекции и отбору полирезистентных штаммов. Неоправданное применение комбинации антимикробных средств бывает обусловлено тем, что врачи начинают лечение до взятия материала на посев или же, получив данные о возбудителе и его чувствительности, не меняют схему лечения. Конечно, отказаться от терапии, доказавшей свою эффективность, может быть трудно. Тем не менее нужно всегда стремиться назначать препарат с наиболее узким спектром действия и минимальными побочными эффектами. Лечение смешанных инфекций. Комбинированная антимикробная терапия показана при смешанной инфекции, возбудители которой чувствительны к разным антимикробным средствам. Например, абсцессы брюшной полости, печени и головного мозга, а также инфекции половых органов часто бывают вызваны смешанной аэробной и анаэробной микрофлорой.
Усиление действия антимикробных средств [ править | править код ]
Совместное применение нескольких антимикробных средств может значительно усиливать их действие, хотя преимущества комбинированного лечения перед монотерапией доказаны лишь для небольшого числа инфекций.
Наиболее убедительные доказательства получены для энтерококкового эндокардита (Wilson et al., 1995). In vitro пенициллины оказывают на Enterococcus faecalis и Enterococcus faecium лишь бактериостатическое действие, а в комбинации со стрептомицином или с гентамицином — бактерицидное. Причем после монотерапии пенициллинами рецидивы возникают намного чаше, чем после комбинированной терапии.
In vitro пенициллины действуют синергично со стрептомицином или гентамицином и в отношении зеленящих стрептококков. В экспериментах на животных комбинация этих препаратов быстрее уничтожала возбудителей в вегетациях на клапанах по сравнению с монотерапией пенициллинами. Поданным клинических исследований, при стрептококковом эндокардите двухнедельная комбинированная терапия столь же эффективна, как и четырехнедельная монотерапия пенициллинами. Кроме того, пенициллины и аминогликозиды проявляют синергизм в отношении Staphylococcus aureus (как in vitro, так и в экспериментальных моделях in vivo). Например, у некоторых больных с инфекционным эндокардитом трехстворчатого клапана, вызванным Staphylococcus aureus, эффективна двухнедельная терапия тобрамицином или гентамицином (в низких дозах) в сочетании с нафциллином, хотя обычно таким больным назначают монотерапию нафциллином в течение 4—6 нед (Chambers etaL, 1988).
Комбинация β-лактамных антибиотиков и аминогликозидов рекомендуется при инфекциях, вызванных Pseudomonas aeruginosa. In vitro β-лактамные антибиотики, активные в отношении псевдомонад, и аминогликозиды действуют синергично в отношении большинства штаммов Pseudomonas aeruginosa. В экспериментах на животных комбинированная терапия тоже оказалась эффективнее, чем монотерапия указанными препаратами. В некоторых, хотя далеко не во всех, клинических испытаниях (Hilfetal., 1989; Vidal etal., 19%; Leibovici et al., 1997) сочетание β-лакгамных антибиотиков с аминогликозидами увеличивало выживаемость при тяжелых псевдомонадных инфекциях. Комбинированную терапию рекомендуется применять и при инфекциях, вызванных другими грамотрицательными палочками. Однако ее преимущества перед монотерапией во многих случаях остаются недоказанными (Ваглеге, 1992; Rybak and McGrath, 1996).
Синергизм сульфаниламидов и ингибиторов дигидрофолатредуктазы (например, триметоприма) обусловлен блокадой последовательных этапов синтеза фолиевой кислоты. Комбинированный препарат триметоприм/сульфаметоксазол активен в отношении микроорганизмов, устойчивых к сульфаниламидам. Его успешно применяют при инфекциях мочевых путей, пневмоцистной пневмонии, брюшном тифе, дизентерии и не которых инфекциях, вызванных устойчивыми к ампициллину штаммами Haemophilus influenzae.
По данным исследований in vitro и экспериментов на животных, фторцитозин и амфотерицин В действуют синергично в отношении Cryptococcus neoformans. При криптококковом менингите в отсутствие ВИЧ-инфекции фторцитозин позволяет снизить дозу амфотерицина В и сократить продолжительность лечения с 10 до 6 нед; риск побочных эффектов при этом снижается, а эффективность лечения остается прежней (Bennett et al., 1979). Кроме того, при криптококковом менингите на фоне СПИДа эта комбинация позволяет быстрее добиться стерильности СМЖ, чем монотерапия амфотерицином В (van der Horst etal., 1997).
Предупреждение лекарственной устойчивости [ править | править код ]
Комбинированная терапия препятствует отбору штаммов, устойчивых к одному из препаратов. Если частота появления мутантов, устойчивых к одному антимикробному средству, составляет, например, 10
6, то вероятность одновременного возникновения обеих мутаций равна произведению этих частот, то есть 10
13. Чтобы это событие произошло, число микроорганизмов должно быть на несколько порядков больше, чем обычно бывает при инфекциях. Предупреждение лекарственной устойчивости лежит в основе комбинированной терапии туберкулеза. При монотерапии микобактерии туберкулеза часто приобретают устойчивость к препарату, а одновременное назначение двух и более противотуберкулезных средств существенно повышает шансы на успех лечения. Другим примером служит лечение стафилококковых инфекций (например, эндокардита протезированных клапанов и остеомиелита) рифампицином. Добавление второго препарата позволяет избежать появления устойчивых к рифампицину штаммов стафилококков (Zim-merli et al., 1998). С той же целью комбинированную терапию назначают и при инфекции, вызванной Helicobacter pylori (Taylor et al., 1997). В отношении прочих инфекций убедительных данных о том, что комбинированная терапия предотвращает возникновение лекарственной устойчивости, нет.
Недостатки комбинированной терапии [ править | править код ]
К ним относятся повышение риска побочных эффектов, появление полирезистентных штаммов и высокая стоимость. Кроме того, как уже было отмечено, бактериостатические и бактерицидные препараты могут действовать антагонистично. Клиническое значение антагонизма антимикробных средств остается неясным. Хотя in vitro он наблюдается довольно часто, in vivo случаи антагонизма редки. Наиболее яркий пример такого антагонизма—лечение пневмококкового менингита.
В 1951 г. Леппер и Даулинг заметили, что при лечении пневмококкового менингита пенициллином летальность составила 21%, а при одновременном назначении хпортетрациклина она увеличилась до 79% (Lepper and Dowling, 1951). Позднее эти данные были подтвержаены другими исследователями, обнаружившими увеличение летальности бактериального менингита у детей с 4,3 до 10,5% при комбинированной терапии ампициллином, хлорамфениколом и стрептомицином по сравнению с монотерапией ампициллином (Mathies at al., 1967).
Антагонизм возникает только в том случае, если оба препарата активны в отношении данного микроорганизма, и в большинстве случаев не играет сколько-нибудь заметной роли. Несмотря на то что комбинация бактериостатического и бактерицидного препарата обычно дает лишь бактериостатический эффект, лечение в большинстве случаев все равно будет успешным благодаря действию защитных механизмов. Если же эти механизмы не срабатывают и для излечения инфекции необходимо бактерицидное действие (например, при менингите, эндокардите, у больных с нейтропенией при инфекциях, вызванных грамотрицательными бактериями), эффективность антимикробной терапии снижается.
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Проблема рациональной антибактериальной терапии инфекций дыхательных путей не теряет актуальности и в настоящее время. Наличие большого арсенала антибактериальных препаратов, с одной стороны, расширяет возможности лечения различных инфекций, а с другой
Проблема рациональной антибактериальной терапии инфекций дыхательных путей не теряет актуальности и в настоящее время. Наличие большого арсенала антибактериальных препаратов, с одной стороны, расширяет возможности лечения различных инфекций, а с другой — требует от врача-клинициста осведомленности о многочисленных антибиотиках и их свойствах (спектр действия, фармакокинетика, побочные эффекты и т. д.), умения ориентироваться в вопросах микробиологии, клинической фармакологии и других смежных дисциплинах.
Согласно И. В. Давыдовскому, «врачебные ошибки — род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Ошибки в антибактериальной терапии инфекций дыхательных путей имеют наибольший удельный вес в структуре всех лечебно-тактических ошибок, совершаемых в пульмонологической практике, и оказывают существенное влияние на исход заболевания. Кроме того, неправильное назначение антибактериальной терапии может иметь не только медицинские, но и различные социальные, деонтологические, экономические и другие последствия.
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Тактические ошибки антибактериальной терапии
I. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
Наиболее распространенная ошибка в амбулаторной практике — назначение антибактериальных препаратов при острых респираторных вирусных инфекциях (ОРВИ), имеющее место как в терапевтической, так и в педиатрической практике. При этом ошибки могут быть обусловлены как неправильной трактовкой симптоматики (врач принимает ОРВИ за бактериальную бронхолегочную инфекцию в виде пневмонии или бронхита), так и стремлением предотвратить бактериальные осложнения ОРВИ.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Одной из распространенных ошибок при проведении антибактериальной терапии является назначение одновременно с антибиотиком противогрибковых средств с целью профилактики грибковых осложнений и дисбактериоза. Следует подчеркнуть, что при применении современных антибактериальных средств у иммунокомпетентных пациентов риск развития грибковой суперинфекции минимален, поэтому одновременное назначение антимикотиков в этом случае не оправдано. Комбинация антибиотика с противогрибковым средством целесообразна только у больных, получающих цитостатическую или противоопухолевую терапию или у ВИЧ-инфицированных пациентов. В этих случаях оправдано профилактическое назначение антимикотиков системного действия (кетоконазол, миконазол, флуконазол), но не нистатина. Последний практически не всасывается в желудочно-кишечном тракте и не способен предотвратить грибковую суперинфекцию иной локализации — полости рта, дыхательных или мочевыводящих путей, половых органов. Часто практикующееся назначение нистатина с целью профилактики дисбактериоза кишечника вообще не находит логического объяснения.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Сandida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Сandida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
Определяющим фактором выбора препарата должен быть спектр природной активности антибиотика: необходимо, чтобы он охватывал основных возбудителей внебольничных инфекций дыхательных путей (см. таблицу 3).
Кроме того, при выборе препарата следует учитывать уровень приобретенной резистентности возбудителей в популяции. Основные тенденции, касающиеся резистентности возбудителей, отмеченной в последние годы, отражены в таблице 4. Наиболее значимые проблемы, связанные с применением основных антибактериальных средств при инфекциях дыхательных путей, могут быть сформулированы следующим образом.
С учетом вышесказанного, оптимальными средствами для лечения внебольничных инфекций дыхательных путей в настоящее время могут быть признаны β-лактамные антибиотики и новые фторхинолоны (см. таблицу 5). Использование макролидов должно быть ограничено — препараты можно назначать при нетяжелой пневмонии у детей или пациентов молодого возраста, особенно при наличии признаков атипичного течения (микоплазменная, хламидийная).
 |
| Таблица 5. Значение антибактериальных средств при инфекциях нижних дыхательных путей в амбулаторной практике. |
Следует подчеркнуть, что назначение некоторых антибактериальных препаратов, применяемое в амбулаторной практике при респираторных инфекциях, нельзя признать рациональным. К таким препаратам прежде всего относятся:
В таблице 6 приведены современные рекомендации по антибактериальной терапии внебольничных респираторных инфекций, с учетом всех требуемых критериев и доказанной эффективности в контролируемых клинических исследованиях.
Представленные рекомендации имеют наиболее общий характер. В то же время с практических позиций выбор оптимального антибактериального препарата также должен осуществляться с учетом особенностей пациента и заболевания. Так, например, у больных пневмонией молодого и среднего возраста без отягощающих факторов терапевтический эффект оказывают амоксициллин, макролиды, защищенные пенициллины и новые фторхинолоны. Однако у больных пожилого возраста в этиологии заболевания большее значение приобретают S. aureus и грамотрицательные бактерии, что объясняет снижение эффективности амоксициллина и макролидов у этой категории больных.
Также распространенной во врачебной практике ошибкой является отказ от назначения антибактериальной терапии при пневмонии беременным женщинам из-за опасения негативного влияния препаратов на плод. Следует отметить, что перечень антибактериальных препаратов, прием которых нежелателен во время беременности из-за риска эмбриотоксического действия, ограничен — тетрациклины, хлорамфеникол, сульфаниламиды, ко-тримоксазол, фторхинолоны, аминогликозиды. Другие антибиотики, в частности β-лактамы, макролиды, могут применяться у беременных женщин.
Другие возможные факторы, влияющие на выбор антибактериального препарата, представлены в таблице 7.
 |
| Таблица 7. Особые клинические ситуации при внебольничных инфекциях нижних дыхательных путей. |
Нередки ошибки при выборе антибактериального препарата в случае неэффективности первоначального. Здесь необходимо также остановиться на ошибках антибактериальной терапии, которые касаются несвоевременной оценки неэффективности первоначального антибиотика. Общепринятым критическим сроком оценки эффективности (или неэффективности) антибактериальной терапии считаются 48—72 ч с момента его назначения. К сожалению, приходится нередко сталкиваться с такими случаями, когда больной продолжает получать назначенный антибиотик в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Обычно критерием эффективности антибактериальной терапии является снижение или нормализация температуры тела больного, уменьшение признаков интоксикации. В тех случаях (не столь частых), когда лихорадка с самого начала заболевания отсутствует, приходится ориентироваться на другие признаки интоксикации (головная боль, анорексия, общемозговая симптоматика и т. д.), а также на отсутствие прогрессирования заболевания за период проводимого лечения.
Продолжение антибактериальной терапии, невзирая на ее неэффективность, имеет немало негативных последствий. При этом затягивается назначение другого, более адекватного антибиотика, что ведет к прогрессированию воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией) и развитию осложнений, а также удлиняет сроки лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов препаратов, а также развития и усиления антибиотикорезистентности. Продолжение лечения, несмотря на неэффективность проводимой терапии, подрывает доверие больного и его родственников к лечащему врачу. Очевидна и неэкономичность такой ошибочной тактики антибактериальной терапии (напрасный расход неэффективного АП, дополнительные затраты на лечение токсических эффектов и др.).
Кроме того, ошибки встречаются при замене неэффективного антибиотика на другой, т. е. при смене препарата. При этом врач забывает, что принцип выбора антибактериального препарата остается прежним, т. е. ориентироваться следует на клиническую ситуацию с учетом, однако, неэффективности первоначального препарата и ряда других дополнительных признаков. Отсутствие эффекта от первоначально назначенного антибиотика в известной степени должно служить дополнительным ориентиром, позволяющим обосновать выбор второго препарата. Так, например, отсутствие эффекта от применения β-лактамных антибиотиков (пенициллины, цефалоспорины) у больного с внебольничной пневмонией позволяет предполагать атипичную этиологию пневмонии (микоплазменной, хламидийной или легионеллезной) с учетом, разумеется, других клинических признаков.
Клинические признаки атипичной пневмонии, вызванной Mycoplasma pneumoniae или Chlamydia pneumoniae:
Наличие клинических признаков атипичной пневмонии делает обоснованным назначение антибактериальных препаратов из группы макролидов, доксициклина или фторхинолонов (левофлоксацин, моксифлоксацин, офлоксацин).
III. Ошибки в выборе режима дозирования антибактериального препарата
Ошибки в выборе оптимальной дозы антибактериального средства могут заключаться в назначении как недостаточной, так и избыточной дозы препарата. И те и другие ошибки чреваты негативными последствиями.
Если доза антибиотика недостаточна и не создает в крови и тканях дыхательных путей концентрацию, превышающую минимальную дозу для подавления основных возбудителей инфекции, что является условием эрадикации соответствующего возбудителя, то это не только может служить одной из причин неэффективности терапии, но и создает реальные предпосылки для формирования резистентности микроорганизмов. Ошибки в выборе оптимальной дозы могут быть связаны как с назначением недостаточной разовой дозы, так и с неправильным режимом дозирования (недостаточная кратность введения).
В качестве примера неадекватного режима дозирования антибиотиков при внебольничной пневмонии можно привести амоксициллин, который ранее рекомендовался в суточной дозе до 1 г. Однако современные рекомендации предполагают назначение амоксициллина в суточной дозе 1,5 и даже 3 г для преодоления возможной резистентности S. pneumoniae. Примеры неадекватных режимов дозирования антибиотиков в амбулаторной практике при респираторных инфекциях приводятся в таблице 8.
 |
| Таблица 8. Неадекватные режимы дозирования пероральных антибактериальных препаратов в амбулаторной практике при респираторных инфекциях у взрослых. |
Неправильный выбор интервалов между введениями антибактериальных препаратов обычно обусловлен не столько сложностями парентерального введения препаратов в амбулаторных условиях или негативным настроем больных, сколько неосведомленностью практикующих врачей о некоторых фармакодинамических и фармакокинетических особенностях препаратов, которые должны определять режим их дозирования. Типичной ошибкой является назначение в амбулаторной педиатрической практике при пневмонии бензилпенициллина с кратностью введения два раза в сутки, так как более частое его введение неудобно для пациента. Следует отметить, что при нетяжелом течении пневмонии вряд ли оправдано стремление некоторых врачей к обязательному назначению парентеральных антибиотиков. Современные антибактериальные препараты характеризуются хорошей биодоступностью при приеме внутрь, а также одинаковой клинической эффективностью с парентеральными препаратами, поэтому в подавляющем большинстве случаев оправдано лечение пероральными препаратами. Если назначение парентеральных антибиотиков действительно необходимо, следует выбрать препарат с длительным периодом полувыведения (например, цефтриаксон), что позволяет назначать его один раз в сутки.
IV. Ошибки при комбинированном назначении антибиотиков
Одной из ошибок антибактериальной терапии внебольничных респираторных инфекций является необоснованное назначение комбинации антибиотиков. Врачи старших поколений помнят то время (50—70-е гг. прошлого столетия), когда при лечении пневмонии обязательным считалось назначение пенициллина и стрептомицина, о чем свидетельствовали многие учебные пособия и руководства. Это был своеобразный стандарт лечения пневмоний для того времени. Несколько позднее одновременно с антибиотиками рекомендовалось назначение сульфаниламидов, с учетом полученных в свое время З. В. Ермольевой данных о химиотерапевтическом синергизме сульфаниламидов и пенициллина.
В современной ситуации, при наличии большого арсенала высокоэффективных антибактериальных препаратов широкого спектра, показания к комбинированной антибактериальной терапии значительно сужены, и приоритет в лечении респираторных инфекций остается за монотерапией. В многочисленных контролируемых исследованиях показана высокая клиническая и бактериологическая эффективность адекватных антибактериальных средств при лечении респираторных инфекций в режиме монотерапии (амоксициллин, амоксициллин/клавуланат, цефалоспорины II-III поколений, новые фторхинолоны). Комбинированная антибактериальная терапия не имеет реальных преимуществ ни в выраженности эффекта, ни в предотвращении развития резистентных штаммов.
Основными показаниями к комбинированной антибактериальной терапии являются тяжелое течение пневмонии — в этом случае общепринятым стандартом лечения становится комбинированное назначение парентерального цефалоспорина III поколения (цефотаксим или цефтриаксон) и парентерального макролидного антибиотика (эритромицин, или кларитромицин, или спирамицин); последние включаются в комбинацию для воздействия на вероятных атипичных микроорганизмов (легионелла или микоплазма). Следует отметить, что в настоящее время в клинической практике появились новые антибактериальные препараты (левофлоксацин, моксифлоксацин) с высокой активностью в отношении как типичных, так и атипичных возбудителей, что позволяет назначать их в режиме монотерапии даже при тяжелой пневмонии.
Другой клинической ситуацией, оправдывающей комбинированное назначение антибиотиков, является пневмония у иммунокомпрометированных пациентов (лечение цитостатиками, СПИД), при которой имеется высокая вероятность ассоциации возбудителей (см. таблицу 7).
К сожалению, часто в амбулаторной практике приходится сталкиваться с ситуациями, при которых больным с нетяжелым течением пневмонии, при отсутствии осложнений, тяжелой фоновой патологии назначается два антибиотика. Логичного обоснования этой тактики лечения нет, при этом следует учитывать возможный антагонизм препаратов, более высокий риск нежелательных реакций и увеличение стоимости лечения.
Следует отметить, что нерациональные комбинации антибактериальных препаратов имеют и официальные лекарственные формы, которые выпускаются отечественной фармацевтической промышленностью, например ампиокс, олететрин. Разумеется, применение таких препаратов недопустимо.
V. Ошибки, связанные с длительностью антибактериальной терапии и критериями клинической эффективности
В некоторых случаях проводится необоснованно длительная антибактериальная терапия. Такая ошибочная тактика обусловлена, прежде всего, недостаточным пониманием цели самой антибактериальной терапии, которая сводится прежде всего к эрадикации возбудителя или подавлению его дальнейшего роста, т. е. направлена на подавление микробной агрессии.
Собственно воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками (аускультативная картина, сохраняющаяся рентгенологическая инфильтрация, ускорение СОЭ) регрессирует медленнее и не требует продолжения антибактериальной терапии (см. таблицу 9). В связи с этим следует считать ошибочной тактику, согласно которой у больногос сохраняющимися рентгенологическими признаками легочной инфильтрации, крепитирующими хрипами (crepitacio redux), увеличением СОЭ при нормализации температуры тела и исчезновении (или уменьшении) признаков интоксикации продолжают проводить антибактериальную терапию.
 |
| Таблица 9. Сроки исчезновения симптомов при эффективной антибактериальной терапии внебольничной пневмонии. |
Еще более ошибочна тактика замены одного антибиотика на другой в подобных ситуациях, расцениваемых врачом как неэффективность назначенной антибактериальной терапии. У некоторых больных после исчезновения признаков интоксикации и даже регрессии воспалительных изменений в легких в течение длительного времени может сохраняться слабость, потливость, субфебрильная температура. Последняя расценивается врачом как проявление не полностью купированной бронхолегочной инфекции, что «подтверждается» рентгенологическими данными в виде изменения легочного рисунка или «остаточными явлениями пневмонии» и обычно влечет за собой назначение антибактериального препарата, несмотря на отсутствие изменений со стороны крови. Между тем подобная клиническая ситуация часто обусловлена вегетативной дисфункцией после легочной инфекции (постинфекционная астения) и не требует антибактериальной терапии, хотя, разумеется, в каждом конкретном случае необходимы тщательное обследование больного и расшифровка всей имеющейся симптоматики.
Рекомендованная длительность применения антибактериальных препаратов при бронхолегочных инфекциях приведена в таблице 10.
 |
| Таблица 10. Длительность антибактериальной терапии бактериальных респираторных инфекций в амбулаторной практике. |
Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва