что такое синдром кабуки
Синдром Кабуки – это редко встречающееся моногенное заболевание, характеризующееся своеобразными фенотипическими признаками и интеллектуальной дефицитарностью. Больные имеют лицевые особенности (миндалевидный разрез глаз, страбизм, арочные брови, широкую переносицу, низко посаженные оттопыренные уши и др.), скелетные аномалии, пороки внутренних органов, олигофрению. Диагностика основывается на клинических критериях, подтвержденных генетическими анализами. Лечение сводится к коррекции врожденных аномалий, угрожающих жизни и здоровью ребенка, терапии сопутствующих расстройств (аутоиммунных, эндокринных, инфекционных и др.).
МКБ-10
Общие сведения
Синдром маски Кабуки (синдром грима Кабуки) получил свое название по внешнему виду и выражению лица больных, придающих им сходство с персонажами одноименного японского театра. Известно, что актеры театра Кабуки наносят на лицо специальный грим, особо выделяя глаза и брови, а в кульминационные моменты представления застывают на месте, устремив взгляд в одну точку и сводя глаза к переносице. Патология описана в 1981 году двумя авторами, представившими наблюдения за пациентами с характерными фенотипическими чертами, и в их честь именуется также синдромом Ниикава-Куроки. Синдром относится к категории орфанных: в Японии его частота составляет 1:32000, на Западе – 1:86000. На сегодняшний день описано порядка 350 случаев заболевания.
Причины
Патология имеет гетерогенную этиологию. Известно, что синдром является врожденным. Большая часть диагностированных случаев заболевания носит спорадический характер и развивается вследствие мутаций, возникающих «де ново». Факторы, влияющие на изменчивость, не определены. В 2010-2012 г.г. изучены две наиболее часто регистрируемые наследственные формы синдрома, в основе которых лежат мутации генов:
В генетических исследованиях встречаются данные о сочетании синдрома Кабуки с другими наследственными заболеваниями: синдромом Фрейзера, гипокалиемическим периодическим параличом, синдромом Фанкони, сахарным диабетом 1 типа. Сообщается о наличии у больных структурных перестроек хромосом, таких как кольцевая Х-хромосома, транслокации, дупликации, инверсии 8 хромосомы. Относительно небольшая выборка пациентов и сравнительно недавнее внедрение молекулярно-цитогенетических методов диагностики оставляют перспективы для дальнейших исследований этиологии синдрома.
Патогенез
Ввиду неполной изученности причин синдрома Ниикава-Куроки патологические механизмы также остаются недостаточно ясными. Наиболее освещены роль и влияние мутаций в генах KMT2D и KDM6A. Оба гена выступают эпигенетическими регуляторами модификации гистонов (ядерных белков) и играют важную роль в процессе экспрессии генов. Дефекты кодируемых ими ферментов изменяют метилирование лизина в гистоне H3, что приводит к развитию гетерогенных врожденных аномалий (черепно-лицевых, скелетных, висцеральных), неврологических и эндокринных нарушений. Кроме этого, KMT2D и KDM6A принимают участие в дифференцировке наивных CD4+ Т-лимфоцитов в иммунокомпетентные клетки. Этим объясняется тот факт, что у многих пациентов с синдромом Кабуки отмечаются иммунные нарушения, проявляющиеся как снижением противоинфекционной защиты, так и аутоиммунными расстройствами.
Симптомы
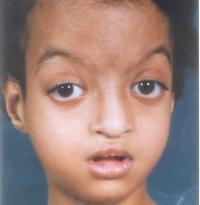
Клиническая картина характеризуется множественными дефектами, затрагивающими различные анатомические системы: лицевой скелет, опорно-двигательный аппарат, кожные покровы, сердечно-сосудистую систему, ЖКТ, мочеполовые органы, анализаторы и пр. Также выявляются нарушения неврологического, эндокринного, иммунного статуса различной степени выраженности. Наиболее патогномоничны для синдрома лицевой дисморфизм, который делает лица пациентов, похожими на маску актеров театра кабуки, низкорослость и снижение интеллекта.
Лицевые аномалии включают микроцефалию, высоко поднятые (аркообразные) брови, гипертелоризм, антимонголоидную глазную щель (опущение наружных уголков глаз относительно внутренних), эктропион нижнего века. Дополняют портрет больного с синдромом Кабуки низко расположенные торчащие и деформированные уши, широкий приплюснутый нос, маленький рот с тонкими губами. Реже отмечается голубоватая окраска склер, небные расщелины, заячья губа, микрогнатия, аномалии зубов (гиподонтия, микродонтия, неправильный прикус). Своеобразное выражение лица заметно уже в раннем детстве, с годами же черты приобретают еще более грубый и гротескный вид.
Отклонения в развитии костно-суставной системы представлены деформацией позвонков, сколиозом, недоразвитием трубчатых костей, полиморфными аномалиями пальцев рук (брахидактилией, синдактилией, арахнодактилией, клинодактилией), деформацией стопы. Уже на первом году жизни обнаруживается задержка роста, в последующем низкорослость сохраняется и становится более заметной. Характерна гипермобильность суставов, являющаяся причиной частых вывихов. Со стороны кожных покровов встречается гиперэластичность кожи, наличие гипо- и гиперпигментированных пятен, гиперемия кожи лица, алопеция и гирсутизм. Важный дерматоглифический маркер – выступающие подушечки пальцев рук.
Из висцеральных пороков при синдроме Кабуки наиболее часты и клинически значимы ВПС (дефекты перегородок, единственный желудочек, коарктация аорты, тетрада Фалло, транспозиция магистральных сосудов), аномалии ЖКТ (незавершенный поворот кишечника, атрезия ануса, врожденные диафрагмальные грыжи), пороки развития мочевого тракта (гидронефроз, подковообразная почка). У девочек может отмечаться преждевременное телархе, у мальчиков – крипторхизм, гидроцеле и микропенис.
Анатомическим дефектам сопутствуют функциональные расстройства ‒ синдромы мальабсорбции и холестаза, сердечные блокады, мочеточниковый рефлюкс. Патология зрительного анализатора включает миопию, астигматизм, катаракту, птоз, косоглазие. У большинства детей диагностируется тугоухость.
У 80% пациентов обнаруживаются неврологические нарушения: гипотонус мышц, тремор, судороги, эпилепсия, ЗПРР. Степень олигофрении варьирует от слабой до умеренно выраженной. Могут наблюдаться черты аутистического поведения, обсессивно-компульсивный синдром.
Ввиду дефектов иммунной регуляции и снижения уровня сывороточных Ig отмечаются частые инфекции, аутоиммунные патологии (тромбоцитопеническая пурпура, геморрагический васкулит.), гематологические заболевания (гемолитическая анемия). Из гормональных нарушений наиболее часты СД 1 типа, врожденный гипотиреоз, снижение секреции СТГ и АКТГ, ожирение.
Осложнения
Потенциальные осложнения тесно связаны с теми мультисистемными поражениям, которые имеются у ребенка. У новорожденных возможны серьезные нарушения сосания и глотания, требующие установки желудочного зонда или гастростомы. Также в младенчестве отмечаются необъяснимые эпизоды гипогликемии, угрожающие переходом в гипогликемическую кому. Врожденные пороки сердца могут вызывать серьезные гемодинамические расстройства, требующие проведения кардиохирургических вмешательств. Частые ОРВИ нередко осложняются отитами, пневмониями. Прогрессирующая атрофия зрительных нервов может приводить к слепоте. У больных с синдромом Кабуки имеется повышенный риск развития лимфолейкоза и неходжкинских лимфом.
Диагностика
Основная проблема диагностики – низкая информированность специалистов первичного звена о данном синдроме, отсутствие четко выработанных клинических критериев и методов лабораторной верификации заболевания. Диагноз в основном устанавливается на основании фенотипичеких маркеров; в крупных медицинских центрах доступно генетическое тестирование. Первичная диагностика проводится генетиком, однако пациенты с синдромом Кабуки требуют обследования и курации целым рядом специалистов: педиатром, кардиологом, неврологом, ортопедом, урологом, иммунологом, ортодонтом и т. д. Этапы обследования включают:
При высоких рисках рождения ребенка с генетическими аномалиями назначается инвазивная пренатальная диагностика с последующим полногеномным секвенированием. Дифференциальная диагностика осуществляется с другими генетическими синдромами, сопровождающимися множественными нарушениями развития: Ди Джорджи, Ван-дер-Вуда, Мельника-Фрейзера, Элерса-Данло, Чарджа и другими.
Лечение синдрома Кабуки
Ввиду генетической детерминированности заболевания полное излечение невозможно. Стандарты терапии синдрома не регламентированы, на практике применяется симптоматический подход к устранению тех нарушений, которые мешают развитию ребенка. Хирургическая патология (грыжи, ВПС, расщелины ЧЛО, атрезия анального канала, крипторхизм и т.п.) устраняются в ходе оперативного лечения.
Сопутствующие аутоиммунные расстройства корригируются назначением глюкокортикоидов, иммуносупрессоров, моноклональных антител. Рецидивирующие инфекционные процессы диктуют необходимость применения антибактериальных средств, внутривенного введения человеческого иммуноглобулина. При выявлении диабета 1-го типа решается вопрос о назначении инсулинотерапии.
Прогноз и профилактика
Дети, страдающие синдромом Кабуки, нуждаются в постоянном уходе и наблюдении, социальной адаптации, инклюзивном образовании. Семье, воспитывающей такого ребенка, требуется психологическая поддержка. В связи с большим количеством сложных дефектов (анатомических, иммунологических, эндокринных, неврологических) качество и продолжительность жизни пациентов снижены. Профилактика спорадических случаев синдрома не разработана, ведущую роль здесь отводится грамотной прегравидарной подготовке, исключению воздействия мутагенных факторов среды. Выяснить вероятность наследования синдрома Кабуки ребенком при наличии семейных случаев патологии позволяет генетическое консультирование.
Синдром Кабуки. Неврологические аспекты, клиническое наблюдение
Полный текст
Аннотация
Кабуки синдром [Kabuki syndrome, Kabuki make-up syndrome, Niikawa-Kuroki syndrome] (KС) относится к редким генетическим расстройствам, при котором вовлекаются множественные системы организма. Из неврологических проявлений при КС характерными являются микроцефалия, мышечная гипотония, судорожный синдром, парез глазодвигательных нервов, слабость сосательного и глотательного рефлексов, тугоухость, умственная отсталость.
Ключевые слова
Полный текст
Впервые синдром кабуки (СК) был одновременно описан Niikawa et al. и Kurokiet et al. в 1981 г. [1, 2]. Частота встречаемости СК составляет в Японии 1 : 32 000, а в западных странах — 1 : 86 000 [3]. Выделяют два типа СК в зависимости от вида мутации в генах. СК 1-го типа (СК1) с аутосомно-доминантным типом наследования, который вызывают гетерозиготные патогенные мутации в гене KMT2D (другое его название — MLL2), кодирующем лизинспецифическую метилтрансферазу 2D (lysine-specific methyl transferase 2D). Ген KMT2D расположен на хромосоме 12q13.12 [4]. СК 2-го типа (СК2) — Х-сцепленное заболевание, развивающееся в результате гетерозиготной патогенной мутации в гене KDM6A, кодирующем гистон-деметилазу, взаимодействующую с геном KMT2D. Ген KDM6A локализован на Х-хромосоме (Xp11.3) [4–7]. У большинства больных (70 %) регистрируют СK1, СK2 выявляют значительно реже — в менее чем 5 % случаев [7].
Название СК получил из-за соответствия фенотипических проявлений пациентов маскам, используемым в танцевальном представлении традиционного японского театра (рис. 1).
Рис. 1. Маска театра кабуки
Fig. 1. Kabuki theater mask
Для СК характерен лицевой дизморфизм, включающий низко посаженные уши, антимонголоидный разрез глаз, длинные глазные щели, густые ресницы, выворот нижнего века (эктропион), брови в виде арок с редким ростом в их боковой части, широкую переносицу, приплюснутый кончик носа, большие оттопыренные уши, низкий рост волос [1, 2, 3, 8]. С самого рождения у младенцев описывают снижение сосательного и глотательного рефлексов, что зачастую приводит к необходимости постановки гастростомы [8, 9].
К частым офтальмологическим находкам при СК относится паралич отводящего нерва, нистагм, косоглазие, птоз [10, 11]. T.P. Mc Veigh описал при СК микрофтальмию [11]. Для СК характерна такая форма косоглазия, при которой имеются негрубая малоугловая эзотропия (др.-греч. ἔσω — «внутрь», греч. τρόπος — «поворот») и выраженное нарушение бинокулярного зрения (рис. 2).
Рис. 2. Пациент с синдромом кабуки. Малоугловая эзотропия в среднем положении. Легкое ограничение отведения обоих глаз (Kim N.G., 2011)
Fig. 2. A patient with Kabuki syndrome. Small angle esotropia in the middle position. Slight limitation of abduction in both eyes. Published by N.G. Kim, 2011
При неврологическом осмотре в 30 % случаев обнаруживают диффузную мышечную гипотонию [3, 9]. Вместе с тем при мышечной биопсии не выявляют никаких отклонений от нормы [8]. У большинства детей наблюдается длительное нарушение координации движений в виде тремора кистей и стоп [12].
Для СК характерна постнатальная задержка роста. К 6–10 годам у некоторых больных развивается ожирение [9].
Судороги при СК возникают в 36–45 % случаев в любой возрастной категории, но чаще у девочек [13, 14]. Средний возраст начала эпилепсии составляет 11 лет (9,5–12,8 года). По данным M. Lodi et al., при СК на интериктальной ЭЭГ регистрируется фокальная эпилептическая активность в лобно-центральной области или лобно-центрально-теменных регионах, а также диффузная высокоамплитудная спайк-волновая активность с нормальной ЭЭГ сна [14]. H. Ito описал случай с развитием синдрома Веста у шестимесячной девочки. К возрасту 9 месяцев применение витамина В6, вальпроевой кислоты и зонисамида способствовало исчезновению гипсаритмии и формированию спорадических спайковых и волновых эпилептиформных комплексов в теменно-затылочных областях; однако к двум годам у ребенка сформировалась глубокая умственная отсталость [15]. N. Matsumoto, N. Niikawa пришли к выводу, что при СК имеется широкий диапазон клинической вариабельности, в 84 % случаев IQ ниже 80 [16]. В возрасте старше трех лет у детей формируется расстройство аутистического спектра, проявляющееся ограниченным кругом интересов, бедностью эмоций, тягой к жеванию несъедобных предметов и пр. [17]. Отражением комплексного нарушения социального и интеллектуального развития при СК является системное недоразвитие речи за счет недоразвития интеллекта, праксиса и слуха, выявляемое в 100 % случаев [18, 19]. В 14 % случаев СК сохраняется нормальный интеллект и отмечаются нормальные показатели физического развития [19].
В большинстве случаев антиэпилептическая терапия хорошо контролирует эпилептические приступы (ЭП): при миоклонических судорогах в терапии наиболее эффективен леветирацетам. Вместе с тем фокальные ЭП трудно поддаются лечению: у двух пациентов ЭП имели резистентный характер, что привело к развитию эпилептического статуса и летальному исходу [13, 14, 20].
В настоящее время выявлено 13 генетических поломок, ассоциированных с СК [21]. Несмотря на то что в большинстве случаев находят мутацию в гене MLL2, ее отсутствие при клиническом фенотипе СК наводит на мысль, что заболевание может быть результатом генетической гетерогенности с более сложными межгеномными взаимодействиями [22].
По данным нейроизображения при СК обнаруживают вентрикулодилатацию боковых желудочков, гипоплазию мозолистого тела, гипоплазию аденогипофиза [23, 24]. C. Grunseich опубликовал случай развития выраженного тремора и симметричного повышения сигнала от чечевицеобразного ядра, красных ядер и зубчатых ядер с двух сторон при легком снижении церебральной диффузии [12]. S. Yoshioka описал двухлетнего мальчика с задержкой роста, мышечной гипотонией и клиническими проявлениями СК. При МРТ выявлена микрогирия в области сильвиевой щели [24]. В литературе описано развитие окклюзионной гидроцефалии в результате стеноза водопровода мозга у взрослого пациента с СК, у которого в младенчестве были зафиксированы мышечная гипотония, нарушение сосания, судороги с трансформацией в синдром Веста, микроцефалия. Позднее диагностирована атрофия мозга, задержка полового созревания и роста, дефицит соматотропного гормона, сахарный диабет [25].
Скелетные аномалии включают патологию черепа (микроцефалию), готическое нёбо, расщелину твердого нёба в сочетании с заячьей губой, в 68 % случаев зубные аномалии (широкие зубные промежутки, недостаточное количество зубов, неправильный прикус); эпителиальный крестцово-копчиковый ход, повышенную подвижность суставов (74 %), сколиоз, короткие пальцы рук (особенно мизинцев), изменение дерматоглифики ладони — фетальные подушечки на кончиках пальцев [3, 5, 8].
Грыжи (пупочные/паховые, диафрагмальные), вывихи бедра/надколенников/плеча, крипторхизм, гипоспадия, нарушение развития почек (28 %), аномалии развития трахеобронхиального дерева, атрезия желчных путей, диафрагмальная грыжа и другие аноректальные аномалии — неполный спектр хирургической патологии при СК [8]. В 42–50 % случаев диагностируют врожденные пороки сердца — дефекты в клапанах сердца или перегородках сердца, коарктацию аорты, транспозицию крупных сосудов [26, 27].
Эндокринная патология представлена гипотиреозом, диабетом, гипогликемией (гиперинсулинизм) или сахарным диабетом, поздним половым созреванием, гипофизарным нанизмом [3, 7, 23, 24].
При СК нарушается иммунный статус, картина фенотипически напоминает общую вариабельную иммунную недостаточность [27, 28]. Среди лабораторных иммунных нарушений выявляют снижение одного или нескольких классов сывороточных иммуноглобулинов (дефицит IgA встречается в 80 % случаев) [28]. Это обусловлено тем, что гены KMT2Dи KDM6A принимают участие в эпигенетической регуляции и оказывают существенное влияние на развитие иммунокомпетентных клеток. Выход наивных Т- и В-клеток из тимуса и костного мозга при СК соответствует норме [29]. Пролиферация Т-клеток и формирование специфических антител после иммунизации существенно нарушены: выявлено снижение памяти В- и Т-клеток, что объясняет развитие дисгаммаглобулинемии и иммунорегуляторных расстройств в течение всего детства [27, 30]. Аутоиммунные нарушения проявляются развитием идиопатической тромбоцитопенической пурпуры (хроническое или рецидивирующее течение), кумбс-позитивной гемолитической анемии, аутоиммунного тиреоидита, витилиго, сахарного диабета, артрита, нефрита, целиакии, болезни Крона [31, 32]. В связи с феноменом иммунной дерегуляции дети восприимчивы к рецидивирующим инфекциям (средний отит, инфекция верхних вдыхательных путей, пневмония), что регистрируют в 63 % случаев [30].
Принципы терапии синдрома кабуки
Стандарты терапии при СК до сих пор не разработаны. Врожденные аномалии при необходимости корригируют с помощью хирургических вмешательств. При рецидивирующих инфекциях проводят углубленное обследование для исключения аномалий развития. На фоне дефицита иммуноглобулинов назначают заместительную терапию внутривенным иммуноглобулином. Лечение аутоиммунных расстройств включает назначение глюкокортикоидов, иммуносупрессивных препаратов (микофенолата мофетил), биологических генно-инженерных препаратов (ритуксимаб). Есть единичные сообщения о проведении спленэктомии при рефрактерной иммунной тромбоцитопении [31]. У пациентов с СК существует повышенный риск развития нервно-мышечной блокады и злокачественной гипертермии. В этой связи при необходимости выполнения оперативного вмешательства применяют ремифентанил как альтернативный анестетик [33].
Диагноз СК устанавливают по клиническим признакам и комбинации лицевого дисморфизма с мышечной гипотонией, сниженным IQ. Для подтверждения диагноза определяют мутации в генах KMT2D (MLL2) или KDM6A. Дифференциальный диагноз проводят с алкогольной фетопатией (опущение кончика носа, микроцефалия, снижение интеллекта, низкорослость); коллагенопатией Элерса – Данлоса (гипермобильность/растяжимость суставов, кожи, голубые склеры, повышенная ломкость капилляров кожи, нормальный интеллект); с CHARGE-синдромом (колобома, врожденный порок сердца, атрезия хоан, задержка роста, аномалия гениталий, нарушение слуха; мутации в гене CHD7); делецией 22q11 (врожденные пороки сердца, низкий IQ, расщелина нёба, малые уши, поднятая верхняя губа, широкий кончик носа; низкорослость в детстве, уменьшающаяся ко взрослому возрасту).
Клинический случай
Мальчик М., 8 мес., поступил экстренно с жалобами на судорожные приступы. Наблюдается задержка психомоторного развития. ЭП происходят три раза в день в виде адверсии глаз влево и тонического напряжения в руках, сериями по 2–3 мин. На момент поступления получал вигабатрин 85 мг/кг в сутки.
Из раннего анамнеза известно, что рожден от второй беременности (первая беременность — выкидыш на сроке 6 недель), протекавшей с 30 недель с фетоплацентарной недостаточностью, гестозом легкой степени, маловодием, сахарным гестационным диабетом. Роды на 39-й неделе, вес при рождении 3130 г, рост 50 см, оценка по шкале Апгар 7/7 баллов, выписан на 4-е сутки жизни. До 1,5 месяца мать отмечала у ребенка эпизоды беспричинного беспокойства, снижение двигательной активности. В возрасте 1,5 месяца развился первый ЭП в виде отведения глаз и подергивания конечностей. На ЭЭГ зарегистрирован паттерн «вспышка – подавление». Проведена МРТ головного мозга, при которой выявлена задержка миелинизации белого вещества. Мальчику назначена постоянная антиэпилептическая терапия (кеппра, конвулекс). Так как терапия оказалась неэффективной, добавлен вигабатрин. Обследован на врожденные болезни накопления (кровь ТМС, моча на органические кислоты, лактат/пируват) — данных за нарушение митохондриального окисления, митохондриальное заболевание и аминоацидопатии не получено. Мутаций, соответствующих фенотипу пациента, не выявлено. В связи с отсутствием контроля над ЭП в возрасте 8 мес. проведен курс стероидной терапии, выписан с улучшением — приступы сократились до 1–2 раз в сутки (несерийные, парциальные в виде адверсий глаз влево, кивков головы, тонического напряжения в руках).
Неврологический статус в возрасте 8 мес.: состояние по заболеванию тяжелое. Голова микроцефальной формы, 44 см (норма — 44,85–46,7 см, менее 3-го центиля). Вес 9 кг (75-й центиль), рост 67 см (норма — 68,15–71,30 см, менее 3-го центиля). Гипертрихоз области лба, низкий лоб, лицевой дисморфизм — аркообразные брови, низкий фильтрум, опущенный кончик носа, укорочение мизинцев (рис. 3, 4).
Рис. 3. Мальчик М. с синдромом кабуки 1-го типа: a — возрасте 3 нед.; b — возраст 8 мес.; c — возраст 16 мес. Лицевой дисморфизм, мышечная гипотония, задержка развития
Fig. 3. A boy M., with Kabuki syndrome 1 type: a — 3-week—old; b — 8 months; c — 16 months. Dysmorphic facial features, floppy baby syndrome, developmental delay
Рис. 4. Мальчик М. с синдромом кабуки 1-го типа. Брахидактилия
Fig. 4. The boy М. with Kabuki syndrome type 1. Brachydactyly
Вскармливается из рожка, поперхивается при попытке накормить твердой пищей. Имеется легкое альтернирующее сходящееся косоглазие. Спонтанная частая адверсия глаз вверх. Продуктивный контакт отсутствует — визуальное внимание составляет до 20 секунд. Гулит на фоне хорошего самочувствия. Не смеется. Длительно беспричинно беспокоится, успокаивается при укачивании на руках. Выпрямительные реакции не развиты. Умеренное повышение мышечного тонуса в дистальных отделах конечностей, грубее в ногах, ретракция ахилловых сухожилий. Объем пассивных движений в суставах полный. Сухожильные рефлексы оживлены с рук, высокие — с ног. Пальцы рук сжаты в кулачки, зрительно-моторная координация не развита, симптом Бабинского (+), симптом Гюстера (+). Спонтанная двигательная активность носит хаотичный, некоординированный характер.
Соматический статус. Аппетит переменный, сон укороченный, беспокойный. Повышенное потоотделение головы. Кожные покровы обычной окраски, патологической сыпи нет. Язык обложен белым налетом. Периферические лимфоузлы не увеличены. Дыхание жесткое, выслушиваются проводные хрипы. ЧД — 18–22 в минуту. При аускультации сердца тоны ясные, ритмичные. ЧСС — 98–118, патологических шумов нет. Живот напряжен, немного вздут. Повышенный метеоризм. Стул с задержкой. Печень и селезенка пальпаторно не увеличены. Почки не пальпируются. Мочеиспускание по возрасту.
Результаты обследований в возрасте 8 мес.:
Реакция Кумбса — отрицательная. Диагностирована гемолитическая, кумбс-отрицательная гиперрегенераторная анемия.
Рис. 5. Мальчик М. с синдромом кабуки 1-го типа. Малоугловая эзотропия в среднем положении
Fig. 5. The boy M. Kabuki Syndrome type 1. Small angle esotropia in the middle position
Рис. 6. ЭЭГ мальчика М. в возрасте 8 мес. Диффузное замедление фонового ритма, более выраженное в задних отделах. Региональная эпилептиформная активность в левой височно-теменно-затылочной области
Fig. 6. A patient M., 8 months. EEG. Diffuse slowing of the background rhythm, more pronounced in the posterior parts. Regional epileptiform activity in the left temporal-parietal-occipital region
Рис. 7. МРТ мальчика М. с синдромом кабуки 1-го типа в возрасте 1 мес. (a, c, e, f) и 8 мес. (b, d, f, h). Атрофические изменения в лобно-височных отделах полушарий мозга и замедление миелинизации области ствола, заднего бедра внутренней капсулы
Fig. 7. MRI of the boy M. with 1 type Kabuki syndrome at the age of 1 month (a, c, e, f) and 8 months (b, d, f, h). Atrophic changes in the frontal-temporal hemispheres of the brain and slowing myelination of the trunk, posterior limb of the inner capsule
В дальнейшем проводили подбор антиэпилептической терапии. В этой связи осуществляли нейрофизиологический контроль (рис. 8).
Рис. 8. ЭЭГ мальчика М. с синдромом кабуки 1-го типа: a — возраст 9 мес. Паттерн модифицированной гипсаритмии с региональным акцентом в левой височной области; b — возраст 10 мес. Диффузное замедление фонового ритма, периодическое региональное замедление и эпилептиформная активность в левой височной области; c — возраст 12 мес. Диффузное замедление фонового ритма, эпилептиформная активность не регистрируется
Fig. 8. EEG, the boy M. with molecular-positive 1 type Kabuki syndrome: a — at the age of 9 months — is a pattern of modified hypsarrhythmia with a regional accent in the left temporal region; b — EEG at the age of 10 months. Diffuse slowing of background rhythm with periodic regional slowing and epileptiform activity in the left temporal region; c — EEG at the age of 12 months. Diffuse slowing of the background rhythm, epileptiform activity is not recorded
Соматическое состояние резко ухудшилось после введения стероидов: приступы затяжного беспокойства, отказ от еды, лихорадка, рвота, многократный жидкий стул. В связи с развившей острой энтеропатией стероиды были отменены. По результатам повторной иммунограммы IgA — 0,04 г/л (снижение, референтные значения — 0,08–0,91).
В возрасте 11 мес. в терапию добавлен зонегран. На этом фоне ЭП сохранялись по типу инфантильных спазмов сериями по 2–3 мин, с частотой несколько раз в день. Попытки отмены вигабатрина (трижды) были неэффективны, что проявлялось учащением ЭП. Затем зонегран был заменен на трилептал — приступы сократились до 1 раза в сутки, преимущественно возникали на фоне дремоты и засыпания. Ребенок был проконсультирован генетиком, выставлен основной диагноз: «Синдром кабуки 1-го типа (молекулярно позитивный, мутация в гене KMT2D). Симптоматическая мультифокальная эпилепсия, резистентная к терапии». Сопутствующий диагноз: «Синдром гиперрегенераторной анемии. Синдром холестаза. Пиелоэктазия, стабильное течение».
В связи с сохраняющимися эпилептическими приступами в возрасте 14 мес. ребенку введена кетогенная диета. Проведена ЭЭГ (сон 70 мин + пробуждение): на фоне дезорганизации фоновой ритмики зарегистрирована интериктальная эпилептиформная активность (комплексы «острая – медленная волна») амплитудой 105 мкВ в левых височных отведениях, с косой ориентацией диполя, с реверсией отрицательной фазы Т5. Физиологические паттерны сна сформированы по возрасту. Во сне регистрируется вышеописанная интериктальная эпилептиформная активность с низким индексом. Эпилептические приступы отсутствуют (рис. 9).
Рис. 9. Мальчик М. с синдромом кабуки 1-го типа в возрасте 12 мес. ЭЭГ (сон + бодрствование). Состояние на фоне кетогенной диеты. Интериктальная эпилептиформная активность (комплексы «острая – медленная волна») амплитудой 105 мкВ в левых височных отведениях (a) с косой ориентацией диполя, с реверсией отрицательной фазы Т5 (b). Исследование проведено в г. Тольятти
Fig. 9. The boy M. with 1 type Kabuki syndrome at the age of 12 months. EEG (sleep + wakefulness) — after a ketogenic diet. Interictal epileptiform activity (complexes “sharp-slow wave”) with an amplitude of 105 mV in the left temporal areas (a), with an oblique orientation of the dipole, with a negative phase reversal T5 (b). The study wasconducted in Toliatti
Законные представители пациента дали согласи на обработку и публикацию персональных данных и иллюстративных материалов.
Обсуждение
В литературе описаны патогенные и непатогенные мутации в генах KMT2D и KDM6A. У больных с фенотипическими признаками СК патогенные мутации выявляют в 55,8–80,0 % случаев [34]. Патогенные мутации не описаны у фенотипически здоровых людей. При СК встречаются мутации-негативные и мутации-позитивные пациенты [28, 34]. Как причина развития заболевания описаны малые делеции или инсерции, нонсенс- и миссенс-мутации, нарушения рамки считывания, часть из них являются патогенными, некоторые — с неизвестным клиническим значением (рис. 10).
Рис. 10. Спектр мутаций гена KMT2D: a — схематическое изображение гена KMT2D. Каждый тип мутации иллюстрируется точкой с определенным сочетанием цвета и формы. Каждая вертикальная точка представляет генетическую мутацию, описанную в литературе. Красным цветом обозначена патогенная мутация; b — схематическое изображение мутаций в гене KMT2D (Liu S. et al, 2015)
Fig. 10. The spectrum of KTM2D gene mutations: a — schematic representation of the KMT2D gene. Each type of mutation is illustrated by a dot with a specific combination of color and shape. Each vertical point represents a genetic mutation described in the literature. Red color denotes pathogenic mutation; b — schematic representation of mutations in the KMT2D gene. Published by Liu S. et al., 2015
Патогенные мутации в гене KMT2D могут быть выявлены в мозаичной форме, а носитель может передать эту мутацию потомству [34]. У 20–45 % пациентов с СК генетическая основа остается неизвестной, что свидетельствует о генетической гетерогенности заболевания [4–6, 8, 33, 34].
Наиболее характерные фенотипические проявления СК представлены лицевым дизморфизмом (94 %), нарушением вскармливания в раннем возрасте (100 %), мышечной гипотонией (100 %). К дополнительным признакам СК относят брахидактилию, гиперрастяжимость суставов, дисплазию ногтей (80 %) [3, 7]. К другим аномалиям при СК относят гипертрихоз, левые пороки сердца, скелетные, урогенитальные и аноректальные врожденные аномалии [7, 8, 33]. Фенотипические признаки заболевания у мутации-негативных и мутации-позитивных пациентов не различаются [3].
У мальчика М. наблюдается картина дизонтогенетической ранней энцефалопатии с признаками дисморфии. В этой связи был заподозрен генетический синдром. При проведении полного секвенирования экзома выявлена мутация chr 12:49433219 А>С в гене KMT2D в гетерозиготном состоянии, расположенном на хромосоме 12q13.12. Данный вид CK обусловлен нарушением функции лизинспецифической метилтрансферазы 2D (lysine-specific methyltransferase 2D) и обусловлен наследованием от отца (фенотипически здоров). Из дополнительных признаков заболевания у ребенка выявлены: гемолитическая кумбс-негативная анемия, дисфункция гепатобилиарного тракта (гепатомегалия, повышение альфа-ФП, цианокобаламина крови, щелочной фосфатазы), дисгаммаглобулинемия, пиелоэктазия. К возрасту 12 мес. у мальчика развилась резистентная к терапии эпилепсия, проявляющаяся полиморфными парциальными эпилептическими приступами и инфантильными спазмами.
По данным литературы, у детей с синдромом кабуки в лечении синдрома Веста эффективен зонисамид [15]. В нашем случае зонисамид оказался неэффективен, но наблюдалась высокая чувствительность ЭП к вигабатрину. Несмотря на снижение индекса эпилептиформной активности на интериктальной ЭЭГ сна, у ребенка сохраняются сложно-парциальные ЭП во время дремоты и пробуждения, редкие инфантильные спазмы. У мальчика отмечается выраженная задержка психомоторного развития.
Выводы
Данный клинический случай демонстрирует молекулярно-позитивный синдром кабуки 1-го типа. Большинство зарегистрированных мутаций KMT2D являются de novo и обнаруживаются в спорадических случаях. Анализ варианта chr 12:49433219 А>С в гене KMT2D по базам данных не зарегистрирован. Таким образом, в нашем случае у мальчика выявлена редкая мутация, унаследованная от отца, имеющего нормальный фенотип и интеллектуальное развитие. Не исключена передача мутации в мозаичной форме. Особенность данного случая заключается в развитии у мальчика резистентной младенческой эпилепсии, чувствительной к вигабатрину и кумбс-отрицательной гемолитической терапии. Ранняя диагностика СК имеет решающее значение для семейного и генетического консультирования, что определяет вид и сроки терапевтических вмешательств. Специалисты должны быть осведомлены, что синдром кабуки имеет клинико-молекулярный полиморфизм, а база биологических и медицинских знаний будет ежегодно обновляться.