что такое сероконверсия при коронавирусе
Бессимптомная сероконверсия иммуноглобулинов при SARS-CoV-2-инфекции и как она может уберечь медперсонал от COVID-19.
Ранее сообщалось, что отделения гемодиализа госпиталей подвержены высокому риску распространения инфекционных заболеваний. Причинами называют невозможность соблюдать социальное дистанцирование в открытых отсеках, большое числа сменяющих друг друга пациентов, а также значительное число процедур как при подготовке к гемодиализу, так и во время его проведения.
Целью исследования, проведённого на базе отдельно стоящего амбулаторного педиатрического отделения для гемодиализа с пятью койками и тремя изолированными помещениями в Riley Hospital for Children, Indianapolis, USA и опубликованного в JAMA, было измерить уровни серийных антител против SARS-CoV-2 у пациентов, медсестер, врачей и обслуживающего персонала, присутствовавших при проведении гемодиализа у пациента с симптомами вирусной инфекции.
Начать проведение данного исследования было решено после того как стало известно, что 7 дней назад (день 0) у одного из пациентов наблюдались лихорадка и общие симптомы вирусного заболевания. Результат ПЦР теста на SARS-CoV-2 в мазке из носоглотки оказался положительным, и оставался положительным при повторных тестах на 7, 14 и 19 день. Сеансы гемодиализа ему проводились в изолированной комнате, начиная со дня 0. При этом весь персонал отделения и пациенты, которым производился гемодиализ, всегда были в масках.
Измерения уровня сывороточного IgM и IgG в сыворотке из образцов цельной крови были произведены у 13 пациентов, проходивших гемодиализ в отделении, у 11 медсестер и 10 врачей отделения, а также у 4 человек из обслуживающего персонала на 7, 14 и 21 дни от начала исследования. Сероконверсией считались положительные анализы на IgM или IgG.
Между 0-м и 7-м днем у 2 человек из медицинского персонала отмечались симптомы вирусного заболевания верхних дыхательных путей и лихорадка при отрицательных результатах ПЦР теста. В дальнейшем один из них сероконвертировал на 21-й день, несмотря на 3 отрицательных результата ПЦР. У остальных участников исследования не проводилось назофарингеальное тестирование на SARS-CoV-2 и не было симптомов COVID-19 до 7-го дня.
К 21 дню у 11 из 25 сотрудников отделения (44%) и у 3 из 13 пациентов (23%) были обнаружены положительные антитела к SARS-CoV-2. При том, что ни у одного из участников исследования между 7 и 21 днями не наблюдалось симптомов заболевания. У одного человека из медицинского персонала, который непосредственно опекал ПЦР-положительного пациента и у двух из 11 медицинских работников, которые ухаживали за 2 двумя пациентами с субклинической сероконверсией, в дальнейшем были обнаружены антитела против SARS-CoV-2. Все они оставались бессимптомными, несмотря на то, что у одного из них всё же был положительным результат теста на ПЦР в мазке из носоглотки.
Данное исследование продемонстрировало высокую распространенность субклинической сероконверсии у лиц, находящихся в контакте с возможными носителями SARS-CoV-2. Это дает надежду, что большее число работников здравоохранения может быть антитело положительными, чем можно было бы ожидать. Информация о серопревалентности медсестер и врачей позволит стратегически правильно укомплектовать персонал по уходу за SARS-CoV-2-позитивными больными и пациентами с подозрением на положительную реакцию, и тем самым уменьшить риск заражения, которому подвергаются медицинские работники в период пандемии COVID-19.
Поскольку это исследование имеет небольшой размер выборки и короткое последующее наблюдение, необходимы более масштабные исследования данной проблемы.
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
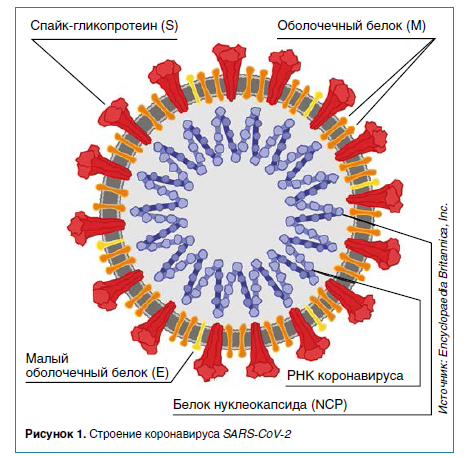
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
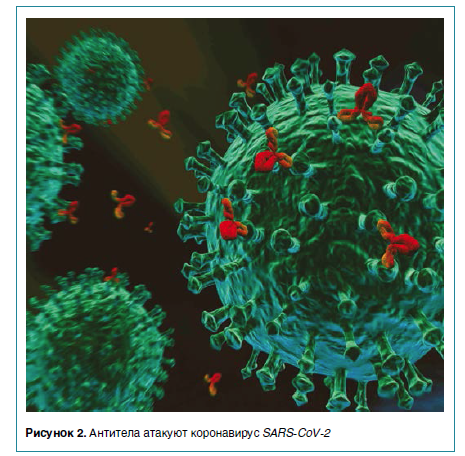
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
«Есть повод для паники» Чем опасен новый штамм коронавируса и что ждать от омикрона россиянам? Отвечает биолог
Пока в России доминирующим штаммом коронавируса считается дельта, за пределами страны появляются все новые и новые варианты инфекции. 11 ноября стало известно о возникновении так называемого омикрон-штамма. Его выявили в Южной Африке, а к концу месяца по всему миру начали всерьез из-за него переживать: считается, что новый вариант коронавируса опаснее предыдущих, а риск заражения омикроном есть даже у переболевших COVID-19. В Кремле заявили, что вопрос локдауна пока не рассматривается, но специалисты будут действовать по ситуации. В РФПИ уже занялись исследованием эффективности существующих вакцин против омикрона. Насколько опасен новый вариант вируса для России, чем он отличается от дельты и насколько эффективны против него современные препараты, «Лента.ру» спросила доктора биологических наук, профессора Школы системной биологии Университета Джорджа Мейсона (Вирджиния, США) Анчу Баранову.
Что за новый штамм на нас напал?
Баранова: Повод для паники есть, но пока чисто биоинформатический. Находки опасных мутаций — в сиквенсе вируса, то есть чисто предсказательные. Как этот штамм поведет себя в европейских популяциях, еще предстоит увидеть. И как его нейтрализуют антитела, выработанные от вакцин, тоже предстоит увидеть. Равно как и предстоит оценить скорость распространения нового штамма в популяциях, где сейчас идет волна дельты. В течение двух недель станет все более-менее понятно.
Чего боятся биологи?
В сиквенсе вируса вызывают опасения места, в которых произошли мутации. Вот есть S-белок коронавируса (шип). У него есть рецептор-связывающий домен (RBD), с помощью которого вирус проникает в клетку человека. Это такая болвашка, которая торчит на S-белке, и к ней цепляются нейтрализующие антитела. Так вот на этой болвашке десять мутаций. То есть сохранных мест, куда могли бы подцепиться антитела, там довольно мало, основные площадки для антител выбиты, их просто нет.
Получается, что антитела не могут уверенно распознать S-белок, а значит, не могут облепить собой вирус и обезвредить его. И это самая большая опасность, тем более что мы уже знаем, что люди, заболевшие омикроном в Гонконге, были полностью провакцинированы
Мутации омикрона могут говорить о том, что инфицированные будут переносить болезнь тяжелее?
Мы об этом пока ничего не знаем. В чатах, где коллекционируют лучшие юморески про коронавирус, недавно появился новый мем: «Главный симптом омикрона — чудовищная усталость». Тут же ответ на картинке: «А, значит, я буду чувствовать себя как обычно. Что тогда волноваться?».
Просто пока все люди, что заболели в Южной Африке, — молодые. Там такая структура населения. По ней сложно реальную картину представить, пожилых не было. Вот когда придут данные из Европы — тогда и узнаем.
Количество мутаций в омикроне в несколько раз больше, чем в «ужасной» дельте. Как так получилось, что эволюция вируса прошла незаметно для человечества? Не было выявлено до этого никаких предшественников омикрона?
Это как раз легко объяснить. В Южной Африке полно ВИЧ-инфицированных. И они не получают терапию в достаточном объеме. Один месяц пьют таблетки, а на другой — нет денег на лекарства. Поэтому у них все время полускомпенсированное иммунное состояние. В Африке очень много людей, способных к длительному носительству коронавируса, для них он становится хроническим заболеванием. А когда вирус сидит в одном и том же организме долгое время, и при этом на него развивается какой-никакой субстандартный иммунный ответ, у этого вируса появляются условия для эволюции.
Можно ли одновременно заразиться сразу двумя штаммами коронавируса — дельтой и омикроном?
В теории, наверное, можно. Удача — такая случайная вещь. Наверное, можно пофантазировать, что кому-то «повезет»: сначала один вирус начихали и тут же — другой. Но эти вирусы начнут конкурировать между собой, чтобы занять человеческие клетки. Точно так же, как будут конкурировать вирусы в популяции. Когда идет конкуренция, то, как правило, вирусы не идут друг с другом нос в нос длительное время. Кто-то начинает побеждать и занимает все пространство.
То есть для человека неважно, инфицировался он тремя, двумя штаммами или одним. На раннем этапе какая-то из разновидностей вируса победит. Чтобы несколько вариантов коронавируса остались надолго — это вряд ли.
Однако инфицирование сразу коронавирусом и вирусом какой-то другой разновидности простуды — бывает. Такая картина примерно у десяти процентов больных. Течет обычно как простой коронавирус.
А вот ситуация, когда в результате внутренней эволюции у конкретного человека могут возникнуть два разных клона одного и того же вируса, более опасна
Например, человек лечится глюкокортикостероидами (синтетические гормоны, которые используются при неотложных состояниях, — прим. «Ленты.ру») и при этом долго лежит на аппарате искусственной вентиляции легких. Его пытаются спасти. Как раз такие больные и служат резервуарами для появления новых вариантов вируса. Но выбора у нас тут нет — именно с помощью глюкокортикостероидной терапии спасаются жизни.
По статистике, в африканских странах по сравнению с другими мало коронавируса. Почему? Там просто плохой учет?
Есть теория гигиены, моя любимая. И мне кажется, что в случае с коронавирусом тоже что-то от нее есть. Чем чистоплотнее люди, чем меньше их дети ползают в грязи, тем больше вылезает потом каких-то аллергий и чего-то еще. То есть грязь в каких-то количествах полезна. Эту теорию не я придумала, она достаточно широко обсуждается. Но это одна из гипотез того, почему в Африке так мало тяжелых случаев ковида. Например, европейцы активно истребляют тех же глистов — остриц. Нам неприятно думать, что в нашем организме черви. А в Африке никуда особо от этого не денешься. Нравится, не нравится — у многих детей есть острицы. Эти глисты учат иммунную систему не особо сильно реагировать на чужеродные антигены, поэтому там гораздо меньше астмы и аллергии.
С ковидом — та же самая история. Когда ковидом болеют в легком режиме, покашлял немного, потемпературил — это не трагедия. Трагедия — когда возникает цитокиновый шторм. А этот шторм — гиперреакция иммунной системы организма, по каким-то компонентам можно назвать ее аллергической реакцией. У европейцев иммунитет в основном нетренированный, поэтому наша иммунная система начинает сходить с ума. А если бы она раньше встречалась с какими-то антигенами-глистами, она бы привыкла с ними жить.
Гипотеза чистоты, конечно, не единственная — здесь и малый вклад пожилых в структуру африканских популяций, ну и, конечно, не слишком интенсивное тестирование.
Есть вероятность, что омикрон со временем исчезнет?
Всегда есть такая вероятность. Никто не видел, как этот штамм взаимодействует в популяции с дельтой.
Представьте себе футбольное поле, на котором три кочки. Футболист по полю бегает. Шансов, что он врежется в кочку, довольно мало. А если на этом поле 500 кочек, то шансов гораздо больше. Если футболист будет между ними бегать, то получится вынос мозга, а не игра. Когда «футбольное поле» занято дельтой — а этот штамм лидирует и в США, и в России, — новый вирус прийти туда и захватить территорию так просто не может. А в Африке — может. Поэтому то, что омикрон так быстро начал расти в Африке в базах данных по количеству, еще не значит, что он так же быстро начнет расти в Европе, России и США. Но это мы скоро увидим по результатам внутренней трансмиссии вируса в тех странах, куда этот новый штамм прилетел.
А если начнет вытеснять дельту, как спасаться?
Тогда нужно будет делать новую вакцину
Утешительный приз: все наработанные схемы лечения продолжат работать. Мутации омикрона на них никак не влияют. То есть омикрон все же пока не Мегатрон (главный антагонист франшизы «Трансформеры» — прим. «Ленты.ру»).
Семь вопросов о новом штамме коронавируса «омикрон»
1. Чем новый штамм «омикрон» отличается от других штаммов коронавируса?
— Новый геновариант коронавируса линии B.1.1.529 по классификации ВОЗ получил название «омикрон» и признан вариантом, вызывающим озабоченность (VOC).
Мутации в этом варианте, которые в различных комбинациях встречались и ранее, оказывают влияние на трансмиссивность и контагиозность вируса, то есть повышают заразность вируса, усиливают связываемость с рецепторами, потенциально усиливают проникновение вируса в клетки, влияют на увеличение инфекционности. Поэтому новый вариант коронавируса действительно вызывает серьезные опасения и требует немедленного и всестороннего изучения.
2. Когда впервые новый штамм «омикрон» был обнаружен?
— Первоначально вариант омикрон был обнаружен в Южной Африке. Самые ранние образцы датированы 9-11 ноября 2021 г. 23 ноября в базу GISAID был загружен образец последовательности из Гонконга (образец был взят 12 ноября 2021 г.). 25 ноября был загружен еще один образец из Гонконга (от 18 ноября). 27 ноября был загружен образец из Израиля (от 20 ноября). Также 27 ноября была загружена полногеномная последовательность нового вируса SARS-CoV-2, выделенного 24 ноября в Бельгии. Все новые страны заявляют об обнаружении у них штамма «омикрон».
3. Обнаружен ли новый штамм «омикрон» в Российской Федерации?
— На сегодняшний день подтвержденных случаев обнаружения в России этого штамма нет. Роспотребнадзор продолжает тщательный мониторинг.
4. Могут ли существующие тест-системы определить новый штамм «омикрон»?
— Все ПЦР-тест-системы, применяемые в России, эффективны в том числе для выявления заболевания новым штаммом «омикрон».
Для углубленной лабораторной дифференциальной диагностики ЦНИИ эпидемиологии Роспотребнадзора с момента опубликования полногеномной последовательности нового штамма уже разработал диагностикум. Он позволит не только подтвердить диагноз, а определить принадлежность образца коронавируса именно к этому штамму.
5. Тех, кто вернулся из зарубежных стран будут как-то специально обследовать на наличие нового штамма «омикрон»?
— На сегодняшний день на границе Российской Федерации, в аэропортах, организовано бесплатное тестирование граждан, прибывающих из рисковых стран – прежде всего из ЮАР, а также сопредельных африканских государств, Китайской Народной Республики, Великобритании, Израиля, Гонконга и ряда других стран, объявивших об обнаружении штамма «омикрон».
Гражданам, которые находились по личным нуждам, в африканском регионе, прежде всего в ЮАР, потребуется соблюдать 14-дневный карантин по возвращении. По оперативным данным речь идет о нескольких сотнях человек.
6. Эффективны ли российские вакцины против нового штамма «омикрон»?
— Ученые в мире и в Российской Федерации уже изучают особенности этого штамма, в том числе в части возможности его нейтрализации антителами, вызванными как вакцинацией, так и перенесенным ранее заболеванием.
7. Какие меры профилактики помогут избежать заражения новым штаммом «омикрон»?
— Меры профилактики заболевания в том числе новым штаммом остаются прежними – прежде всего вакцинация, ревакцинация, мытье рук, сокращение контактов, ношение масок, соблюдение социальной дистанции, использование антисептиков, регулярное проветривание.
Все эти простые, но эффективные меры направлены на снижение вероятности передачи вируса от человека к человеку и сохранят ваше здоровье и ваших близких.