что такое секвенирование генома коронавируса
Коронавирус встраивается в геном человека. Как это?
Фрагменты генома коронавируса могут включаться в геном человека, установили ученые из Массачусетского технологического института. Это может объяснить положительные тесты на инфекцию у переболевших, следует из исследования. Это значит, что коронавирус с нами навсегда?
Читайте «Хайтек» в
Как коронавирус может попасть в геном человека?
Как сообщает портал о биологии bioRxiv, исследователи из американского Массачусетского технологического института пришли к выводу, что небольшие фрагменты генома коронавируса COVID-19 способны включаться в ДНК человеческих хромосом. Это роднит новый коронавирус с ВИЧ, вызывающим СПИД.
Чтобы проверить, может ли геном РНК SARS-CoV-2 интегрироваться в ДНК наших хромосом, ученые добавили ген обратной транскриптазы (ОТ) — фермента, превращающего РНК в ДНК, в человеческие клетки, и культивировали сконструированные клетки с SARS-CoV-2.
В одном из экспериментов ученые использовали ген обратной транскриптазы из ВИЧ. Также они предоставили ген обратной транскриптазы с использованием последовательностей человеческого ДНК, известных как элементы LINE-1, которые являются остатками древних ретровирусных инфекций.
В итоге клетки, которые вырабатывают любую форму фермента, сделали так, что некоторые фрагменты РНК SARS-CoV-2 были преобразованы в ДНК и интегрированы в хромосомы человека.
Авторы эксперимента считают: несмотря на то, что работу проводили в лабораторных условиях, те же процессы могут запускаться и в человеческом организме при инфицировании новым коронавирусом. В группе риска — прежде всего пациенты с ВИЧ.
Что это значит?
На практике это может привести к ложноположительным тестам, которые будут показывать как «больного» уже переболевшего и более не заразного человека. Другие последствия такой генетической модификации человека пока не известны.
Элементы SARS-CoV-2, встраиваясь в человеческую ДНК, скорее всего, становятся субгеномными фрагментами. Иными словами, речь уже не о полноценном вирусе, а о его следах в ДНК. Возможно, именно из-за них у переболевших COVID-19 анализ ПЦР часто дает положительный результат даже после выздоровления.
Кроме того, открытым остается вопрос: способен ли SARS-CoV-2, встроившись в ДНК, производить собственные копии — как, например, делает ВИЧ. Сами авторы считают, что вероятность невелика: после интеграции в геном фрагментов РНК размножение нового вируса невозможно. А значит, переболевшие, несмотря на позитивные тесты, уже не заразны.
Есть ли другие мнения на это исследование?
Специалисты указывали на недостаток данных и на то, что лабораторные условия значительно отличаются от живого организма. Кроме того, вероятность интеграции вирусной РНК в геном с помощью элементов LINE-1 крайне мала — они редко проявляют активность в человеческой ДНК.
Молекулярный биолог Мариус Уолтер из Института исследований старения Бака (США) в Twitter призвал администрацию портала bioRxiv удалить публикацию, поскольку она содержит опасные и ничем не подкрепленные утверждения.
По его мнению, нет четких доказательств, что фрагменты человеческой ДНК, похожие на элементы SARS-CoV-2, появились в результате обратной транскрипции вирусной РНК. Тому есть другие объяснения, более правдоподобные, отметил он.
With all respect for the authors, I think this is an extremely poor paper. The good thing is, I also think it’s actually very easy to disprove. A few thoughts bellowhttps://t.co/0ITkKJin1b
Тем не менее, Дэвид Балтимор, американский биохимик, получивший Нобелевскую премию за открытие обратной транскриптазы, на страницах журнала Science назвал работу «впечатляющей и неожиданной».
Тем более пока не ясно, умирают ли в человеческом организме клетки, где произошел процесс обратной транскрипции, или продолжают жить.
Как еще коронавирус влияет на нас?
В начале декабря журнал Nature опубликовал статью о результатах исследования влияния генов на тяжесть течения коронавируса. Ученые исследовали ДНК пациентов почти 200 отделений реанимации британских больниц, у которых был подтвержден коронавирус. Затем геномы попавших в реанимацию сравнили с геномами здоровых людей, чтобы выявить возможные различия.
Исследование показало, что на тяжелое течение коронавируса может влиять ген TYK2, если у него есть дефект. Также отличия обнаружили в гене DPP9, который играет важную роль при воспалениях, и в гене OAS, препятствующем репликации вируса.
Молекулярные биологи из Германии детально изучили, как РНК коронавируса нового типа взаимодействует с содержимым человеческих клеток.
Ученые из Германии выделили несколько генов и вариаций в ДНК, из-за которых в 2-3 раза увеличивается вероятность осложнений при COVID-19 или потенциальный летальный исход. Часть из них отвечает за подавление инфекций, другие играют важную роль в цикле размножения самого вируса. Они отвечают за сбор ферментов, которые тот использует при производстве новых копий самого себя.
Для того, чтобы понять это, исследователи составили список белков, которые так или иначе взаимодействуют с частицами SARS-CoV-2 при их проникновении в клетки человека.
В результате выяснилось, что коронавирус так или иначе взаимодействует со 104 пептидами человека. Как показал анализ, 20 из них могут или подавить, или развить инфекцию. О некоторых из них, таких как EIF4F и EIF4B, ученые уже знали из предыдущих опытов.
Исследователи из Университета Тоямы и Тоямского института здравоохранения нашли прямую корреляцию между количеством РНК вируса SARS-CoV-2 в крови пациента и тяжестью течения COVID-19.
Чтобы проверить эту идею, они провели ретроспективное исследование 56 пациентов, поступивших с COVID-19 в несколько центров Японии в период с 13 апреля по 28 сентября 2020 года. Исследователи сравнили анализы вирусной РНК в их крови с ПЦР-тестами из носоглотки, собранными в течение семи дней после образца сыворотки.
Результаты исследования показали, что у критических пациентов РНК-эмиссия наблюдалась в 100 процентах случаев, у тяжелых — в половине, у умеренных — в 4 процентах случаев, а у легких и бессимптомных ее не было совсем.
В результате гипотеза авторов исследования подтвердилась: по количеству вирусной РНК в крови можно судить о тяжести течения болезни.
Ученые из Великобритании заметили, что у 20% пациентов, выздоровевших от коронавируса, есть повышенный риск развития психических расстройств. Они отмечают, что эта тенденция связана со стрессом и физическими последствиями болезни.
В исследовании, опубликованном в журнале The Lancet Psychiatry, провели анализ электронных медицинских карт 69 млн человек в США, среди них были 62 тыс. пациентов, которые переболели коронавирусом. Процент психических расстройств среди последних был выше, причем они развивались в течение трех месяцев после выздоровления.
В течение трех месяцев после положительного теста на коронавирус у каждого пятого исследуемого нашли первые признаки тревоги, депрессии или бессонницы. Это было примерно в два раза чаще, чем у других групп пациентов за тот же период.
Специалисты в области психического здоровья, не принимавшие участия в исследовании, сказали, что эти результаты могут свидетельствовать о том, что коронавирус может воздействовать на мозг человека, увеличивая риск развития сразу нескольких психических заболеваний.
Долгосрочные последствия
Недавний опрос, проведенный в группе поддержки тех, кто страдает от последствий коронавирусной инфекции, показал усталость — наиболее частый из 50 основных симптомов.
Несмотря на сильнейшую слабость, люди с постковидом нередко жалуются на бессонницу. Им бывает сложно заснуть. Но даже если это удается, через 2-3 часа многие внезапно просыпаются и уже не могут погрузиться обратно в сон.
Исследования показывают, что коронавирус поражает эндотелий — слой клеток, выстилающий внутреннюю поверхность кровеносных сосудов. Это приводит к воспалению, боли в сосудах (особенно ощутимой на руках или ногах), появлению красной сыпи-«паутинки», просвечивающей сквозь кожу.
Почечная недостаточность наблюдалась примерно у каждого седьмого пациента с тяжелой формой COVID‑19.
«Интересных штаммов будет всё больше и больше». Как в НИИ Пастера ищут изменения в структуре коронавируса — и как SARS-CoV-2 мутирует в Петербурге
С начала 2021 года в НИИ Пастера ищут случаи заражения новыми штаммами коронавируса. За почти три месяца в Петербурге официально не выявили ни одного. При этом специалисты уверены: штаммы уже циркулируют в популяции, а в будущем их будет больше.
«Бумага» поговорила с руководительницей проекта секвенирования генома SARC-CoV-2 Анной Гладких и сотрудницей института Елизаветой Рогачевой о том, как и из-за чего мутирует вирус, почему за долгое время удалось расшифровать не более 200 геномов и как за время пандемии менялись штаммы, распространившиеся на Северо-Западе.
Анна Гладких
руководитель проекта секвенирования генома коронавируса в НИИ Пастера, старший научный сотрудник группы молекулярной генетики патогенных микроорганизмов отдела эпидемиологии
Как мутирует коронавирус и почему до недавнего времени не было слышно о различных штаммах
— Почему вообще появляются новые штаммы?
— Коронавирус [SARC-CoV-2] — это одноцепочечный РНК-вирус. Попадая в клетку, он многократно умножается, чтобы распространиться. У коронавируса нет системы репарации, то есть системы для исправления ошибок в своей собственной нуклеиновой кислоте. В результате многократного умножения происходят изменения последовательности РНК. Они и являются мутациями.
— Как понимаю, таких мутаций достаточно много, но не все они влияют на свойство вируса?
— Да. То, что мы часто слышим о британском, южноафриканском, бразильском, нигерийском штаммах, — это результат их известности. Они считаются наиболее эпидемически опасными, поэтому о них и говорят.
На самом деле других штаммов коронавируса в природе очень много. Но не все они делают вирус более агрессивным или влияют на его распространение. Поэтому об этих штаммах и не говорят.
— Почему одни штаммы влияют на биологию вируса, а другие — нет?
— Нужно сказать, что геном вируса состоит из нескольких генов, кодирующих белки, и некодирующих областей. Если мутация происходит в некодирующей области, то она не влияет на какой-либо белок. Есть ряд мутаций, которые не приводят к изменению кодируемой аминокислоты (так называемые silent mutation), — соответственно, они никак не влияют на производимый ею белок.
Сейчас больше говорят о тех мутациях, которые каким-то образом изменяют характер связи с рецептором клетки человека. Если сродство к рецептору усиливается, то эти штаммы и считают более агрессивными.
— Возможно ли проследить примерную хронологию мутации коронавируса в мире? Почему до конца 2020-го почти ничего не было слышно об этих штаммах?
— Первый штамм коронавируса возник в китайском Ухане в конце 2019 года, именно он стал распространяться по всему миру. При этом уже тогда он начал меняться. Штаммы, которые затем выявлялись в Европе, уже имели точечные мутации. Когда штаммы попали в Россию, они уже были не идентичны первому штамму из Уханя.
Британский вариант выявили в сентябре 2020 года. Сначала о нем накапливалась информация, параллельно он получал распространение в Британии. Британский штамм — один из вариантов коронавируса, в котором сразу возникло очень много мутаций, по сравнению с другими распространенными на тот момент штаммами.
— Корректно ли говорить, что лишь в конце 2020 года появились такие массовые мутации, влияющие на свойства вируса?
— Думаю, к этому времени просто накопилась статистика по секвенированию. Ученые по всему миру стали массово получать эти последовательности и анализировать их.
Почему в Петербурге скорее всего есть британские и южноафриканские штаммы коронавируса, хотя их не находили
Примечание: НИИ Пастера исследует коронавирус на территории Северо-Западного региона. Ученым поступают образцы из 11 субъектов РФ, в том числе Петербурга.
— На Северо-Западе выявляли британские, южноафриканские, бразильские штаммы коронавируса?
— Британских и южноафриканских у нас не выявлено. Пока мы можем сказать, что штаммы Северо-Западного региона неоднородны, есть определенная вариабельность их геномов.
— Как вы думаете, почему так? Это отражает реальную ситуацию?
— Думаю, что на данный момент выявлены не все штаммы, которые реально циркулируют на территории. У нас нет таких мощностей, чтобы стопроцентно секвенировать штаммы от всех пациентов, заболевших коронавирусной инфекцией.
Я полагаю, что интересных штаммов со временем будет выявляться всё больше и больше. Пока нельзя сказать, насколько они распространены, сколько процентов они составляют в структуре заболеваемости. Прошло слишком мало времени.
— А о чем говорит то, что в России выявлено всего несколько десятков британских штаммов из тысяч проанализированных образцов?
— Я не могу делать заявления о том, какова доля британского штамма в общем числе выявленных случаев заболевания коронавируса в России и как они будут распространяться в дальнейшем.
Но то, что их больше, чем выявлено, — это понятно. Потому что охват секвенирования — выборочный. Дальше — больше. Будут ли они дальше распространяться в геометрической или линейной прогрессии — не знаю.
— Как вы думаете, эти штаммы уже присутствуют, например, в Петербурге, хотя их не выявили?
— Вероятно, да. Если они выявлены в других регионах (например, в Москве), то рано или поздно они появятся и у нас в Петербурге, потому что население у нас мобильное: люди путешествуют, ездят в другие страны.
— Известно, изменился ли штамм, который был наиболее распространен на Северо-Западе в начале пандемии?
— Когда первый штамм был выявлен, секвенирование еще масштабно не проводилось. То, что он изменился, — однозначно. Постоянно происходят какие-то мутации.
— Можно сказать, какой сейчас штамм наиболее распространен по Северо-Западу?
— Штаммов много. Точечные мутации возникают. Сказать, что один штамм превалирует, я не могу: это требует дополнительных исследований.
Как происходит расшифровка геномов коронавируса и в чем сложность этого процесса
— Зачем вообще нужно секвенирование ковидных штаммов?
— Секвенирование — расшифровка последовательностей либо части генома, либо полного генома. Оно предоставляет кладезь информации: мы можем узнавать, как устроен геном, сравнивать его с имеющимся геномом, изучать структуру генов, а соответственно, и белков. И, в частности, искать какие-то уникальные генетические события, характерные именно для новых штаммов. На основании расшифрованных последовательностей можно проследить родство штамма, был ли он завезен или он местный.
Я перечислила только некоторые аспекты. На самом деле данные полного генома можно использовать для множества других анализов.
— Какое практическое применение у секвенирования? Могут ли полученные знания помогать эпидемиологам, медикам?
— То, что мы сейчас проводим в НИИ Пастера (как одном из учреждений Роспотребнадзора), — и есть практическое применение. Нам, как и ряду других институтов, было поручено секвенировать и искать известные, считающиеся более опасными штаммы коронавируса.
По факту, мы проводим мониторинг: есть ли в Северо-Западном регионе штаммы британского, южноафриканского и бразильского типов. Конечно, если мы выявим эти штаммы, это поможет медикам и эпидемиологам — они смогут точнее прогнозировать, как будет распространяться вирус, представлять развитие эпидемии и степень вариабельность вируса. Секвенирование также дает понимание биологии вируса, его изменчивости, хода его эволюции.
Мы [в НИИ Пастера] занимаемся этим с начала 2021 года, когда был издан приказ Роспотребнадзора по осуществлению непрерывного мониторинга штаммов SARS-Cov-2 методами секвенирования. Согласно нему мы и проводим нашу работу. В НИИ Пастера мы имеем возможность осуществляем два вида секвенирования: фрагментное (участков генома) и полногеномное. Для этого мы применяем две разные технологии и два разных прибора.
— Давайте проговорим: ваша задача — из 30 тысяч нуклеотидов генома коронавируса найти несколько — один-два знака, — которые отличаются от исходного варианта? Это и есть расшифровка штамма?
— В целом вы правы, но порой их не один-два, а гораздо больше. Геном коронавируса состоит из чуть менее 30 тысяч нуклеотидов. Для британского, южноафриканского, бразильского вариантов известен ряд замен либо делеций (то есть выпадения нуклеотидов) по отношению к референсному штамму. Их мы и ищем в геноме. Нахождение этих замен или делеций говорит о том, что этот штамм принадлежит к тому или иному варианту.
Секвенирование — это сложный, многостадийный процесс, который требует соответствующей квалификации. Нужно внимательно относиться к получаемым данным, чтобы не дать ложноположительных или ложноотрицательных результатов. Мы не можем расходовать реактивы зря, делая ошибки и набивая шишки. То есть каждый запуск должен быть эффективным.
Полногеномным секвенированием по всему миру — в том числе и в России — занимаются только специалисты высокого уровня, владеющие современными методами молекулярной биологии и хорошо понимающие этот процесс.
Процесс это долгий. Подготовка «библиотек» (фрагментов нуклеиновой кислоты для секвенирования генома), например, занимает несколько дней. Есть протокол, по которому мы работаем: он включает много этапов, много различного оборудования (помимо самого секвенатора). Время полногеномного секвенирования зависит от степени сохранности клинического материала, который к нам поступает. Если он сильно деградирован или из него по какой-то причине сложно амплифицировать геном, то это требует больше времени, чем если материал свежий или хорошей сохранности. То есть время и сложность дополнительных манипуляций варьируется в зависимости от качества материала, и нам приходится варьировать методику практически в каждом случае.
Почему в России расшифровывают меньше геномов коронавируса, чем в Европе
— По последним данным, в России с начала 2021 года расшифровано 9 тысяч геномов коронавируса, из них выявили несколько десятков случаев британского штамма и единицы южноафриканского. Кажется, что это не очень большие цифры.
— Я считаю, что это серьезные цифры. И это то, что опубликовано — а что находится в работе, мы не знаем. Базы постоянно пополняются. Ведь чтобы выявить один британский вариант, нужно обработать сотни образцов.
Расшифровка 9 тысяч геномов — большая работа еще и потому, что, по сравнению с той же Великобританией, наши мощности сиквенсных центров намного меньше. И эти мощности, и количество задействованных специалистов несопоставимы. Так что те цифры по секвенированию, которые мы сейчас имеем — это хороший результат. Будем стремиться к большему.
— Мне сложно оценить, насколько их не хватает. Могу сказать, что у нас мощности другого порядка, нежели в институтах Европы.
Когда у нас такие задачи возникли, наши мощности — по-возможности — стали очень быстро наращиваться. Мы в институте Пастера делаем всё, что можем.
— Какие мощности в НИИ Пастера? Они отличаются от центров Европы?
— У нас один прибор, который мы используем для полногеномного секвенирования. Полагаю, что в сиквенсных центрах в Европе их десятки. Можно сразу предположить, сколько мы можем получить данных с одного прибора, даже если он будет работать непрерывно. Плюс, как я уже сказала, надо подготовить «библиотеки», сами образцы проанализировать, оценить их качество, подходят ли они для секвенирования, и так далее.
— Подытоживая: основная проблема — нехватка технологических мощностей, а не кадров, например?
— Я говорю за институт Пастера. Но у нас один прибор. Мы делаем максимум из того, что можем делать. Но да, наши мощности значительно уступают.
При этом стоит отметить, что мы научно-исследовательский институт. Наши задачи — не только секвенировать. Хотя на это и брошено много ресурсов.
— Что могло бы дать массовое секвенирование, если бы оно было?
— Чем больше данных, тем лучше. Мы бы лучше понимали, как эпидемия развивается на территории России: сколько у нас собственных штаммов, как изменяется вирус. Плюс лучше бы понимали, как происходят заносы, в том числе повторные. Думаю, это бы позволяло и лучше прогнозировать, как эпидемия будет развиваться дальше.
— Что происходит после того, как вы секвенировали геном? Вы отправляете это в Роспотребнадзор?
— В России сейчас формируется собственная база данных геномов вирусов. Мы ее пополняем своими данными.
— В общемировой дискурс ваша работа как-то вписывается?
— Пока это российская база, она закрыта для мирового сообщества. Будет ли она в открытом доступе или нет, решит руководство Роспотребнадзора.
Какие результаты получил НИИ Пастера с начала 2021-го и кто работает над секвенированием
Читайте, как петербургский эпидемиолог изучал в Ухане происхождение COVID-19 и что удалось выяснить. Это интервью с участником миссии ВОЗ Владимиром Дедковым.
«Бумага» рассказывала, что антитела к коронавирусу есть у половины жителей Петербурга, это показало исследование. Значит ли, что эпидемия закончилась? Возможна ли третья волна? Читайте интервью с эпидемиологом.
Э то данные на февраль, тогда в стране выявлялось до 600 случаев заболевания в сутки.
Ваш гид по мутациям SARS-CoV-2 Биологи рассказывают о том, как меняется коронавирус
Этот материал впервые был опубликован в казахстанском издании «Vласть». «Новая газета» перепечатывает его на условиях партнерства.

Что такое мутации? Из школьного курса биологии вы помните, что эволюция — по сути накопление адаптаций к окружающей среде. Так вот, мутации — это и есть способ адаптироваться. Вирусы — не что иное, как генетическая информация в упаковке из белка (и иногда липидов). Из-за своей простоты (и хитрости, конечно) мутируют они постоянно (в среднем до 1 млн раз быстрее человека), это их способ существования. Коронавирус SARS-CoV-2 в этом году совершил огромный рывок в развитии, он перепрыгнул на нового хозяина, — на человека. Этот выход из зоны комфорта дался ему нелегко, и он до сих пор к нам привыкает. Поэтому в мутациях нет ничего удивительного. Другое дело, что за обычными простудными коронавирусами, с которыми мы встречаемся каждый сезон, мы так тщательно не следим. Сравниваем мы SARS-CoV-2, как правило, с вирусом атипичной пневмонии 2003-2004 годов. А уж за тем, как развивается сам SARS-CoV-2, сейчас происходит беспрецедентно тщательный контроль. По вирусным меркам коронавирус не так изменчив. Было подсчитано, что в одном ВИЧ-инфицированном пациенте разница между двумя вирусами ВИЧ будет больше, чем между Уханьским и британским штаммом коронавируса! Собственно, это одна из причин, по которой до сих пор не удалось создать вакцину против постоянно «убегающего» от иммунной системы и мутирующего ВИЧ.
Как можно следить за мутациями?
Эволюционные биологи любят рисовать деревья, но не обычные, а филогенетические. Каждый листик — генетическая последовательность (например, ДНК какого-то вида животных или растений, РНК или ДНК вируса или даже аминокислотная цепочка белка). Самый удобный сайт, содержащий информацию о РНК коронавируса по всему миру — Neхtstrain.org. Информация на нем обновляется в реальном времени. Сайт был создан задолго до пандемии, и содержит информацию о распространении и эволюции многих инфекций, таких как вирус Зика, корь и туберкулез. Во время пандемии этот ресурс стал одним из важнейших инструментов борьбы с дезинформацией и фейками, так как это прекрасный пример открытости данных. Он позволяет в реальном времени понять, как быстро могут меняться вирусы и как вирус смог перепрыгнуть на нового хозяина. В этом материале мы расскажем о том, как пользоваться этим ресурсом и что мы на данный момент знаем о мутациях SARS-CoV-2.
Kакие бывают мутации и что значат все эти буквы и цифры в громких заголовках?
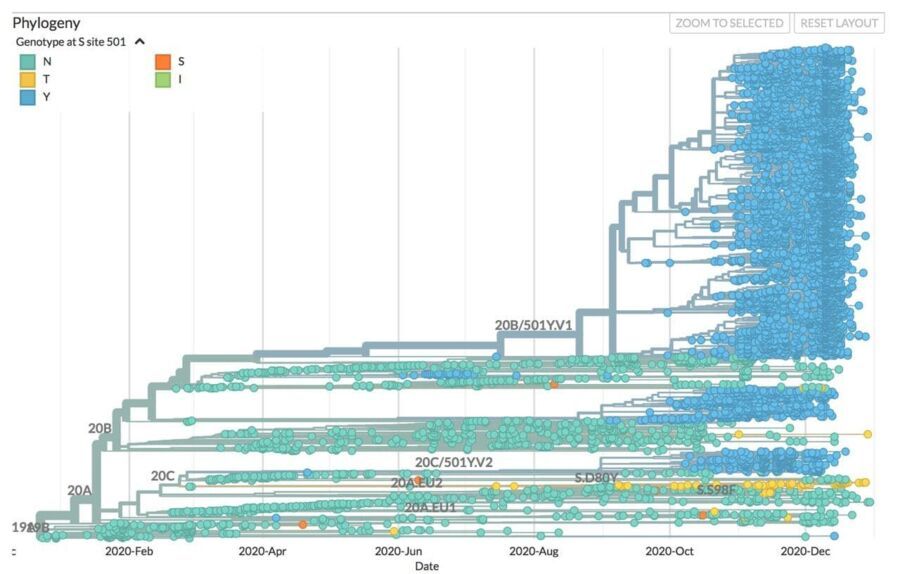
Генетический код, состоящий из четырех букв — это, пожалуй, самый красивый механизм в природе. Четыре буквы (А, Т, Г, Ц в ДНК и А, У, Г, Ц в РНК) обозначают четыре азотистых основания, последовательность которых и является генетическим кодом. В случае SARS-CoV-2 генетическая информация представляет собой молекулу РНК, в которой около 30 000 азотистых оснований. Сбором данных, которые используются для анализа сайтом Neхtstrain, занимается организация GISAID (первые буквы от global initiative on sharing avian influenza data). Эта организация появилась в 2006 году, чтобы объединить усилия во время эпидемии птичьего гриппа, и стала успешным примером открытости и борьбы с сокрытием данных о вспышках инфекционных заболеваний. На данный момент в открытом доступе можно найти почти 300 000 последовательностей геномов SARS-CoV-2 (геном=набор генов), которые расставлены в филогенетическом дереве с 5 января 2020 года по сегодняшний день.
Теперь о том, как вирус «решает», какие мутации ему нужны. Селективное давление —термин, который описывает степень воздействия естественного отбора, которая влияет на скорость появления генетических изменений. Еще в начале эпидемии высказывалось мнение, что коронавирус будет мутировать, а значит, «слабеть», чтобы не убивать хозяина. Но на самом деле,
SARS-СoV-2 не меняется в сторону снижения или повышения летальности, так как особого эволюционного давления для этого не наблюдается — смертность и так не слишком высока.
Важно повторить, что большинство мутаций проходят незамеченными и не сохраняются в популяции. Если мутация очень сильно мешает вирусу (например, полностью отключая очень важный ген), то, скорее всего, она не сохранится попросту потому, что вирусу от нее будет слишком плохо. А выигрышной для вируса будет мутация (или группа мутаций), которая поможет закрепиться в хозяине как можно дольше, не убивая его слишком быстро, чтобы успеть распространиться. Это и увеличение «заразности» (то есть, более эффективное проникновение в клетку и длительное асимптоматическое течение), и мутации, помогающие «спрятаться» от иммунной системы (а именно, от иммунных клеток памяти и антител).
Мухтар Садыков и его коллеги в своей недавней публикации отметили важность изучения как позитивного (то есть, когда мутации необходимы вирусу для адаптации), так и негативного селекционного давления (когда участки генома важны для функционирования вируса, то частота мутаций там ниже среднего).
Наибольшее количество изменений, — уже более 4000 мутаций, — происходит в знаменитом белке-шипе. Шипы на поверхности, из-за которых вирус и получил свое название (сходство с короной солнца), важны для того, чтобы прикрепиться к рецептору на поверхности клетки хозяина и заразить ее. Этот процесс можно себе представить так: вы — вирус, а ваша ладонь — белок-шип. Чтобы открыть дверь (рецептор на поверхности клеток АСЕ2) и зайти в комнату (в клетку), вы, вирус, держитесь ладошкой (белком-шипом) за ручку (участок на АСЕ2, который связывается с шипом). На этом видео вы можете посмотреть как именно происходит эта встреча.
Коротко о четырех главных мутациях
Теперь давайте проследим, как менялся коронавирус. Начать, пожалуй, следует с его происхождения. И хотя точного ответа у нас до сих пор нет, филогенетический анализ подсказывает нам, что SARS-СoV-2 ближе к коронавирусам летучих мышей и панголинов (или яванских ящеров), чем к вирусу атипичной пневмонии 2003-2004 годов SARS-СoV. Основная разница между двумя человеческими вирусами в том, что SARS-СoV-2 намного эффективнее «открывает дверь» в клетку, изменив тот самый белок-шип. И если в геноме коронавирусов летучих мышей этого «апдейта» пока не было обнаружено, то в коронавирусах панголинов схожее преимущество уже присутствует. Существуют две главные гипотезы происхождения SARS-СoV-2: он или мутировал в организме животного (летучей мыши или панголина), или же изменился до неузнаваемости уже в организме человека. Анализируя имеющиеся данные, ученые приходят к выводу о том, что искусственное создание коронавируса в лаборатории — версия хоть и интересная, но на данный момент беспочвенная. Доктор Мухтар Садыков на примере коронавируса также напоминает о важности контроля за вирусами животных:
«Согласно исследованиям, вирус, очень похожий с SARS-СoV-2, начал циркулировать в летучих мышах уже несколько десятков лет назад. Это важное напоминание о необходимости мониторинга за различными вирусами животных, чтобы предупредить возникновение эпидемий».
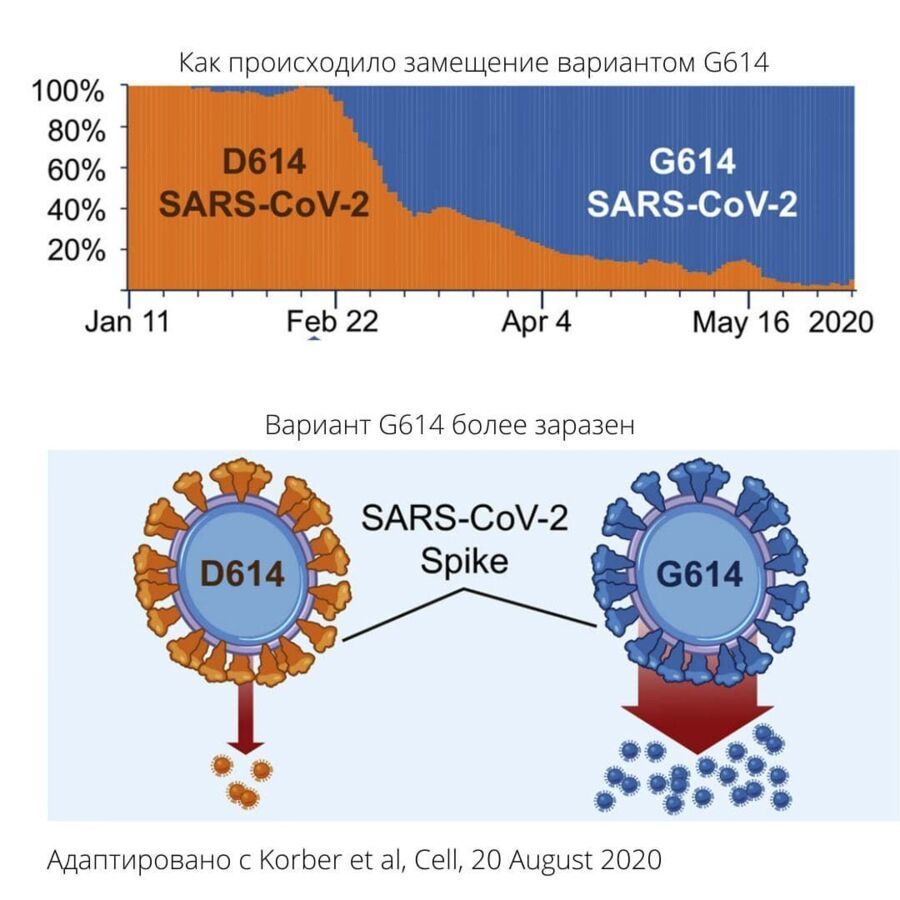
Итак, год назад появился новый коронавирус. Генетическая последовательность, которая используется в качестве начального образца генома коронавируса, была взята у пациента из Уханя в декабре 2019 года. Вирус тут же начал мутировать, а ученые сразу начали тщательно за этим следить. Уже в январе была замечена, пожалуй, главная мутация — D614G — замена аспартата на глицин на позиции 614 в белке-шипе. Мутация стала настолько важной и удобной для вируса, что уже к июню стала доминировать во всем мире. Эти две аминокислоты сильно различаются по своим свойствам и было ожидаемо, что такое изменение может значительно повлиять на поведение вируса. Как именно? Исходя из исследований на клетках, на лабораторных животных, а также согласно эпидемиологическим данным, мы можем сделать вывод о том, что этот вариант вируса заражает эффективнее, а также лучше размножается (Hou et al Science, 18 Dec 2020) в верхних дыхательных путях. Но также было предварительно показано, что эта мутация не влияет на тяжесть заболевания, на чувствительность к нейтрализующим антителам и на эффективность вакцин.
Следующий нашумевший вариант вируса называется «Cluster 5», он был обнаружен в июне 2020 в Дании у людей, работающих с норками. Тут важно отметить, что норки — важный и давно известный резервуар для инфекций, они способствуют ускоренному изменению вируса и поэтому контроль за ними очень важен. Этот вариант вируса содержит комбинацию мутаций всё там же, в белке-шипе: делеция (потеря) аминокислот на позициях 69-70; замена Y453F внутри участка, который связывается с ACE2; замена I692V and M1229I. Датские власти, а с ними и все мы, испугались не на шутку. Чтобы ограничить дальнейшее распространение этого варианта вируса, были уничтожены около 14 млн норок. А некоторые страны, например, Нидерланды, и вовсе запретят норковые хозяйства к 2024 году. Но по предварительным данным, эта мутация не влияет на тяжесть и степень передачи инфекции. Однако, у этого варианта слегка снижена чувствительность к нейтрализующим антителам, что вызывает некоторые опасения в связи с повторным заражением. Но Дания показала пример максимально быстрого реагирования, поэтому этот вариант удается держать под контролем.
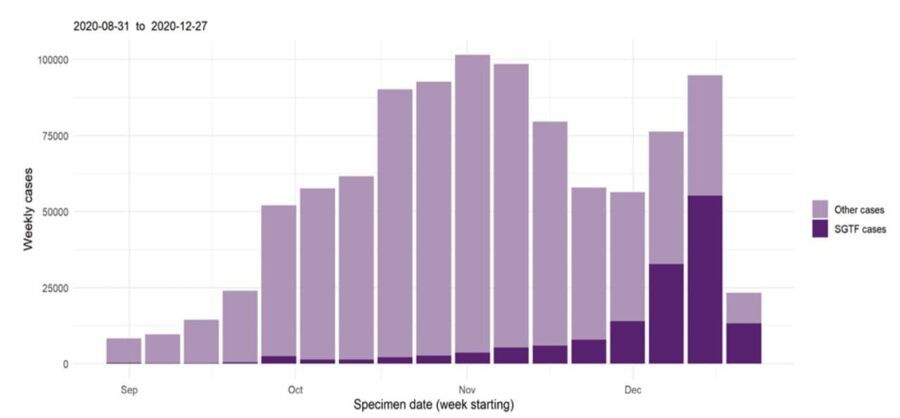
Третья важная мутация, которая стала поводом для написания этого материала, является частью так называемого британского варианта коронавируса — VOC 202012/01 (он же VUI – 202012/01, он же B.1.1.7). Обнаружен он был в октябре 2020 года, на начало января он присутствует уже в более чем 30 странах. Он содержит 23 мутации, большинство из них находится в белке-шипе. Одна из мутаций схожа с датскими норками, это делеция на позициях 69-70. А главная мутация — N501Y — является заменой аминокислоты в маленьком участке белка-шипа, который связывается с АСЕ2. Комбинация этих двух мутаций, вероятно, и объясняет повышенную контагиозность данного варианта вируса. Как мы об этом узнали? Дело в том, что один из самых популярных ПЦР тестов в Великобритании — TaqPathCOVID-19 компании Thermo Fisher. Он определяет наличие 3 участков РНК вируса. Один из них, что находится в белке-шипе в аккурат на месте делеции 69-70, вдруг перестал выявляться, тогда как другие два были на месте. Это побудило британцев на всякий случай определить полную последовательность генома и обнаружить новый вариант вируса! Этот ПЦР тест дал нам много информации о распространении этого штамма за короткий срок (следить было проще простого — двa участка вместо трех), а реакция властей и возможность проведения массового секвенирования быстро позволила нам определить точные генетические изменения. Но это также говорит о том, что, возможно, в других странах мы попросту не заметили появление этого варианта, что еще раз подчеркивает значимость секвенирования.
На что влияет это изменение вируса? Ключевым фактором здесь является, видимо, комбинация мутаций, что, возможно, изменяет не только состав, но и форму шипа и других белков, что является своеобразной попыткой сбежать от «наручников» нейтрализующих (умелых, качественных) антител, которые должны в идеале сформироваться у нас по результату знакомства с вирусом или (внимание!) с вакциной. У нас есть некоторые данные о том, как эти мутации могут по отдельности влиять на поведение вируса. Так, потеря двух аминокислот на позициях 69-70 не только снижает эффективность некоторых диагностических тестов, как было описано выше, но также она, возможно, возникла в результате использования терапии плазмой переболевших пациентов.
То есть, возможно, использование антител в качестве терапии в некоторых пациентах может создавать среду для селективного давления и подобного изменения структуры вируса.
Следовательно, эта мутация может привести к тому, что вирус сможет избежать иммунного ответа антителами. Также в этом варианте присутствуют 6 мутаций в гене ORF1ab, но они пока мало изучены. Другой интересной мутацией является P681H, которая влияет на слияние мембраны клетки и оболочки вируса, что, возможно, помогает вирусу проникать в клетки респираторного эпителия, а также облегчает передачу вируса на животных моделях. Еще одно важное изменение: белок ORF8, который очень изменчив и значительно различается с аналогичным белком SARS-CoV (вируса атипичной пневмонии). Мутация, которая поменяла код 27 аминокислоты на знак «стоп» делает его последовательность в четыре раза меньше (26 аминокислот вместо 121). На что это влияет? Пока не ясно, но мы знаем, что этот белок сбивает с толку нашу иммунную систему, отключая интерферон, и имеет непосредственное отношение к цитокиновому шторму. Возможно, потеря функции этого белка повлияет на течение болезни, но это еще необходимо установить экспериментально. Ну и самая известная мутация N501Y (замена аминокислоты на позиции 501) находится в ключевом контактном участке белка-шипа, состоящем из 6 аминокислот. Предполагается, что это изменение может значительно повлиять на степень связывания с рецептором АСЕ2.
Какая у нас есть информация о распространении этого варианта? Качество данных зависит от страны (ресурсы для секвенирования и организация тестирования). Примером здесь, пожалуй, является Дания, которая секвенирует до 2000 геномов в неделю. 86 случаев VOC 202012/01 уже было зарегистрировано (11% всех новых случаев), и они развиваются в отдельной ветке, что означает, что имело место локальное распространение варианта. Ситуация же в Великобритании очень беспокоит, стране пришлось объявить новые строгие карантинные меры. Но дело здесь, скорее всего, не только в новом варианте вируса, а также в эпидемиологической ситуации по возвращению с каникул. Вообще относительно новых версий коронавируса важно не делать поспешных решений. Панику порождают высказанные вслух предположения. Так, некоторые британские специалисты высказались о том, что новый вариант опаснее для детей, но по факту, скорее всего, это связано с открытием школ.
Предварительно по эпидемиологическим данным из-за очевидного экспоненциального роста мы видим, что этот вариант возможно более заразен. Но так ли он опасен в плане тяжести болезни? На прошлой неделе британская правительственная комиссия опубликовала результаты исследования, которое говорит о том, что вариант VOC 202012/01 не является более опасным по тяжести заболевания. В этом когортном исследовании участвовали 1769 пациентов, зараженных новым вариантом коронавируса, и их данные сравнили с таким же числом пациентов, зараженных старым вариантом.
Итак, было показано, что нет статистической разницы в продолжительности и тяжести заболевания, в показателях смертности и в вероятности повторного заражения.
Поэтому основной вывод: без паники, новый вариант не так опасен, как его представляет Борис Джонсон!
И четвертый вариант вируса, который следует упомянуть — из Южной Африки под кодовым названием 501Y.V2. Он похож на британский, так как содержит ключевую мутацию N501Y, но появился он независимо от него. Этот вариант доминирует в южно-африканском регионе с ноября 2020 года, на сегодня обнаружен в четырех странах. Было показано, что такое изменение вируса повышает вирусную нагрузку, следовательно, возможно, более эффективно заражает клетки. А в остальном нужно больше данных. Кстати, количество данных напрямую зависит от доходов страны, ведь секвенирование в таком количестве, как в Европе, африканским странам не доступно. А нехорошо от этого нам всем, так как в случае с мутациями «Предупрежден — значит вооружен»! Будем надеяться, что пандемия заставит пересмотреть взгляд на технологическое неравенство.
Будут ли работать вакцины?
Пожалуй, самый обсуждаемый и сложный на сегодня вопрос. Мутации коронавируса обнажают недостатки и преимущества разных подходов к разработке вакцин. Традиционные цельновирионные (содержащие живой или убитый вирус) вакцины, возможно, менее подвержены кардинальному изменению эффективности из-за мутаций. Тогда как новые подходы, использующие часть вируса (белок или РНК), рискуют не сработать, так как изменения в вирусе могут быть слишком значимы. Безусловно, настораживает тот факт, что мутации, укрепившиеся в белке-шипе, могут сделать его неузнаваемым для антител, сформировавшихся после вакцинации. Мутации затронули участки, которые входят в состав самых успешных РНК вакцин от Pfizer/Biontech и Moderna. Основатель компании Biontech Угур Шахин успокаивает: «Да, мы знаем, что некоторые участки мутировали. Но там еще много участков, которые остались нетронутыми и пока нет оснований считать, что вакцина не сработает». К слову, компания Biontech уже проверила более 20 установившихся вариантов вируса, и сейчас проверяет «британский» вариант. Также ученый отметил, что в случае необходимости поменять РНК последовательность, они готовы это сделать за две недели, в короткий срок обеспечив миллионы новых доз. В этом главное преимущество РНК вакцин.
У Мухтара Садыкова есть интересные предположения относительно мутаций на белке-шипе:
«На данный момент есть уже с десяток установившихся мутаций на белке-шипе, которые отличаются от первого Уханьского вируса. А также есть множество других мутаций, которые помогают вирусу избежать распознавания иммунной системой. Сейчас, после массовой вакцинации, у вируса может появиться сильное эволюционное давление, особенно на белок-шип. Это может привести еще ко многим мутациям, что в итоге заставит нас пойти по сценарию ежегодной вакцинации, как с вирусом гриппа».
Доктор Болат Султанкулов, работающий над проектом по использованию нанотел для диагностики коронавирусной инфекции, чуть более оптимистичен: «Я предполагаю, что существующие вакцины все-таки будут работать против нового штамма. Дело в том, в ответ на вакцину формируются поликлональные антитела, а это значит, что если нет кардинальных изменений в форме белка-шипа, антитела, вырабатывающиеся на вакцину, должны физически перекрывать доступ к участку, который связывается с АСЕ2. Однако, это лишь мое предположение и нам нужны экспериментальные данные от производителей вакцин. Единственное, чего мы еще не получили, так это данных о том что вирус слабеет, становится менее агрессивным по симптоматике, переходит в разряд «простудных», так как снижение смертности в основном связано с тем, что мир чуть-чуть научился лечить Ковид-19. После массовой вакцинации мы увидим насколько вирус приспосабливается, так как в популяции есть пул генотипа супер-распространителей, они, в свою очередь, и являются генераторами новых мутаций. Дело в том, что иммунная система супер-распространителей работает по-другому, они своего «летучие мыши». Будет очень интересно, как именно они реагируют на вакцинацию, так как предположительно они вырабатывают меньше антител и дают вирусу возможность мутировать, чтобы избежать иммунного ответа.
А как мы знаем из эпидемиологии, всегда есть «пациент 0» и одного человека достаточно, чтобы все началось заново. Возможно, это будет не в этом году, а через полгода или 10 лет.
Вирус, скорее всего никуда не исчезнет, нам остается лишь наблюдать и быть готовыми к быстрому реагированию. А предположение о том, что он никуда не уйдет и после вакцинации связано с его родичами, вызывающими обычную простуду. Остается надеяться на то, чтобы вирус пошел по их пути и просто ослаб».
Есть некоторые опасения по тому, как происходит сейчас вакцинация от Ковид-19. Дело в том, что она происходит двумя инъекциями. Первая — знакомство с антигеном и появление специфического иммунитета, а вторая — закрепление иммунитета в адекватной для защиты дозе. Существуют опасения, что вакцинация в низкой дозе (например, проведение первой инъекции и задержка второй) будет создавать селективное давление на вирус и даст рост еще большим изменениям. А поэтому не совсем уместно изменение графика вакцинации или вакцинация мизерной доли населения. По словам одного из создателей сайта Neхtstrain.org Эммы Ходкрофт, кампании по вакцинации должны быть быстрыми, масштабными и четко организованными. Если добавить к этому сложности с хранением и транспортировкой РНК вакцин, то задача не из легких.
Какие мы можем сделать выводы сейчас?
Сами по себе мутации — нормальный и постоянный для вирусов процесс. Большинство главных мутаций коронавируса не делают его опаснее в плане тяжести заболевания, ведь вирусу не нужно, чтобы мы умирали быстрее. Однако, возможно, они делают его заразнее, и для этого уже есть некоторые данные. Мутаций у коронавируса много (в одном только белке-шипе их более 4000), и мы за ними тщательно следим. Влияние этих мутаций на эффективность вакцин пока не было доказано, мы ждем данных от производителей вакцин и независимых лабораторий, которые сейчас проверяют это на новых вариантах.
Что делать нам всем? Дистанцируйтесь и надевайте маски, пока ученые получают больше данных. А мы будем держать вас в курсе новостей.
Асель Мусабекова — биолог и вирусолог, специально для Vласти