что такое рестадирование в медицине
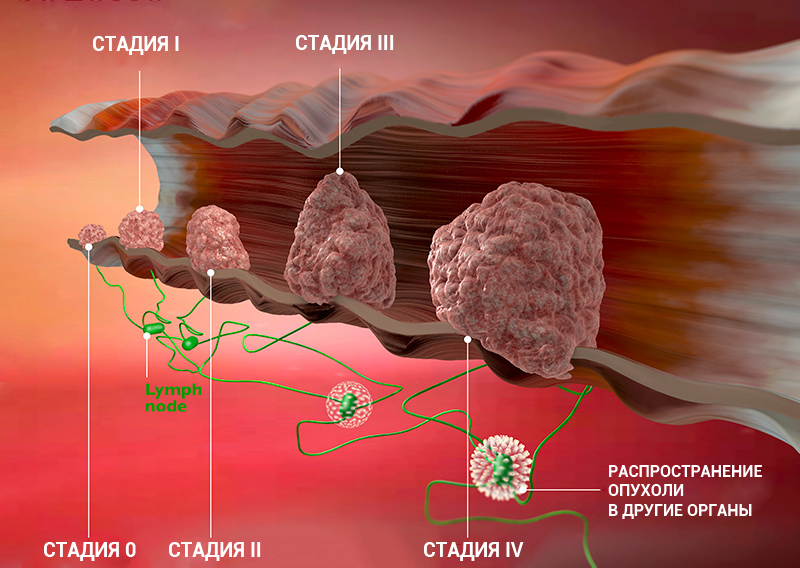
Стадии рака
Определение стадии рака (стадирование) помогает описать расположение злокачественного новообразования и возможный вред, наносимый им другим частям тела. Врачи часто применяют тесты, позволяющие определить стадию рака. Окончательное стадирование возможно только после завершения всех тестов.
| Международная классификация стадий рака TNM |
|---|
| Стадии рака мочевого пузыря |
| Стадии рака молочной железы |
| Стадии немелкоклеточного рака легких |
| Стадии мелкоклеточного рака легких |
| Стадии рака желудка |
| Стадии рака шейки матки |
| Стадии рака поджелудочной железы |
| Стадии рака тела матки |
| Стадии рака печени |
| Стадии рака яичников |
| Стадии рака предстательной железы |
| Стадии рака ротовой полости и ротоглотки |
| Стадии рака пищевода |
Знание стадии рака помогает врачу:
Международная классификация стадий рака TNM
Для описания стадии рака широко применяется международная классификация стадий рака TNM по системе Американского объединенного комитета по онкологическим заболеваниям (AJCC). Врачи используют результаты тестов и сканирования, чтобы дать ответы на следующие вопросы:
Ниже приведена общая характеристика системы стадирования TNM. Однако для каждого вида рака существует отдельная система TNM.
Группировка стадий рака
Врачи комбинируют значения T, N, M для определения стадии рака для каждого пациента. Большинство онкологических заболеваний имеют 4 стадии: от стадии I (первой) до IV (четвертой). Некоторые виды рака имеют стадию 0 (нулевую).
Прогностические факторы рака
Помимо системы стадирования TNM, используются также другие данные, чтобы определить возможность выздоровления и выбрать наилучший доступный метод лечения. К прогностическим факторам относятся:
Другие системы стадирования
Система TNM чаще применяется для описания таких видов онкологии, в результате которых образуются твердые опухоли. К таким видам злокачественных новообразований относятся рак молочной железы, рак толстой кишки и рак легкого. Однако для классификации остальных видов рака, врачи применяют другие системы стадирования. К таким видам злокачественных новообразований относятся следующие:
Контрольное обследование – рестадирование
Стадия рака не меняется с течением времени. В том случае, если рак рецидивирует или распространяется на другую часть тела, он по-прежнему находится в той стадии, которая определена в результате первичного диагноза. Дальнейшая информация о размерах и развитии раковой опухоли просто уточняет данную стадию.
Иногда врачи могут проводить рестадирование рака для определения эффективности лечения или для получения большего количества информации о раке, который возобновился после проведенного лечения. В этом процессе используется описанная выше система стадирования. Некоторые тесты, проведенные при первичном диагностировании онкологии, могут быть использованы повторно. После этого врач может определить новую стадию рака. В таком случае он приписывает букву ‘r’ нижнего регистра перед новой стадией, чтобы показать, что она отличается от первоначальной. Однако это происходит не часто.
Итак, определение стадии рака играет одну из ключевых ролей в выборе лечебной тактики. При подозрении на наличие онкологического заболевания, нужно как можно скорее обратиться к специалистам, которые проведут необходимое диагностическое обследование и составят план лечения, исходя из полученных результатов диагностики.
Лечение в клиниках “АССУТА” и “ХАДАССА”
Вас интересует лечение в Израиле?
Крупнейшие профессиональные больницы Израиля – «Ассута» в Тель-Авиве и «Хадасса» в Иерусалиме предлагают реальную возможность получить качественное и специально для вас подобранное лечение у замечательных специалистов по адекватным ценам.
Мы помогаем найти решение ваших проблем со здоровьем, а также предоставляем полную информацию о лучших израильских врачах.
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Современная лучевая терапия лимфогранулематоза
В.П. Харченко, Г.А. Паньшин, В.М. Сотников, П.В. Даценко
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
Современная лучевая терапия лимфогранулематоза имеет за плечами столетний опыт эмпирического применения и блестящего концептуального осмысления, во многом определившего идеологию, стратегию и тактику лучевого лечения онкологических заболеваний в целом.
Идея широкопольного облучения с целью девитализации не только клинически определяемой опухоли, но и ее субклинических диссеминатов в окружающих тканях, а также идея профилактического облучения зон вероятного лимфогенного метастазирования были впервые сформулированы и реализованы при лимфогранулематозе. В последующем они были с успехом применены и при других онкологических заболеваниях (рак молочной железы, рак легкого, опухоли головы-шеи), став основой современной концепции радикальной лучевой терапии опухолей. Эти идеи стали базисом технологии радикального лучевого лечения лимфогранулематоза, предусматривающей широкопольное облучение пораженных лимфатических коллекторов и профилактическое облучение клинически интактных лимфатических коллекторов от подбородочных до паховых (программа тотального нодального облучения). Разовые и суммарные очаговые дозы были подобраны эмпирически и составляли 1.5-2.0 Гр ежедневно и 40-44 Гр суммарно на пораженные зоны, а на зоны профилактического облучения суммарно 30-36 Гр.
В настоящее время есть все основания утверждать, что данная технология как универсальный, пригодный для большинства клинических ситуаций (исключая IV стадию заболевания) метод лечения лимфогранулематоза устарела. На смену пришли многочисленные методики, генетически с ней связанные, столь же эффективные, но гораздо более безопасные как в плане непосредственных, так и отдаленных побочных эффектов. Фактически в течение последних 30 лет идет нарастающий процесс диверсификации радикальной программы, имеющий целью достижение постулированного теорией медицины идеала – индивидуальной программы лучевого лечения для каждого больного лимфогранулематозом.
Чтобы понять истоки и движущие силы этого процесса обратимся вновь к истории. Радикальная программа лучевой терапии была разработана в 30-50-х гг. прошлого столетия в условиях, когда отсутствовали эффективные методы выявления распространенности заболевания, за исключением рентгенографии грудной клетки. Достаточно сказать, что еще в 70-80-х гг., вплоть до появления ультразвука и компьютерной томографии для выявления субдиафрагмального распространения заболевания широко использовались такие косвенные методы, как внутривенная урография и ангиография.
Правда, в это время уже была предложена бипедальная рентгеноконтрастная лимфография (1952 г.), остающаяся и поныне ценным методом диагностики поражения подвздошных и забрюшинных лимфатических узлов, но в клинической практике она широко не применялась.
Наконец, ко времени окончательного оформления технологии радикального лучевого лечения химиотерапия лимфогранулематоза только зарождалась (De Vita, 1962).
Таким образом, стандартизация радикальной лучевой терапии лимфогранулематоза, как по максимальному объему, так и по высоким суммарным очаговым дозам, была вынужденной, возмещавшей несовершенство диагностики и слабость химиотерапии того времени.
За прошедшие годы ситуация разительно изменилась. Прогресс в развитии методов лучевой диагностики и химиотерапии привел к тому, что классическая технология радикальной лучевой терапии применяется гораздо реже, хотя продолжает существовать и может быть использована в особых клинических ситуациях, например, при резистентном и рецидивирующем течении лимфогранулематоза или в сочетании с высокодозной химиотерапией [5].
Реально же лучевая терапия стала неотъемлемой частью современной технологии клинического ведения больного лимфогранулематозом, основными этапами которой являются диагностика и стадирование, химиотерапия, рестадирование в процессе химиотерапии и после ее окончания, лучевая терапия, рестадирование и последующее наблюдение.
Современная лучевая терапия, как, впрочем, и химиотерапия лимфогранулематоза, все более и более приобретает черты высоких технологий. Парадокс, однако, состоит в том, что если для химиотерапии высокая технология означает переход к миелоаблативным и субмиелоаблативным схемам, требующим применения колониестимулирующих факторов и/или трансплантации стволовых кроветворных клеток, то для лучевой терапии высокой технологией является переход от высокодозного тотального или субтотального нодального облучения к более адекватным в плане доз и объема прецизионным методикам локального облучения зон исходного поражения, зон исходно больших массивов поражения, остаточных опухолей.
Характерными чертами современной лучевой терапии лимфогранулематоза являются:
Рассмотрим каждый из этих пунктов более подробно.
Лучевая терапия применяется как для лечения первичных больных, так и рецидивов. В самостоятельном плане лучевая терапия может быть использована для прогностически наиболее благоприятной категории больных без факторов риска субдиафрагмального распространения. К факторам риска, исключающим больного из группы благоприятного прогноза и формирующим группу промежуточного прогноза, по данным GHSG, относятся:
К неблагоприятным прогностическим факторам, ограничивающим показания к чисто лучевому лечению, относят возраст старше 40 лет, массивное поражение лимфатических узлов средостения, поражение трех и более зон лимфатических коллекторов, В-стадия, экстранодальный очаг.
У больных локальными стадиями с факторами риска и при III-IV стадиях заболевания лучевая терапия всегда является частью программы комплексного лечения. Существует и ряд специальных показаний к лучевой терапии: локальное прогрессирование в процессе химиотерапии у первичных больных [15]; изолированные рецидивы после химиотерапии [19]; остаточные очаги после высокодозной химиотерапии у первично-резистентных больных и у больных с рецидивами [6]; в сочетании с высокодозной химиотерапией – как этап подготовки к трансплантации стволовых кроветворных клеток [18].
Мета-анализ проведенных исследований позволяет заключить, что в сравнении с лучевой терапией химиолучевое лечение локального лимфогранулематоза позволяет увеличить с 75-90% до 90-100% 5-летнюю безрецидивную, но не общую выживаемость, остающуюся в пределах 95-100% [11,17].
При генерализованном лимфогранулематозе сочетание химиотерапии и лучевой терапии позволяет увеличить 5-летнюю общую и безрецидивную выживаемость с 50-60% до 70%, а в группе больных с полной или частичной ремиссией после химиотерапии – до 90% [4].
К весомым достоинствам современной лучевой терапии относится значительно меньший риск лучевых реакций со стороны легких и сердца, в первую очередь благодаря уменьшению суммарных очаговых доз до 35-36 Гр при чисто лучевом лечении и до 25-36 Гр при химиолучевом лечении [3,17]. В современной практике лучевого лечения лимфогранулематоза дозы свыше 36 Гр должны подводиться сугубо локально и лишь на частично регрессировавшие очаги.
Таким образом, в большинстве случаев СОД находятся в пределах толерантности либо незначительно превышают толерантный для критических органов (легкие и сердце) уровень в 30 Гр и даже выходят на толерантный для костного мозга уровень 20-24 Гр. Как следствие, частота клинически выявляемых постлучевых пневмонитов составляет 2-4%, перикардитов – менее 1% [26,10].
Отдаленные последствия современных программ лечения лимфогранулематоза, включающих интенсивную антрациклинсодержащую химиотерапию и редуцированную по дозам и/или объему лучевую терапию, пока достоверно не изучены – нет достаточно больших контингентов больных со сроками наблюдений 15-20 лет. Имеющиеся в настоящее время данные, основанные на опыте 60-80-х гг. прошлого века, свидетельствуют о том, что в структуре смертности больных лимфогранулематозом при 20-летнем наблюдении частота вторых опухолей составляет до 25.7%, а кардиальных осложнений – до 35.1% [16].
В сущности, пока не решен один из кардинальных вопросов комплексного лечения лимфогранулематоза: какие пропорции химиотерапии и лучевой терапии дают минимальное число побочных эффектов при сохранении высокой эффективности. Нужно ли продолжать усиливать химиотерапию и пытаться снизить интенсивность лучевой терапии вплоть до полного отказа от нее или существует некий оптимум, за которым нарастание токсического и канцерогенного эффектов химиотерапии сведет на нет эффект снижения дозы и объема лучевой терапии. Следует подчеркнуть, что полный отказ от лучевой терапии не приведет к исчезновению индуцированных неоплазий. Математически доказана достоверная связь между химиотерапией и лейкозами, между лучевой терапией и раком молочной железы, в то время как на частоту остальных опухолей вид проведенного лечения не влиял [12]. По данным большинства исследований риск вторых опухолей после химиолучевого лечения не превышает риска их развития после химиотерапии [20]. C другой стороны, наибольшие и прогрессирующие изменения генома нормальных клеток выявлены именно после химиолучевого лечения [9].
Прямым следствием этой неопределенности, а также стремления уменьшить число лучевых осложнений, сделать лучевую терапию более безопасной является ее мультивариантность. К сожалению или к счастью, в лечении лимфогранулематоза, как правило, нет метода выбора. Практически для любого больного может быть предложен ряд лечебных программ, обеспечивающих примерно равную общую выживаемость, каждая из которых имеет свои положительные и отрицательные стороны.
В пределах этих программ, как лучевых, так и химиолучевых, основные параметры лучевой терапии существенно варьируют. Так при I-II стадии чаще всего рекомендуется либо облучение до диафрагмы (мантия) либо субтотальное нодальное облучение. Для прогностически неблагоприятной группы больных (IIB-IV стадии) предлагаются следующие объемы лучевой терапии в рамках комбинированного лечения:
Рекомендуемые СОД также варьируют от 20 Гр до 40 Гр.
Выбор конкретных параметров лучевой терапии зависит от целого ряда факторов, в первую очередь, от параметров проведенной химиотерапии. Уменьшение СОД на зоны поражения до 36 Гр и на непораженные зоны до 20-24 Гр возможно только после антрациклинсодержаших схем химиотерапии (ABVD, BEACOPP). По материалам нашей клиники, количество местных рецидивов при этом не превышает 4%. В то же время применение таких устаревших схем химиотерапии как COPP, CVPP и их аналогов определяет необходимость усиления лучевого компонента химиолучевой программы. Например, только расширенная радикальная программа с профилактическим облучением легких позволяет снизить количество легочных рецидивов у больных с массивным поражением средостения с 31.4% до 6.6% [1].
Проблема сокращения объема облучения при химиолучевом лечении лимфогранулематоза более сложна, чем проблема оптимальных суммарных очаговых доз. Этому есть определенное теоретическое обоснование. Расчеты кинетики клеточной гибели в процессе лечения показывают, что даже при достижении в результате химиотерапии полной ремиссии (размеры остаточной опухоли 5 мм и менее) в ней могут сохраниться до 1 млн. клоногенных опухолевых клеток [7]. Такая степень регрессии опухоли позволяет лишь уменьшить дозу облучения приблизительно на 30% (что согласуется с клиническими данными), но не отказаться от лучевой терапии вообще.
Мы проанализировали отдаленные результаты химиолучевого лечения (2 цикла COPP+ЛТ) в двух группах больных лимфогранулематозом: 58 больных с профилактическим облучением и 29 больных с облучением только зон исходного поражения. Общая 10-летняя выживаемость составила 77.4% и 54.1% соответственно, безрецидивная – 62.9% и 39%, различие статистически значимо. Интенсификация лекарственного компонента программы (COPP/ABVD, MOPP/ABVD) уменьшила, но не отменила лечебный эффект профилактического облучения: общая 10-летняя выживаемость составила 89.2% и 80% соответственно, безрецидивная – 86.1% и 74.3%, однако без статистически значимого различия. Наиболее вероятно, что уже в ближайшем будущем повышение достоверности стадирования и рестадирования за счет повсеместного внедрения современных методов обследования, а также дальнейшее повышение эффективности химиотерапии сделает профилактическое облучение достоянием истории.
В условиях современной тенденции к минимизации лучевой терапии существенно возрастают требования к ее информационному обеспечению, которые включают:
Интерес радиологов к морфологическому варианту заболевания вполне закономерен, ибо выделен новый тип лимфогранулематоза (нодулярный с лимфоидным преобладанием), отличающийся по клиническому течению от классической болезни Ходжкина, а адекватная ему радиологическая тактика пока не разработана.
Определение онкобелков как маркеров радиорезистентности все шире входит в клиническую практику. По-видимому, уже в ближайшем будущем эта информация будет в обязательном порядке учитываться при планировании лучевого лечения.
Краеугольным камнем современной технологии лучевой терапии является исходное стадирование. Его тщательность и достоверность во многом определяют методику и результаты лучевой терапии. При этом простая констатация поражения какой-либо анатомической области или органа совершенно недостаточна. Необходимо для каждой пораженной анатомической области указать размеры и количество лимфатических узлов, их расположение относительно анатомических ориентиров, а для атипично расположенных лимфатических узлов – расстояние в сантиметрах до анатомических ориентиров. Последнее весьма существенно, ибо отдельные регионы, например подмышечно-подключичный, отличаются значительной вариабельностью топографии лимфатических узлов.
Процедура стадирования объективно является зоной конфликта интересов химиотерапевта и радиолога, ибо экономические затраты несут химиотерапевтические или гематологические отделения, а плодами пользуются радиологи. Конфликт этот наблюдается повсеместно, и именно поэтому протоколы кооперированных исследований предусматривают обязательное участие радиолога в стадировании больных.
Совершенно особая проблема – достоверность выявления очагов поражения в различных анатомических областях современными диагностическими методами. В рамках данного сообщения подробно остановиться на этой теме не представляется возможным. Тем не менее, необходимо коснуться такого важного для лучевой терапии вопроса, как диагностика поражения периферических лимфатических узлов. Безусловно, устаревшей и недостоверной является пальпация этих зон. Только тщательное ультразвуковое исследование является тем достаточным диагностическим минимумом, который позволяет достоверно выявить поражение периферических лимфатических узлов, описать расположение, форму, размеры, количество и даже их структуру.
Рестадирование позволяет ранжировать каждый очаг по степени чувствительности к химиотерапии и лучевой терапии с возможностью обоснованного изменения величины суммарной очаговой дозы для каждой зоны облучения, а потенциально и для каждого пораженного лимфатического узла. Тем самым будет осуществлен переход к «ответ-адаптированной» терапии [13], реализующий кибернетический принцип обратной связи.
Неотъемлемой частью обследования больного лимфогранулематозом становится определение функционального состояния жизненно важных органов, в первую очередь легких и сердца, являющихся объектами повреждающего воздействия как химиотерапии (адриамицин, блеомицин), так и лучевого лечения. Мониторинг их состояния в процессе химиолучевого лечения и в последующем позволит прогнозировать и в определенной мере предотвратить тяжелые лучевые повреждения этих органов.
Существенные резервы повышения эффективности лучевой терапии лимфогранулематоза выявляются при совершенствовании ее технического оснащения (источник излучения, дозиметрия, планирующие системы, мониторинг точности укладки). Доказано существенное уменьшение степени облучения здоровых тканей у больных лимфогранулематозом при использовании фотонного излучения медицинского ускорителя, модулируемого по интенсивности [25]. Трехмерное планирование лучевой терапии позволяет на 50% сократить объем облучаемой ткани молочных желез [27], уменьшить ошибки планирования полей облучения выше и ниже диафрагмы [23,21].
Характерной особенностью современной лучевой терапии лимфогранулематоза является ее высокая чувствительность к квалификации врача-радиолога. Так, половина радиологов Австралии и Новой Зеландии неправильно планируют облучение средостения [8]. Ошибки при планировании подмышечно-подключичных полей достигают 40% [21]. Как следствие, результаты лечения лимфогранулематоза в учреждениях практического здравоохранения всегда хуже, чем в специализирующихся на лечении этого заболевания центрах. Более того, даже в онкологических институтах с небольшим потоком больных результаты хуже. В качестве примера можно привести данные онкологического института г.Брно (Чехия), где ежегодно лечатся 15-20 больных лимфогранулематозом: 5-летняя общая выживаемость больных с IB-IIB стадиями составляет всего 65%, а частота рецидивов в облученных зонах достигает 15%.
Обобщая все сказанное выше, необходимо констатировать, что с развитием медицины и смежных с ней областей меняется и лучевая терапия лимфогранулематоза, ее задачи, методика и техническое оснащение. Сохраняя высокую эффективность, она становится все более изящной и все более соответствует современной цели терапии лимфогранулематоза – излечению с минимальными последствиями.




Copyright © 2008