что такое рений и для чего он нужен
Рений
Рений — плотный, серебристо-белый металл.Существование рения было предсказано Д. И. Менделеевым («двимарганец»), по аналогии свойств элементов в группе периодической системы.
Элемент открыли в 1925 году немецкие химики Ида и Вальтер Ноддак при проведении исследований в лаборатории компании Siemens & Halske. Элемент назван в честь Рейнской провинции Германии — родины Иды Ноддак.
Рений стал последним открытым нерадиоактивным элементом.
Геохимия рения
Рений — один из редчайших элементов земной коры. Его кларковое число — 10 −3 г/т. По геохимическим свойствам он схож со своими гораздо более распространенными соседями по периодической системе — молибденом и вольфрамом. Поэтому в виде малых примесей он входит в минералы этих элементов. Основным источником рения служат молибденовые руды некоторых месторождений, где его извлекают как попутный компонент.
Единственное в мире месторождение рения обнаружено в 1992 году на вулкане Кудрявый, остров Итуруп, Южно-Курильские острова. Месторождение представлено фумарольным полем с постоянно действующими источниками высокотемпературных глубинных флюидов — фумаролами. Это означает, что месторождение активно формируется по сегодняшний день. Рений находится в форме минерала рениит ReS2, со структурой, аналогичной молибдениту.
Свойства рения
Физические свойства
Рений — четвёртый в списке элементов с наибольшей плотностью в твёрдом состоянии.
Рений — тугоплавкий тяжёлый металл, по внешнему виду напоминает сталь. Порошок металла — чёрного или темно-серого цвета в зависимости от дисперсности. По ряду физических свойств рений приближается к тугоплавким металлам VI группы (молибден, вольфрам), а также к металлам платиновой группы. По температуре плавления рений занимает второе место среди металлов, уступая лишь вольфраму, а по плотности — четвёртое (после осмия, иридия и платины). Чистый металл пластичен при комнатной температуре, но вследствие высокого модуля упругости после обработки твёрдость рения сильно возрастает из-за наклёпа. Для восстановления пластичности его отжигают в водороде, инертном газе или вакууме. Рений выдерживает многократные нагревы и охлаждения без потери прочности. Его прочность при температуре до 1200 °C выше, чем вольфрама, и значительно превосходит прочность молибдена. Удельное электросопротивление рения в четыре раза больше, чем у вольфрама и молибдена. [3]
Химические свойства
Компактный рений устойчив на воздухе при обычных температурах. При температурах выше 300°C наблюдается окисление металла, интенсивно окисление идет при температурах выше 600°C. Рений более устойчив к окислению, чем вольфрам, не реагирует непосредственно с азотом и водородом; порошок рения лишь адсорбирует водород. При нагревании рений взаимодействует с фтором, хлором и бромом. Рений почти не растворим в соляной и плавиковой кислотах и лишь слабо реагирует с серной кислотой даже при нагревании, но легко растворяется в азотной кислоте. Со ртутью рений образует амальгаму. [4]
Рений взаимодействует с водными растворами пероксида водорода с образованием рениевой кислоты.
Получение
Технология получения рения
Рений получают при переработке сырья с очень низким содержанием целевого компонента (в основном это медное и молибденовое сульфидное сырье).
Переработка сульфидного ренийсодержащего медного и молибденового сырья основана на пирометаллургических процессах (плавка, конвертирование, окислительные обжиг). В условиях высоких температур рений возгоняется в виде высшего оксида Re2O7, который затем задерживается в системах пылегазоулавливания.
В случае неполной возгонки рения при обжиге молибденитовых концентратов, часть его остается в огарке и затем переходит в аммиачные или содовые растворы выщелачивания огарков. Таким образом, источниками получения рения при переработке молибденитовых концентратов могут служить сернокислотные растворы мокрых систем пылеулавливания и маточные растворы после гидрометаллургической переработки огарков.
При плавке медных концентратов с газами уносится 56—60 % рения. Невозогнавшийся рений целиком переходит в штейн. При конвертировании последнего содержащийся в нем рений удаляется с газами. Если печные и конверторные газы используют для производства серной кислоты, то рений концентрируется в промывной циркуляционной серной кислоте электрофильтров в виде рениевой кислоты. Таким образом, промывная серная кислота служит основным источником получения рения при переработке медных концентратов.
Основные методы выделения из растворов и очистки рения — экстракционные и сорбционные. [3]
Мировая добыча рения
Мировая добыча рения в 2006 году составила около 40 тонн.
Сырьевые источники и запасы
Общие мировые запасы рения составляют около 13000 тонн, в том числе 3500 тонн в молибденовом сырье и 9500 т — в медном. При перспективном уровне потребления рения в количестве 40—50 тонн в год человечеству этого металла может хватить еще на 250—300 лет. Приведенная цифра носит оценочный характер без учета степени повторного использования металла.
Запасы рения в виде рениита на острове Итуруп оцениваются в 10-15 тонн, в виде вулканических газов — до 20 тонн в год. [5]
В практическом отношении важнейшими сырьевыми источниками получения первичного рения в промышленном масштабе являются молибденовые и медные сульфидные концентраты. В общем балансе производства рения в мире на них приходится более 80 %. Остальное в основном приходится на вторичное сырье.
Применение
Важнейшие свойства рения, определяющие его применение это: очень высокая температура плавления, устойчивость к химическим реагентам, каталитическая активность (в этом он близок к платиноидам).
Рений используется при изготовлении:
Кроме того, из рения делают самоочищающиеся электрические контакты. При замыкании и разрыве цепи всегда происходит электрический разряд, в результате чего металл контакта окисляется. Точно также окисляется и рений, но его оксид Re2O7 летуч при относительно низких тепературах (температура кипения — всего 362,4 °C) и поэтому при разрядах он испаряется с поверхности контакта. Поэтому рениевые контакты служат очень долго.
Биологическая роль
Маловероятно, что рений участвует в биохимических процессах. Вообще о воздействии рения на живые организмы известно очень мало, не изучена его токсичность, поэтому при работе с его соединениями следует быть осторожным.
Изотопы
Природный рений состоит из двух изотопов: 185 Re (37,4 %) и 187 Re (62,6 %). Первый из них стабилен, а второй испытывает бета-распад с периодом полураспада 43,5 млрд. лет. Этот распад используется для датировки древних руд и метеоритов (см. Рений-осмиевый метод) по накоплению в минералах, содержащих рений, стабильного изотопа 187 Os. Распад 187 Re интересен также тем, что его энергия является наименьшей (всего 2,6 кэВ) среди всех изотопов, испытывающих бета-распад.
Рений, свойства металла, его характеристики и особенности
Рений является очень плотным переходным металлом, в таблице Д.И. Менделеева обозначен как химический элемент с атомным номером 75. В переводе на латинский означает ренус, название реки Рейн в Германии. Открытие рения в сравнении недавнее- 1925год. Его обнаружили немецкие химики, а в 1928году удалось получить чистый рений, который добыли из норвежского молибденита. Для этого переработали 600 кг. этой породы. Не все химические элементы имеют стабильный изотоп, рений содержит его, в результате этого он стал последним открытым элементом, у которого он есть. Элементы открытые позже, не имеют стабильных изотопов.
Металл рений
Для получения металла используют медные и молибденовые сульфидные концентраты, они являются важнейшими сырьевыми источниками получения первичного рения. Приблизительное содержание в них может быть 0,005% по массе. Геохимические свойства этого металла очень похожи на вольфрам и молибден. Добыча рения непростое дело и требует больших затрат. В мире известно только одно выгодное месторождение рения — это остров Итуруп на курильских острова, там содержится он в форме минерала ренит, структура как у молибденита. А в Финляндии также обнаружили минерал таркианит, который содержит рений.
Свойства рения
Рений — очень твердый металл, его плотность составляет 21,02 г/см3, порошок металла темно-серого или черного цвета. Для высокой плотности необходима очень высокая температура плавления, у рения она 31860 С, в этом он уступает вольфраму, а кипение 55960 С является парамагнитным. Имеет гексагональную кристаллическую решетку. Цифры показывают, что он тугоплавкий металл и очень напоминает вольфрам и молибден, а также металлы платиновой группы. Пластичен при комнатной температуре, но после обработки твердость металла сильно возрастает из-за наклепа, так как высокий модуль упругости.
Механические свойства рения позволяют ему выдерживать многократные нагревы и охлаждения, после которых прочность не теряет своих свойств. И даже при температуре 12000 С прочность становится выше, чем у вольфрама. Еще одно преимущество рения перед молибденом и вольфрамом в том, что у него удельное электросопротивление в 4 раза больше.
Химические свойства рения придают ему устойчивость на воздухе при обычной температуре. Когда она выше 3000 С происходит окисление металла, а при 6000 С оно протекает более интенсивно. Среди платиновых металлов он более устойчив к окислению, с азотом и водородом непосредственно не реагирует. С такими элементами как бром, хлор и фтор вступает в реакцию лишь при нагреве. Наблюдается слабая реакция с серной кислотой, даже после нагревания, но легко растворяется в азотной кислоте.
Среди тугоплавких металлов рений не образует карбидов. Хорошие показатели твердости, прочности, устойчивости свойств рения позволяют использовать его:
Таким образом, видно, что свойства рения позволяют использовать этот ценный металл и его сплавы в самых разных отраслях промышленности, и он находит новые формы применения.
Оставьте свой комментарий Отменить ответ
Рутений – простое вещество, которое является переходным металлом, относится к…
Рений
Ре́ний / Rhenium (Re), 75
[Xe] 4f 14 5d 5 6s 2
Ре́ний — химический элемент с атомным номером 75 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом Re (лат. Rhenium). При стандартных условиях представляет собой плотный серебристо-белый металл.
Содержание
История
Существование рения было предсказано Д. И. Менделеевым («двимарганец»), по аналогии свойств элементов в группе периодической системы.
Элемент открыли в 1925 году немецкие химики Ида и Вальтер Ноддак при проведении исследований в лаборатории компании Siemens & Halske. Элемент назван в честь Рейнской провинции Германии — родины Иды Ноддак.
Рений стал последним открытым элементом, у которого известен стабильный изотоп. Все элементы, которые были открыты позднее рения (в том числе и полученные искусственно) не имели стабильных изотопов.
Нахождение в природе
Мировая добыча рения
Сырьевые источники и запасы
Общие мировые запасы рения составляют около 13 000 тонн, в том числе 3500 тонн в молибденовом сырье и 9500 т — в медном. При перспективном уровне потребления рения в количестве 40—50 тонн в год человечеству этого металла может хватить ещё на 250—300 лет. Приведённое число носит оценочный характер без учёта степени повторного использования металла.
Геохимия рения
Рений — один из редчайших элементов земной коры. Его кларковое число — 10 −3 г/т. По геохимическим свойствам он схож со своими гораздо более распространёнными соседями по периодической системе — молибденом и вольфрамом. Поэтому в виде малых примесей он входит в минералы этих элементов. Основным источником рения служат молибденовые руды некоторых месторождений, где его извлекают как попутный компонент.
50×20 м с постоянно действующими источниками высокотемпературных глубинных флюидов — фумаролами. Это означает, что месторождение активно формируется по сегодняшний день. Рений находится здесь в форме минерала рениит ReS2, со структурой, аналогичной молибдениту.
Ещё один минерал, содержащий рений, — таркианит (Cu,Fe)(Re,Mo)4S8 с 53,61 мас. % рения — был обнаружен в концентрате из месторождения Хитура в Финляндии (Kojonen еt аl., 2004).
Свойства рения
Физические свойства
Химические свойства
Рений взаимодействует с водными растворами пероксида водорода с образованием рениевой кислоты.
Стоимость
Получение
Технология получения рения
Рений получают при переработке сырья с очень низким содержанием целевого компонента (в основном это медное и молибденовое сульфидное сырье).
Переработка сульфидного ренийсодержащего медного и молибденового сырья основана на пирометаллургических процессах (плавка, конвертирование, окислительный обжиг). В условиях высоких температур рений возгоняется в виде высшего оксида Re2O7, который затем задерживается в системах пылегазоулавливания.
В случае неполной возгонки рения при обжиге молибденитовых концентратов, часть его остается в огарке и затем переходит в аммиачные или содовые растворы выщелачивания огарков (NH4ReO4), которые позже восстанавливают водородом:
Полученный порошок рения методами порошковой металлургии превращают в слитки металла.
Таким образом, источниками получения рения при переработке молибденитовых концентратов могут служить сернокислотные растворы мокрых систем пылеулавливания и маточные растворы после гидрометаллургической переработки огарков.
При плавке медных концентратов с газами уносится 56—60 % рения. Невозогнавшийся рений целиком переходит в штейн. При конвертировании последнего содержащийся в нём рений удаляется с газами. Если печные и конверторные газы используют для производства серной кислоты, то рений концентрируется в промывной циркуляционной серной кислоте электрофильтров в виде рениевой кислоты. Таким образом, промывная серная кислота служит основным источником получения рения при переработке медных концентратов.
Применение
Кроме того, из рения делают самоочищающиеся электрические контакты. При замыкании и разрыве цепи всегда происходит электрический разряд, в результате чего металл контакта окисляется. Точно так же окисляется и рений, но его оксид Re2O7 летуч при относительно низких температурах (температура кипения — всего 362,4°C), и при разрядах он испаряется с поверхности контакта. Поэтому рениевые контакты служат очень долго.
Биологическая роль
Маловероятно, что рений участвует в биохимических процессах. Вообще о воздействии рения на живые организмы известно очень мало, не изучена его токсичность, поэтому при работе с его соединениями следует быть осторожным.
Изотопы
Природный рений состоит из двух изотопов: 185 Re (37,4 %) и 187 Re (62,6 %). Первый из них стабилен, а второй испытывает бета-распад с периодом полураспада 43,5 млрд лет. Этот распад используется для датировки древних руд и метеоритов (см. Рений-осмиевый метод) по накоплению в минералах, содержащих рений, стабильного изотопа кэВ) среди всех изотопов, испытывающих бета-распад.
Рений. Свойства рения. Применение рения
Описание и свойства рения
Рений – металл с белым оттенком. Порошок рения имеет напротив чёрный окрас. Это очень твёрдый и плотный по структуре металл. Плавление — 3186º С, кипение — 5596º С. Имеет парамагнитные свойства.
Природный минерал рений фото ниже:
При температурном режиме свыше 300º С, металл начинает интенсивно окислятся, в зависимости от повышения температуры. Реакции рения более устойчивы к окислу, чем например, у вольфрама. Реакций с водородом и азотом почти не происходит, лишь адсорбция с водородом.
Во время нагревания начинает происходить взаимодействие с хлором, фтором и бромом. Не растворяется в кислотах, кроме азотной кислоты. При взаимодействии рения с ртутью образуется амальгама.
Взаимодействуя с пероксидом водорода (а точнее его водным раствором), образует рениевую кислоту. Единственный элемент, представляющий тугоплавкие металлы, не образующий карбидов.
Известно, что рений не задействован в биохимии. О его возможном воздействии имеется довольно малок количество фактов, но достоверна его токсичность, поэтому в любом случае он ядовит для живых существ.
Добыча и происхождение рения
Это крайне редкий металл. В природных залежах наиболее часто встречается сочетание вольфрам – рений – молибден. Примесь этого элемента также содержится в минералах его соседей. Основная добыча рения идёт из молибденовых залежей, где он извлекается попутно.
Также рений извлекается из редчайшего природного минерала, именующимся джезказганит — по названию казахского города, вблизи которого он был найден. Также рений содержится в колумбите (ниобии), колчедане, цирконе и некоторых редкоземельных минералах.
Рений рассредоточен по всему миру, в ничтожных концентрациях. Достоверно известно лишь одно серьёзное месторождение этого метала – Итуруп, маленький остров на Курилах, Россия. Открыто в 1992 г. Рений там представлен минералом рениитом ReS2, имеющим строение схожее с молибденитом.
Месторождение представляет собой небольшую площадку на вершине спящего вулкана, где активно действуют термальные источники. Это говорит, что месторождение продолжает свой рост, и по предварительным оценкам оно ежегодно выкидывает в атмосферу около 37 тонн этого металла.
Вторым более или менее пригодным для промышленной разработки источником рения, можно считать месторождение Хитура, находящееся в Финляндии. Там рений содержится в минерале таркианите.
Как получают рений? Производство этого метала происходит посредством обработки первичного сырья с довольно низким процентом металла. В основном используются обрабатываются медные и молибденовые сульфиды.
Этапы пирометаллургического процесса, применяющегося при работе с содержащими рений рудами, включают в себя процедуру плавления, конвертирования и окислительного обжига.
При огромных температурах плавления сначала получается высший оксид Re2O7, задерживающийся специальными улавливателями. Нередко часть рения остаётся в саже после обжига, из которой его можно получить с помощью водорода. Далее полученный порошок переплавляют в слитки рения.
При плавлении из руды возгоняется большая часть рения, остаток оседает в штейне. В процессе конвертации штейна, содержащийся в нём рений выделяется посредством газа.
Концентрация рения производится с помощью серной кислоты, после чего получается рениевая кислота. Используя определённые методы очистки, рений выделяется из кислотного раствора.
Исходя из довольно низкой продуктивности данного метода – выход может составить не более 65% содержащегося в руде металла, постоянно проводятся научные изыскания на предмет выявления более продуктивных альтернативных методов производства металла.
Современные технологии уже подразумевают применение водного раствора, вместо кислотного. Это позволит улавливать гораздо больше металла при во время очистки.
Применение рения
К основным преимуществам рения, за что его так ценят во всём мире, считаются тугоплавкость, малая коррозия при воздействии различных химических веществ и т.д. В виду высоких цен на этот металл, его стараются использовать только в крайних и исключительных случаях.
Ещё не так давно, основной областью его применения были жаростойкие сплавы рения с различными металлами, используемые в ракетостроении и авиастроительной промышленности.
В частности, сплавы шли на производство запчастей для сверхзвуковых истребителей. Подобные сплавы включают в свой состав, по меньшей мере, 6% металла рения.
Этот аспект быстро сделал реактивные двигатели крупным источником потребления мировых запасов рения. К тому же за счёт этого он стал считаться военно-стратегическим запасом.
Специальные термопары, содержащие рений позволяют измерять огромные температуры. Рений позволяет платиновым металлам продлить их срок службы. Также из рения делаются пружины для точной аппаратуры и нити накаливания для спектрометров и манометров.
Если точнее, то там используется вольфрам с рениевым покрытием. За счёт его устойчивости к химическим воздействиям, рений используется для создания защитных покрытий против кислотной и щелочной среды.
Рений нашёл применение при изготовлении специальных контактов, которые самоочищаются после кратковременного короткого замыкания. На обычных контактах остаётся окисел, который порой не пропускает ток. На рении он тоже остаётся, но вскоре улетучивается. Поэтому контакты из рения имеют очень долгий срок службы.
Цена рения
Мировой запас этого металла составляет порядком 13 тысяч тонн по большей части в молибденовых и медных залежах. Они являются его основными источниками в металлургической промышленности.
В принципе это не удивительно, более 2/3 всего рения на планете содержится именно в них. А оставшаяся треть представляет собой вторичный материал.
По некоторым подсчётам этих запасов хватит ещё лет на триста не меньше. Причём в этом отчёте вторичное использование не учитывалось. А подобные проекты разрабатывались достаточно давно, и некоторые проекты на практике доказали свою состоятельность.
Цены на любой продукт устанавливаются основываясь на доступность товара. Как становиться ясным, рений, купить который по карману не каждому, отнюдь не доступный металл. К тому же имеется активный спрос на рений. Цена у него естественно соответствующая.
Механизм и технология получения покрытий рением из расплавленных электролитов. Структура и свойства рения.
Содержание:
1. Что такое рений?
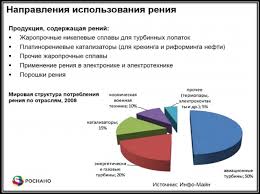
Рений пластичен в литом и рекристаллизованном состоянии, деформируется на холоду, имеет исключительно высокое сопротивление деформации. При температурах до 2000 о С рений сохраняет высокие прочностные и пластические характеристики, опережая другие тугоплавкие металлы. Рений обладает высокой коррозионной стойкостью во влажных средах, не растворяется при комнатной температуре в растворах соляной, серной и плавиковой кислоты. Рений устойчив в атмосфере водорода, азота и углеводородов даже при высоких температурах. Данные характеристики рения и определили его применение в мировой промышленности, а именно как материал для:
Рений также используется в:
На реакции β-распада 187 Re основан рений-осмиевый метод определения возраста горных пород и метеоритов.
Около 65% производимого в мире рения идет на получение Pt-Re катализаторов для нефтеперерабатывающей промышленности (получение бензина с высоким октановым числом).
В то же время, высокая стоимость рения, высокая температура плавления, большая чувствительность к кислороду и большая степень наклепа затрудняют общепринятые металлургические переделы и механическую обработку рения. Поэтому перспективными являются методы, позволяющие получать рениевые покрытия или готовые изделия без последующей или с минимальной механической обработкой.
Существуют различные методы получения рениевых покрытий:
Метод получения рения из хлоридных расплавов был впервые разработан в ИВТЭ УрО РАН. Он позволяет получать сплошные слои рения толщиной от нескольких микрон до нескольких миллиметров, а также фольги и изделия сложной конфигурации, годные к применению без последующей или с минимальной механической обработкой.
На структуру и морфологию рения, электроосажденного из хлоридного расплава, оказывает влияние ряд факторов:
Важным фактором является наличие кислородсодержащих соединений в составе расплавленного электролита.
Даже небольшие примеси кислорода в составе расплавленного электролита для осаждения тугоплавких металлов оказывают существенное влияние на структуру и физико-химические свойства катодных осадков. В большинстве случаев наблюдается изменение текстуры осадков и нарушение сплошности покрытия. Однако имеются сведения для процессов осаждения вольфрама, проведенных Молчановым А.М., о том, что при определенном мольном отношении О/Me возможно получение качественных сплошных осадков со столбчатой структурой. Поэтому изучение влияния кислородсодержащих примесей на структуру и морфологию электролитических осадков тугоплавких металлов является актуальной научной задачей.
2. Свойства рения.
2.1 Физико-химические свойства металлического рения.
Некоторые химические свойства рения:
2.2 Свойства оксидов рения.
Диоксид рения ReO2 образуется:
• при частичном восстановлении высших оксидов рения водородом при 300 о С,
• при нагревании ReO3 до 300 о С в вакууме:
• при диспропорционировании соединений Re (VI):
Триоксид рения ReO3 образуется по реакциям:
Пентаоксид рения Re2O5 получен при действии на раствор Re (VII) в концентрированной серной кислоте сульфата железа (II). Пентаоксид рения также образуется электрохимическим восстановлением перрената в сернокислом растворе.
Re2O7 может образовываться по реакции при 750 о С:
2.3 Химические свойства галогенидов и оксогалогенидов рения.
С бромом рений образует бромиды и оксобромиды: ReBr5, ReBr4, Re3Br9, ReO3Br, ReOBr4.
С йодом рений дает соединения: ReJ4, Re3J9, ReJ2, ReJ, и не образует оксойодидов.
Известны хлориды и оксохлориды рения: ReCl6, ReCl5, ReCl4, Re3Cl9, ReO3Cl, ReOCl4. Из хлоридов рения наиболее изучены ReCl5 и ReCl3. Для высшей степени окисления рения (+7) известен только оксохлорид ReO3Cl, который образуется по реакции:
Высший оксохлорид рения (VI) образуется по реакциям:
6ReCl3 + 5O2 = 4ReOCl4 + 2ReO3Cl (в токе сухого кислорода)
Оксохлорид рения (VI) реагирует с водой:
Re (V) образует пентахлорид ReCl5 при действии избытка хлора на металлический рений при температуре 500-700 о С:
ReCl5 на воздухе образует:
Трихлорид рения получается разложением ReCl5 при 375 о С в токе азота. Трихлорид рения состоит из трехядерных групп Re3Cl9, соединенных мостиками из атомов хлора. Re3Cl9 поглощает пары воды из воздуха с образованием Re(OH)Cl2. Он быстро гидролизуется водой до HF и HReO4.
Трихлорид ReCl3 при 400-450° С сублимируется с разложением, при 800-850° С испаряется без разложения, выше 1000° С диссоциирует на Re и Сl2, на воздухе при комнатной температуре устойчив, в присутствии влаги образует дигидрат ReCl3*2H2O, при нагревании на воздухе или в среде О2 дает оксохлориды и Сl2
При сплавлении ReCl5 с хлоридом щелочного металла образуется гексахлорренат.
3Re (V) = 2Re(IV) + Re (VII)
3. Методы осаждения рениевых покрытий.
Осадки рения возможно получать плазменным напылением порошков, вакуумной конденсацией паров металла на охлаждаемой поверхности, газофазным методом восстановления или разложения летучих соединений рения, диффузионным методом, гальваническим осаждением из водных растворов или расплавов солей.
Плазменное напыление может быть осуществлено с большой скоростью, однако получаемые при этом изотропно структурные слои имеют значительную пористость и в условиях повышенных температур, за счет конденсационно-рекристаллизационных процессов в изделиях изменяется объем слоя, возникают дефекты, приводящие к изменению свойств изделий вплоть до их разрушения.
Вакуумная конденсация позволяет получить слои высокой плотности, но, как правило, при этом малы скорости осаждения, требуется сложное оборудование и в целом технология получения толстых осадков из тугоплавких металлов, особенно при больших габаритных размерах и сложных профилях поверхности изделий, трудноосуществима.
Газофазный метод обеспечивает относительно высокие скорости наращивания неплотных слоев, обладающих требуемой кристаллографической структурой. Технология относительно проста по используемому оборудованию, но требует строгого соблюдения и контроля условий процесса, применения высокочистых компонентов, тщательного соблюдения техники взрывобезопасности.
Диффузионный метод позволяет получать тонкие покрытия, но не позволяет получать готовые изделия.
Рений возможно получать из сульфатных, сульфатно-аммонийных, фторидных, щелочных, фторидно-щелочных, оксалатных и фосфатных водных электролитов.
Водные электролиты для осаждения рения имеют следующие недостатки:
1) Используются нерастворимые аноды, поэтому состав электролита постоянно изменяется и требует частой корректировки;
2) Низкий катодный выход по току;
3) Сильное выделение водорода;
4) Осадки сильно загрязняются различными примесями, вследствие чего они, как правило, становятся твердыми, напряженными, иногда растрескивающимися. Это приводит к невозможности получения толстых компактных осадков в одну стадию электролиза.
Поэтому для получения толстых покрытий рением применяют послойное наращивание с термообработкой каждого слоя в атмосфере водорода, аргона или в вакууме при температурах 700-1100 о С в зависимости от материала подложки.
Наиболее перспективным методом для получения сплошных осадков рения является метод высокотемпературной гальванопластики. Он позволяет с высокой скоростью получить сплошные чистые слои металла с точно заданной толщиной (от нескольких микрометров до нескольких миллиметров) и структурой. Так, в УрО РАН ИВТЭ были получены электролизом хлоридного расплава готовые изделия и ориентированные фольги из рения.
В литературе имеются сведения об осаждении рения из вольфраматных, хлоридно-фторидных, оксофторидных, и хлоридных расплавов.
3.1 Электроосаждение рения из вольфраматного электролита.
При осаждении рения из вольфраматных электролитов с добавками перренатов возможно получать сплошные осадки металлического рения. В работе академика Барабошкина А.Н. с соавторами были проведены кинетические исследования в расплаве Na2WO4-KReO4 с добавкой WO3, позволяющей изменять в широких пределах активность кислорода. Эксперименты проводили в алундовом тигле на воздухе, рабочим и вспомогательным электродом служил электролитический рений. В качестве электрода сравнения использовался платиново-кислородный (воздушный) электрод.
Была также предложена катодная брутто-реакция восстановления рения:
В работе Тарасовой К.П. с соавторами рений осаждался из Na2WO4-K2WO4 вольфраматного электролита с добавкой оксида вольфрама (VI) и перрената калия на никелевую подложку на воздухе в алундовом тигле. Анодом служил металлический рений. В данной работе было исследовано влияние температуры электролита, плотности тока и концентрации KReO4 на изменение текстуры и структуры осадков, а также на сцепление с подложкой и микротвердость.
Было выяснено, что наибольшее влияние на структуру осадков оказывает концентрация перрената и температура электролита. Повышение температуры от 700-800 о С до 900-950 о С вызывает переход от кустистой структуры осадка к столбчатой. Одновременно при низкой температуре осадок становится мелкокристаллическим, с нечеткой огранкой поверхности и характерными полусферическими наростами. При высокой температуре поверхность осадка приобретает более однородную макроструктуру и образуется гладкими гранями кристаллов. Преимущественными ориентациями зерен (аксиальные текстуры) являются (101(-)0) и (112(-)0). Переходу от одной структуры к другой способствовало увеличение температуры и снижение концентрации перрената калия. На прочность сцепления покрытия с подложкой в основном влияла концентрация перрената: в пределах концентрации 1-4% сцепление удовлетворительное, при 5 осадок отслаивается от подложки.
Закономерности изменения структуры, текстуры и микротвердости электролитических осадков рения, полученных из вольфраматных расплавов аналогичны хлоридным. Примесью, включаемой в осадок, также как и в хлоридных расплавах, авторы считают оксидные соединения рения (низшие оксиды или рениевые бронзы). Повышение концентрации перрената в расплаве способствует соосаждению оксида рения, повышение температуры, наоборот, способствует осаждению рения с малым содержанием оксида.
3.2 Электроосаждение рения из оксофторидного электролита.
ReO 4- + (7-x)e → Re(x) + 4O 2-
В то же время, процесс анодного окисления, по мнению исследователей, сопровождается образованием гексафторида рения:
3.3 Электроосаждение рения из хлоридно-фторидного электролита.
Электровосстановлению рения из хлоридно-фторидного электролита посвящена работа Affonune A. с соавторами. В ней исследовано электрохимическое поведение K2ReCl6 в расплавленной эвтектике LiF-NaF-KF. Авторы считают, что K2ReCl6 восстанавливается до металла в обратимую двухэлектронную реакцию и анодно окисляется с образованием в расплаве Re(III) по обратимому одноэлектронному процессу.
3.4 Электроосаждение рения из хлоридного электролита.
3.4.1 Катодный и анодный процесс в хлоридном электролите.
В работе А.Н.Барабошкина и О.Н.Виноградова-Жаброва имеются сведения что в хлоридном электролите без примесей разряд рения идет из Re(IV) с выходом по току, близким к 100%:
Большое исследование электрохимического поведения рения проведено Кузнецовым С.А. в солевых расплавах рения на основе NaCl, NaCl-KCl, KCl, CsCl. На циклических вольт-амперограммах в электролите на основе NaCl с концентрацией рения 1% по массе автор находит один четкий пик восстановления комплексов рения, соответствующий ему пик электроокисления металла и волна окисления ионов хлора. Стационарные вольт-амперные кривые имели одну площадку предельного диффузионного тока. Потенциостатический электролиз при потенциалах данной волны приводит к образованию на катоде металлического рения. При скорости развертки потенциала
Автор также считает, что катодный процесс описывается реакцией:
Таким образом методом циклической вольт-амперометрии показано, что в расплаве на основе NaCl присутствую только ионы Re(III).
Иная картина представляется в расплавах на основе KCl и CsCl с концентрацией рения 1% по массе. Вольт-амперометрические исследования, показывают, что при хлорировании рения в этих солях образуется комплекс Re(IV), а не Re(III). На вольт-амперных кривых в катодной области зарегестрировано два пика. Первая стадия является обратимой до скорости развертки 2 В/с, число переносимых электронов равно 1. Вторая трехэлектронная стадия с образованием металлического рения на катоде является обратимой в расплаве KCl при скорости развертки потенциала 1 В/с, а в расплаве CsCl по крайней мере при скорости развертки > 0,125 В/с уже является необратимой.
В эквимолярной смеси NaCl-KCl при хлорировании рения вольт-амперограммы имели такой же вид, как и в расплаве на основе NaCl (данный электролит также имел концентрацию рения не больше 1% по массе). Автор объясняет это тем, что в данном расплаве во второй координационной сфере находятся ионы натрия, но уже при 60 мольных процентах KCl наблюдалось вытеснение внешнесферных катионов натрия и замен их на калий. В расплаве образовывались комплексы Re (IV), четко фиксируемые на циклических вольт-амперограммах по появлению волны электроокисления:
Окисление-восстановление рения, по реакции:
протекает при потенциалах, близких к выделению хлора.
Анодный процесс растворения рения изучался как в щелочных растворах, так и в расплавах. Основная реакция происходит практически со 100% выходом по току по схеме:
Анодное растворение рения в расплаве LiCl-KCl сопровождается при низких плотностях тока образованием не только Re(IV), но и Re(III). Последний диспропорционирует на Re(IV) и Re(0).
3.4.2 Структура рениевого покрытия.
Рентгенограмма рениевого покрытия приведена на рисунке 1.
Наибольшее влияние на структуру рениевого покрытия, осажденного из хлоридного электролита, оказывает температура электролиза, катодная плотность тока, катионный состав электролита и наличие в нем примесей (особенно кислорода), а также материал и структура подложки.
В зависимости от вышеобозначенных условий отмечается четыре типа структур рения, полученных из хлоридных электролитов:
1. Очень темные осадки, иногда растрескивающиеся, пористые. Структура на шлифе не выясняется
2. Серые (бархатистые), очень мелкокристаллические, беспористые. На шлифе поперечного сечения столбчатая тонковолокнистая структура
3. Зеркально-гладкие, блестящие, беспористые. На поверхности встречаются выступы характерной полусферической формы.
4. Структура «черный бархат», образованная щеткой игл в особо чистых по кислороду условиях и высокой плотности тока в электролите на основе NaCl. Покрытие, имеющее такую структуру обладает отражательной способностью близкой к абсолютно черному телу.
Переход от одной формы осадка к другой может быть объяснен феноменологически, исходя из числа образующихся зародышей и направлений роста, структуры, величин градиентов электрического, температурного, концентрационных полей, в расплаве, осадке и на границе фаз твердое/жидкое, а также влиянием кислородсодержащих примесей.
Микрораспределение потока осаждаемого вещества при электролизе определяется механизмом и кинетикой электродных реакций, микрогеометрией поверхности, а также ее энергетической и кинетической неоднородностью.
При чисто диффузионной кинетике плоский фронт роста осадка неустойчив, независимо от состава электролита, механизма электродного процесса и токового режима, если только удельное сопротивление осадка не выше, чем эффективное сопротивление расплава.
Любые торможения электродного процесса, локализованные на поверхности осадка либо в непосредственной близости к его поверхности, способствуют повышению равномерности распределения потока осаждаемого вещества на шероховатых поверхностях.
Сглаживающий эффект может быть получен при электроосаждении в следующих случаях:
3.4.3 Рост металлической пленки тугоплавких поливалентных металлов на поверхности хлоридного расплава при электроосаждении.
Для хлоридного электролита характерно образование металлической пленки рения на поверхности расплава, которая, разрастаясь, может замыкать катод с анодом, нарушая нормальный ход электролиза. Данное явление изучалось в работе А.Н.Барабошкина с соавторами.
Пленки такого рода характерны для металлов, образующих летучие высшие галогениды (рений, молибден, титан, цирконий, алюминий) и образуются только в галогенидных ваннах с растворимыми анодами из осаждаемого металла, когда электролиз ведется в атмосфере чистого инертного газа. В этом случае валентная форма ионов в расплаве близка к равновесной с металлом и, как правило, значительно более низкая, чем высшая допустимая валентность данного элемента. Пленки не образуются при электролизе в атмосфере воздуха расплавов, содержащих оксианионы металлов в высшей валентной форме, например вольфраматы, молибдаты.
Пленка не наблюдается при электролизе расплавов нелетучих галогенидов серебра, меди, хрома.
Согласно некоторым исследованиям при электроосаждении молибдена, установлено, что рост металлической пленки происходит со стороны, обращенной к электролиту, а не к газовой фазе. Пленка образуется на границе раздела фаз расплав-газ и расплав-твердое на участке поверхности, непосредственно прилегающей к катоду, и имеет электрический контакт с катодом, утолщаясь в дальнейшем при катодном осаждении на нее металла.
Авторами этих исследований предполагается два принципиально отличных механизма образования пленки.
Второй механизм не предполагает существования первично пленки. Избыточная концентрация ионов низшей валентности образуется при катодной реакции. Диффундируя от катода, они диспропорционируют на границе раздела фаз, на которой и катализируется образование зародышей кристаллов металла. Зарождение кристаллов на твердых поверхностях облегчено. Каталитические свойства границы газ-расплав могут быть объяснены адсорбцией частичек различных примесей.
Отмечается, что особенно облегчено диспропорционирование на границе газ-расплав будет в случае, если одним из его продуктов является легко летучий продукт.
3.4.4 Влияние температуры и плотности тока на свойства осадков рения, полученных из хлоридных электролитов.
Влияние температуры и плотности тока на свойства осадков рения изучалось в работах под руководством А.Н.Барабошкина и О.Н.Виноградова-Жаброва.
При температурах 850-950 о С осадки снова становились мелкокристаллическими.
При граничных условиях могло существовать две текстуры.
Наряду с изменением структуры осадков с повышением температуры менялась микротвердость и напряженность. При повышении температуры осадки становились менее напряженными, микротвердость их уменьшается.
В ряде опытов при температуре выше 750 о С отмечались пузыри, не являющиеся следствием дегазации графитового электрода.
В целом с ростом температуры происходит переход текстур роста (1000) → (1100) → (0001).
Сводная информация по зависимости текстур роста рения от температуры и плотности тока приведена в таблице 1, измеренная микротвердость покрытия, полученного при разной температуре и плотности тока 0,1А/см 2 приведена в таблице 2.
Измеренная скорость осаждения рения при плотности тока 0,1А/см 2 в NaCl-KCl электролите была равна 80-83 мкм/час.
Hμ на шлифе поперечного сечения осадка относительно подложки
3.4.5 Влияние катионного состава электролита на свойства осадков рения в хлоридных электролитах.
Хлоридный расплав может быть приготовлен на основе фоновых солей с различными катионами: Li, Na, K, Cs. При этом могут быть использованы не только индивидуальные соли, но и их смеси.
Влияние катионного состава (Na,K,Cs и их смеси) наиболее полно рассмотрено в обобщенной работе О.Н.Виноградова-Жаброва, Л.М.Минченко и соавторов. В работе R.A. Bailey рассматривается состав на основе Li-K.
3.4.6 Влияние примесей на свойства осадков рения из хлоридных электролитов.
Влияние кислородсодержащих примесей в расплаве на структуру осадков рения рассмотрено в ряде работ. В них авторы считают вредными примесями в хлоридном расплаве для осаждения рения кислородсодержащие соединения: О2, H2O, CO2, неконтролируемое количество которых вносится при сборке и загрузке электролизера. В дальнейшем, при нагревании и плавлении расплава они образуют оксосоединения рения, возгоняющиеся из расплава благодаря большой летучести. Кроме этого оксокатионы имеют близкие потенциалы восстановления с катионмаи Re(IV), поэтому они могут соосаждаться на катоде. Также была изучена кинетика электроосаждения рения в зависимости от загрязнения системы кислородом. Авторы не исследовали процесс при точном мольном отношении О/Re. Кроме этого, авторы не провели подробных структурных исследований осадков, полученных при различной концентрации кислорода в расплаве.
В очищенном расплаве осадки имели текстуру такую же, как и после введения кислорода.
Количество кислорода, при котором появляются пузыри, заданного введением перхлората калия непосредственно в электролит и присутствии кислорода в атмосфере над расплавом совпадает.
С увеличением содержания кислородной примеси поляризация на поликристаллическом электроде увеличивается, как на катоде, так и на аноде. Также поляризация уменьшалась с увеличением температуры. Фоновым электролитом в обоих случаях выступал хлорид калия. Также было установлено, что поляризация на монокристаллическом катоде выше, чем на поликристаллическом.
В некоторых работах предложены химические и электрохимические реакции в электролизере, возникающие при попадании кислорода в расплав. Первоначально происходит химическая реакция взаимодействия гексахлоррената с кислородом по реакции:
Оксокатион ReO 3+ восстанавливается на катоде (совместно с Re 4+ ) по реакции:
2ReO 3+ + 6e → ReO2 + Re
При низких температурах ReO2 внедряется в осадок, что приводит (при больших его количествах) черного порошкообразного покрытия. При высоких температурах оксид рения диспропорционирует по схеме:
3.4.7 Влияние материала и структуры подложки.
В литературе описано осаждение рения на графитовую, рениевую, вольфрамовую, никелевую и иридиевую подложку.
В работе Н.О.Есиной и Л.М,Минченко изучалась зависимость текстуры рениевых осадков, осажденных из хлоридного калиево-натриевого электролита, в зависимости от текстуры рениевой подложки. Так, было показано, что при осаждении на монокристаллические рениевые фольги происходит эпитаксиальный рост монокристаллических слоев осадка толщиной до 400 мкм. Однако эпитаксиальный рост происходит только в случае совпадения ориентации подложки с осью текстуры роста, формирующейся в осадках рения в этих условиях осаждения.
Морфология поверхности была представлена ограненными пирамидками и ямками. Появление огранки свидетельствует об анизотропии скоростей роста рения в различных направлениях. При увеличении плотности тока поверхность сглаживается, уменьшаются размеры ямок и пирамидок роста. Структура осадков не зависит от радиуса изгиба подложки.
В статье Н.О.Есиной, Л.М.Минченко, А.А.Панкратова изучен эпитаксиальный рост рения, электроосажденного из хлоридного расплава CsCl-Cs2ReCl6 на монокристаллические подложки (прямые и изогнутые) из рения с ориентациями (1000), (1100), (0001) и вольфрама с ориентациями (110), (100), (112), (111). В работе также найдены оптимальные условия эпитаксиального роста на монокристалле рения с ориентациями (0001) и (1100) и показана принципиальная возможность гетероэпитаксиального роста рения на монокристаллических подложках из вольфрама с ориентациями (111) и (100) при определенных условиях электроосаждения из расплава. В статье говорится, что эпитаксиальный рост рения зависит как от условий электролиза, так и от ориентации подложки. Нарушение эпитаксиального роста и формирование текстуры роста в осаждаемом слое рения происходило в случае несовпадения ориентации подложки с направлением оси текстуры роста.