что такое пунктуация в медицине
Программы лечения рака
Виды рака могут классифицироваться в зависимости от местонахождения опухоли, её размеров, причины возникновения и др. На развитие опухолевого процесса в организме могут влиять различные факторы, от неправильного питания до генетической наследственности. Все виды рака требуют определенной схемы лечения, что позволяет сохранить нормальное течение жизни.
Виды рака характеризуются отличием клеточного строения опухоли, динамикой развития, а также уровнем выживания во время лечения.
Онкологические заболевания могут возникать во всех системах и органах организма. Классификация видов онкологических заболеваний происходит в зависимости от места локализации опухоли и множества других факторов. Так процесс развития злокачественной опухоли может происходить в желудочно-кишечном тракте, мочеполовой системе, верхних дыхательных путях и грудной клетке, коже, скелете и мягких тканях, кровеносной и лимфатической системе, головном и спинном мозге. Рак представляет собой активное прогрессирующее патологическое разрастание атипичных клеток, заменяющих нормальные ткани.
Многие виды рака легко диагностируются на ранних стадиях, что позволяет победить онкологическое заболевание результативно и эффективно. В латентный период, когда симптомы и признаки рака еще не проявились у больного, но размножение раковых клеток уже происходит, выявляется форма и вид онкологического заболевания.
Все виды рака проявляются симптоматикой в зависимости от местонахождения опухоли и ее стадии. Болевые синдромы проявляется в месте роста онкологии, а также ухудшается общее состояние организма, незначительно повышается температура, снижается аппетит. Важным условием в эффективном лечении является ее выявление на ранних стадиях, когда раковые клетки еще не попали в кровь и лимфу.
Стадии развития онкологического заболевания
Что же такое метастазы?
Диагностика заболевания методом компьютерной томографии помогает обнаружить вид онкологического заболевания и образование метастазов в организме и подобрать эффективное лечение для улучшения картины заболевания.
Виды раковых заболеваний
Виды рака определяются в зависимости от множества факторов. Онкологическое заболевание классифицируется по нескольким критериям:
Виды рака разделяются по месту нахождения опухоли. То есть органе или системе, где он развивается.
Также виды онкологических заболеваний разделяются по типу ткани. Раковые клетки активно размножаются в мышечной, эпителиальной, костной, сосудистой, нервной и соединительной ткани. Развитие злокачественного образования в нескольких видах тканей называется сложным.
По строению клеток опухоли различают:
По принципу деления раковых клеток разделяют виды клинического, морфологического и гистологического рака.
Факторы риска
Все виды рака возникают в организме под действием определенных факторов. Развитие онкологического заболевания в основном зависит от образа жизни. Неправильное питание некачественными продуктами с большим содержанием канцерогенов вызывают развитие злокачественных опухолей. Чрезмерное употребление алкоголя и курение также является фактором возникновения рака, а также работа на вредных производствах и предприятиях, где происходит накопление организмом ядовитых веществ.
Также на наличие в организме раковых клеток влияет наследственность. Патологические процессы в клетках могут происходить после их мутации во внутриутробном периоде и во время развития организма. Так некоторые виды рака развиваются у новорожденных детей вместе с ростом тканей организма.
Плохая экология и высокий уровень радиации также являются причинами возникновения рака.
Диагностика онкологических заболеваний
Раннее диагностирование заболевания позволяет подобрать эффективное лечение и повысить шансы на выздоровление и сохранение нормального течения жизни больного. Успешный метод лечения возможен только после обнаружения раковой опухоли и определения вида онкологического заболевания.
Диагностика лечения начинается с консультации специалиста и оценки симптомов заболевания, после чего назначается ряд исследований. Виды рака определяются после ультразвукового исследования и взятия биопсии. Полноценный подход к диагностике заболевания с учетом возраста, сопутствующих недугов и факторов риска помогает исключить ложные симптомы.
Методы лечения онкологических заболеваний
В зависимости от вида онкологического заболевания подбираются методы лечения. Наиболее эффективным является комбинированный или комплексный подход к избавлению от недуга.
От вида онкологического заболевания назначается дополнительное лечение, такое как, лучевая терапия и прием химиопрепаратов.
Успешный исход лечения, может быть достигнут, если пациент настроен на лечение и соблюдение врачебных рекомендаций, профилактическим мерам и наблюдению у врача-онколога. Ранняя диагностика онкологического заболевания позволяет избежать усугубления состояния, восстановлению нормального течения жизни, а также избежанию возможности рецидива.
Профилактика онкологических заболеваний
Виды рака должны контролироваться на протяжении всей жизни с использованием скрининговых исследований. Из-за скрытого течения онкологического заболевания симптомы могут проявиться уже в запущенной стадии, когда лечение может быть малоэффективно. Поэтому профилактические обследования и внимательный подход к опасным симптомам помогут сохранить здоровье на долгие годы, а если болезнь все-таки наступила, особенно, если учтены все факторы риска, то это позволит подобрать правильный метод лечения для любого вида онкологического заболевания.
Унификация требований к формулировке диагноза
Однако, как справедливо указывается в рекомендациях Минздрава России, подмена рубрики «Основное заболевание» понятием «комбинированное основное заболевание» при коморбидности в настоящее время нарушает требования действующего федерального законодательства и МКБ-10, а при летальных исходах излишне усложняет выбор так называемой первоначальной причины смерти – основы статистики причин смерти населения.
В основу совершенствования правил формулировки диагноза и, при летальных исходах, оформления медицинского свидетельства о смерти должны быть положены современные дефиниции и требования действующего законодательства РФ (Федеральный закон № 323-ФЗ) и экспертов ВОЗ, отраженные в МКБ-10.
Диагноз
Диагноз (греч. διάγνωσις – распознавание) – медицинское заключение о состоянии здоровья, об имеющемся заболевании (травме, состоянии), выраженное в терминах, предусмотренных принятыми классификациями и номенклатурой болезней, обозначающих название болезней (состояний), их форм, вариантов течения и основанное на всестороннем систематическом изучении пациента. Содержанием диагноза также могут быть особые физиологические состояния организма (беременность, климакс, состояние после разрешения патологического процесса и др.), заключение об эпидемическом очаге.
Заболевание
Заболевание определяется как нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды, возникающее в связи с воздействием патогенных факторов при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма.
Состояние определяется как изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи. Ведущий принцип формулирования диагноза в медицине – нозологический.
Приведем некоторые термины и определения в соответствии с отраслевым стандартом ОСТ ТО № 91500.01.0005-2001 [10]:
1) нозологическая форма (единица) определяется как совокупность клинических, лабораторных и инструментальных диагностических признаков, позволяющих идентифицировать заболевание (отравление, травму, физиологическое состояние) и отнести его к группе состояний с общей этиологией и патогенезом, клиническими проявлениями, общими подходами к лечению и коррекции состояния;
2) синдром – это состояние, развивающееся вследствие заболевания и определяющееся совокупностью клинических, лабораторных, инструментальных диагностических признаков, позволяющих идентифицировать его и отнести к группе состояний с различной этиологией, но общим патогенезом, клиническими проявлениями, общими подходами к лечению, зависящих вместе с тем и от заболеваний, лежащих в основе синдрома.
Диагноз является интегральным выражением представления врача-специалиста о состоянии здоровья пациента и об имеющемся заболевании (травме, состоянии) на основании данных, полученных в результате диагностики, представляющей собой комплекс медицинских вмешательств, направленных на распознавание состояний или установление факта наличия либо отсутствия заболеваний, осуществляемых посредством сбора и анализа жалоб пациента, данных его анамнеза и осмотра, проведения лабораторных, инструментальных, патологоанатомических и иных исследований в целях определения диагноза, выбора мероприятий по лечению пациента и (или) контроля осуществления этих мероприятий.
Исходя из вышеизложенных положений федерального законодательства диагноз наделен разнообразными функциями:
1) медицинской: диагноз является обоснованием к выбору методов лечения и профилактических мероприятий, а также служит для оценки прогноза развития заболевания;
2) социальной: диагноз является обоснованием для медицинской экспертизы (экспертиза временной нетрудоспособности, медикосоциальная экспертиза, военно-врачебная экспертиза, судебно-медицинская и судебно-психиатрическая экспертиза, экспертиза профессиональной пригодности и экспертиза связи заболевания с профессией, а также экспертиза качества оказания медицинской помощи);
3) экономической: диагноз является основой для нормативного регулирования здравоохранения в рамках порядков оказания медицинской помощи, стандартов медицинской помощи и клинических рекомендаций (протоколов лечения).
4) статистической: диагноз является источником государственной статистики заболеваемости и причин смерти населения. Принимая во внимание законодательно установленный приоритет интересов пациента при оказании медицинской помощи, ни одна функция диагноза не может быть реализована за счет создания условий, которые могут обеспечить снижение качества оказания медицинской помощи. И потому диагноз всегда должен представлять собой полноценное, насколько это возможно в конкретных условиях, медицинское заключение о состоянии здоровья и об имеющемся заболевании (состоянии).
Медицинская и социальная функции диагноза приоритетны по отношению к экономической и статистической. В связи с этим подчеркиваем, что недопустимо любое выхолащивание или упрощение диагноза, мотивируемое необходимостью подогнать его под стандартизованные формулировки, схемы или правила.
В российском здравоохранении традиционно принята общая структура диагноза, строго отвечающая требованиям ВОЗ и включающая следующие составные части, или рубрики:
1. основное заболевание – заболевание, которое само по себе или в связи с осложнениями вызывает первоочередную необходимость оказания медицинской помощи в связи с наибольшей угрозой работоспособности, жизни и здоровью, либо приводит к инвалидности, либо становится причиной смерти;
2. сопутствующее заболевание – заболевание, которое не имеет причинно-следственной связи с основным заболеванием, уступает ему в степени необходимости оказания медицинской помощи, влияния на работоспособность, опасности для жизни и здоровья и не является причиной смерти.
Следует обратить внимание на то, что понятия «основное заболевание» и «сопутствующее заболевание» определены законодательно и не подлежат модификациям при дальнейшем обсуждении этих терминов. Из законодательно установленного определения основного заболевания следует обяза- тельность наличия в структуре диагноза рубрики «Осложнения основного заболевания», которые определяют первоочередную необходимость оказания медицинской помощи в связи с наибольшей угрозой работоспособности, жизни и здоровью, либо приводят к инвалидности, либо становятся причиной смерти.
Исходя из этого положения общая структура диагноза должна быть представлена следующими рубриками:
1. Основное заболевание.
2. Осложнения основного заболевания.
3. Сопутствующие заболевания.
Такая рубрификация диагноза впервые была утверждена приказом Минздрава СССР от 03.01.1952 № 4 и без изменений сохранилась до наших дней в бланках медицинских карт.
Но даже при этой простейшей конструкции диагноза могут возникнуть трудности при выборе основного и сопутствующих заболеваний (состояний), поэтому эксперты ВОЗ приняли ряд правил выбора заболеваний (состояний), которые используются при анализе заболеваемости и смертности.
Так, за состояние (заболевание), которое следует использовать для анализа заболеваемости по единичной причине, рекомендовано принимать такое, по поводу которого проводилось лечение или обследование во время соответствующего эпизода обращения за медицинской помощью. При этом как основное определяется состояние (заболевание, травма), диагностированное в конце эпизода оказания медицинской помощи, по поводу которого главным образом проводились обследование и лечение пациента. При наличии более одного такого состояния (заболевания) в качестве основного выбирают то, на долю которого пришлась наибольшая часть использованных ресурсов.
Для анализа причин смерти эксперты ВОЗ ввели понятие «первоначальная причина смерти», которое определяется как болезнь (травма), вызвавшая цепь болезненных процессов, непосредственно приведших к смерти, или обстоятельства несчастного случая либо акта насилия, которые вызвали смертельную травму.
Смертельное осложнение, определяющее развитие терминального состояния и механизма смерти (но не элемент самого механизма смерти), определяется как непосредственная причина смерти.
Таким образом, понятие первоначальной причины смерти аналогично понятию основного заболевания, а понятие непосредственной причины смерти – смертельному осложнению основного заболевания. Сопутствующие заболевания, поскольку они не способствуют смерти и не имеют причинно- следственной связи с основным заболеванием, не могут быть ассоциированы с причиной смерти, в статистике причин смерти не используются и потому в медицинское свидетельство о смерти не выносятся.
В МКБ-10 коморбидные заболевания (состояния) определяются как прочие важные заболевания (состояния), способствовавшие смерти. В конструкции диагноза такие коморбидные заболевания (состояния) целесообразно указывать как конкурирующие, сочетанные и/или фоновые заболевания (состояния) в дополнительной рубрике после рубрики «Основное заболевание». Они должны иметь общие осложнения с основным заболеванием, так как они совместно вызывают цепь болезненных процессов, непосредственно приведших к смерти.
Исходя из этих положений структура диагноза при коморбидности должна быть представлена следующими рубриками:
1. Основное заболевание.
2. Конкурирующие, сочетанные, фоновые заболевания (коморбидные заболевания, при наличии).
3. Осложнения основного (и коморбидных, при наличии) заболеваний.
4. Сопутствующие заболевания.
Конкурирующее заболевание
Определяется как нозологическая единица (заболевание или травма), которой одновременно с основным заболеванием страдал умерший, и каждая из них по отдельности, несомненно, могла привести к смерти.
Сочетанное заболевание
Определяется как нозологическая единица (заболевание или травма), которой одновременно с основным заболеванием страдал умерший, и которые, находясь в различных патогенетических взаимоотношениях и отягощая друг друга, привели к смерти, причем каждое из них по отдельности не вызвало бы летального исхода.
Фоновое заболевание
Определяется как нозологическая единица (заболевание или травма), которая стала одной из причин развития другого самостоятельного заболевания (состояния), отягощающего его течение и способствующего возникновению общих смертельных осложнений, приведших к летальному исходу.
В соответствии с правилами ВОЗ, в качестве первоначальной причины смерти должно учитываться только одно из этих состояний, выбранное в соответствии с таблицами рангов, рекомендованными ВОЗ. В диагнозе это заболевание (состояние) указывается в рубрике «Основное заболевание» и вписывается в часть I медицинского свидетельства о смерти. Все прочие заболевания (состояния), связанные с причиной смерти (конкурирующие, сочетанные и фоновые), в соответствии с рекомендациями о необходимости анализа по множественным причинам, должны быть отражены в части II медицинского свидетельства о смерти как прочие важные состояния, способствовавшие смерти.
Таким образом, структура диагноза должна включать следующие рубрики: основное заболевание, осложнения основного заболевания и сопутствующие заболевания. В рубрике «Основное заболевание» указывается только то заболевание (состояние), которое стало поводом для проведения лечебно-диагностических мероприятий во время последнего эпизода оказания медицинской помощи, а при летальном исходе само по себе или через свои осложнения могло привести к смерти. Это заболевание (состояние) указывается и кодируется в части I медицинского свидетельства о смерти в ка- честве первоначальной причины смерти.
В соответствующих пунктах части I свидетельства о смерти записываются непосредственная причина смерти (смертельное осложнение) и так называемые промежуточные состояния, которые выбираются из раздела «Осложнения основного заболевания», но не кодируются. При коморбидности прочие важные заболевания (состояния), ставшие поводом для оказания медицинской помощи, а при летальном исходе способствовавшие смерти, определенные как конкурирующие, сочетанные и/или фоновые заболевания, указываются в диагнозе в дополнительной рубрике после рубрики «Основное заболевание» и вносятся, соответственно, в часть II медицинского свидетельства о смерти с соответствующими кодами по МКБ-10.
Сопутствующие заболевания (состояния) в медицинское свидетельство о смерти не выносятся и не кодируются как не имевшие причинно-следственной связи с основным заболеванием, а при летальном исходе не повлиявшие на наступление летального исхода.
Сведения об авторах:
Зайратьянц Олег Вадимович – доктор медицинских наук, профессор, заведующий кафедрой пато-
логической анатомии ГБОУ ВПО «Московский государственный медико-стоматологический универ-
ситет им. А.И. Евдокимова» Минздрава России, вице-президент Российского и председатель Мос-
ковского обществ патологоанатомов
Мальков Павел Георгиевич – доктор медицинских наук, доцент, профессор кафедры патологиче-
ской анатомии ГБОУ ДПО «Российская медицинская академия последипломного образования» Мин-
здрава России, руководитель курса патологической анатомии кафедры физиологии и общей пато-
логии факультета фундаментальной медицины ФГБОУ ВО «Московский государственный университет
им. М.В. Ломоносова»
Кактурский Лев Владимирович – член-корреспондент РАН, доктор медицинских наук, профессор,
научный руководитель ФГБНУ «НИИ морфологии человека», президент Российского общества пато-
логоанатомов (Москва)
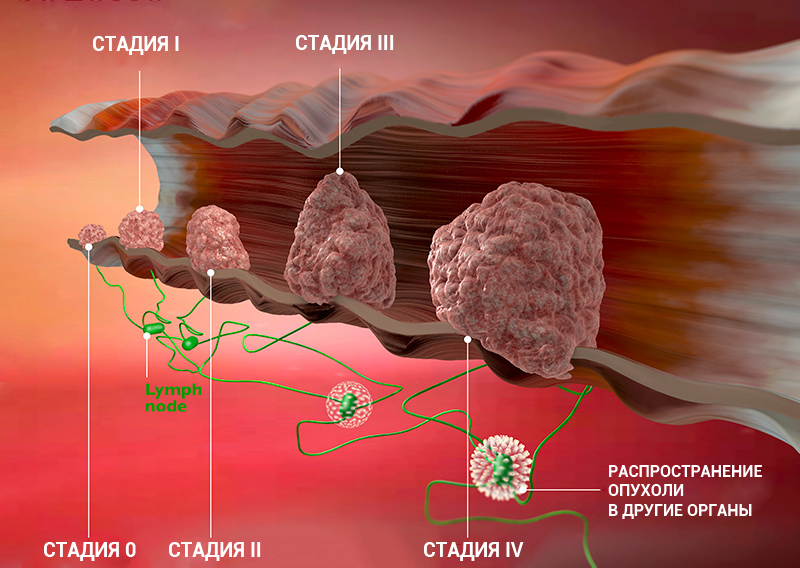
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Что такое пунктуация в медицине

Поиск
Цервикальная интраэпителиальная неоплазия: возможности диагностики и лечения
Цервикальные интраэпителиальные неоплазии являются предраковыми поражениями шейки матки. Ключевым фактором развития рака шейки матки является персистенция и интеграция вируса папилломы человека высокого онкогенного риска. В обзоре представлены современные методы диагностики цервикальных интраэпителиальных неоплазий, цитологическая и кольпоскопическая классификации, методы лечения.
Сervical intraepithelial neoplasia: possibilities of diagnosis and treatment
Рак шейки матки занимает второе место по частоте среди злокачественных новообразований органов репродуктивной системы у женщин и первое место среди онкогинекологических заболеваний у женщин в возрасте до 30 лет [1]. Раку шейки матки предшествуют цервикальные интраэпителиальные неоплазии (CIN). В оригинальной терминологии подобные поражения были подразделены на три стадии: CIN I, включающую недифференцированные клетки на протяжении одной трети расстояния от базальной мембраны до поверхности эпителия, соответствует легкой дисплазии, CIN II – на протяжении двух третей этого расстояния соответствует умеренной дисплазии и CIN III – на протяжении более чем двух третей толщи эпителиального пласта соответствует тяжелой дисплазии и Cainsitu. Объединение тяжелой дисплазии и Cainsitu в одну категорию было оправдано ввиду сложности их дифференцировки [2].
Диагноз интраэпителиальной неоплазии базируется на семи морфологических критериях: увеличение размеров ядра, изменение формы ядра, увеличение плотности ядерной окраски, ядерном полиморфизме, увеличение митозов, атипичных митозах, нарушении или отсутствии созревания [3].
Заподозрить CIN позволяет цитологическое исследование, обеспечивающее возможность ранней диагностики предраковых состояний рака шейки матки и позволяющее оценить в динамике эффективность проводимой терапии. Точность цитологического теста вариабельна и зависит от многих факторов, таких как методика приготовления мазков, техника приготовления мазков, квалификация лаборанта. Считается, что до 30% случаев рака шейки матки развивается у женщин, которые регулярно проходили цитологический скрининг, при этом забор материала или интерпретация результатов были ошибочными, т.е. давали ложноотрицательные результаты [4].
Цитологическое исследование в настоящее время один из экономически выгодных методов, однако, следует принимать во внимание, что чувствительность его составляет 58%, а специфичность 69% [5].
Очень важным является обнаружение в мазке как плоских, так и эндоцервикальных и метапластических клеток, это подтверждает, что была захвачена зона трансформации, являющаяся зоной максимального риска развития РШМ. В последние годы во многих странах используются цитологические классификации, включающие широкий спектр патологических изменений шейки. Наиболее распространенной из них является классификация, разработанная в городе Бетесда (США) в 1988 году – The Bethesda System (TBS) (табл. 1). В классификации Бетесда выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions low and highgrade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени — умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак. Для обозначения клеточных изменений, трактовка которых затруднена, введен термин ASCUS – atypical squamous cell so fun determined significance (клетки плоского эпителия с атипией неясного значения ASCUS у женщин репродуктивного возраста характеризуется определенными критериями. Наиболее принципиальным является размер ядра в сравнении со средним размером ядра плоской клетки или плоской метаплазированной клетки. Размеры ядра клетки ASCUS в 2,5-3 раза больше среднего размера плоской клетки или в 1,5 раза больше ядра зрелой метаплазированной клетки. Если в мазке найдены клетки типа ASCUS, риск обнаружить при гистологическом исследовании CIN II– III составляет 10-20%, инвазивного рака — 0,1% [6].
Терминологическая система Бетесда (2001)
Адекватность образца
— Удовлетворительный (наличие или отсутствие компонента эндоцервикса/зоны трансформации;
— Неудовлетворительный (указать причину).
Интерпретация/результат исследования
1. Негативный в отношении интраэпителиального поражения или злокачественности:
— Микроорганизмы: Trichomonasvaginalis; Candida; изменения флоры, соответствующие бактериальному вагинозу; бактерии, морфологически соответствующие Actinomycessp.; клеточные изменения, соответствующие герпесвирусной инфекции;
— Другие доброкачественные признаки: реактивные клеточные изменения, связанные с воспалением, радиацией, ВМС; железистые клетки; атрофия.
2. Атипии плоских клеток:
— Атипические клетки плоского эпителия неясного значения (ASC-US) или атипичные клетки плоского эпителия, не позволяющие исключить HSIL (ASC-H);
— Низкая степень плоскоклеточного интраэпителиального поражения (LSIL): ВПЧ-эффект, легкая дисплазия, CINI;
— Высокая степень плоскоклеточного интраэпителиального поражения (HSIL): умеренная дисплазия, тяжелая дисплазия, CINII, CINIII, Cainsitu;
3. Атипии железистых клеток:
— Атипичные железистые клетки (AGC): эндоцервикальные, эндометриальные или не определенные (NOS);
— Атипичные железистые клетки, похожие на неопластичные: эндоцервикальные, эндометриальные или не определенные (NOS);
— Эндоцервикальная аденокарцинома insitu(AIS);
Все большее применение в клинической практике находит жидкостная цитология — новая технология приготовления цервикальных образцов. Преимуществом данного метода является уменьшение количества артефактов, связанных с высушиванием образцов, возможность избежать загрязнения проб эритроцитами, воспалительным экссудатом, что обеспечивает высокое качество препаратов. Жидкостная цитология улучшает качество образцов и является более чувствительным методом при более или менее идентичной специфичности по сравнению с традиционным цитологическим исследованием [7, 8].
Кольпоскопия является одним из ведущих методов обследования больных с патологией шейки матки. В настоящее время для интерпретации кольпоскопических картин используется Международная классификация кольпоскопических терминов, одобренная на 14 Всемирном конгрессе Международной федерации по кольпоскопии и цервикальной патологии (IFCPC), состоявшемся в июле 2011 года в Рио-де-Жанейро. Одним из важнейших критериев информативности кольпоскопического исследования является возможность визуализации зоны стыка эпителия. В новой номенклатуре зона трансформации (ЗТ) делится на 3 типа: ЗТ I типа визуализируется полностью; ЗТ II типа визуализируется не полностью, имеет эндоцервикальный компонент; ЗТ III типа полностью не визуализируется. В новой классификации различают тонкий и плотный ацетобелый эпителий. Тонкий ацетобелый эпителий может быть признаком как плоскоклеточных интраэпителиальных поражений низкой степени, так и незрелой метаплазии, реактивных изменений эпителия. Плотный ацетобелый эпителий характерен для плоскоклеточных интраэпителиальных поражений высокой степени тяжести. Пунктуация и мозаичность представляют собой проявления атипической васкуляризации эпителия и могут проявлением различных состояний: воспаления, быстро растущего метапластического эпителия, CIN, рака шейки матки. Нежная мозаика и пунктуация очень тонкие, неинтенсивные, часто сопровождают процессы метаплазии. Грубая мозаика и пунктуация по виду напоминают булыжную мостовую и характеризуют интраэпителиальные неоплазии высокой степени тяжести. К неспецифическим признакам аномальной кольпоскопической картины относятся лейкоплакия, эрозия и характер окрашивания эпителия раствором Люголя. Атипия сосудов является основным признаком при подозрении на инвазию и проявляется в виде хаотически расположенных не анастомозирующих сосудов причудливой формы [9].
Кольпоскопическое исследование обладает невысокой прогностической ценностью – 64,6% при чувствительности 88,4%, специфичности 43,2%. Наиболее специфичными признаками являются ацетобелый эпителий (прогностическая ценность – 91,7%), йодпозитивная мозаика и пунктуация (77,8%), атипическая зона трансформации (77,4%) [10].
Биопсия шейки матки при кольпоскопии необходима во всех случаях, поскольку гистологическому исследованию экзоцервикса в диагностике предраковых процессов принадлежит решающее значение. Для получения достоверных результатов рекомендуется проводить прицельную биопсию под контролем кольпоскопа из пораженных участков шейки матки. Считается, что кольпоскопически ориентированная биопсия повышает точность диагностики ЦИН на 25 %. Некоторые авторы рекомендуют брать несколько образцов ткани шейки матки, особенно при наличии множественных кольпоскопически неоднородных очагов. Эндоцервикальный соскоб исследуется наряду с биопсией шейки матки при ряде патологических состояний, когда требуется дополнительная информация о состоянии цервикального канала (неудовлетворительная кольпоскопия, во всех случаях HSIL) [10].
Существует биопсия двух видов: точечная (прицельная, punch-biopsy) и эксцизионная (расширенная, excisionalbiopsy). При этом показано, что чувствительность прицельной биопсии ниже на 50% по сравнению с петлевой электроэксцизией. В то же время, прицельная биопсия вызывает меньше осложнений последующей беременности, чем петлевая электроэксцизия [11].
Подтверждение этиологической роли ВПЧ в развитии РШМ привело к тому, что диагностика папилломавирусной инфекции стала рассматриваться как важнейший элемент скрининга и профилактики этого заболевания [12].
В скрининговых программах можно использовать только стандартизованные тесты, удовлетворяющие определенным требованиям чувствительности, специфичности, воспроизводимости. ВПЧ-тест должен выявлять по меньшей мере 13 типов ВПЧ высокого онкогенного риска. Разработаны и внедряются ВПЧ-тесты на основе новых технологий: ПЦР в реальном времени – метод, позволяющий определять концентрацию вируса в цервикальном эпителии; технология амплификации нуклеиновых кислот – выявляет мРНК генов Е6 и Е7 ВПЧ.
Одним из первых отечественных ВПЧ-тестов является тест «Апмли-Сенс ВПЧ ВКР скрин-титр-FL», который был разработан специально для скрининга и основан на ПЦР с детекцией в режиме реального времени. Тест позволяет выявлять и определять концентрацию ДНК 12 типов ВПЧ [9].
На основании данных, полученных во многих крупных международных исследованиях, были сформулированы следующие рекомендации по применению теста на ВПЧ в скрининге рака шейки матки:
— в первичном скрининге у женщин старше 30 лет в сочетании с цитологическим исследованием или в качестве самостоятельного теста;
— при ведении пациенток с ASCUS;
— для мониторинга терапии цервикальных поражений высокой степени- CIN II, CIN III, Cainsitu, инвазивный рак [9].
Обзор исследований, проведенных с целью оценки диагностических характеристик цитологического исследования и тестирования на ВПЧ, показал, что:
— чувствительность ВПЧ-тестирования (88-100%) значительно превышает чувствительность цитологического метода (68-86%);
— специфичность ВПЧ-тестирования (68-97% немного уступает специфичности цитологического исследования (78-99%);
— чувствительность и прогностическая значимость отрицательного теста на ВПЧ в сочетании с отрицательным результатом цитологического теста приближаются к 100% [9].
Попытки усовершенствовать раннюю диагностику рака шейки матки в настоящее время сосредоточены на поиске генов зараженной вирусом клетки – хозяина, экспрессия которых в дисплазиях и карциномах необратимо меняется под действием онкобелков вируса.
Одним из таких генов является ген INK4a (синонимы СDKN2А, МТS1, INK4a/ARF). Он кодирует белок р16ink4α, являющийся ингибитором циклин-зависимых киназ Сdk 4\6. На клеточных структурах было установлено следующее. Онкобелок Е7 вируса папилломы высокого онкогенного риска связывается с Rb. При этом распадается комплекс Rb с транскрипционными факторами Е2F. Освобождение Е2F – сигнал к переходу клетки из стадии G1 в стадию репликации ДНК. Существует негативная обратная связь между наличием и функциональной полноценностью Rb и транскрипционной активностью гена, кодирующего р16INK4а: активный Rb подавляет транскрипцию INK4a. Нарушение функции Rb и гиперэкспрессия р16INK4а коррелируют на уровне белка, наличие полноценного Rb приводит к исчезновению р16INK4а, а отсутствие Rb вызывает гиперпродукцию р16INK4а. Эти результаты получили подтверждение и на первичных дисплазиях и на карциномах шейки матки. Содержание Е7 в CINIII и инвазивных РШМ увеличено, а содержание Rb резко снижено; в подавляющем большинстве клеток РШМ Rb отсутствует [14].
Установлено, что окрашивание р16INK4а-специфическими антителами в дополнение к традиционному гистологическому анализу значительно превышает вероятность совпадения мнений гистологов при решении вопроса о стадии дисплазии. Использование р16INK4а как иммуногистохимического маркера может способствовать уменьшению ложноотрицательной и ложноположительной интерпритации биопсии, и таким образом, значительно повысить эффективность гистологического метода исследования в отношении раннего выявления РШМ [14].
Важный метод профилактики рака шейки матки — проведение тотального цитологического скрининга женского населения. Основываясь на опыте различных стран по организации скрининга рака шейки матки, предлагаются следующие рекомендации для проведения профилактических программ в России: возраст начала скрининга — 25 лет; возраст, в котором нецелесообразно продолжать скрининг — 65 лет; интервалы проведения скрининга – каждые 3 года у женщин моложе 50 лет и каждые 5 лет у женщин в возрасте 50-65 лет [9].
Тактика лечения CIN зависит от результатов клинических, кольпоскопических, морфологических методов исследования. Если при CIN I существует возможность как диспансерного наблюдения, так и деструктивного лечения, то при CIN II, CIN III проводится хирургическое лечение ввиду высокого риска прогрессирования заболевания.
Из хирургических методов лечения бесспорное преимущество имеют методы эксцизии, поскольку позволяют удалить ткань шейки матки на контролируемую глубину, а главное позволяют провести гистологическое исследование всего удаленного образца, т.е. выполнить расширенную биопсию и исключить инвазивный рак. У молодых нерожавших женщин объем удаляемой ткани должен быть минимальным. Деструктивные процедуры (лазерная вапоризация, криоабляция) могут быть проведены у женщин, планирующих беременность, у которых поражение имеет небольшие размеры, расположено на эктоцервиксе и полностью визуализируется при кольпоскопии [15].
В последние годы для лечения патологии шейки матки используется метод фотодинамической терапии, который обладает рядом преимуществ: селективная деструкция патологических участков, которая достигается как за счет преимущественного накопления фотосенсибилизатора в опухолевых и патологических тканях, так и за счет направленности светового воздействия; минимальное повреждение здоровой ткани; отсутствие резистентности и токсичности к повторным циклам; возможность многокурсового лечения и отличное заживление тканей с хорошими косметическими результатами. О.И. Трушина и соавт. (2008) проанализировали результаты фотодинамической терапии: противовирусный эффект был получен в 90,4% случаев [16].
Применение иммуномодулирующих препаратов в сочетание с деструкцией приводит к значительному улучшению состояния системы интерферона в крови. Лечение противовирусными и иммуномодулирующими препаратами может проводиться вторым этапом после деструкции, так как переход от инфицирования к дисплазии происходит при нарушенном иммунитете, что приводит к длительной персистенции инфекции и является ключевым фактором для возникновения последующего рецидива заболевания [15].
Л.И. Мальцева, А.В. Ахметзянова, Л.Н. Фаррахова, Н.А. Нигматуллина
Казанская государственная медицинская академия
Мальцева Лариса Ивановна
доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии № 1
1. Чиссов В.И., Старинский В.В., Петрова Г.В.Злокачественные новообразования в России, заболеваемость и смертность. — М., 2010.
2. Richart R.M. Cervical Intraepithelial neoplasia // Pathol. Ann. — 1973. — Vol. 8. — P. 301-328.
3. Reagan J.W., Seidermand I.L., Saracusa Y. The cellular morphology of carcinoma In situ and dysplasia or typical hyperplasia of the uterine cervix // Cancer. — 1983. — Vol. 6. — P. 224-235.
4. Nuovo J., Melnikow J., Howell L.P. New tests for cervical cancer screening / J. Nuovo // Am. Fam. Physician. — 2001. — Vol. 64, № 5. — P.780-786.
5. World Health Organization (WHO). Comprehensive Cervical Cancer Control. A guide to essential practice. — Geneva: WHO, 2006. — http:// www.who.int/ reproductive-health/publications/cervical_cancer_gep/text.pdf.
6. Solomon D., Davey D., Kurman R. et al. The 2001BethesdaSystem. Terminaligy for reporting results of cervical cytology // JAMA. — 2002. — Vol. 16. — P. 2114-2118.
7. Arbyn M., Bergeron C., Klinkhamer P. et al. Liquid compared with conventional cervical cytology: a systematic review and meta-analysis // Obstet. Gynecol. — 2008. — Vol. 111, № 1. — P. 167-177.
8. Ronco G., Segnan N., Giorgi-Rossi P. et al. Human papillomavirus testing and liquid-based cytology: results at recruitment from the new technologies for cervical cancer randomized controlled trial // J. Natl. Cancer. Inst. — 2006. — Vol. 98, № 11. — P. 765-774.
9. Профилактика рака шейки матки: Руководство для врачей. — М.: МЕДпресс-информ, 2012. — 192 с.
10. Роговская С.И. Практическая кольпоскопия. — М.: ГЭОТАР-Медиа, 2010. — 240 с.
11. Фролова И.И., Бабиченко И.И. Клинико-морфологические исследования дискератозов и предрака шейки матки // Вопросы гинекологии, акушерства и перинатологии. — 2003. — Т. 2, № 3. — С. 19-24.
12. Киселев В.И. Вирусы папилломы человека в развитии рака шейки матки. — М., 2004. — 179 с.
13. Narisawa-Saito M., Kiyono T. Basic mechanisms of high-risk human papillomavirus-induced carcinogenesis: roles of E6 and E7 proteins // Cancer Sci. — 2007. — Vol. 98, № 10. — P. 1505-1511.
14. Omori M., Hashi A., Nakazawa K. et al. Estimation of prognoses for cervical intraepithelial neoplasia 2 by p16INK4a immunoexpression and high-risk HPV in situ hybridization signal types // Am. J. Clin. Pathol. — 2007. — Vol. 128, № 2. — P.208-217.
15. Роговская С.И. Папилломавирусная инфекция у женщин и патология шейки матки. В помощь практикующему врачу. — М.: ГЭОТАР-Медиа, 2010. — 192 с.
16. Аполихина И.Н. и др. Фотодинамическая терапия у женщин с папилломавирусной инфекцией // Рос. вестн. акушер-гинеколога. — 2007. — № 1. — С. 28-34.