что такое процесс в химии
Химический процесс
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число,изотопный состав химических элементов.
Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Самопроизвольное превращение веществ осуществляется при условии, что они обладают энергией, достаточной для преодоления потенциального барьера, разделяющего исходное и конечное состояния системы (Энергия активации).
Содержание
Классификация
Существует большое количество признаков, по которым можно классифицировать химические реакции.
По фазовому составу реагирующей системы
По изменению степеней окисления реагентов
В данном случае различают
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
По тепловому эффекту реакции
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продутов меньше суммы энтальпий реагентов (ΔrH 0) — поглощение.
По типу превращений реагирующих частиц
Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах участвующие вещества сохраняют неизменными свои свойства, но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
С помощью химических реакций можно получать практически важные вещества, которые в природе находятся в ограниченных количествах, например азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
Что такое процесс в химии
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

Интересное по рубрике
Найдите необходимую статью по тегам
Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством

Рекомендуем прочитать
Реальный опыт семейного обучения
Звонок по России бесплатный
Посмотреть на карте
Если вы не нашли ответ на свой вопрос на нашем сайте, включая раздел «Вопросы и ответы», закажите обратный звонок. Мы скоро свяжемся с вами.
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическая реакция
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация — электронная изомеризация — диссоциация, в котором активными частицами являются радикалы, ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.
Содержание
Классификация
Существует большое количество признаков, по которым можно классифицировать химические реакции.
По фазовому составу реагирующей системы
По изменению степеней окисления реагентов
В данном случае различают
Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
По тепловому эффекту реакции
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH 0) — поглощение.
По типу превращений реагирующих частиц
Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
С помощью химических реакций можно получать практически важные вещества, которые в природе находятся в ограниченных количествах, например азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
Химические процессы



Возникновение структурной химии означало, что появилась возможность для целенаправленного качественного преобразования веществ, создания схемы синтеза любых химических соединений, в том числе и ранее неизвестных.
Характер любого химического соединения зависит не только от качественного и количественного состава, но и от взаимного влияния атомов и строения молекулы.
Структура вещества и его свойства
Вещества, имеющие одинаковый состав, но разное строение, называют изомерами,а само явление — изомерией.Например, формулу С4Н8O имеет 21 вещество.
Для описания свойств веществ нужно знать не только состав, но и структуру соединения. Особую важность это имеет для органической химии. Электроны одного химического элемента, взаимодействуя с ядром и электронами другого химического элемента, оказываются строго локализованными (размещенными) в пространстве. Так как электрон – это электромагнитная волна с определенной областью распространения, то эта область имеет направление. То есть химическая связь образуется в определенном направлении в пространстве и задает пространственную ориентацию атомов.
Структура молекулы – пространственная и энергетическая упорядоченность системы, состоящей из атомных ядер и электронов.
С пространственной структурой молекулы связано важное явление в органической химии, называемое изомерией.
Изомеры – вещества, имеющие одинаковый состав, но разную структуру молекулы.
Структурная химия стала более высоким уровнем по отношению к учению о составе вещества. При этом химия из науки преимущественно аналитической превратилась в науку синтетическую. Главным достижением этого этапа развития химии стало установление связи между структурой молекул и реакционной способностью веществ.
В твердом состоянии углерод может быть кристаллическим и аморфным и каждое его состояние имеет свое название.
Современная структурная химия достигла больших результатов. Синтез новых органических веществ позволяет получить полезные и ценные материалы, отсутствующие в природе. Так, ежегодно в мире синтезируют тысячи килограммов аскорбиновой кислоты (витамина С), множество новых лекарств, среди которых — безвредные антибиотики, лекарства против гипертонии, язвенной болезни и др.
Самым последним достижением структурной химии является открытие совершенно нового класса металлорганических соединений, которые за свою двухслойную структуру получили название «сэндвичевых» соединений. Молекула этого вещества представляет собой две пластины из соединений водорода и углерода, между которыми находится атом какого-либо металла.
Исследования в области современной структурной химии идут по двум перспективным направлениям:
1) синтез кристаллов с максимальным приближением к идеальной решетке для получения материалов с высокими техническими показателями: максимальной прочностью, термической стойкостью, долговечностью в эксплуатации и др.;
2) создание кристаллов с заранее запрограммированными дефектами кристаллической решетки для производства материалов с заданными электрическими, магнитными и другими свойствами.
3. Общая характеристика растворов
Физические свойства воды совершенно аномальны. Самое удивительное из них — это способность ее при нормальных условиях быть жидкостью. Молекулы похожих на нее химических соединений (H2S или H2Se) намного тяжелее воды, но при этих условиях газообразны.
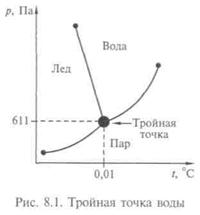
Тройная точка воды, т.е. равновесие воды, льда и пара, наблюдается при температуре 0,01 °С и давлении 611 Па (рис. 8.1). Переохлажденная вода, т. е. остающаяся в жидком состоянии ниже 0°С, ведет себя странно: с одной стороны, плотность ее уменьшается при понижении температуры, с другой — приближается к плотности льда
В отличие от большинства других жидкостей при повышении температуры ее удельный объем уменьшается, а плотность увеличивается, достигая минимума (соответственно максимума) при 4 °С. В обычных жидкостях плотность всегда уменьшается с уменьшением температуры.
При замерзании объем воды увеличивается до 10 %. Плотность воды больше плотности льда. При плавлении кристаллов, когда регулярность упаковки ионов нарушается, плотность уменьшается на 2—4 %. Это свойство воды предохраняет водоемы от сплошного промерзания, спасая в них жизнь. Лед — плохой проводник теплоты.
Очень высока теплоемкость воды — при плавлении льда она увеличивается более чем вдвое. Поэтому моря и океаны являются гигантскими термостатами, сглаживая все колебания температуры воздуха. Кстати, эти же функции может выполнять и водяной пар в атмосфере. Отсутствие водяного пара в пустынях приводит к резким колебаниям ночной и дневной температур.
Вода – универсальный растворитель. Правило растворения – подобное растворяется в подобном.
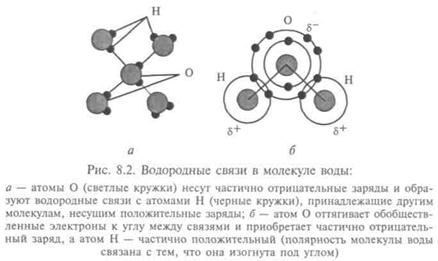
Главное отличие воды — в водородных связях (рис. 8.2),
Комплекс молекул водысуществует в газообразном состоянии, в жидкой воде и во льду. Но, как установил Л. Полинг, лед не является кристаллом с полной упорядоченностью даже при О К. Структура льда достаточно рыхлая: каждая полость окружена шестью молекулами Н20, а каждая молекула — шестью полостями. Размер этих полостей таков, что в них может разместиться одна молекула, не нарушая каркаса водородных связей.
Вещество является кислотой, если оно диссоциирует в воде с образованием ионов водорода, и основанием, если способно в растворе присоединять ионы водорода или образовывать гидроксид ионы ОН. Кислотность или щелочность раствора характеризуется показателем рН, шкала которого охватывает значения от 0 до 14. Эта шкала логарифмическая, т.е. на ней отложены логарифмы концентрации водородных ионов. Кислотность раствора с рН 5 в 10 раз больше, чем с рН 6, и в 100 раз больше, чем с рН 7. Раствор с рН 6 содержит одну миллионную моля ионов водорода на 1 л, нейтральной среде соответствует рН 7, ниже идут более кислые среды, а выше — щелочные.
Химический процесс (от лат. processus— продвижение) представляет собой последовательную смену состояний вещества, представляющий собой непрерывное, единое движение. Процесс превращения одних веществ в другие вещества называется химической реакцией. Вант-Гофф, используя термодинамический подход, классифицировал химические реакции, а также сформулировал основные положения химической кинетики.
В каждой клетке идёт около 10 000 химических реакций.
Химические процессы подразделяются на:
гомо-и гетерогенные(в зависимости от агрегатного состояния реагирующих систем),
экзо-и эндотермические(в зависимости от количества выделяющейся и поглощаемой теплоты),
окислительно-восстановительные(в зависимости от изменения степени окисления вещества, связанной с переходом электронов от одних атомов (восстановитель) к другим атомам (окислитель).
Изучением скорости и особенностей протекания химических реакций занимается химическая кинетика.
На скорость химической реакции также влияют следующие условия и параметры:
1) природареагирующих веществ (например, щелочные металлы растворяются в воде с образованием щелочей и выделением водорода и реакция протекает при обычных условиях моментально, а цинк, железо и другие реагируют медленно и с образованием оксидов, а благородные металлы не реагируют вообще);
2) температура. При повышении температуры на каждые 10 °С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа). Со многими веществами кислород начинает реагировать с заметной скоростью уже при обыкновенной температуре (медленное окисление). При повышении температуры начинается бурная реакция (горение);
3) концентрация.Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ. Горение веществ в чистом кислороде происходит интенсивнее, чем в воздухе, где концентрация кислорода почти в 5 раз меньше. Здесь справедлив закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ;
4)площадь поверхности реагирования.Для веществ в твердом состоянии скорость прямо пропорциональна поверхности реагирующих веществ. Железо и сера в твердом состоянии реагируют достаточно быстро лишь при предварительном измельчении и перемешивании: горение хвороста и полена;
5)катализатор.Скорость реакции зависит от катализаторов, веществ которые ускоряют химические реакции, но сами при этом не расходуются. В.Оствальд, исследуя условия химического равновесия, пришел к открытию явления катализа. Разложение бертолетовой соли и пероксида водорода ускоряется в присутствии оксида марганца (IV) и др.
Катализаторы бывают положительными, ускоряющими реакцию, и отрицательными (ингибиторы) — замедляющими ее. Каталитическое селективное ускорение химической реакции называется катализом и является приемом современной химической технологии (производство полимерных материалов, синтетического топлива и др.). Считается, что удельный вес каталитических процессов в химической промышленности достигает 80%.
.jpg)
.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)