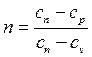Что такое политропный процесс
Политропный процесс
Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В соответствии с сущностью понятия теплоёмкости 


Показатель политропы
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде:
где р — давление, V — объем газа, n — «показатель политропы».




В зависимости от вида процесса, можно определить значение n:
Полезное
Смотреть что такое «Политропный процесс» в других словарях:
ПОЛИТРОПНЫЙ ПРОЦЕСС — (политропический процесс) обратимый термодинамич. процесс при пост. теплоёмкости системы. Линия, изображающая П. п. на термодинамич. диаграмме, наз. политропой. При П. п. кол во подводимого тепла пропорционально вызываемому тем самым повышению… … Физическая энциклопедия
ПОЛИТРОПНЫЙ ПРОЦЕСС — (политропический процесс) термодинамический процесс, характеризующийся постоянной теплоемкостью; для идеального газа описывается уравнением pVn=const, где n постоянная, называемая показателем политропы … Большой Энциклопедический словарь
политропный процесс — Термодинамический процесс, удовлетворяющий соотношению pvn = const, где п — показатель политропы есть величина постоянная. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической… … Справочник технического переводчика
политропный процесс — (политропический процесс), термодинамический процесс, характеризующийся постоянной теплоёмкостью; для идеального газа описывается уравнением pVn = const, где n постоянная, называется показателем политропы. * * * ПОЛИТРОПНЫЙ ПРОЦЕСС ПОЛИТРОПНЫЙ… … Энциклопедический словарь
политропный процесс — politropinis vyksmas statusas T sritis Standartizacija ir metrologija apibrėžtis Termodinaminės sistemos grįžtamasis būsenos pakitimas, kurio metu nesikeičia sistemos savitoji šiluminė talpa. atitikmenys: angl. polytropic process vok. polytrope… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
политропный процесс — politropinis procesas statusas T sritis chemija apibrėžtis Termodinaminės sistemos grįžtamasis būsenos kitimas, kurio metu nesikeičia sistemos savitoji šiluminė talpa. atitikmenys: angl. polytropic process rus. политропический процесс;… … Chemijos terminų aiškinamasis žodynas
политропный процесс — Процесс в идеальном газе, характеризующийся постоянной теплоемкостью … Политехнический терминологический толковый словарь
ПОЛИТРОПНЫЙ ПРОЦЕСС — (политропический процесс), термодинамич. процесс, характеризующийся пост, теплоёмкостью; для идеального газа описывается ур нием pVn = const, где п постоянная, наз. показателем политропы … Естествознание. Энциклопедический словарь
Процесс — (Process) Определение процесса, виды и типы процессов Информация об определении процесса, виды и типы процессов Содержание Содержание Определение Исторический Бизнес процесс Тепловой процесс Адиабатический процесс Изохорный процесс Изобарный… … Энциклопедия инвестора
Политропический процесс
Вы будете перенаправлены на Автор24
Что такое политропический процесс
Уравнение политропы для идеального газа
Получим уравнение политропы для идеального газа, следуя тому, что теплоемкость должна быть постоянна.
Из соотношения Майера:
\[C_p-C_V=\nu R\ \left(5\right).\]
Подставим (5) в (4), получим:
Очевидно, что если теплоемкость процесса постоянная, то
Уравнение интегрируем, потенцируем, получаем:
Запишем первое начало термодинамики:
\[CdT=\frac<2>\nu RdT+pdV\ \left(1.1\right).\]
Запишем уравнение процесса:
Подставим в (1.2) результаты преобразований (1.4) и (1.5), получим:
Готовые работы на аналогичную тему
Задание: Можно ли вычислить работу газа по формуле:
для адиабатного, изотермического и изобарного процессов?
Сравним с уравнением работы для адиабатного процесса, которое было рассмотрено в разделе, посвященном этому процессу, имеем:
Если учесть, что из уравнения Менделеева-Клайперона:
то получаем, что выражения (2.3) и (2.4) эквивалентны.
\[pV^0=const\ \to p=const\ \left(2.8\right).\]
Выражение (2.9) соответствует формуле вычисления работы для изобарного процесса.
Ответ: Данная формула подходит для вычисления работы в процессах: адиабатном и изобарном, не подходит для вычисления работы в изотермическом процессе.
Уравнение политропы имеет вид:
Подставим (3.3) вместо p (3.2), получим:
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
Политропный процесс



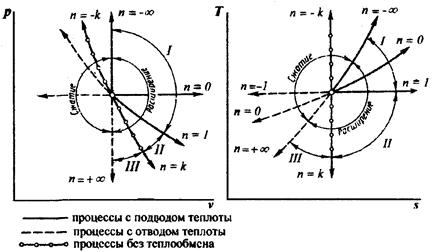
Политропный процесс характеризуется тем, что он протекает в идеальном газе при постоянном значении теплоемкости, которая может иметь любое числовое значение от – ∞ до + ∞.
Для политропного процесса доля количества теплоты, расходуемой на изменение внутренней энергии, остается неизменной:
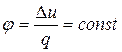
Выведем уравнение политропы. Пусть сn – теплоемкость политропного процесса. В соответствии с уравнениями (dL = pdV, dq = du + dL, dqv = du = сvdT) получим:
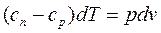
Используя уравнение (dh = du + pdv + vdp = dq + vdp), после ряда преобразований будем иметь:
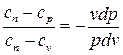
Так как из определения политропного процесса следует, что теплоемкость – величина постоянная, то обозначив
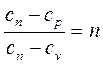
после интегрирования получим:
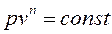
Это уравнение называется уравнением политропного процесса, а n – показателем политропы.
Для политропы справедлива следующая связь между основными параметрами состояния:
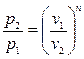
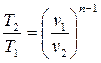
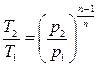
Работу политропного процесса можно определить по формулам:
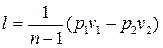
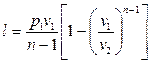
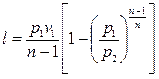
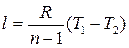
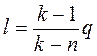
Для определения работы М кг газа нужно в приведенных формулах заменить удельный объем v полным объемом газа V.
Теплоемкость политропного процесса можно найти из уравнения:
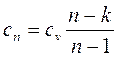
Количество теплоты, сообщаемой газу или отнимаемой от него:
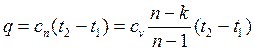
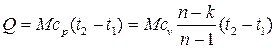
Изменение внутренней энергии газа в политропном процессе находим по общей для всех процессов формуле:
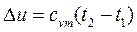
Показатель политропного процесса определяется из уравнения:
Изменение энтропии:
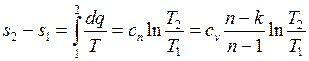
Политропный процесс включает в себя всю совокупность основных термодинамических процессов и поэтому имеет и обобщающее значение. На самом деле из уравнений 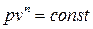
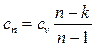
при n = ± ∞ сn = сv и v = const (изохорный процесс);
при n = 0 сn = сp и р = const (изобарный процесс);
при n = 1 сn = ∞ и рv = const (изотермный процесс);
при n = k сn = 0 и pv k = const (адиабатный процесс).
На рисунке 4.5 в pv – и Ts – координатах приведены совмещенные графические зависимости различных термодинамических процессов.
Все процессы можно разделить на три группы (рисунок 4.5).
Группа I (– ∞
Теплоемкость отрицательна. Это хорошо видно из формулы 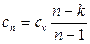
Рис. 4.5 – Политропные процессы в pv и Тs – координатах
Группа III (+ ∞ > n > k). Графики этих процессов располагаются между адиабатой и изохорой. При расширении газа процесс осуществляется с уменьшением внутренней энергии, с совершением работы и отводом тепла в холодильник. С увеличением показателя n увеличивается доля теплоты, отводимой в холодильник, и уменьшается доля теплоты, идущей на совершение работы. Теплоемкость положительна. Доля теплоты, расходуемой на совершение работы, уменьшается с ∞ до 0, а доля внутренней энергии, расходуемой на совершение работы, с –1до 0.
ПОЛИТРОПНЫЙ ПРОЦЕСС
Частные 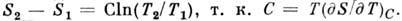
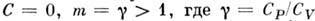
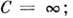
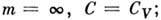
Для неидеальных газов показатель т можно приближённо считать постоянным лишь в нек-ром интервале термодинамич. параметров, поэтому П. п. в техн. термодинамике лишь приближённо представляет реальные термодинамич. процессы.
Лит.: Жуковский В. С., Термодинамика, М., 1983; Новиков И. И., Термодинамика, М., 1984.
Полезное
Смотреть что такое «ПОЛИТРОПНЫЙ ПРОЦЕСС» в других словарях:
ПОЛИТРОПНЫЙ ПРОЦЕСС — (политропический процесс) термодинамический процесс, характеризующийся постоянной теплоемкостью; для идеального газа описывается уравнением pVn=const, где n постоянная, называемая показателем политропы … Большой Энциклопедический словарь
политропный процесс — Термодинамический процесс, удовлетворяющий соотношению pvn = const, где п — показатель политропы есть величина постоянная. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической… … Справочник технического переводчика
политропный процесс — (политропический процесс), термодинамический процесс, характеризующийся постоянной теплоёмкостью; для идеального газа описывается уравнением pVn = const, где n постоянная, называется показателем политропы. * * * ПОЛИТРОПНЫЙ ПРОЦЕСС ПОЛИТРОПНЫЙ… … Энциклопедический словарь
политропный процесс — politropinis vyksmas statusas T sritis Standartizacija ir metrologija apibrėžtis Termodinaminės sistemos grįžtamasis būsenos pakitimas, kurio metu nesikeičia sistemos savitoji šiluminė talpa. atitikmenys: angl. polytropic process vok. polytrope… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
политропный процесс — politropinis procesas statusas T sritis chemija apibrėžtis Termodinaminės sistemos grįžtamasis būsenos kitimas, kurio metu nesikeičia sistemos savitoji šiluminė talpa. atitikmenys: angl. polytropic process rus. политропический процесс;… … Chemijos terminų aiškinamasis žodynas
политропный процесс — Процесс в идеальном газе, характеризующийся постоянной теплоемкостью … Политехнический терминологический толковый словарь
ПОЛИТРОПНЫЙ ПРОЦЕСС — (политропический процесс), термодинамич. процесс, характеризующийся пост, теплоёмкостью; для идеального газа описывается ур нием pVn = const, где п постоянная, наз. показателем политропы … Естествознание. Энциклопедический словарь
Процесс — (Process) Определение процесса, виды и типы процессов Информация об определении процесса, виды и типы процессов Содержание Содержание Определение Исторический Бизнес процесс Тепловой процесс Адиабатический процесс Изохорный процесс Изобарный… … Энциклопедия инвестора
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.