Что такое первый закон термодинамики в физике
Первый закон термодинамики.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
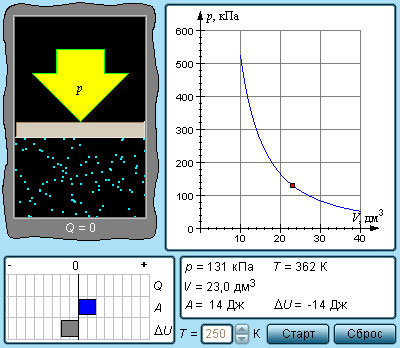
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики 
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
Первый закон термодинамики. Как рассказать просто о сложном?
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях.
1. Определение первого закона термодинамики
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях. Собственно, именно с анализа принципов первых тепловых машин, паровых двигателей и их эффективности и зародилась термодинамика. Можно сказать, что этот раздел физики начинается с небольшой, но очень важно работы молодого французского физика Николя Сади Карно.
Самым важным законом, лежащим в основе термодинамики является первый закон или первое начало термодинамики. Чтобы понять суть этого закона, для начала, вспомним что называется внутренней энергией. ВНУТРЕННЯЯ ЭНЕРГИЯ тела — это энергия движения и взаимодействия частиц, из которых оно состоит. Нам хорошо известно, что внутреннюю энергию тела можно изменить, изменив температуру тела. А изменять температуру тела можно двумя способами:
Нам, также известно, что работа, совершаемая газом, обозначается Аг, а количество переданной или полученной внутренней энергии при теплообмене называется количеством теплоты и обозначается Q. Внутреннюю энергию газа или любого тела принято обозначать буквой U, а её изменение, как и изменение любой физической величины, обозначается с дополнительным знаком Δ, то есть ΔU.
Сформулируем ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ для газа. Но, прежде всего, отметим, что когда газ получает некоторое количество теплоты от какого-либо тела, то его внутренняя энергия увеличивается, а когда газ совершает некоторую работу, то его внутренняя энергия уменьшается. Именно поэтому первый закон термодинамики имеет вид:
Так как работа газа и работа внешних сил над газом равны по модулю и противоположны по знаку, то первый закон термодинамики можно записать в виде:
Понять суть этого закона довольно просто, ведь изменить внутреннюю энергию газа можно двумя способами: либо заставить его совершить работу или совершить над ним работу, либо передать ему некоторое количество теплоты или отвести от него некоторое количество теплоты.
2. Первый закон термодинамики в процессах
Применительно к изопроцессам первый закон термодинамики может быть записан несколько иначе, учитывая особенности этих процессов. Рассмотрим три основных изопроцесса и покажем, как будет выглядеть формула первого закона термодинамики в каждом из них.
3. Применение
Первое начало термодинамики (первый закон) имеет огромное значение в этой науке. Вообще понятие внутренней энергии вывело теоретическую физику 19 века на принципиально новый уровень. Появились такие понятия как термодинамическая система, термодинамическое равновесие, энтропия, энтальпия. Кроме того, появилась возможность количественного определения внутренней энергии и её изменения, что в итоге привело учёных к пониманию самой природы теплоты, как формы энергии.
Ну, а если говорить о применении первого закона термодинамики в каких-либо задачах, то для этого необходимо знать два важных факта. Во-первых, внутренняя энергия идеального одноатомного газа равна: 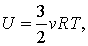
Первый закон термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В этом случае справедливой будет формула внутренней энергии газа:
Первый закон термодинамики для изобарного процесса дает:
Первый закон термодинамики для изотермического процесса выражается соотношением
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
Адиабатический процесс относится к изопроцессам.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Что такое первый закон термодинамики в физике
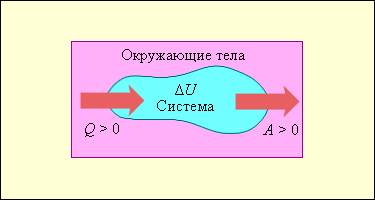
На рис. 3.9.1 условно изображены энергетические потоки между выделенной термодинамической системой и окружающими телами. Величина Q > 0, если тепловой поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, т. е. изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением Δ U внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Применим первый закон термодинамики к изопроцессам в газах.
В изохорном процессе ( V = const) газ работы не совершает, A = 0. Следовательно,
|
Здесь U ( T 1) и U ( T 2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом ( Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам ( Q изобарном процессе ( p = const) работа, совершаемая газом, выражается соотношением
Первый закон термодинамики для изобарного процесса дает:
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q A T 2 T 1; внутренняя энергия убывает, Δ U изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением
В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид
т. е. газ совершает работу за счет убыли его внутренней энергии.
Работа газа в адиабатическом процессе просто выражается через температуры T 1 и T 2 начального и конечного состояний:
Адиабатический процесс (так же, как и другие изопроцессы) является процессом квазистатическим. Все промежуточные состояния газа в этом процессе близки к состояниям термодинамического равновесия (см. §3.3). Любая точка на адиабате описывает равновесное состояние.
Основные сведения о первом законе термодинамики: объяснение понятия
Что такое термодинамика
Слово термодинамика с греческого переводится как «тепло» и «сила».
Термодинамика — это раздел физики, изучающий наиболее общие свойства макроскопических систем, в которых не учитывается молекулярное строение тел, а также способы передачи и превращения энергии в таких системах.
В термодинамике изучают состояния и процессы, для описания которых необходимо ввести понятие температуры.
Термодинамика — это феноменологическая наука, опирающаяся на обобщение полученных экспериментальных данных и опытных фактов.
Процессы, происходящие в термодинамической системе, описываются макроскопическими параметрами, которые вводятся для описания систем, состоящих из большого числа частиц, и не применимы к отдельным молекулам и атомам, в отличие от величин, вводимых в механике или электродинамике. Пример макроскопических величин — это температура, давление, объем, концентрация компонентов системы, которые могут изменяться в ходе процесса.
Не только физика, но химия живет по правилам термодинамики.
Химическая термодинамика — это область химии, изучающая энергию химических процессов, возможности и условия самопроизвольного протекания химических реакций, а также условия достижения химического равновесия.
Как в физике, так и в химии в основе термодинамики лежат три закона или «три начала термодинамики».
Определение и уравнение первого закона термодинамики
Внутренняя энергия тела равна сумме кинетических энергий беспорядочного движения всех молекул относительно центра масс тела и потенциальных энергий взаимодействия всех молекул друг с другом.
Внутренняя энергия идеального газа представляет собой сумму кинетических энергий беспорядочного движения его молекул. Так как молекулы идеального газа не взаимодействуют друг с другом, то их потенциальная энергия обращается в ноль.
Для идеального одноатомного газа внутренняя энергия равна:
Количеством теплоты называют количественную меру измерения внутренней энергии при теплообмене без совершения работы. Обозначение теплоты — Q.
Удельная теплоемкость — это количество теплоты, которую получает или отдает 1 кг вещества при изменении его температуры на 1 К:
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Термодинамическая система — это физическое тело (или их совокупность), способное обмениваться с другими телами энергией и (или) веществом.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следствие из этого закона — это то, что работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Р. Майером в 1842 г. и подтверждено экспериментально английским учёным Дж. Джоулем в 1843 г.
Первый закон термодинамики (Определение №1)
Изменение внутренней энергии ∆ U неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Если работу будет совершать не система, а внешние силы, то первое начало термодинамики примет следующий вид:
Первый закон термодинамики (Определение №2)
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Также формула первого закона термодинамики иногда записывается в другом виде:
Первый закон термодинамики
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет собой, по сути, обобщение опытных фактов. Если руководствоваться им, то можно сказать, что энергия не возникает и не исчезает бесследно, а передается от одной системе к другой, меняя свои формы.
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Как действует первый закон термодинамики в процессах
Первый закон термодинамики применим к различным изопроцессам.
Изопроцессы — это термодинамические процессы, во время протекания которых количество вещества и один из параметров состояния (давление, объем, температура или энтропия) остается неизменным.
В зависимости от того, какой параметр остается неизменным, различают разные процессы:
Изотермический процесс
Изотермический процесс – это процесс, происходящий с газом неизменной массы при постоянной температуре (T = const).
Следовательно, ΔT = 0.
Изотермический процесс описывается законом Бойля-Мариотта.
В случае изотермического процесса изменение внутренней энергии идеального газа равно:
Откуда выражение для первого закона термодинамики принимает следующий вид:
Смысл данной формулы в том, что все переданное газу тепло расходуется на совершение им работы против внешних сил.
Количество теплоты, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.
Изохорный процесс
Изохорный процесс описывается законом Шарля, открытие которое состоялось в 1787 г.
В данном процессе выражение для работы газа имеет следующий вид:
Значение данной формулы в том, что в ходе изохорного процесса газ не совершает работы.
Таким образом, первое начало термодинамики будет выглядеть как:
Все переданное газу тепло расходуется на увеличение его внутренней энергии.
Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло, поглощенное газом (Q>0), и его внутренняя энергия увеличиваются. При охлаждении тепло отдается внешним телам (Q Определение 7
Изобарный процесс описывается законом Гей-Люссака, который был открыт в 1802 году.
В данном случае работа, совершаемая газом, выражается соотношением:
Откуда следует, что первый закон термодинамики для изобарного процесса выглядит так:
Адиабатный процесс
В термодинамике, кроме изопроцессов (изобарного, изохорного и изотермического) рассматриваются процессы, протекающие в отсутствии теплообмена с окружающими телами.
Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими.
В адиабатическом процессе Q = 0, поэтому первый закон термодинамики принимает вид:
В этом случае изменение внутренней энергии газа происходит за счет совершения работы газа над внешними телами.
При расширении газ совершает положительную работу, поэтому его внутренняя энергия газа понижается. Это приводит к понижению температуры газа, из-за чего давление газа при адиабатическом расширении убывает быстрее, чем при изотермическом.
Работа А, совершаемая внешними телами над газом, отличается от работы, совершаемой газом, только знаком:
Адиабатический процесс также можно отнести к изопроцессам.
Применение первого закона термодинамики при решении задач
Запишем первое начало термодинамики:
Формула
Работу против внешних сил, которую совершил газ, можно найти по формуле из механики:
Формула
Отсюда можно найти изменение внутренней энергии:
Над газом была совершена работа 55 Дж, а его внутренняя энергия увеличилась на 15 Джоулей. Какое количество теплоты получил или отдал газ в этом процессе?
Записываем первое начало термодинамики и подставляем данные задачи:
Формула
Рассмотрим несколько примеров для различных изопроцессов.
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Особенность данной задачи в том, что нужно сначала определить какой это изопроцесс. Так как нагревание газа по условиям данной задачи происходит при постоянном объеме, значит перед нами изохорный процесс.
При изохорном процессе:
Формула
Формула
Формула