Что такое периоперационный период
Понятия о периоперативном периоде, его цели и задачи



Периоперативный период – это время с момента принятия решения об операции до восстановления трудоспособности или ее стойкой утраты.
Он включает в себя следующие периоды: предоперационный, интраоперационный (сама операция), послеоперационный. [23]
Предоперационный период – это время от момента поступления больного в хирургическое отделение до начала производства операции.
Основными задачами предоперационного периода являются:
1. Постановка топического диагноза.
2. Определение срочности оперативного лечения.
3. Подготовка пациента к операции.
Цель предоперационного периодасвести до минимума риск предстоящей операции, предотвратить возможность развития послеоперационных осложнений и дать оценку анестезиологического риска Условия для ее выполнения различны в зависимости от срочности оперативного вмешательства. Но независимо от этого должна предусматривать психологическую подготовку больного, подготовку органов и систем организма, операционного поля, выбор метода обезболивания. Уставив диагноз хирургического заболевания, следует выполнить в определенной последовательности основные действия, обеспечивающие подготовку больного к операции:
1) определить показания и срочность операции, выяснить противопоказания;
2) провести дополнительные клинические, лабораторные и диагностические исследования с целью выяснения состояния жизненно важных органов и систем;
3) провести психологическую подготовку больного к операции;
4) осуществить подготовку органов, коррекцию нарушений систем гемостаза;
5) провести профилактику эндогенной инфекции;
6) выбрать метод обезболивания, провести премедикацию;
7) осуществить предварительную подготовку операционного поля;
8) транспортировать больного в операционную;
9) уложить больного на операционный стол.
Интраоперационный период– это период с момента доставки больного в операционную и до выведения больного из наркоза, то есть выполнение хирургической операции. Включает в себя:
– укладывание больного на операционный стол;
– выполнение обезболивания (м/а, наркоз);
– подготовка операционного поля;
– выведение больного из наркоза.
Основным методом лечения больных хирургического профиля является выполнение оперативного вмешательства (операции).[7]
Хирургическая операция – это мероприятие, осуществляемое посредством механического воздействия на ткани и органы больного с лечебной и диагностической целью. Большинство хирургических операций выполняются с лечебной целью. Если во время операции патологический процесс полностью ликвидируется, операция называется радикальной, например удаление желчного пузыря – холециститом. Если патологический процесс не устраняется, но облегчается состояние больного и улучшается функция определенной системы органов, операция называется паллиативной, например наложение обходного желудочно-кишечного анастомоза при неоперабельном раке желудка.
Есть операции, задачей которых является обнаружение патологического и определение его характера, диагностические. К этим операциям относятся биопсии, пункции различных полостей организма, а также вскрытие полостей (лапаротомия, торакотомия), эндоскопические операции (лапароскопия, торакоскопия). Показанием к их выполнению служит невозможность определения наличия и характера патологического процесса специальными методами исследования.
Диагностический этап – ревизия органов – является обязательным этапов любой лечебной операции.
В зависимости от объема операции могут быть большими и малыми. Большие операции проводят в стационаре, малые – в поликлинике (удаление липомы, атеромы, вскрытие абсцесса, панариция).
По времени выполнений хирургических операций могут быть экстренными, срочными, плановыми.
Экстренная операция проводится по жизненным показаниям сразу после госпитализации или после кратковременной подготовки больного. К таким операциям относятся вмешательства при кровотечениях, прободении полых органов, при асфиксии.
Срочная операция выполняется в сроки от 24 до 48 ч после поступления больного, если консервативное лечение безуспешно. Срочная операция производится, если появляются перитонеальные симптомы у больного с острым холециститом, панкреатитом, нарастают симптомы интоксикации у больного с кишечной непроходимостью. При срочных операциях анестезиолог и медицинская сестра имеют больше времени и возможностей для подготовки больного к операции, производят переливание крови и жидкостей, коррекцию нарушений электролитного и белкового баланса.
Плановая операция выполняется после необходимого обследования и подготовки больного. Сроки зависят от характера заболевания и могут быть от одного дня до недели и более, если необходимы дополнительное обследование и специальная подготовка, например при операциях на сердце, легких. [16]
Также операции можно разделить на 4 класса:
1. чистые хирургические операции;
2. условно чистые хирургические операции;
3. контаминированные (загрязненные) операции;
4. грязные и инфицированные операции.
Операции делятся на две группы – кровавые и бескровные. Под первым видом операции понимается хирургическое вмешательство, сопровождающееся рассечением тканей, остановкой кровотечения из рассеченных тканей, наложением швов при соединении тканей и другими манипуляциями в зависимости от характера оперативного вмешательства.
Второй вид хирургической операции – это производство тех или иных хирургических манипуляций, которые не связаны с рассечением тканей и при которых отсутствует кровотечение. К таким оперативным мероприятиям относятся вправление вывихов, сопоставление костных отломков.
При том или ином оперативном вмешательстве, особенно кровавых операциях, предусматривается комплекс профилактических мероприятий, направленных на предупреждение инфекции в послеоперационном периоде, хорошее обезболивание и тщательную остановку кровотечения из рассеченных тканей.
Большинство хирургических операций выполняются с лечебной целью. Если во время операции патологический процесс полностью ликвидируется, операция называется радикальной, например удаление желчного пузыря – холецистэктомия – при камнях в желчном пузыре, осложненных острым холециститом. Если патологический процесс не устраняется, но облегчается состояние больного и улучшается функция определенной системы органов, операция называется паллиативной, например наложение обходного желудочно–кишечного анастомоза при неоперабельном раке желудка. [34]
В ходе хирургической операции различают три этапа:
1) оперативный доступ – манипуляция, посредством которой обнажают органы и ткани, являющиеся объектом хирургического вмешательства;
2) основной момент – оперативное вмешательство на органе, имеющем патологические изменения;
3) заключительный этап – восстановление тканей, разрушенных во время оперативного доступа.
Проводить операции имеет право только специалист-хирург, имеющий сертификат по хирургии.
В операции участвуют как минимум два врача (оператор и ассистент), операционная медицинская сестра, врач-анестезиолог, медицинская сестра, врач – анестезиолог, медицинская сестра – анестезист. Если операция выполняется под местной анестезией, присутвует только врачи-хирурги и операционная сестра.
В операционный блок пациента подают на каталке. В. шлюзе оперблока персонал отделения, сопровождающий пациента, перекладывает его с каталки отделения на каталку операционного блока. Далее персонал операционного блока перевозит пациента в операционную.
Операционный блок – это комплекс помещений, в котором производятся хирургические операции, а также некоторые диагностические пособия (лапароцентез, лапароскопия, эндоскопия).
В операционном блоке предусмотрено строгое зонирование внутренних помещений на стерильную зону (операционные), зону строгого режима (предоперационные, помещения хранения стерильных материалов и другие вспомогательные помещения), зону общебольничного режима (шлюз). Зона общебольничного режима (после шлюза) отделяется от остальных помещений операционного блока «красной чертой».
Операционные пронумерованы и функционально разделены с учетом необходимого оборудования и степени чистоты оперативного вмешательства.
В операционном блоке всегда порядок и высокая трудовая дисциплина. Все находится на своих местах – упаковки и биксы, приборы и инструменты, шкафы с растворами и медикаментами. Операционная готова к работе в любое время суток.
Работа операционного блока строится на строжайшем выполнении правил асептики и антисептики, так как операционная рана – это входные ворота для различного рода инфекции. Строгое соблюдение асептики в большей степени зависит от дисциплинированности персонала и внимательного отношения к мелочам, как в организации, так и в проведении операций, чем от применения антибиотиков и сложного оборудования. [15]
Эффективность выполнения операции в значительной степени зависит от правильного положения больного на операционном столе, что необходимо для улучшения доступа к оперируемому органу. Укладка больного на операционном столе зависит от характера предполагаемого хирургического вмешательства, оно должно быть прежде всего физиологичным и обеспечивать защиту в точках потенциального давления от трения, продолжительного натяжения, сдавления нервных стволов и других повреждений. Правильное расположение больного на операционном столе неотъемлемая часть работы медицинской сестры. Например:
– горизонтальное на спине – операции в грудной и брюшной полости, грыжи, на органах малого таза и т.д.;
– горизонтальное на животе– операции на позвоночнике, на голове, в грудной полости и т.д.;
– на боку – при операциях на мочевыделительной системе (люмботомия);
– положение Трендельбурга операции на промежности и другие.
Послеоперационный период – это время пребывания больного в стационаре с момента окончания операциии до выписки из лечебного учреждения. Он делится на3 части:
– поздний – 2–3 недели;
– отдаленный (реабилитации) – обычно от 3 недель до 2–3 месяцев.
Основными задачами послеоперационного периода являются:
– профилактика и лечение послеоперационных осложнений.
– скорение процессов регенерации.
Проблемы пациентов в послеоперационном периоде:
1. риск аспирации рвотными массами;
2. боли в области операционного доступа;
3. риск застойных явлений в легких;
4. задержка мочеиспускания, риск развития паралитической непроходимости кишечника;
5. дефицит знаний о питьевом и пищевом режиме;
6. риск шоковых состояний;
7. риск послеоперационных кровотечений;
8. риск инфицирования.
Таким образом, периоперативный период складывается из предоперационного, интраоперационного и послеоперационного периодов. Периоперативный период позволяет снизить риски оперативных вмешательств и предотвратить осложнения после операции.
Периоперационный период
Он длится от нескольких часов до 3 дней. В настоящее время ведущие нейрохирургические клиники стараются максимально сократить этот период, поскольку пациент поступает уже достаточно хорошо обследованным (см. список необходимых анализов и исследований до госпитализации) и готовым к проведению хирургического лечения. Нередко операция назначается на день госпитализации, хотя в большинстве случаев это следующие сутки после поступления в клинику. Более длительный период ожидания хирургического вмешательства может быть обусловлен поступлением в стационар в пятницу, либо необходимостью специальной подготовки.
В дооперационном периоде возможно вам будут назначены несколько дополнительных анализов (особенно при наличии сопутствующих заболеваний, например, сахарного диабета) и осмотры врачей – нейроофтальмолога, отоневролога, нейропсихолога, при необходимости – терапевта, эндокринолога и других.
Операция может быть отложена при развитии у пациента после госпитализации воспалительных заболеваний рото- и носоглотки, а также при наступлении менструального цикла у женщин.
Еще одной, но уже запланированной, причиной задержки операции является специальная подготовка – забор у пациента в условиях анестезиологического отделения плазмы крови при планируемой массивной кровопотере во время операции. После этой процедуры пациент находится в клинике, восстанавливает естественным путем объем циркулирующей крови в течение 3-4 дней, а в случае возникновения интраоперационной кровопотери он получит собственную кровь, что существенно снижает риск осложнений гемотрансфузии.
Самый важный этап всей госпитализации, однако, по иронии судьбы, именно его вы не запомните совсем, поскольку практически все нейрохирургические операции по поводу опухолей проводятся под общей анестезией (в наркозе), за исключением СТБ опухолии операций с пробуждением (awake craniotomy).
Очень важно в день операции не принимать пищу и ограничить прием жидкости – это связано с риском регургитации пищевых масс в легкие в состоянии наркозного сна.
Перед операцией голову обязательно нужно вымыть стандартным способом.
Вопрос стрижки волос остается открытым и решается индивидуально в соответствии с предпочтениями врача, планируемой операцией и прической пациента. Мои правила – максимально редко предлагать подстричься перед операцией девушкам и женщинам. Исключения составляют те случаи, когда пациентки обладают короткой прической, а планируемый разрез, ввиду больших размеров опухоли, потребует выбривания 1/3-1/2 волос и сделает ее внешний вид еще более странным, чем равномерно короткая стрижка (2-3 мм). У мужчин разрез кожи должен согласоваться с размером и формой дефектов волосяного покрова головы.
Меня часто спрашивают о размерах трепанационного окна и технике выполнения трепанации. Удивительно, на примерно треть пациентов считает, что череп будет распилен циркулярно по окружности и вся его верхняя часть будет временно удалена для доступа к опухоли. На самом деле так, конечно, не делается. В настоящее время существует тенденция к минимизации трепанационных отверстий и, соответственно, длины кожного разреза. Если опухоль не имеет большой площади прилегания к оболочке головного мозга (чаще всего бывает при менингиомах), то почти всегда выполняется линейный разрез кожи небольшой длины. Исключение составляют случаи, когда опухоль расположена вне волосистой части головы (в лобной области) и разрез кожи удлиняется с целью избегания его выхода на видимую часть.
Трепанация черепа выполняется чаще всего из одного небольшого отверстия, выполненного с помощью специального краниоперфоратора. В это отверстие вводится краниотом и с его помощью выпиливается костный лоскут, обычно круглой формы, в среднем не более 4 см в диаметре.
С учетом вышеобозначенной тенденции к миниинвазивности и минимизации трепанационного окна, эта величина с годами уменьшается. Способствуют этому совершенствование хирургических навыков, а также техническое обеспечение – операционные микроскопы с лучшими характеристиками освещенности поля, фокуса и зума, а также специальные устройства. В частности, я использую сконструированное профессором Д.И. Пицхелаури устройство MARI, с помощью которого размер трепанации (в руках автора) может быть уменьшен до 15 мм
Непосредственно перед подачей в операционную нужно снять все украшения, поскольку во время операции мы используем монополярную коагуляцию. Необходимо прилечь на кровать на 30 минут и затем, находясь в горизонтальном положении, надеть приобретенные заранее компрессионные чулки второго (=среднего) класса компрессии, которые используются для профилактики грозных тромбоэмболических осложнений.
Медицинские сестры транспортируют вас в операционный блок. Настройтесь на положительный исход, это важно!
В настоящее время в специализированных нейрохирургических центрах с большим опытом лечения все чаще используется концепция fast-track: выполняется все возможное для минимизации пребывания пациента в стационаре и особенно в отделении реанимации. Целью ее применения является снижение используемых препаратов и количества инвазивных манипуляций, что в совокупности положительно влияет на процесс восстановления и лечения в целом.
Нейрохирургические центры с достаточным опытом стандартных и сложных операций, с высоким уровнем подготовки нейрохирургов и анестезиологов, примерно в 70% случаев не переводят пациента в отделение реанимации, наблюдая за выходом из наркозного сна в палате пробуждения операционного блока. Из нее пациент в день операции переводится в свою палату клинического отделения. Большое количество операций и слаженность работы профессионалов позволяет без каких-либо осложнений делать это на регулярной основе, что существенно повышает комфорт больного.
Клиники с меньшим опытом переводят всех больных после операций на головном мозге в отделение реанимации для наблюдения за ними как минимум до утра следующего дня, справедливо полагая, что вмешательство на центральной нервной системе – сложная и рискованная операция.
Послеоперационный контроль обычно проводится в виде спиральной компьютерной томографии, призванной оценить радикальность удаления опухоли и наличие/отсутствие операционных осложнений. В ряде случаев выполняется послеоперационная МРТ головного мозга.
Некоторые клиники, в том числе за рубежом, или отдельные врачи в них, не всегда выполняют контрольные снимки или не выдают их пациенту (по разным причинам).
Мое правило – выполнять контрольный КТ-снимок всем пациентам на 0 или 1 сутки после операции, вне зависимости от сложности, длительности и объема операции, а также моей субъективной оценки рисков развития послеоперационных осложнений.
Активизация пациента начинается на следующий после вмешательства день: необходимо сесть в кровати и после 15 минут в положении сидя под контролем кого-то из окружающих встать, пройти на небольшое расстояние (при отсутствии головокружения или выраженной головной боли). Постепенно необходимо увеличивать продолжительность прогулок и обычно со 2-3 дня пациент возвращается к нормальной активности.
В случае возникновения после операции неврологического дефицита – двигательного, речевого итд – к пациенту в специализированных центрах в палату ежедневно приходит соответствующий специалист (инструктор лечебной физкультуры, логопед итд) для проведения восстановительных занятий. В этом случае активизация больного несколько задерживается.
Как минимум дважды до выписки производится перевязка раны.
При выписке пациенту выдается листок нетрудоспособности (при необходимости) и выписной эпикриз. Это документ, который содержит краткую историю заболевания, результаты анализов и исследований, проведенных в клинике, название операции, описание контрольных снимков, результаты патоморфологического исследования и описание динамики состояния (втч неврологического статуса) больного.
Самым важным для пациента разделом этого документа является «заключение и рекомендации», где обязательно должна быть отражена тактика дальнейшего лечения или указаны специалисты, консультации которых нужно организовать для ее определения. Кроме того, в рекомендации вносятся все препараты, которые необходимо принимать после выписки, с указанием дозировок и длительности курса приема, вид и сроки выполнения контрольных МР-исследований, а также ограничения, накладываемые на пациента на основании диагноза и проведенного лечения.
Пациенты высокого периоперационного риска: два подхода к стратификации
И.Б. Заболотских, Н.В. Трембач
Для корреспонденции: Заболотских Игорь Борисович — д-р мед. наук, профессор, заведующий кафедрой анестезиологии, реаниматологии и трансфузиологии ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России, Краснодар; e-mail: pobeda_zib@mail.ru
Для цитирования: Заболотских И.Б., Трембач Н.В. Пациенты высокого периоперационного риска: два подхода к стратификации. Вестник интенсивной терапии им. А.И. Салтанова. 2019;4:34–46. DOI: 10.21320/1818-474X-2019-4-34-46
Несмотря на успехи современной медицины, оперативные вмешательства не стали абсолютно безопасными, до сих пор частота послеоперационных осложнений и летальность остаются высокими, а послеоперационная летальность вышла на третье место среди причин смерти после ишемической болезни сердца и инсульта. Проблема оценки периоперационного риска постоянно привлекает внимание специалистов, поскольку выявление пациентов высокого риска является основой профилактики неблагоприятного исхода. Тем не менее, несмотря на всю важность, проблема эта далека от решения. Данный обзор посвящен двум подходам к стратификации риска: оценке риска летальности и риска осложнений. Анализ литературы показывает, насколько противоречивы оба этих подхода: отсутствие общепринятых определений летальности и осложнений, разнообразие критериев выделения высокого риска — все это приводит к отсутствию единого представления о высоком периоперационном риске. Существующие на данный момент системы оценки риска не лишены значительных недостатков и обладают ограниченной прогностической ценностью. Тем не менее в вопросе стандартизации исследований по стратификации риска наметился прогресс за последнее десятилетие: появляются единые определения летальности и осложнений, создаются национальные регистры — все это позволяет надеяться на улучшение качества прогноза.
Ключевые слова: стратификация периоперационного риска, летальность, осложнения
Поступила: 11.10.2019
Принята к печати: 05.11.2019
С медицинской точки зрения периоперационный риск — это многофакторное понятие, характеризующее вероятность развития неблагоприятного исхода (летального исхода, развитие осложнения) в течение определенного периода после операции или во время операции.
Для чего нужна точная оценка периоперационного риска? Во-первых, это помогает лучше информировать пациентов о необходимости и оправданности тех или иных решений в периоперационный период. Во-вторых, оценка периоперационного риска может помочь определить необходимость в дополнительном обследовании, предоперационной оценке легочной функции, стресс-тестах для оценки состояния сердечно-сосудистой системы и т. д. В европейских руководящих принципах оценка функционально- го состояния пациента является ключевым фактором, определяющим, рекомендуется ли дальнейшее специализированное предоперационное кардиологическое обследование [1]. В частности, показано, что пациенты, функциональные возможности которых были более 4 метаболических единиц при объектив- ном тестировании, имели более низкий периоперационный риск [2].
В-третьих, информация о риске может помочь определиться с тактикой периоперационного ведения. Обсервационные исследования показали, что периоперационное применение бета-блокаторов связано со снижением частоты осложнений у пациентов с более высоким сердечно-сосудистым риском, в то время как у лиц с низким риском может даже увеличить вероятность их развития [3, 4].
В-четвертых, информация о рисках может помочь указать требуемый уровень периоперационного мониторинга, а также то, требуется ли применение инвазивного контроля гемодинамики или перевод в отделение интенсивной терапии. Роль оценки периоперационного риска в выборе стратегии послеоперационного ведения является особенно важной, поскольку лечение в отделении реанимации является дорогостоящим, а свободные реанимационные койки — дефицитом. Расширенный и целенаправленный послеоперационный мониторинг способствует более раннему выявлению и своевремен- ному лечению осложнений, что позволяет улучшить результат лечения пациентов высокого риска [5]. Информация о риске неблагоприятных событий также может быть полезной для сравнения показателей деятельности отдельных специалистов и клиник [6, 7].
В настоящее время наиболее распространены два подхода к оценке риска: выделение группы пациентов с высоким риском летального исхода и пациентов с высоким риском развития осложнений (табл. 1).
Таблица 1. Критерии исходов хирургического лечения, детерминирующие высокий периоперационный риск
Исход
Примеры
Летальный исход во время анестезии Суточная летальность
Госпитальная летальность 30-дневная летальность 90-дневная летальность
Летальность в течение 1 года
□ Тромбоэмболия легочной артерии
□ Послеоперационная когнитивная дисфункция
□ Хирургические осложнения, специфичные для данного вида операции
□ Послеоперационная тошнота и рвота
Пациенты высокого периоперационного риска: стратификация по летальному исходу
Традиционно внимание анестезиологов-реаниматологов приковано к риску летального исхода, связанного с оперативным лечением. Успехи современной анесте- зиологии позволили значительно снизить риск анестезии по сравнению с прошлым веком, однако уровень периоперационной внутрибольничной летальности после плановых операций на данный момент составляет в среднем около 0,5 % [8]. Weiser et al. [9] подсчитали, что более 313 миллионов взрослых пациентов во всем мире ежегодно подвергаются оперативным вмешательствам. Таким образом, количество летальных исходов может в результате составлять несколько миллионов каждый год. Несмотря на успехи современной анестезиологии и периоперационной медицины, летальный исход в связи с операцией и анестезией продолжает быть крайне актуальной проблемой, занимая третье место среди всех причин смерти [10].
В определении периоперационной летальности нет единого подхода, в частности, в различных исследованиях под этим понятием подразумевают летальный исход в разные сроки периоперационного периода (табл. 2). Подобные разночтения в понятии летальности создают трудности при сравнении данных различных исследований и ведут к потенциальным ошибкам в трактовке, поскольку летальность, ограниченная коротким сроком наблюдения, может не охватывать случаи, обусловленные отдаленными последствиями операции и анестезии, а долгосрочный летальный исход может быть вызван причинами, не связанными с проведенным лечением.
Таблица 2. Временные характеристики периоперационной летальности
Срок летального исхода
Частота летальности,
Источник
В течение двух лет
Один из наиболее распространенных способов оценки периоперационного риска — шкала физического статуса ASA — основан на субъективном мнении врача относительно общего состояния здоровья пациента. Известно, что эта шкала в высокой степени субъективна и не включает хирургические риски [19]. Многочисленные исследования показали, однако, увеличение летальности с увеличением класса по ASA (табл. 3).
Таблица 3. Влияние физического статуса на летальность
Класс
Летальность, %
Госпитальная
n = 6300
7-дневная
n = 897,733
30-дневная
n = 2,297,629
30-дневная
n = 1206
В настоящее время на основании оценки физического статуса пациентов высокого риска выделяют эмпирически — с 3-го класса и выше. Анализ, представленный в таблице, показывает, что с ухудшением статуса до 3-го класса происходит скачкообразное увеличение летальности. Следует отметить, что применение указанной системы приводит к выделению значительной части пациентов (до 58 %) в группу высокого риска, летальность в которой составляет 7,7 % [17].
Работа Visnjevac [23] показала, что разделение классов на подклассы по наличию функциональной зависимости (способности к самообслуживанию и зависимости от посторонней помощи) значительно изменяет структуру летального исхода на всех этапах 10-летнего наблюдения, начиная с 1-го месяца. Таким образом, внутри одного класса популяция крайне неоднородна и риск находится под влиянием такого фактора, как функциональная зависимость.
Несмотря на свою субъективность и неоднородность групп, шкала ASA демонстрирует приемлемую прогностическую ценность в оценке риска летального исхода (табл. 4).
Таблица 4. Прогностическая ценность шкалы ASA в оценке риска летальности
Летальность
Площадь под ROC-кривой
Источник
Работа Shoemaker [27] убедительно показала эффективность целенаправленной интенсивной терапии в группе риска, имеющей конкретные критерии: пред- шествующие тяжелые кардиореспираторные заболевания (инфаркт миокарда, хроническая обструктивная болезнь легких, инсульт), заболевания сосудов на последних стадиях, включая аорту, возраст более 70 лет с ограничением функциональных резервов одного или более органов, операции по поводу карциномы, абдоминальные «катастрофы» на фоне нестабильной гемодинамики (например, перитонит), массивная кровопотеря (более 8 ЕД крови), септицемия, дыхательная недостаточность, острая почечная недостаточность. Госпитальная летальность в группе риска составила 28 %.
Сопоставимые цифры летальности при применении указанных критериев получили Wilson [28] и Lobo [29], при этом в группах пациентов, интенсивная терапия которых была оптимизирована, получено снижение как госпитальной (с 17 до 3 %), так и 30-дневной (с 33 до 15,7 %) летальности.
Некоторые из интегральных шкал периоперационного риска были первоначально разработаны для других целей и впоследствии адаптированы к прогнозированию периоперационного риска. Индекс коморбидности Чарлсона, предлагаемый для прогнозирования кратко- срочных послеоперационных исходов после хирургических вмешательств, первоначально был разработан для предсказания долгосрочной летальности среди стационарных больных [30] и лишь затем валидизирован для прогноза долгосрочной летальности у пациентов с сахарным диабетом и гипертонической болезнью после плановых оперативных вмешательств [31].
Исследования, направленные на изучение вклада коморбидности в развитие неблагоприятного исхода и применявшие шкалу Чарлсона, выявили значительную корреляцию между летальностью и баллами по шкале. При этом 30-дневная летальность значительно увеличивалась у пациентов с количеством баллов более 4 [16], что позволило выделить группу риска с летальностью 14,9 %. В целом пациенты группы высокого периоперационного риска при использовании этой шкалы составляют 26 % всех пациентов и в структуре летальности занимают 91 %. Прогностическая ценность шкалы в прогнозировании летальности колеблется от отсутствия таковой до хорошей (табл. 5).
Таблица 5. Прогностическая ценность шкалы Чарлсона в оценке риска летальности
Летальность
Площадь под ROC-кривой
Источник
Одной из шкал, непосредственно разработанных для оценки риска летального исхода и развития послеоперационных осложнений, является шкала POSSUM (Physiological and Operative Severity Scoring System for Enumeration of Morbidity and Mortality). В ее основе лежат 12 параметров, которые необходимо регистрировать в предоперационный период, включая возраст, наличие симптомов кардиореспираторных заболеваний и некоторых лабораторных маркеров. Уравнение регрессии, включающее все переменные, позволяет рассчитать риск госпитальной летальности у конкретного пациента. Эмпирически была выделена группа высокого периоперационного риска выше 5 %. Анализ показал, что данному критерию соответствовали примерно 10 % всех пациентов; при этом госпитальная летальность составила около 12 % (табл. 6).
Таблица 6. Летальность в группе пациентов высокого риска по шкале POSSUM
Пациенты высокого риска,%
Госпитальная летальность в группе риска, %
Вклад высокого риска в общую летальность, %
Источник
В настоящее время известно несколько модификаций этой шкалы, в зависимости от области хирургии. Специфические шкалы показывают лучшую прогностическую ценность в оценке риска летальности, чем исходная шкала (табл. 7).
Таблица 7. Прогностическая ценность модификаций шкалы POSSUM в оценке риска летальности после операций по поводу рака желудка
Шкала
Площадь под ROC-кривой
Шкала P-POSSUM, разработанная в Великобритании, была затем валидизирована в нескольких странах: Японии, Австралии и Италии. Данная модификация является наиболее часто используемой моделью. С одной стороны, шкала обладает высокой точностью. Так, два исследования, изучавшие 30-дневную летальность после обширных оперативных вмешательств, выявили высокую прогностическую значимость шкалы [36, 37] (AUROC 0,9 и 0,92), Donati et al. получили подобные данные для госпитальной летальности (AUROC 0,91) [25]. Однако у шкалы есть недостатки — она включает в себя интраоперационные факторы и потому не может считаться предоперационным методом оценки риска: не- которые переменные достаточно субъективны, а их количество велико (18 параметров).
Шкала хирургического риска (Surgical Risk Scale) до недавнего времени наряду с P-POSSUM являлась одной из наиболее часто используемых в оценке риска неблагоприятного исхода. Заключая в себе данные о тяжести операции, виде операции и физическом статусе по ASA (в сумме от 3 до 14 баллов), шкала удобна в применении в предоперационный период. Два исследования показали хорошую прогностическую ценность в оценке риска 30-дневной летальности (AUROC — 0,85 и 0,89) [36, 37] и одно — в оценке госпитальной летальности (AUROC 0,95) [24]. Тем не менее применение шкалы ASA приводит к некоторой субъективизации, а классификация тяжести операций трудна в рутинном использовании. Наконец, шкала не была валидизирована на большой популяции.
Шкала POSPOM (Preoperative Score to Predict Postoperative Mortality) является одной из наиболее со- временных систем оценки риска послеоперационной летальности [38]. В основу модели легли данные почти трех миллионов пациентов из 479 центров, при этом валидизация проводилась на схожей по численности когорте из тех же 479 центров. Оценка включала в себя как факторы, обусловленные состоянием пациента, так и факторы, связанные с оперативным вмешательством. Авторы отметили, что летальность значительно возрастает у пациентов с количеством баллов более 30. На основании этого факта эмпирически было предложено выделить группу высокого периоперационного риска, включающую около 20 % всех пациентов, при этом 30-дневная и 90-дневная летальность составила 3,9 и 11,3 % соответственно [39].
Kim M. et al. [40] на основании кластерного анализа выделили пять классов латентного риска, внутри которых пациенты обладают характерными свойствами (лабораторные показатели, гендерные характеристики, наличие сопутствующих заболеваний):
От 1-го к 5-му классу 30-дневная летальность увеличивается с 0,06 до 22 %, при этом система показывает хорошую прогностическую ценность (AUROC 0,87 при 95 % ДИ 0,866–0,872), а включение в прогностическую модель функционального класса по ASA и характеристик хирургического вмешательства увеличивает ценность еще больше (AUROC 0,915 при 95% ДИ 0,913–0,917).
Еще одной разработанной не так давно системой оценки периоперационного риска является шкала, полученная в результате анализа результатов лечения 211 тысяч пациентов из 250 госпиталей США в рамках национальной программы по улучшению качества хирургической помощи (NSQIP). Целью данной про- граммы служили выявление факторов риска 30-дневной летальности после оперативного вмешательства и раз- работка калькулятора расчета ее риска. В результате анализа более миллиона анестезий такой калькулятор был создан и в настоящее время является системой оценки 21 предоперационного фактора, которые компьютерная программа включает в уравнение логистической регрессии. Результат представляет собой риск 30-дневного летального исхода, выраженный в процентах [41]. Рассчитанный индивидуально риск сравнивается с частотой летальности, полученной в исследуемой популяции (в настоящее время в регистре содержится информация о более чем миллионе пациентов из почти 400 клиник со средней летальностью 1,6 %), таким образом, пациента с риском летального исхода более 1,6 % относят к пациентам высокого риска. Разработанная модель является надежным инструментом оценки риска летальности (C-statistic = 0,944).
Исходя из вышесказанного, становятся понятными различия в полученных цифрах летальности, на которую оказывают влияние принцип выделения группы риска, период, в течение которого регистрируется летальный исход, а также год проведения исследования (табл. 8).
Таблица 8. Летальность в группе высокого риска в зависимости от применяемого критерия
Шкалы
Летальность в группе высокого риска, %
Источник
Исходя из вышесказанного, согласно данному под- ходу, высокий периоперационный риск — это высокая вероятность развития летальности у конкретно- го пациента, определенная одной из систем оценки. И 30-дневная, и госпитальная летальность являются приемлемыми и надежными определениями неблагоприятного исхода. Стратификация пациентов высокого периоперационного риска чаще всего основана на эмпирическом выборе порогового значения шкал ASA-PS, POSSUM, POSCOM и NSQIP, выше которого пациент относится к группе высокого риска, при этом за 30 лет «пороговая» величина послеоперационной летальности в группах высокого риска существенно снизилась. При верификации пациентов высокого периоперационного риска целесообразно указывать шкалу, на основании которой определен риск летального исхода, а для уточнения степени высокого риска важно использовать валидизированные с этой целью факторы.
Пациенты высокого периоперационного риска: стратификация по послеоперационным осложнениям
Вторым подходом к верификации высокого периоперационного риска является оценка вероятности развития существенных и второстепенных послеоперационных осложнений. При этом оценивается как риск осложненного послеоперационного периода в целом (наличие одного или нескольких осложнений, различия по тяжести осложнений), так и риск конкретного осложнения. Частота послеоперационных осложнений колеблется в широком диапазоне, составляя от 3 до 18 % [42–44]. Различия в данных объясняются отсутствием четких определений осложнений и различием в дизайне исследований. В работах, посвященных анализу развития осложнений и выявлению группы риска, также отсутствует единый подход к регистрируемым исходам.
Существенное количество исследований регистрируют некоторый перечень осложнений [27–29] или композитных исходов [40], иногда независимо от тяжести. Ряд авторов выделяет группы осложнений, что позволяет отделить риск серьезных жизнеугрожающих событий [17, 45]. В то же время нередко регистрируемые исходы имеют различное определение от исследования к исследованию, а иногда оно и вовсе отсутствует, что вызывает затруднения в оценке частоты исходов и факторов риска, а также делает сложным сравнение разных исследуемых выборок.
Вид осложнения и его тяжесть — основные характеристики исхода. К настоящему времени разработано несколько классификаций осложнений. В 1992 г. Clavien et al. предложили классификацию тяжести осложнений, состоящую из 4 степеней [46]. В 2005 г. Dindo et al. [47] предложили модификацию этой шкалы. Второй пересмотр расширил классификацию до 5 классов, содержащих 7 уровней тяжести (табл. 9). Вторая измененная классификация добавила точности, включая информацию о том, было ли вмешательство по поводу осложнения связано с общей анестезией, была ли необходима госпитализация в отделение интенсивной терапии по поводу органной недостаточности, и если да, то осложнения подразделялись по степени наличия органной недостаточности.
На основе анализа многочисленных исследований o применении шкалы Clavien—Dindo авторы системы пришли к заключению, что система требует изменений.
Таблица 9. Классификация осложнений по тяжести Clavien—Dindo
Степень тяжести
Критерий
Любые отклонения от нормального послеоперационного течения, не требующие медикаментозного лечения или хирургического, радиологического вмешательства. Разрешается терапевтическое лечение: антипиретики, анальгетики, диуретики, электролиты, физиотерапия. Лечение раневой инфекции
Требуется лечение в виде гемотрансфузии, энтерального или парентерального питания
Требуется хирургическое, эндоскопическое или радиологическое вмешательство без общего обезболивания
Вмешательство под общим обезболиванием
Жизнеугрожающие осложнения (включая осложнения со стороны центральной нервной системы), требующие интенсивной терапии, наблюдения в реанимации, резекции органа. Недостаточность одного органа
Учитывая потребность в единстве определений, в первую очередь для будущих исследований по оценке риска осложнений, в 2016 г. совместной рабочей группой Европейских обществ по анестезиологии и по интенсивной терапии была разработана классификация послеоперационных исходов [50]. Классификация послеоперационных исходов представлена 22 индивидуальными осложнениями с подробным описанием критериев, с помощью которых необходимо установить тот или иной диагноз, а также оценить тяжесть осложнения:
1.1 Острое повреждение почек
1.2 Острый респираторный дистресс-синдром
1.3 Несостоятельность анастомоза
1.5 Остановка сердца
1.6 Кардиогенный отек легких
1.7 Тромбоз глубоких вен
1.9 Желудочно-кишечное кровотечение
1.10 Инфекция без определенного источника
1.11 Лабораторно подтвержденная бактериемия
1.12 Инфаркт миокарда
1.13 Повреждение миокарда после некардиальных операций
1.15 Паралитическая кишечная непроходимость
1.16 Послеоперационное кровотечение
1.17 Тромбоэмболия легочной артерии
1.18 Острое нарушение мозгового кровообращения
1.19 Послеоперационная раневая инфекция (поверхностная)
1.20 Послеоперационная раневая инфекция (глубокая)
1.21 Послеоперационная инфекция (орган/пространство)
1.22 Инфекция мочевыводящих путей
Кроме того, классификация выделяет 4 составные характеристики послеоперационного исхода: большие кардиоваскулярные события, послеоперационные легочные осложнения, анкетирование послеоперационной заболеваемости, качество восстановления. Каждый исход содержит в себе несколько осложнений с критериями их диагностики. Для оценки степени тяжести осложнений рекомендуется применять классификацию Clavien в любой модификации.
Разработка данных дефиниций позволила унифицировать процесс регистрации исходов в проводимых в настоящее время эпидемиологических исследованиях [8, 51]. Тем не менее такой подход имеет свои слабые стороны, поскольку строгое соблюдение номенклатуры приводит к недооценке частоты встречаемости некоторых осложнений вследствие отсутствия в некоторых клиниках необходимых ресурсов для подтверждения соответствия развившегося события критериям исхода [51].
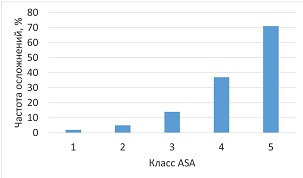
Шкала ASA применялась также для оценки риска осложнений. Ухудшение физического статуса по ASA коррелирует с увеличением риска периоперационных осложнений. Так, в исследовании Hackett et al. [22] участвовало более двух миллионов пациентов (11,7 % операций — экстренные) в некардиальной хирургии. Авторы регистрировали послеоперационные осложнения, развившиеся в течение 30-дневного периода (одно осложнение и более: тромбоз глубоких вен; тромбоэмболия легочной артерии; дыхательная недостаточность, потребовавшая реинтубации; продленная искусственная вентиляция легких; почечная недостаточность; кома; инсульт; остановка кровообращения; инфаркт миокарда; пневмония; инфекция мочевыводящих путей; сепсис; септический шок). В результате анализа количество осложнений прогрессивно возрастало с увеличением класса (рис. 1).
Рис. 1. Частота послеоперационных осложнений в зависимости от физического статуса (цит. по [22])
Наиболее частыми осложнениями являлись: дыхательная недостаточность, потребовавшая проведения продленной искусственной вентиляции легких (> 48 ч) (15,9 %) или реинтубации (10 %), сепсис (15 %), пневмония (12,7 %) и инфекция мочевыводящих путей (14 %).
Следует отметить, что частота осложнений у пациентов 2-го класса ASA и более была в 4 раза выше (16,9 vs 4,3 %); 74 % всех осложнений развились именно в группе высокого риска, при этом данная тенденция оставалась неизменной независимо от вида оперативного вмешательства [22].
Частота периоперационных осложнений всех классов по классификации Clavien—Dindo была выше в группе пациентов со статусом по ASA ≥ 3 (p 48,9*
**Тяжелые осложнения (3–5-я степень по Clavien—Dindo).
Существует два фактора, обусловливающих клиническую ценность шкал оценки периоперационного риска — прогностическая ценность и удобство в еже- дневной рутинной клинической практике. Очевидно, что прогностическая ценность должна стремиться к 100 %, однако очень часто ее увеличение перевешивается трудностью применения. Системы оценки риска, заключающие в себе большое количество независимых предикторов неблагоприятного исхода, обычно более точны в оценке риска, но с большим трудом могут быть встроены в рутинную предоперационную оценку. Более того, клинический опыт подсказывает, что специалисты неохотно пользуются «громоздкими» формулами [62], отдавая предпочтение простым способам стратификации высокого периоперационного риска. Очевидным доказательством этого тезиса является не снижающаяся популярность такой субъективной и не самой точной шкалы, как шкала ASA.
Из вышесказанного следует, что под периоперационным риском также подразумевают вероятность развития послеоперационных осложнений. Основной проблемой, связанной с данным подходом, является отсутствие единой системы классификации и определений послеоперационных осложнений. В настоящее время наиболее часто применяются классификация ESA- ESICM и классификация NSQIP, оценку тяжести осложнений рекомендуется проводить с помощью шкалы Clavien—Dindo. Для определения высокого риска чаще всего применяются те же «пороговые» значения, что и в случае с летальностью, однако такой подход обладает недостатками. Известные системы прогнозирования риска, демонстрировавшие на момент создания хорошую прогностическую ценность в оценке риска осложнений, в настоящее время по ряду причин уже не обладают прежней ценностью; выделение с их по- мощью групп риска вызывает трудности и чревато как недооценкой, так и переоценкой риска. Наибольшей точностью обладают системы, включающие в себя комбинации факторов риска, связанных с состоянием пациента и характеристиками оперативного вмешательства.
Заключение
Оценка периоперационного риска является одним из наиболее важных элементов в работе врача, поскольку позволяет индивидуализировать и рационализировать периоперационное ведение пациента. Однако выявление пациента высокого риска — нетривиальная задача и сопряжено с рядом трудностей. Несмотря на интуитивную простоту понятия «периоперационный риск», каждый понимает под ним что- то свое, и причин этому несколько. Во-первых, отсутствует единый подход к определению исхода, как летальности, так и осложнений. Во-вторых, разработанные на одной когорте пациентов шкалы чаще всего не демонстрируют заявленную прогностическую ценность на другой. В-третьих, большая часть «пороговых» величин в системах оценки риска являются субъективными. Наконец, разработанные несколько десятилетий назад шкалы не отражают реальное состояние медицины, и их эффективность значительно ниже, чем в момент создания. Тем не менее попытки улучшить прогноз ведутся постоянно и небезуспешно. Разработка единых определений исхода, набор больших регистров, позволяющих получить достоверные предикторы неблагоприятного исхода, — все это перспективные направления, которые позволят в будущем точно сказать, кто такой пациент высокого риска.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Заболотских И.Б. — разработка плана статьи, литературный поиск, анализ литературных источников, редакция статьи, подготовка окончательного варианта работы; Трембач Н.В. — литературный поиск, анализ литературных источников, оформление окончательного варианта статьи.