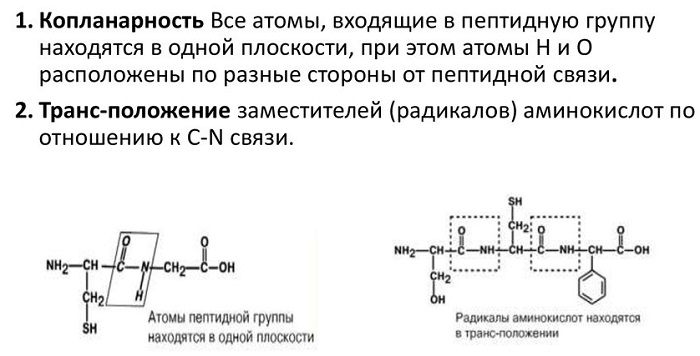
Что такое пептидная связь
Пептидная связь
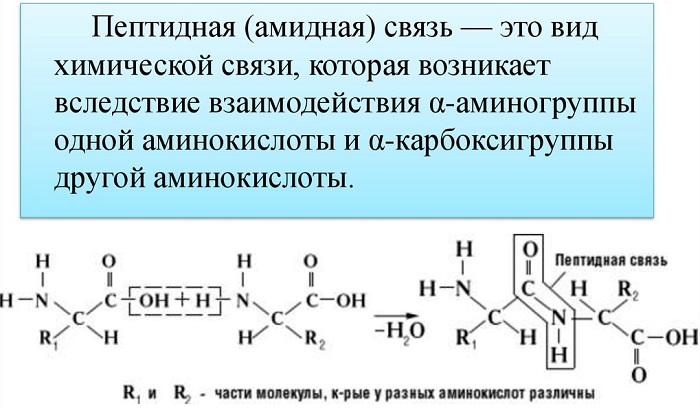
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Свойства пептидной связи
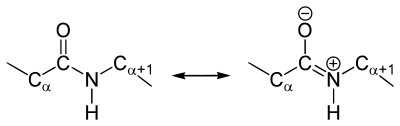
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Ссылки
Полезное
Смотреть что такое «Пептидная связь» в других словарях:
ПЕПТИДНАЯ СВЯЗЬ — ( CO NH ) химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков … Большой Энциклопедический словарь
пептидная связь — – амидная связь (NH CO ), образующаяся между амино и карбоксильной группами аминокислот в результате реакции дегидратации … Краткий словарь биохимических терминов
пептидная связь — Ковалентная связь между альфа аминогруппой одной аминокислоты и альфа карбоксильной группой другой аминокислоты [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN peptide bond … Справочник технического переводчика
Пептидная связь — * пептыдная сувязь * peptide bond ковалентная связь между двумя аминокислотами, возникающая в результате соединения α аминогруппы одной молекулы с α карбоксильной группой др. молекулы, с одновременным удалением воды … Генетика. Энциклопедический словарь
пептидная связь — ( СО NH ), химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков. * * * ПЕПТИДНАЯ СВЯЗЬ ПЕПТИДНАЯ СВЯЗЬ ( CO NH ), химическая связь, соединяющая аминогруппу одной аминокислоты… … Энциклопедический словарь
пептидная связь — peptide bond пептидная связь. Pазновидность амидной связи, образуется между α карбоксильной и α аминогруппой двух аминокислот. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО,… … Молекулярная биология и генетика. Толковый словарь.
пептидная связь — peptidinis ryšys statusas T sritis chemija apibrėžtis Amidinis ryšys, jungiantis elementariąsias grandis baltymo ar peptido molekulėje. atitikmenys: angl. peptide bond rus. пептидная связь … Chemijos terminų aiškinamasis žodynas
ПЕПТИДНАЯ СВЯЗЬ — Связь между аминной группой одной аминокислоты и карбоксильной группой другой … Толковый словарь по психологии
Строение аминокислот. Изоэлектрическая точка. Характеристика пептидной связи
Даже и не знаю с чего начать, давайте попробуем вот так. Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Поэтому, если нам хочется построить дом, то сначала нужно разобраться с кирпичами, правильно? Вот в этой статье и будем разбираться с аминокислотами: какие они бывают, сколько их и какие у них свойства. Дальше синтезируем пептид и определим — почему некоторые молекулы называются пептидами, а другие белками. Поймем почему про пептидную связь пишут, что она частично-двойная. А в конце небольшой подарок — торсионные углы. Вроде неплохо получилось? Тогда поехали.
Строение аминокислот
По названию все понятно, аминокислота — это молекула, которая содержит аминогруппу и карбоксильную группу. Но посмотрите на центральный углерод, что за бабник? У него целых четыре разных заместителя — водород, аминогруппа, карбоксильная группа и радикал. Он называется…. Альфа-углерод, такой альфа-самец прямо.
Такое общее строение у всех аминокислот, которые входят в состав белков, но они кое-чем отличаются. Да-да, радикалом. Основных аминокислот — 20 штук, хотя если честно, то 19. А если еще честнее, то их больше, но не будем путаться. У одной аминокислоты особенное строение, она даже не аминокислота вовсе, а иминокислота. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. И тут все очень логично — радикалы делятся на неполярные и полярные. Первые нерастворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует только эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
Опа, а глицин то получается не альфа-самец, у него два одинаковых заместителя — водороды.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Изоэлектрическая точка
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
Думаю, что нужно кое-что уточнить. Вы понимаете, что эти реакции обратимы. Когда я добавляю кислоту или щелочь, неважно, то я смещаю реакцию в какую-то сторону. Пусть я добавляю кислоту. С каждой каплей реакция смещается в сторону образования глицина +1, но только при pH равном 2,34 в растворе будет большая часть глицина +1. Хотя на pH +3 большая часть будет глицина с зарядом 0. Надеюсь, что понятно объяснил.
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Химики не корите, не слишком точно конечно, но запомнить легче. Получается, что в молекуле глицина pKa карбоксильной группы=2,34, а pKa аминогруппы=9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Образование пептидов
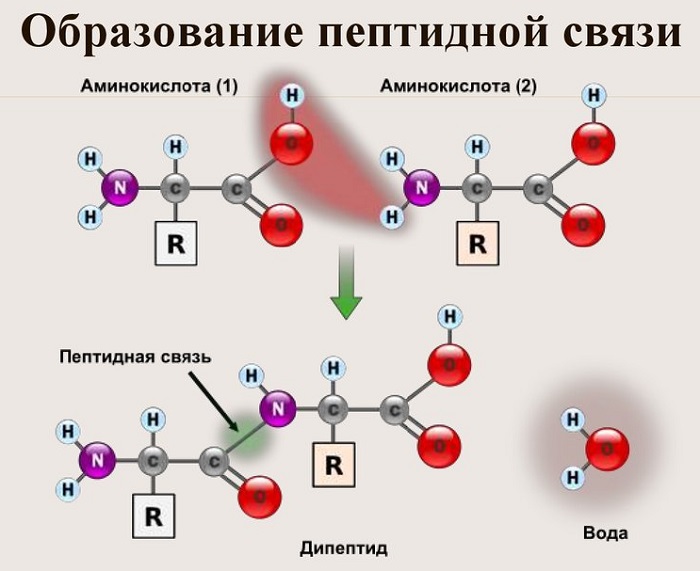
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
Пептидная связь
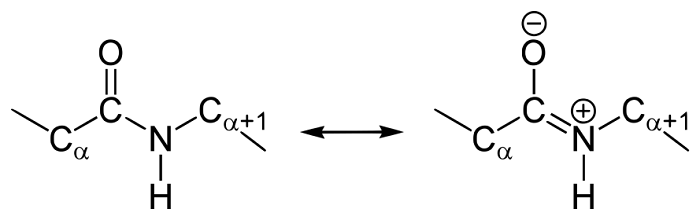
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
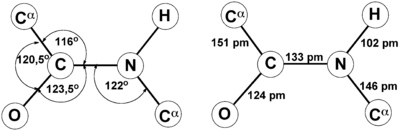
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.
Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
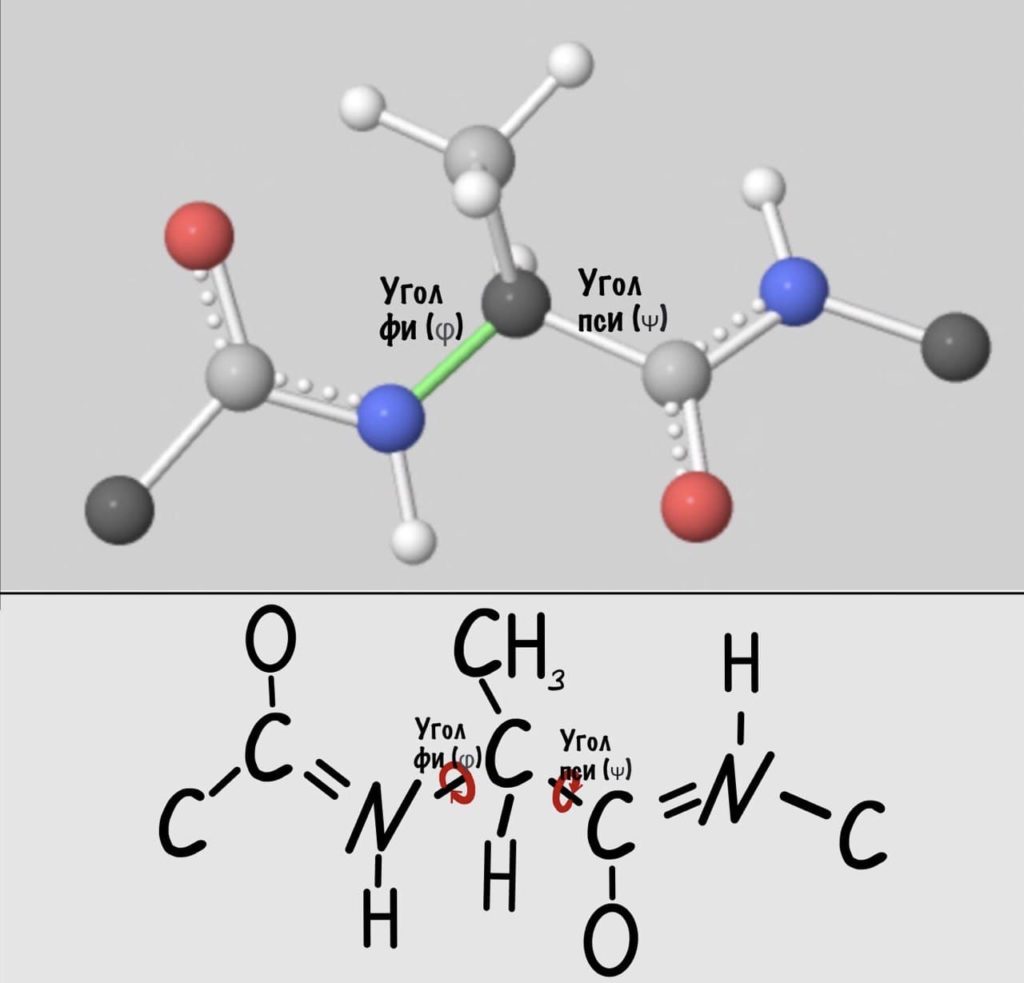
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
Еще это можно посмотреть графически с помощью проекций Ньюмана.
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
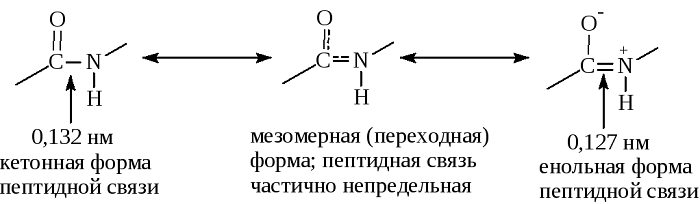
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
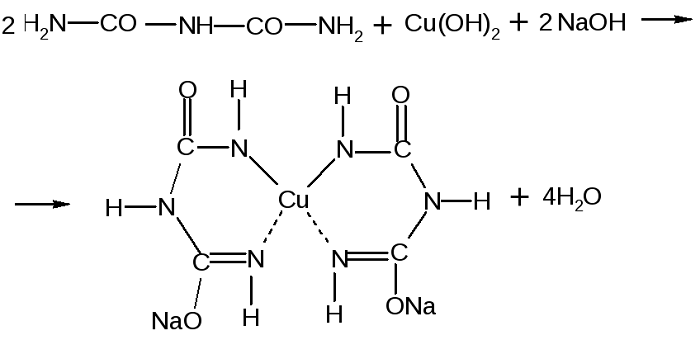
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Что такое пептидная связь
Биомолекулы. Пептиды и белки
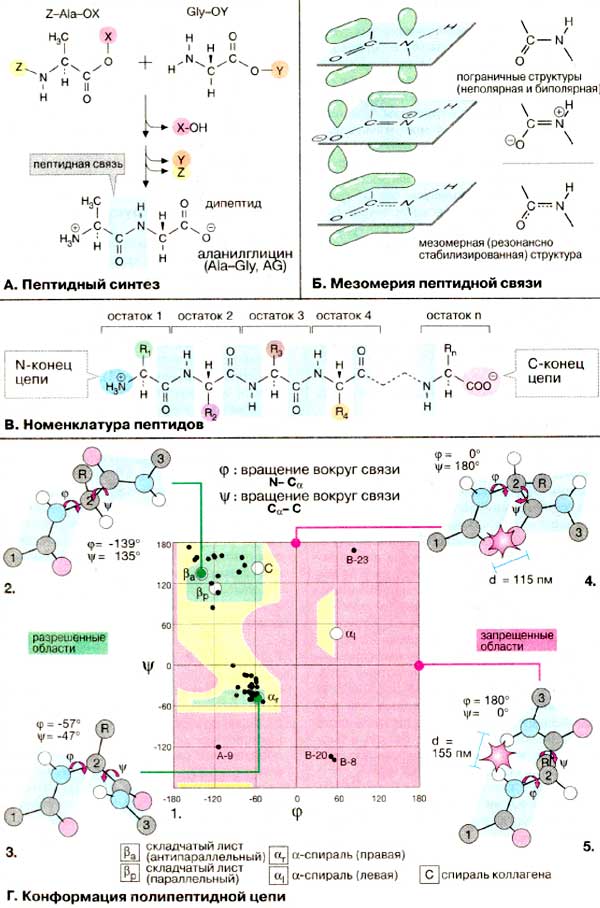
A. Пептидный синтез
В клетках пептиды и белки синтезируются в процессе трансляции на рибосомах (см. сс. 244-249). При химическом синтезе пептидов следует помнить, что целевой продукт образуется с высоким выходом лишь при условии, что функциональные группы, не участвующие в реакции, заблокированы защитными группировками (X,Y). В противном случае в приведенном примере наряду с целевым дипептидом AIa-Gly должны образовываться Gly-Ala, Gly-Gly и Ala-Ala. Кроме того, необходимо активировать карбоксильную группу (Z), что облегчает нуклеофильное присоединение по аминогруппе. В настоящее время пептиды с определенной аминокислотной последовательностью получают с помощью автоматических пептидных синтезаторов.
Б. Мезомерия пептидной связи
B. Номенклатура пептидов
Г. Конформация полипептидной цепи
Для каждого конкретного аминокислотного остатка ввиду стерических ограничений разрешены только определенные комбинации углов вращения φ и ψ. Для наглядности информацию о связи между углами φ и ψ в каждом пептидном звене представляют графически с помощью φ/ψ-карты ( 1 ). На карте видно, что большинство комбинаций двугранных углов оказываются запрещенными (поля, выделенные красным цветом). Так, например, при комбинации φ = 0 о / ψ = 180 о ( 4 ) атомы кислорода карбонильных групп должны сблизиться на расстояние 115 пм, что намного меньше, чем сумма вандерваальсовых радиусов двух атомов. Аналогичным образом, при комбинации φ = 180 о / ψ = 0 о ( 5 ) происходит наложение водородных атомов двух ΝΗ-групп. Поэтому для углов φ и ψ остаются разрешенными сочетания, лежащие в пределах дискретных областей, окрашенных в зеленый цвет ( 2, 3 ). В эти разрешенные области попадают все приведенные на последующей схеме вторичные структуры. Конформации, попадающие в зоны, выделенные желтым цветом, энергетически невыгодны, но возможны.
Конформационные карты ( карты Рамачандрана ) построены на основе модельных экспериментов с небольшими пептидами. Однако конформационные параметры большинства аминокислотных остатков в белках также попадают в разрешенные области карты. На карте 1 черными точками показаны пары углов φ и ψ в небольшом белке инсулине (см. с. 78).
Что такое пептидная связь
Пептидная связь образуется при реакции аминогруппы одной аминокислоты и карбоксильной группы другой с выделением молекулы воды:
Пептидная связь – ковалентная связь между карбонильной группой (С=О) одного остатка аминокислоты и аминогруппой (N-H) другого остатка.
Связанные пептидной связью аминокислоты образуют полипептидную цепь.
Характерной особенностью пептидной связи является то, что 6 атомов при ней находятся в одной плоскости. Это связано с тем, что связь С=О не является полностью кратной, а связь С-N не является полностью простой. В реальности наличествует некая, близкая к полуторной, связь, чем и объясняется планарное расположение 6 атомов:
Вызвано это различной электроотрицательностью атомов С, N и O.
Подобное строение пептидной связи накладывает отпечаток на формирование вторичной и третичной структуры белка.
Среди полимеров из аминокислотных остатков, в зависимости от длины полимерной цепи, различают:
Олигопептиды или просто пептиды, содержат до 20 остатков аминокислот
Полипептиды содержат от 20 до 50 остатков аминокислот
Белки содержат более 50 АК-остатков. Самый маленький белок с 51 аминокислотным остатком в двух полипептидных нитях, соединенных двумя дисульфидными мостиками –S–S–, называется инсулином. Образуется в организме из белка с одной полипептидной нитью проинсулина, вырезанием отрезка нити – пептида С. Белки состоят в среднем из 500 аминокислотных остатков. Длинные белки – коллаген и тропоколлаген – содержат около 1 000 аминокислотных остатков.
Белки, в зависимости от состава, бывают простые (содержащие только незамещенные остатки аминокислот в полипептидной цепи) и сложные, когда посредством боковых радикалов аминокислотных остатков к полипептидной цепи присоединены молекулы жирных кислот, сахаров, ацилглицеринов, другие органические группы (в том числе порфириновые), остатки фосфорной кислоты и т.д.
К сложным белкам, в частности, относятся:
• липопротеины (содержат остатки липидов);
• гликопротеины (содержат остатки сахаров, масса белковой части превышает массу углеводной части);
• протеогликаны (полисахариды, содержащие полипептидные участки);
• фосфопротеины (остатки фосфорной кислоты);
• металлопротеины (ионы металлов, связанные донорно-акцпторным взаимодействием с простетическими группами, типа порфиринов).