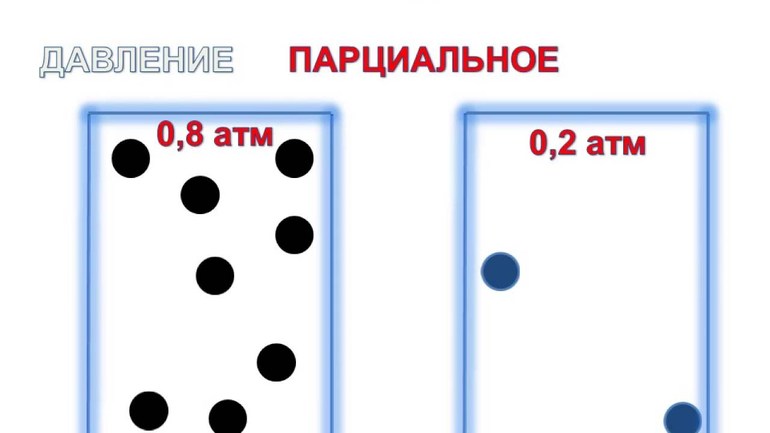
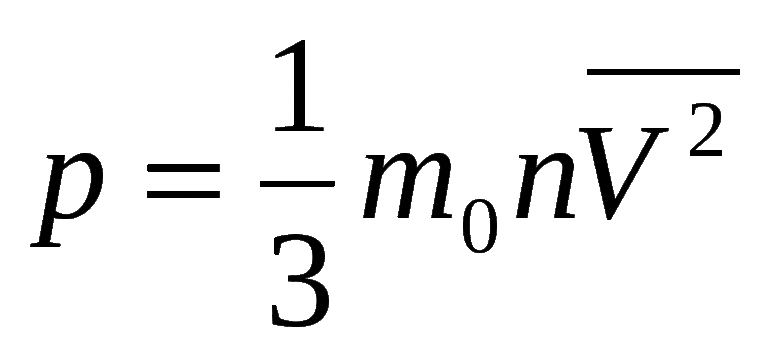Что такое парциальное давление газа в смеси
Парциальное давление
Из Википедии — свободной энциклопедии
Прибор Рамзая для обнаружения парциального давления.
Во внутреннем сосуде Р из палладия находится смесь азота и водорода под общим давлением в 1 атм. Сосуд Р соединён с дифференциальным манометром и помещён в сосуд большего размера. При высоких температурах водород легко диффундирует через палладиевую оболочку, и стенки сосуда Р становятся полупроницаемыми — они проницаемы для водорода, но непроницаемы для азота. Пропуская нагретый водород с давлением в 1 атм через больший сосуд, исследователь обнаружит, что давление смеси газов в сосуде Р превысит 1 атм на величину парциального давления азота при данной температуре.
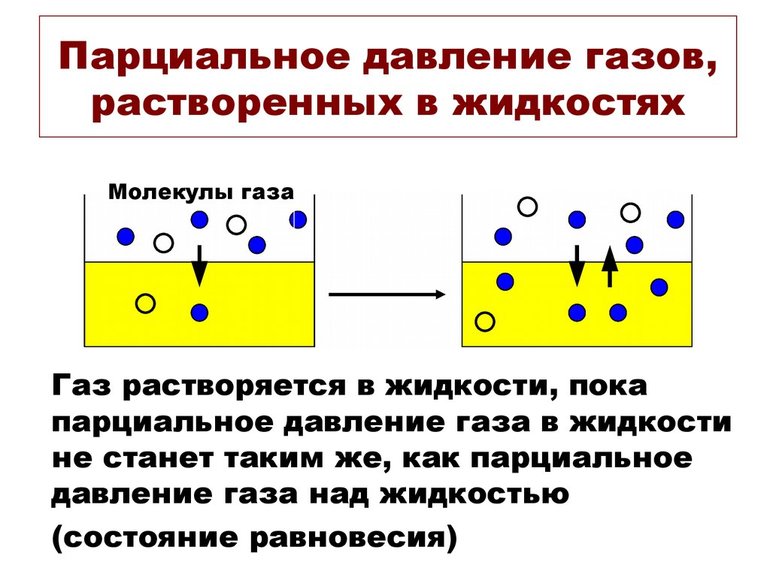
В химии парциальное давление газа в смеси газов определяется как указано выше. Парциальное давление газа, растворённого в жидкости, является парциальным давлением того газа, который образовался бы в фазе газообразования в состоянии равновесия с жидкостью при той же температуре. Парциальное давление газа измеряется как термодинамическая активность молекул газа. Газы всегда будут вытекать из области с высоким парциальным давлением в область с более низким давлением; и чем больше разница, тем быстрее будет поток. Газы растворяются, диффундируют и реагируют соответственно их парциальному давлению и не обязательно зависимы от концентрации в газовой смеси.
Парциальное давление и объем
Когда мы имеем дело со смесями газов, важно знать, что они имеют такие характеристики, как парциальный объем и парциальное давление. Для начала определим, что такое смесь идеальных газов.
Смесь идеальных газов – это смесь нескольких газообразных веществ, которые при заданных условиях не будут вступать в определенные химические реакции.
Понятие парциального давления
Парциальное давление – это особая характеристика, описывающая состояние компонентов смеси идеальных газов. Сформулируем основное определение:
Формула парциального давления будет выглядеть так:
p i = m i μ i R T V = μ i R T V
Следует подчеркнуть, что поскольку средние кинетические энергии молекул смеси равны, то существует и равенство температур всех компонентов газовой смеси, находящейся в состоянии термодинамического равновесия.
Для нахождения давления смеси идеальных газов нужно воспользоваться законом Дальтона в следующей формулировке:
p = ∑ i = 1 N p i = R T V ∑ i = 1 N ν i
Исходя из него, мы можем выразить парциальное давление так:
Понятие парциального объема
У газовой смеси также есть такая характеристика, как парциальный объем.
Парциальный объем V i i -газа в газовой смеси – это такой объем, который мог бы иметь газ при условии отсутствия всех остальных газов и сохранении исходной температуры и объема.
Если речь идет о смеси идеальных газов, то к ней применим закон Амага:
В самом деле, при выражении ν i из формулы выше у нас получится следующее:
ν i = p V i R T ; p = R T V p R T ∑ i = 1 N V i → V = ∑ i = 1 N V i
Для расчета парциального объема газа используется следующая формула:
Нам известно, что параметры, определяющие состояние смеси идеальных газов, будут подчиняться уравнению Менделеева-Клайперона. Формула будет выглядеть так:
Все параметры данного уравнения будут относиться ко всей смеси. Это же уравнение удобнее записать так:
Здесь параметры R s m = R μ s m = R ∑ i = 1 N q i μ i означают удельную газовую постоянную смеси.
Начнем с вычисления количества молей каждого компонента смеси. Для этого можно использовать формулу:
ν H 2 = m H 2 μ H 2
Считаем, что получится:
Теперь с помощью уравнения Менделеева-Клайперона можно найти парциальное давление каждого компонента:
Сначала рассчитаем давление водорода:
p H 2 V = ν H 2 R T → p H 2 = ν H 2 R T V
Парциальное давление будет равно:
Теперь то же самое подсчитываем для гелия:
Чтобы найти общее давление смеси газов, сложим сумму давлений ее составляющих:
Подставляем полученные ранее значения и находим нужный результат:
Начнем с вычисления общей массы газовой смеси.
Переходим к вычислению массовых компонентов смеси:
Тогда газовая постоянная смеси будет равна:
R s m = R ∑ i = 1 N g i μ i
Объем смеси вычисляем с помощью уравнения Менделеева-Клайперона:
V s m = m s m R s m T s m p s m
Трактовка закона
Учёный Дальтон в 1801 году сформировал закон парциальных давлений: Па смеси из идеальных газов равняется сумме рi её компонентов. Уравнение имеет следующий вид: Рсм=n (сумма pi), где n — число долей смеси.
Для определения парциального давления в химии используется отдельный компонент из атмосферного воздуха. При расчете учитывается значение каждого отдельного вещества, их число, температуры с объёмами. При необходимости можно найти общий показатель, сложив давление каждого компонента в отдельности.
Каждый газ в сосуде должен обозначаться как «идеальный». При нормальных условиях они взаимодействуют с углекислым газом, водородом, водой, азотом, водяным паром, кислородом, компонентами крови и прочими компонентами из таблицы Менделеева. При этом не образуются соединения. Отдельные молекулы способны сталкиваться между собой, отталкиваясь, но не деформируясь.
Физические и химические задачи решаются с помощью формулы парциального давления (закон открыли учёные Бойль и Мариотт): (k = P x V). Кроме полного варианта, уравнение записывается сокращённо k = PV, где:
Второстепенные значения
Давление может измеряться в разных величинах: процент, паскаль (Па). Смысл последнего: сила в 1 ньютон приложена к площади в 1 кв. м. Если результат такой зависимости записывается в атмосферах, тогда для его нахождения потребуется учесть, что одна атмосфера равняется 101,325 Па.
Температура идеального газа повышается, если увеличивается объём, а снижается, если уменьшается последний показатель. Такое соотношение может называться законом Чарльза, который имеет следующий математический вид: k = V / T. Значение температуры в уравнении измеряется в градусах Кельвина. Оно зависит от градусов Цельсия. Чтобы его найти, прибавляется 273.
Уравнение используется в химии для определения мольной доли (концентрация, которая выражается через отношение количества молей 1 компонента к суммарному числу молей пары веществ, входящих в смесь). Кроме объёма, для газа характерна молярная масса (вес одной доли компонента) и объём. Существуют легкие способы её подсчёта:
Уравнения Дальтона и Бойля
Физик и химик Дальтон считается первым учёным, предположившим структуру атомных элементов, их свойства. Общее давление вычисляется следующим образом: Р= P1 + P2 + P3. Пример: в колбе содержится по 10 г оксигена и нитрогена. Их общее Р будет равно 20 (10+10). Для вычисления pi используется температура, равная 37 градусам Цельсия.
Чтобы перевести её в градусы Кельвина, значение по Цельсию, равное 37, добавляется к 273. Результат — 310. Для вычисления количества молей газов используется масса, поделённая на молярную. Если уравнение касается нитрогена, вес каждого компонента соответствует цифре 14.
Так как вещество содержит в себе 2 атома, то 14х2, что равно 28. Масса в граммах делится на полученный результат. Таким способом вычисляется количество молей, приблизительно равное 0,4 моль. Чтобы найти аналогичное значение у оксигена, применяется масса 16. Вещество относится к двухатомным газам, поэтому 16х2 равняется 32. По результатам получается, что 0,3 моль оксигена содержится в составе газовой смеси.
Если в задаче указывается общее давление и pi в атмосферах, тогда используется в качестве константы R (0.0821 л атм/K моль). При подстановке данных в уравнение можно узнать Pобщее. Чтобы вычислить ПД нитрогена, 0,4 моль умножается на константу и температуру. Результат делится на 2 литра, что приблизительно равно 5.09 атм. Аналогичные шаги выполняются для вычисления ПД оксигена. Конечный результат равен 3.82 атм.
Свойства веществ
Значение pi газа, растворённого в жидкости, равняется pi того вещества, который образовался бы в фазе газообразования в случае равновесия с жидкостью при аналогичной температуре. Парциальное давление (ПД) измеряется в качестве термодинамической активности молекул вещества.
Газы постоянно вытекают из сферы с высоким ПД в область с низким давлением. Чем больше такая разница, тем быстрее поток. Газам свойственно растворяться, диффундировать, реагировать на ПД. В некоторых случаях показатель не зависит от концентрации газовой смеси.
При решении задач в области химии и физики учитываются свойства газов: сжимаемость и способность расширяться. Они не имеют своей формы, поэтому расширяются до заполнения сосуда, принимая его форму. По аналогичной причине они не имеют объёма. Газ давит на стенки ёмкости по всем направлениям одинаково. Характерное свойство компонентов — способность смешиваться между собой в разных соотношениях.
Так как объём зависит от температуры и давления, поэтому в норме должно быть 0 °C и 760 мм рт. ст. При этом нет места влаги. Если объём считается нормальным, его обозначают стоящей впереди буквой. Подобная зависимость отображается в термодинамике с помощью графика. Если доказана зависимость объема от давления, при этом температура постоянная, используются изотермы (линии, которые изображают на диаграмме процесс с неизменной температурой).
Точки и функции
В законе Бойля чётко указана зависимость объёма от давления при одинаковой температуре. Если данные нанести на график в функцию давления, через точки можно будет провести кривую. Точный эксперимент и незначительный разброс точек позволяют описать объёмное поведение системы с небольшой погрешностью.
Несколько подобных кривых для разных температур во всём диапазоне изученных условий позволяет описать объёмное поведение газа. Одновременно отображаются кривые постоянного давления, которые описывают изменения основных показателей. Чтобы получить окончательные результаты, кривые требуют незначительного сглаживания. Подобные графики сделать самостоятельно менее сложно.
Объём газа при неизменной температуре сильно изменяется с колебаниями давления. Но графически представить такую зависимость в широком диапазоне изменения давлений трудно. Если охвачена широкая область изменения, используются крупные масштабы.
Для упрощения процесса построения на график наносится зависимость произведения Р от давления при одной температуре, что существенно уменьшает область выявления функции. Наибольший эффект получается от применения 1−2 специальных функций объёма, которые называются коэффициентом сжимаемости и остаточным объёмом.
Каждое понятие характеризуется объёмным поведением газа с учётом его отклонений от нормального состояния вещества и созданных идеальных условий. Чтобы упростить поставленную задачу, график отображается на специальной бумаге либо при помощи компьютерных программ. Во втором случае достаточно ввести данные. Сервис самостоятельно строит прямые, кривые и прочие элементы графика.
Простые зависимости лучше отображать в стандартных программах Word. Графические сложные задачи в химии и физике решаются с помощью «Agrafer» — известная компьютерная программа, которая используется не только студентами, но и школьниками.
зМБЧБ 1. пУОПЧОЩЕ ЪБЛПОЩ ИЙНЙЙ

1.2 зБЪПЧЩЕ ЪБЛПОЩ ИЙНЙЙ
1.2.1 ъБЛПО бЧПЗБДТП Й УМЕДУФЧЙЕ ЙЪ ОЕЗП
уТЕДЙ ЧЕЭЕУФЧ У ТБЪМЙЮОЩН БЗТЕЗБФОЩН УПУФПСОЙЕН ОЕПВИПДЙНП ЧЩДЕМЙФШ ЗБЪЩ, ЛПФПТЩЕ ЙЗТБАФ ПЗТПНОХА ТПМШ ОЕ ФПМШЛП Ч ОБЫЕК ЦЙЪОЙ, ОП Ч ТБЪМЙЮОЩИ ФЕИОПМПЗЙЮЕУЛЙИ РТПГЕУУБИ. оЕПВИПДЙНП РПНОЙФШ, ЮФП ДМС ЛПМЙЮЕУФЧЕООПК ИБТБЛФЕТЙУФЙЛЙ МАВПЗП ЗБЪБ ЙУРПМШЪХАФ ДБЧМЕОЙЕ, ФЕНРЕТБФХТХ Й ЪБОЙНБЕНЩК ПВЯЕН. оБЙВПМЕЕ ЮБУФП РТЙНЕОСАФ ФБЛ ОБЪЩЧБЕНЩЕ ОПТНБМШОЩЕ ХУМПЧЙС (О.Х.), ЛПФПТЩЕ УППФЧЕФУФЧХАФ ДБЧМЕОЙА т=10 5 рБ Й ФЕНРЕТБФХТЕ ф=273 л.
уПЗМБУОП ЪБЛПОХ бЧПЗБДТП: ПДЙОБЛПЧЩЕ ПВЯЕНЩ ТБЪМЙЮОЩИ ЗБЪПЧ РТЙ ПДЙОБЛПЧЩИ ХУМПЧЙСИ (ДБЧМЕОЙЙ Й ФЕНРЕТБФХТЕ) УПДЕТЦБФ ПДЙОБЛПЧПЕ ЮЙУМП НПМЕЛХМ.
вПМШЫПЕ РТБЛФЙЮЕУЛПЕ ЪОБЮЕОЙЕ ЙНЕЕФ УМЕДУФЧЙЕ ЙЪ ЪБЛПОБ бЧПЗБДТП: РТЙ ОПТНБМШОЩИ ХУМПЧЙСИ (О.Х.) ПДЙО НПМШ МАВПЗП ЗБЪБ ЪБОЙНБЕФ ПВЯЕН, ТБЧОЩК 22,4 М.
пВЯЕН 22,4 М ОБЪЩЧБАФ НПМСТОЩН (НПМШОЩН) ПВЯЕНПН ЗБЪБ Й ПВПЪОБЮБАФ УППФЧЕФУФЧЕООП VM = 22,4 М/НПМШ.
рТЙНЕТ: ХЗМЕЛЙУМЩК ЗБЪ CO2. йНЕЕН н(CO2) = 44 З/НПМШ. ъОБЮЙФ, ПДЙО НПМШ CO2 ЙНЕЕФ НБУУХ 44 З Й ЪБОЙНБЕФ ПВЯЕН (РТЙ О.Х.), ТБЧОЩК 22,4 М, Б ФБЛЦЕ УПДЕТЦЙФ Ч ЬФПН ПВЯЕНЕ 6,02·10 23 НПМЕЛХМ ЗБЪБ.
оЕФТХДОП РПЛБЪБФШ, ЮФП УЧСЪШ НЕЦДХ НБУУПК m Й ПВЯЕНПН V ЛПОЛТЕФОПЗП ЗБЪБ РТЙ О.Х. ПРТЕДЕМСЕФУС ЖПТНХМПК:
 | (1.3) |
еУМЙ ХУМПЧЙС, Ч ЛПФПТЩИ ОБИПДЙФУС ЗБЪ ПФМЙЮБЕФУС ПФ ОПТНБМШОЩИ, ФП ЙУРПМШЪХАФ ХТБЧОЕОЙЕ нЕОДЕМЕЕЧБ-лМБРЕКТПОБ, ЛПФПТПЕ УЧСЪЩЧБЕФ ЧУЕ ПУОПЧОЩЕ РБТБНЕФТЩ ЙДЕБМШОПЗП ЗБЪБ:
 | (1.4) |
1.2.2 ъБЛПО дБМШФПОБ
еУМЙ НЩ ЧЕТОЕНУС Л ХТБЧОЕОЙА ИЙНЙЮЕУЛПК ТЕБЛГЙЙ, ТБУУНБФТЙЧБЕНПК Ч ТБЪДЕМЕ 1.1.1, ФП, У ХЮЕФПН НПМСТОЩИ ПВЯЕНПЧ ЗБЪПЧ, ЕЗП НПЦОП РТЕДУФБЧЙФШ Ч УМЕДХАЭЕН ЧЙДЕ
йЪ РТЙЧЕДЕООПЗП РТЙНЕТБ ЧЙДОП, ЮФП НБУУЩ ЗБЪПЧ ЪБНЕОЕОЩ ОБ НПМШОЩЕ ПВЯЕНЩ. пФУАДБ УМЕДХЕФ ЖПТНХМЙТПЧЛБ ЪБЛПОБ дБМШФПОБ: ПВЯЕНЩ ТЕБЗЙТХАЭЙИ ЗБЪПЧ Й РТПДХЛФПЧ ЙИ ТЕБЛГЙК ПФОПУСФУС ДТХЗ Л ДТХЗХ ЛБЛ ОЕВПМШЫЙЕ ГЕМЩЕ ЮЙУМБ (ЛПЬЖЖЙГЙЕОФЩ ХТБЧОЕОЙС ТЕБЛГЙЙ).
1.2.3 ъБЛПО РБТГЙБМШОЩИ ДБЧМЕОЙК
оБ РТБЛФЙЛЕ ЮБУФП РТЙИПДЙФУС ЧУФТЕЮБФШУС УП УНЕУША ТБЪМЙЮОЩИ ЗБЪПЧ (ОБРТЙНЕТ, ЧПЪДХИ), ч ЬФПН УМХЮБЕ ОЕПВИПДЙНП РТЙНЕОСФШ ЧЩЫЕТБУУНПФТЕООЩЕ ЗБЪПЧЩЕ ЪБЛПОЩ ДМС ЛБЦДПЗП ЗБЪБ Ч ПФДЕМШОПУФЙ Й ЪБФЕН УХННЙТПЧБФШ РПМХЮЕООЩЕ ЧЕМЙЮЙОЩ. рТЙ ЬФПН РПМШЪХАФУС ФБЛЦЕ ЪБЛПОПН РБТГЙБМШОЩИ ДБЧМЕОЙК: ПВЭЕЕ ДБЧМЕОЙЕ ЗБЪПЧПК УНЕУЙ ТБЧОП УХННЕ РБТГЙБМШОЩИ ДБЧМЕОЙК ПФДЕМШОЩИ ЗБЪПЧ, УПУФБЧМСАЭЙИ ДБООХА УНЕУШ, ФП ЕУФШ
пРТЕДЕМЙН У РПНПЭША ХТБЧОЕОЙС нЕОДЕМЕЕЧБ-лМБРЕКТПОБ РБТГЙБМШОЩЕ ДБЧМЕОЙС ЛБЦДПЗП ЙЪ ЗБЪПЧ, УПУФБЧМСАЭЙИ ДБООХА ЗБЪПЧХА УНЕУШ:
т(о2) = (m/M)RT/V = (4З/2З/НПМШ)·8,31·273л/0,0112Н Ъ = 4·105 рБ,
т(уп) = (14З/28З/НПМШ)·8,31·273л/0,0112Н Ъ = 10 5 рБ,
т(N2) = (56З/28З/НПМШ)·8,31·273л/0,0112Н Ъ = 4·10 5 рБ.
пВЭЕЕ ДБЧМЕОЙЕ ЗБЪПЧПК УНЕУЙ ТБЧОП:
чЕМЙЮЙОБ РБТГЙБМШОПЗП ДБЧМЕОЙС ПРТЕДЕМСЕФУС ОЕУЛПМШЛЙНЙ УРПУПВБНЙ, ОП ОБЙВПМЕЕ ЮБУФП ЧУФТЕЮБАЭЙКУС РТБЛФЙЮЕУЛЙ УРПУПВ ПУОПЧБО ОБ ЙУРПМШЪПЧБОЙЙ ЖПТНХМЩ
 | (1.6) |
рТЙНЕТ: ПРТЕДЕМЙФШ НБУУХ ЛЙУМПТПДБ п2, УПДЕТЦБЭЕЗПУС Ч 1 Н Ъ ЧПЪДХИБ РТЙ ОПТНБМШОЩИ ХУМПЧЙСИ, ЕУМЙ РТПГЕОФОПЕ УПДЕТЦБОЙЕ ЛЙУМПТПДБ Ч ЧПЪДХИЕ УПУФБЧМСЕФ 21ПВ.%
рБТГЙБМШОПЕ ДБЧМЕОЙЕ п2 Ч ЧПЪДХИЕ ПРТЕДЕМСЕН РП ЖПТНХМЕ
т(п2) = 10 5 рБ·21%/100% = 0,21·10 5 рБ
пФУАДБ, УПЗМБУОП ХТБЧОЕОЙС нЕОДЕМЕЕЧБ-лМБРЕКТПОБ
m(O2) = PVM/RT = (0,21·10 5 рБ·1Н Ъ ·32З/НПМШ)/8,31·273л = 297 З
тБУУНПФТЙН ЧПЪНПЦОПУФШ ХЮЕФБ ЙЪНЕОЕОЙС ПВЯЕНБ ЙМЙ ДБЧМЕОЙС РТЙ РТПФЕЛБОЙЙ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ, Ч ЛПФПТПК ХЮБУФЧХАФ ЙМЙ ПВТБЪХАФУС ЗБЪППВТБЪОЩЕ РТПДХЛФЩ. дМС ХЮЕФБ ЬФПЗП ОЕПВИПДЙНП ЧУРПНОЙФШ, ЮФП ЛПЬЖЖЙГЙЕОФЩ Ч ХТБЧОЕОЙЙ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ РТСНП РТПРПТГЙПОБМШОЩ ЮЙУМХ НПМЕК ТЕБЗЙТХАЭЙИ Й ПВТБЪХАЭЙИУС ЧЕЭЕУФЧ. рТЙНЕОЙФЕМШОП Л ЗБЪБН ОЕПВИПДЙНП ХЮЕУФШ ФБЛЦЕ, ЮФП:
фБЛЙН ПВТБЪПН, УТБЧОЙЧБС ЛПЬЖЖЙГЙЕОФЩ ЙУИПДОЩИ ЧЕЭЕУФЧ Й РТПДХЛФПЧ ТЕБЛГЙЙ, НПЦОП УДЕМБФШ ЧЩЧПД ПВ ЙЪНЕОЕОЙЙ ПВЯЕНБ (ДБЧМЕОЙС) Ч ИПДЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ.
оБРТЙНЕТ, Ч ИЙНЙЮЕУЛПК ТЕБЛГЙЙ
ЧУЕ ЧЕЭЕУФЧБ СЧМСАФУС ЗБЪБНЙ, чЙДОП, ЮФП ДП ТЕБЛГЙЙ ЙНЕМПУШ 3 НПМС ЗБЪБ (2 НПМС уп Й 1 НПМШ п2), Б РПУМЕ ТЕБЛГЙЙ ПУФБМПУШ 2 НПМС уп2. сУОП, ЮФП ПВЯЕН 3 НПМЕК ЗБЪБ (22,4·3=67,2М) ВПМШЫЕ ПВЯЕНБ 2 НПМЕК (22,4·2=44,8М), ФП ЕУФШ VОБЮ> VЛПО. ъОБЮЙФ, ДБООБС ТЕБЛГЙС РТПФЕЛБЕФ МЙВП У ХНЕОШЫЕОЙЕН ПВЯЕНБ (ЙЪПВБТОЩК РТПГЕУУ), МЙВП У ХНЕОШЫЕОЙЕ ДБЧМЕОЙС (ЙЪПИПТОЩК РТПГЕУУ).
ч УМХЮБЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ
ЙНЕЕН ЗБЪППВТБЪОЩЕ ЧЕЭЕУФЧБ уп2 Й уп Й ФЧЕТДПЕ ЧЕЭЕУФЧП у. уТБЧОЙЧБЕН ЛПЬЖЖЙГЙЕОФЩ ФПМШЛП ДМС ЗБЪППВТБЪОЩИ ЧЕЭЕУФЧ Й ЙНЕЕН ДМС ЙУИПДОЩИ ЧЕЭЕУФЧ 1 Й ЛПОЕЮОЩИ ЧЕЭЕУФЧ 2. фБЛ ЛБЛ 1 

Парциальное давление
В химии парциальное давление газа в смеси газов определяется как указано выше. Парциальное давление газа, растворённого в жидкости, является парциальным давлением того газа, который образовался бы в фазе газообразования в состоянии равновесия с жидкостью при той же температуре. Парциальное давление газа измеряется как термодинамическая активность молекул газа. Газы всегда будут вытекать из области с высоким парциальным давлением в область с более низким давлением; и чем больше разница, тем быстрее будет поток. Газы растворяются, диффундируют и реагируют соответственно их парциальному давлению и не обязательно зависимы от концентрации в газовой смеси.
Содержание
Законы Дальтона парциального давления





Смеси идеальных газов
Мольная доля отдельных компонентов газа в идеальной газовой смеси может быть выражена в пределах парциальных давлений компонентов или молей компонентов:
и парциальное давление отдельных компонентов газов в идеальном газе может быть получено используя следующее выражение:






Мольная доля компонентов газа в газовой смеси равна объёмной доле этого компонента в газовой смеси. [4]
См. также
Примечания
Полезное
Смотреть что такое «Парциальное давление» в других словарях:
ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ — (от позднелат. partialis частичный), давление, к рое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же темп ре. Общее давление смеси газов равно сумме П. д. отд. составляющих смеси (см.… … Физическая энциклопедия
ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ — давление каждого (см.) или (см.) в смеси нескольких газов, которое данный газ или пар имел бы, если бы он один занимал весь объём смеси, находясь при ее температуре. Общее давление смеси равно сумме П. д. всех ее составляющих. П. д. используют в… … Большая политехническая энциклопедия
ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ — (от позднелат. partialis частичный) давление компонента идеальной газовой смеси, которое он оказывал бы, если бы один занимал объем всей смеси (см. Дальтона законы) … Большой Энциклопедический словарь
парциальное давление — Давление газа, входящего в состав газовой смеси, к рое он оказывал бы, занимая один весь объем смеси при той же темп ре. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN partial pressure … Справочник технического переводчика
Парциальное давление — см. Давление … Российская энциклопедия по охране труда
парциальное давление — 3.7 парциальное давление (partial pressure): Давление, создаваемое одним компонентом газовой смеси при той же температуре и в том же объеме, который занимает смесь. Примечание В смеси идеальных газов парциальное давление каждого компонента равно… … Словарь-справочник терминов нормативно-технической документации
парциальное давление — (от позднелат. partialis частичный), давление компонента идеальной газовой смеси, которое он оказывал бы, если бы один занимал объём всей смеси (см. Дальтона законы). * * * ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ (от позднелат. partialis… … Энциклопедический словарь
парциальное давление — dalinis slėgis statusas T sritis Standartizacija ir metrologija apibrėžtis Dujų mišinio vieno sando slėgis, kurį turėtų tas sandas, jei vienas užimtų visą mišinio tūrį. Idealiųjų dujų dalinis slėgis p₁ = N₁ · p; čia N₁ – sando molinė dalis, p –… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
парциальное давление — dalinis slėgis statusas T sritis Standartizacija ir metrologija apibrėžtis Dujų mišinio vieno sando slėgis. atitikmenys: angl. partial pressure vok. Partialdruck, m; Teildruck, m rus. парциальное давление, n pranc. pression partielle, f … Penkiakalbis aiškinamasis metrologijos terminų žodynas
парциальное давление — dalinis slėgis statusas T sritis chemija apibrėžtis Dujų mišinio vieno komponento slėgis. atitikmenys: angl. partial pressure rus. парциальное давление … Chemijos terminų aiškinamasis žodynas