что такое фигуры митозов
Что такое фигуры митозов
В морфологической характеристике опухолевых клеток большую роль играют исследования митотического режима. Исчерпывающие сведения о митотическом режиме в нормальных клетках можно найти в фундаментальных работах И. А. Алова, а о митотическом режиме в опухолевых клетках—в работах И. А. Алова и И. А. Казанцевой.
Накопленные факты позволили определить следующие основные направления возможного использования исследования митотического режима в опухолях: 1) ранняя диагностика рака; 2) дифференциальная диагностика доброкачественных и злокачественных опухолей сходного гистогенеза; 3) разработка методов прогнозирования малигнизации предопухолевых процессов, 4) дифференциальная диагностика опухолей разного гистогенеза и уточнение гистогенетнческой принадлежности новообразования (первичного н метастатического), 5) оценка степени терапевтического повреждения опухоли.
Суммируя материалы, полученные И. А. Казанцевой, можно следующим образом охарактеризовать особенности митотического режима при гиперпластических и диспластических процессах и в опухолевых клетках.
Для многих нормальных эпителиальных тканей характерны умеренная митотическая активность, которая, однако, значительно выше в быстро обновляющихся тканях; примерно одинаковое количество клеток в стадии профазы и метафазы с преобладанием иногда первой; невысокая частота патологических митозов.
При фоновых процессах (умеренная дисплазня эпителия гортани и шейки матки, эпидермизация псевдоэрозий шейки матки, простая железисто-кистозная гиперплазия эндометрия и др. ) отмечают некоторое увеличение митотической активности, небольшое преобладание клеток в стадии метафазы, повышение количества патологических митозов, среди которых около 90% составляют колхициноподобные метафазы и отставание хромосом в метафазе.
При гиперпластических и диспластических процессах, которые могут рассматриваться как предраковые (тяжелая дисплазня шейки эпителия матки, атипическая гиперплазия эпителия гортани и др ), а также при некоторых доброкачественных опухолях может наблюдаться дальнейшее нарастание нарушений митотического режима, связанных с преобладанием метафаз, учащением числа патологических митозов и их разнообразие с появлением разновидностей, ведущих к анеуплоидин, расширение зоны, где встречаются делящиеся клетки.
Для клеток злокачественных опухолей характерно преобладание метафаз над другими стадиями митоза, резкое возрастание частоты патологических митозов, различная степень повышения митотической активности, нередко незначительная. Существуют опухоли, в которых митотическая активность ниже, чем в нормальных тканях. Мнение, что во всех опухолях клетки делятся чаше, чем в норме, неверно.
Нет, по-видимому, и прямой связи между митотической активностью и быстротой роста опухоли.
Обнаружение соответствующих нарушений митотического режима может быть дополнительным ранним диагностическим признаком наступившей малигнизации или иметь прогностическое значение при оценке предопухолевых процессов чем резче выражены нарушения митотического режима, тем неблагоприятнее прогноз.
Не исключено, что, возможно, имеют место некоторые различия в характере нарушения митотического режима в опухолях разного гистогенеза.
На основании изучения митотического режима может быть получена полезная информация для оценки степени повреждения опухолевых клеток при лучевом или лекарственном лечении новообразований. Например, снижение митотического индекса и нарастание так называемых комковатых митозов, являющихся разновидностью К-митозов и ведущих клетку к гибели, может служить одним из критериев терапевтического эффекта.
Исследование закономерностей митотического режима в новообразованиях имеет решающее значение для понимания механизмов, определяющих книети ку популяции опухолевых клеток, которая по многим параметрам оказывается весьма гетерогенной. Если рассматривать популяцию опухолевых клеток с точки зрения их деления, то следует отметить, что вышедшие из митотического цикла опухолевые клетки могут или вступить на путь диффереицировки, или вновь вступить в митоз и продолжать пролиферировать, или остаться в покоящемся состоянии. Таким образом, в популяции имеется 3 группы клеток, нахо дящихся во взаимосвязи друг с другом недифференцированные покоящиеся клетки, недифференцированные пролиферирующие клетки и дифференцирующиеся, но уже не пролифернрующие клетки.
Покоящиеся опухолевые клетки, как было показано О. И. Епифановой и соавт., сохраняют жизнеспособность и пролиферативный потенциал, они резистентны к химиотерапевтическим препаратам (цитостатикам, алкилирующим соединениям, антибиотикам), митотическим ингибиторам Сохраняя способность при каких-то условиях вновь вступать в митоз, эти клетки являются источником рецидивов, что делает их изучение крайне важным. Хотя существуют сведения о том, что в покоящихся опухолевых клетках ниже проницаемость плазматической мембраны, более резко конденсирован хроматин, возможно, в ДНК имеются участки, более прочно связанные с белком, повы шено обновление молекул, однако их практическая идентификация в опухоли пока еще невозможна, так как мы не знаем их особенностей нх обмена, ни их морфологических, гистохимических или ультраструктурных особенностей, ко торые позволили бы отличить их от других недифференцированных опухолевых клеток.
В связи с тем что недифференцированные пролиферирующие опухолевые клетки чувствительны к лучевому и химнотерапевтическому лечению, делают попытки перевести покоящиеся клетки в группу пролиферирующих путем гормональных воздействий или иных мероприятий.
Катаплазия на светооптическом уровне касается не только морфологии опухолевых клеток (их фенотипа), но еще в большей степени их морфогенетических потенций, что выражается в нарушении обычной тканевой и органной структуры новообразований. Органная и тканевая катаплазия, являющаяся, так же как инвазивный рост и метастазирование, наиболее характерным морфологическим признаком опухолевого роста, наряду с клеточной катаплазией составляют ту сумму признаков, которые позволяют на светооптическом уровне идентифицировать опухоль во всем многообразии ее строения.
Классические гистологические методы поэтому были и остаются основой морфологической диагностики новообразований человека, однако использование только их не дает возможности решать встающие перед онкологией новые задачи. Расширить методические возможности морфологической верификации новообразований можно с помощью таких современных способов исследования, как электронная микроскопия, гистохимия, иммуногистохимия. Анализ ультраструктурных, гистохимических, иммуногистохимических и биологических особенностей опухолевых клеток главным образом в плане диагностики и установления гистогенеза новообразований человека дан в последующих трех разделах.
Митоз и мейоз
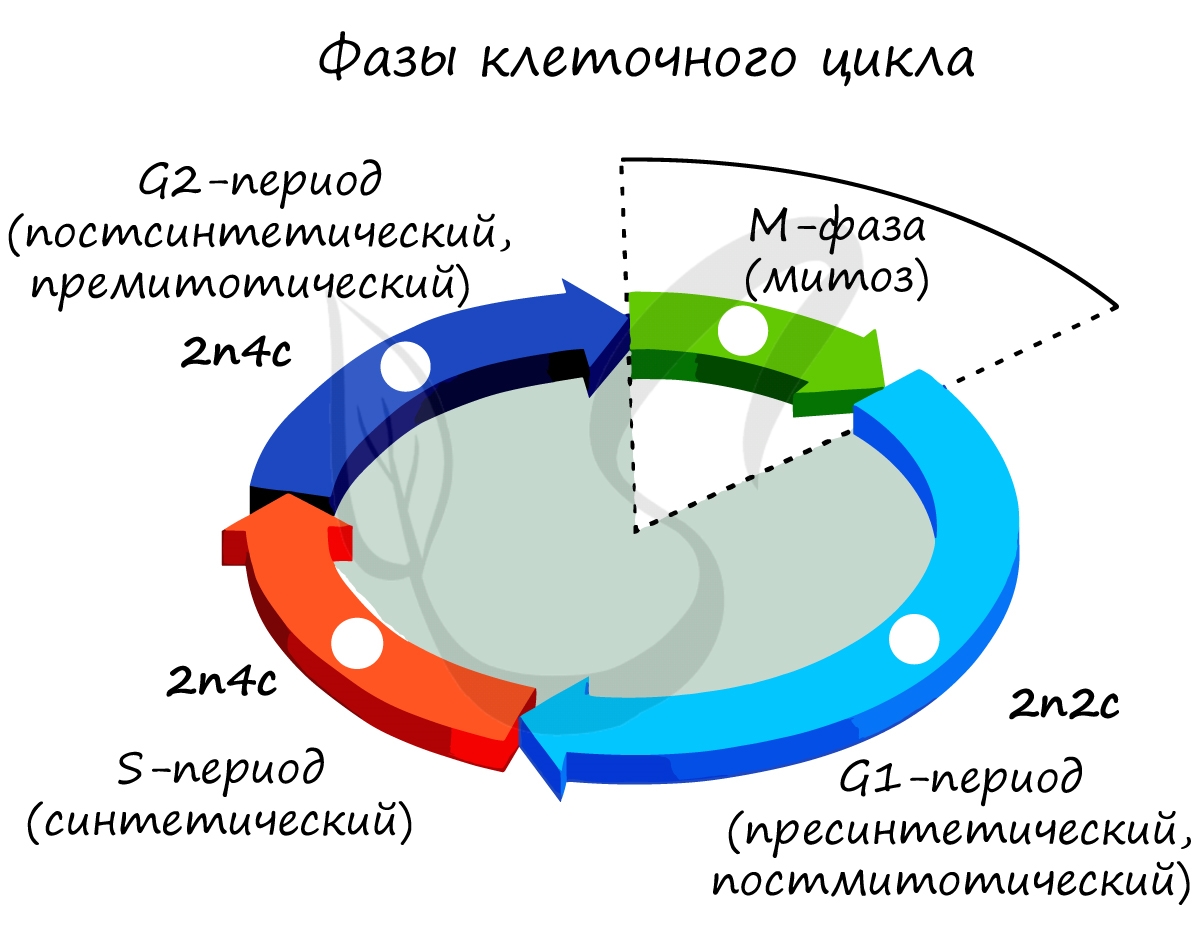
Жизненный цикл клетки (клеточный цикл)
С момента появления клетки и до ее смерти в результате апоптоза (программируемой клеточной гибели) непрерывно продолжается жизненный цикл клетки.
Интенсивно образуются рибосомы, синтезируется АТФ и все виды РНК, ферменты, клетка растет.
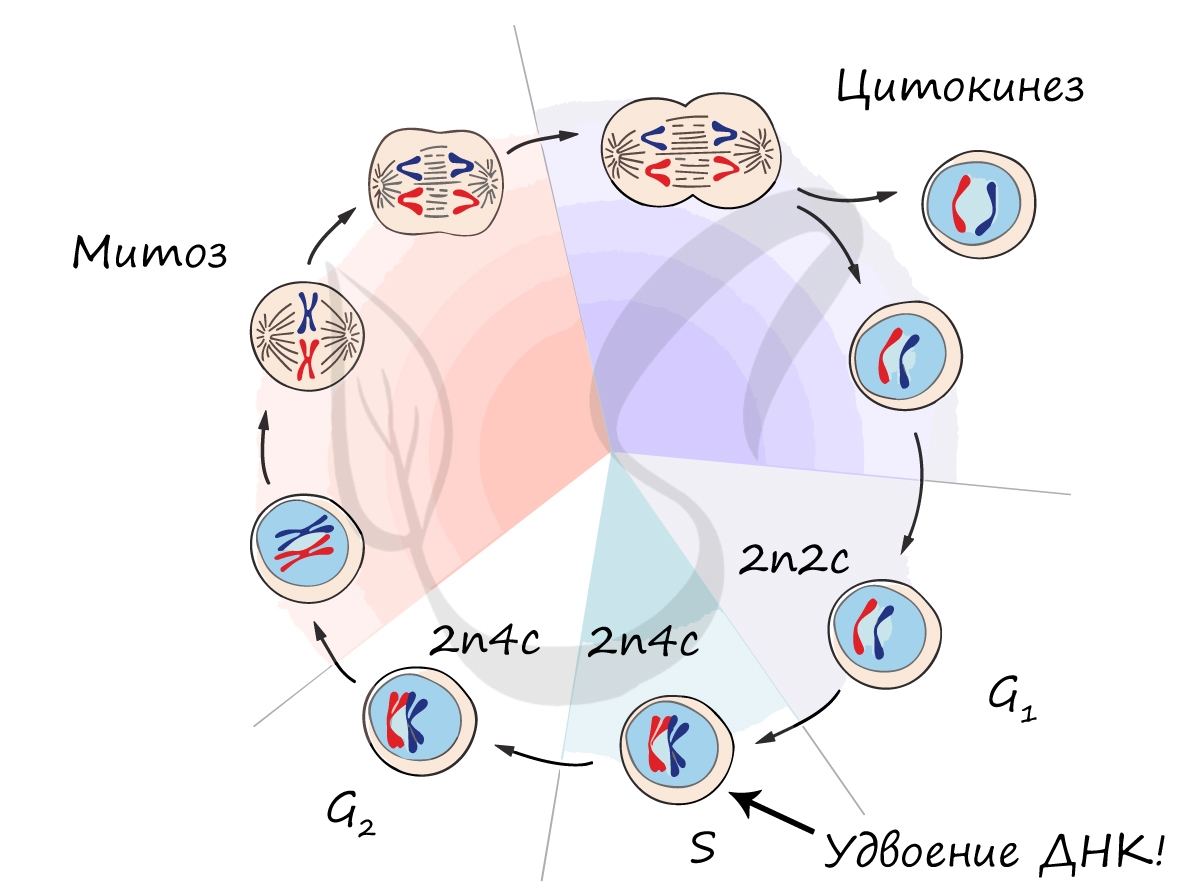
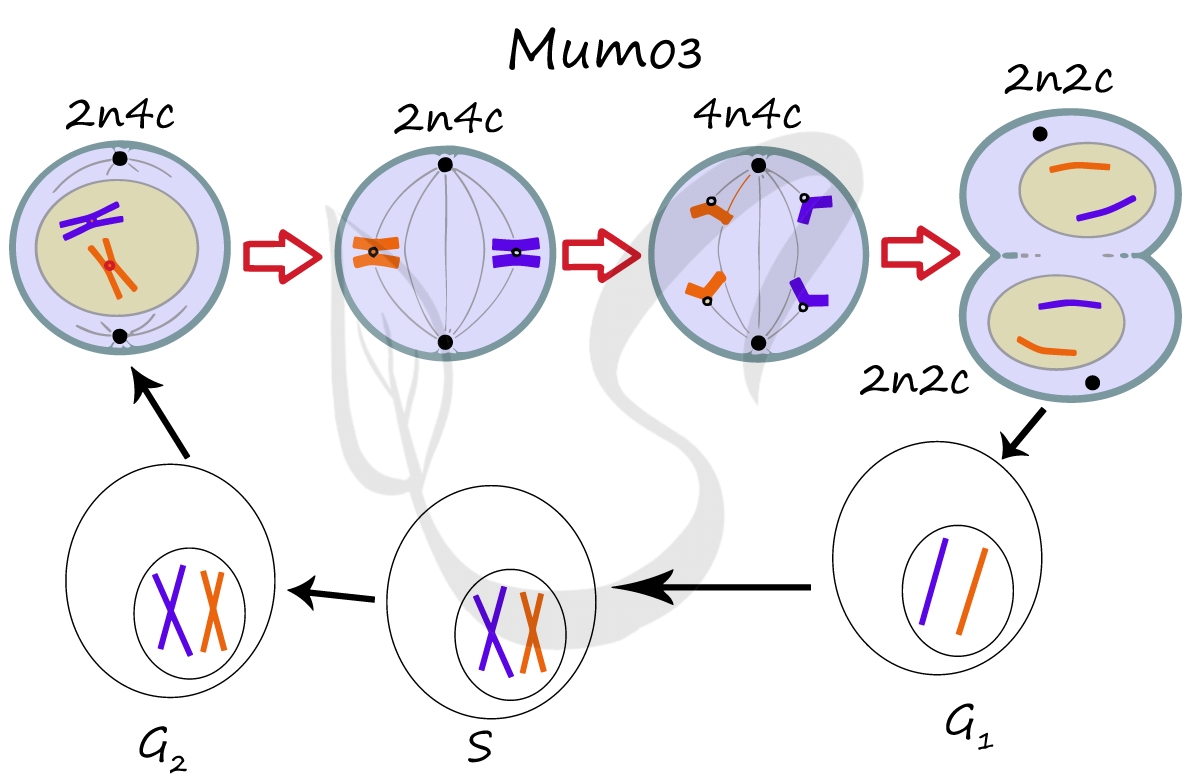
Митоз является непрямым способом деления клетки, наиболее распространенным среди эукариотических организмов. По продолжительности занимает около 1 часа. К митозу клетка готовится в период интерфазы путем синтеза белков, АТФ и удвоения молекулы ДНК в синтетическом периоде.
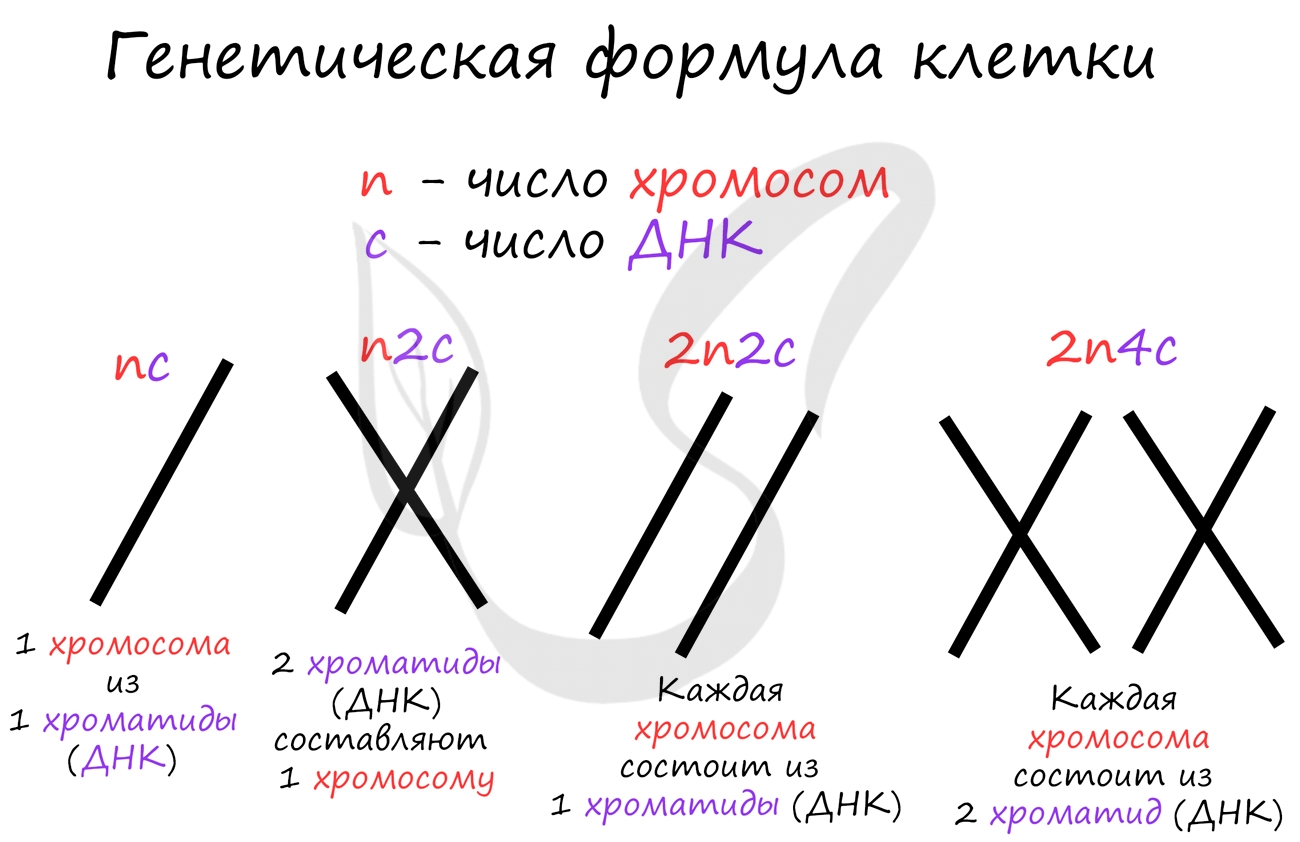
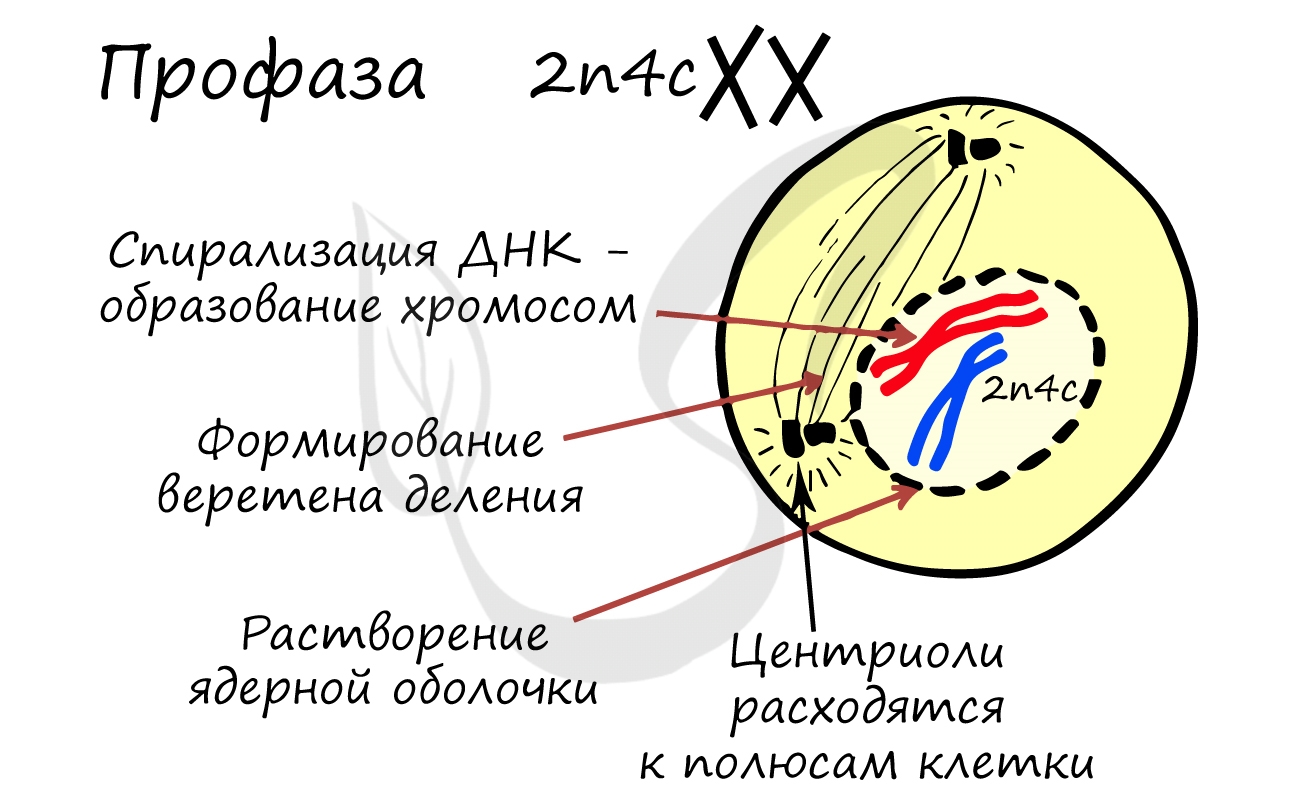
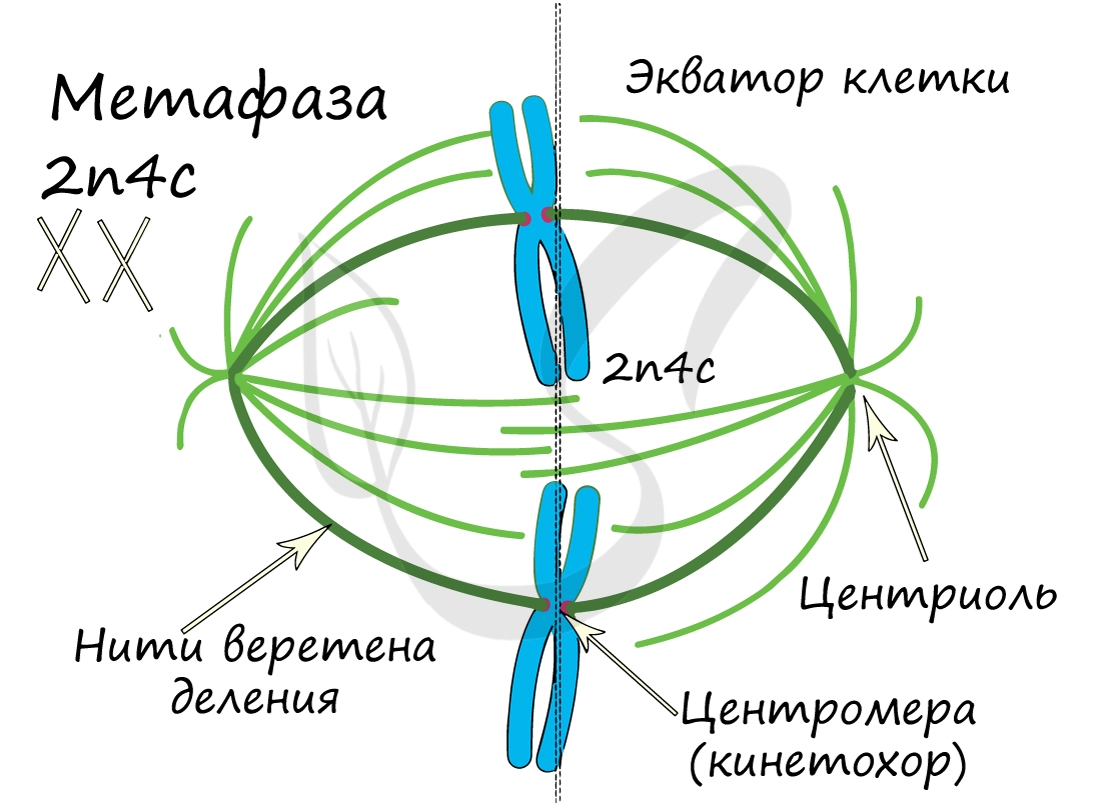
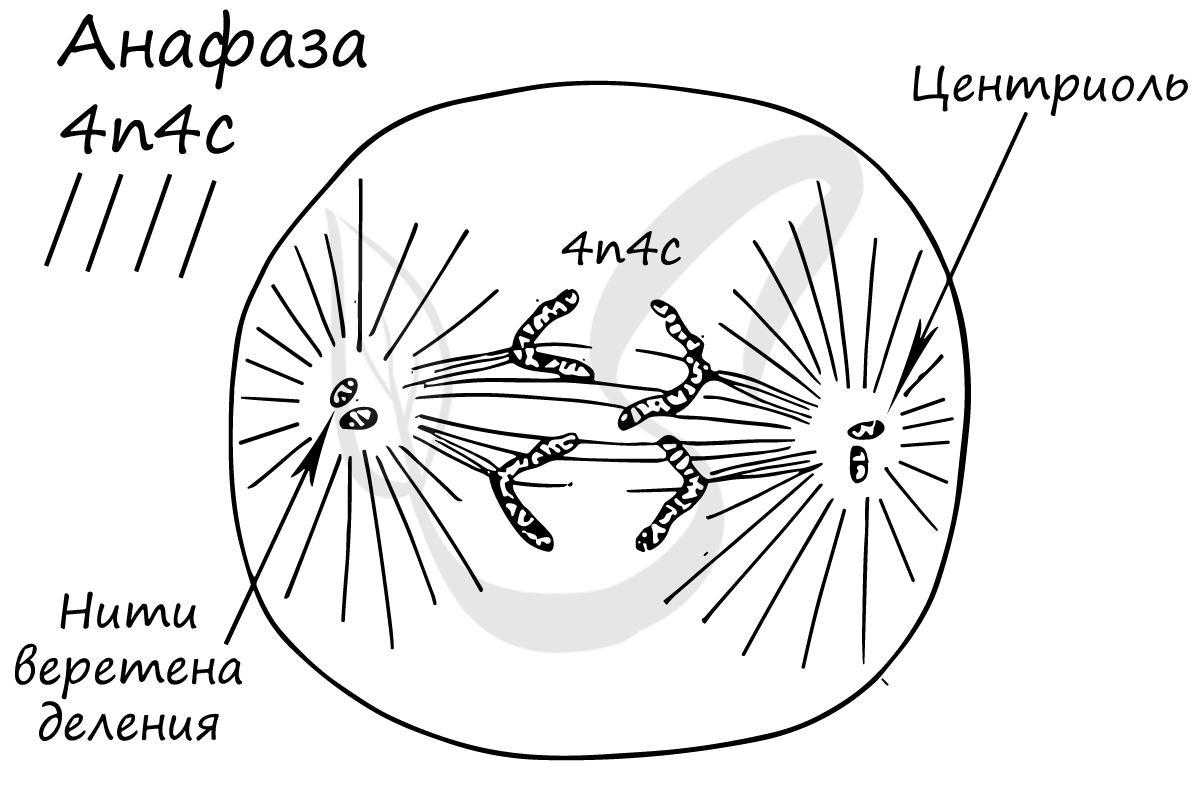
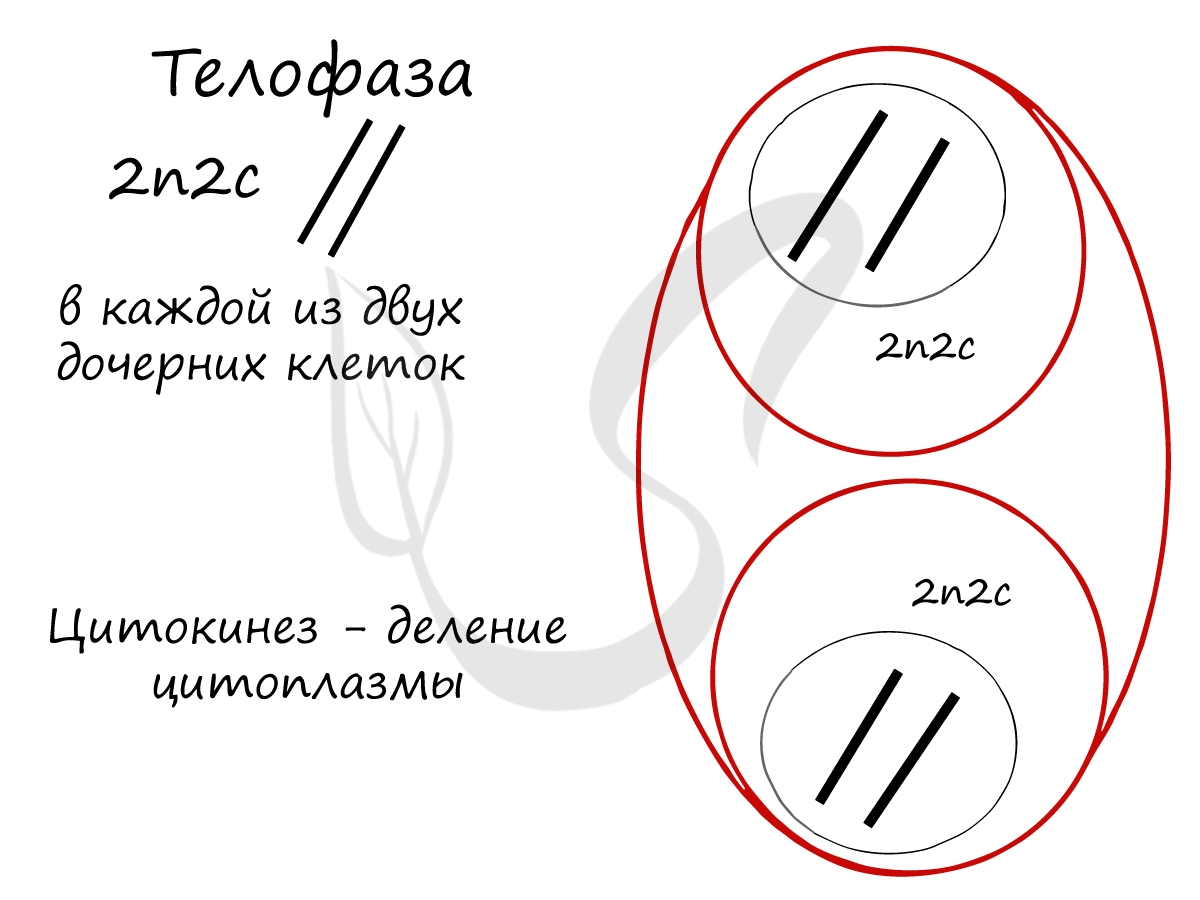
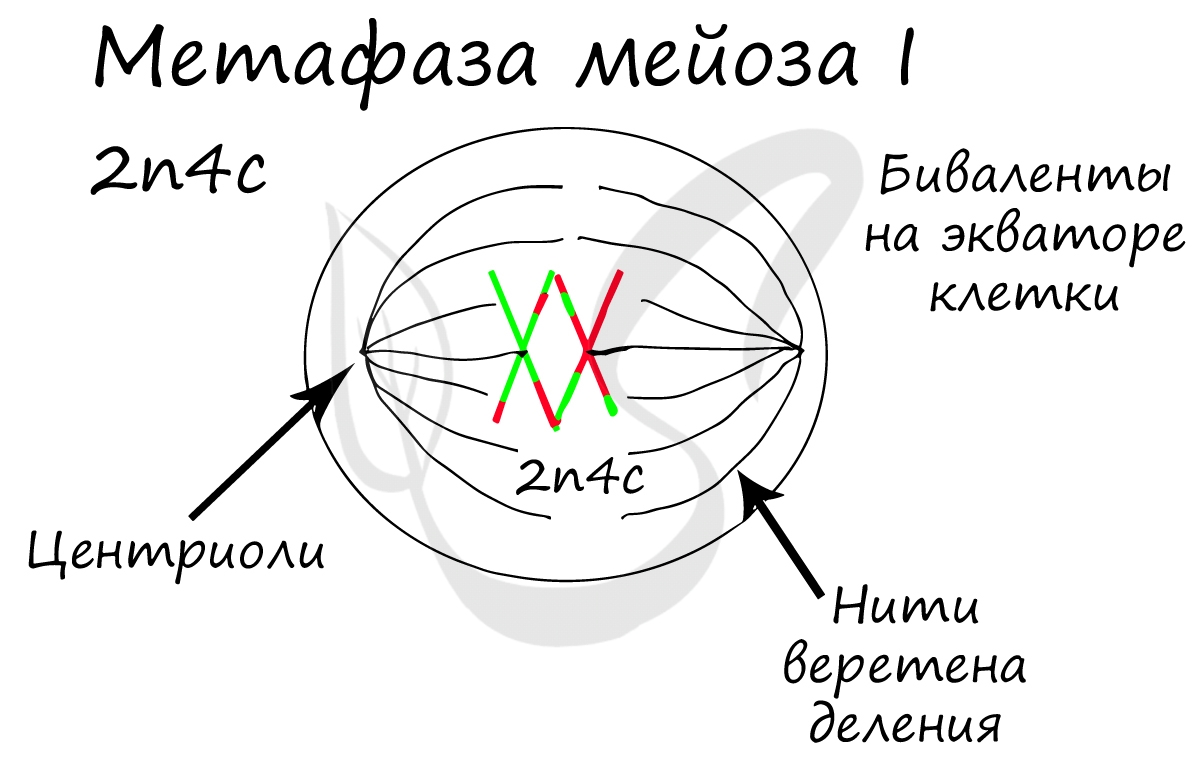
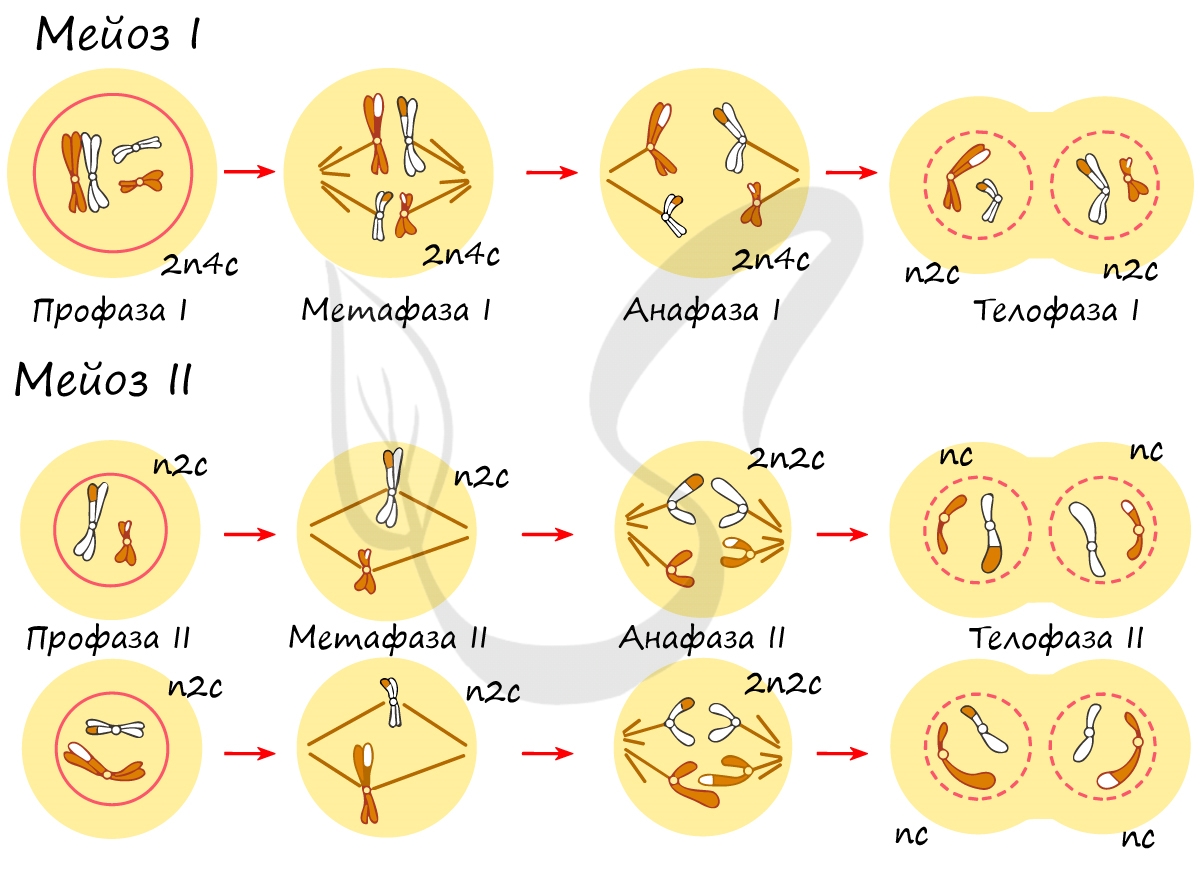
Митоз состоит из 4 фаз, которые мы далее детально рассмотрим: профаза, метафаза, анафаза, телофаза. Напомню, что клетка вступает в митоз с уже удвоенным (в синтетическом периоде) количеством ДНК. Мы рассмотрим митоз на примере клетки с набором хромосом и ДНК 2n4c.
ДНК максимально спирализована в хромосомы, которые располагаются на экваторе клетки. Каждая хромосома состоит из двух хроматид, соединенных центромерой (кинетохором). Нити веретена деления прикрепляются к центромерам хромосом (если точнее, прикрепляются к кинетохору центромеры).
Попробуйте самостоятельно вспомнить фазы митоза и описать события, которые в них происходят. Особенное внимание уделите состоянию хромосом, подчеркните сколько в них содержится молекул ДНК (хроматид).
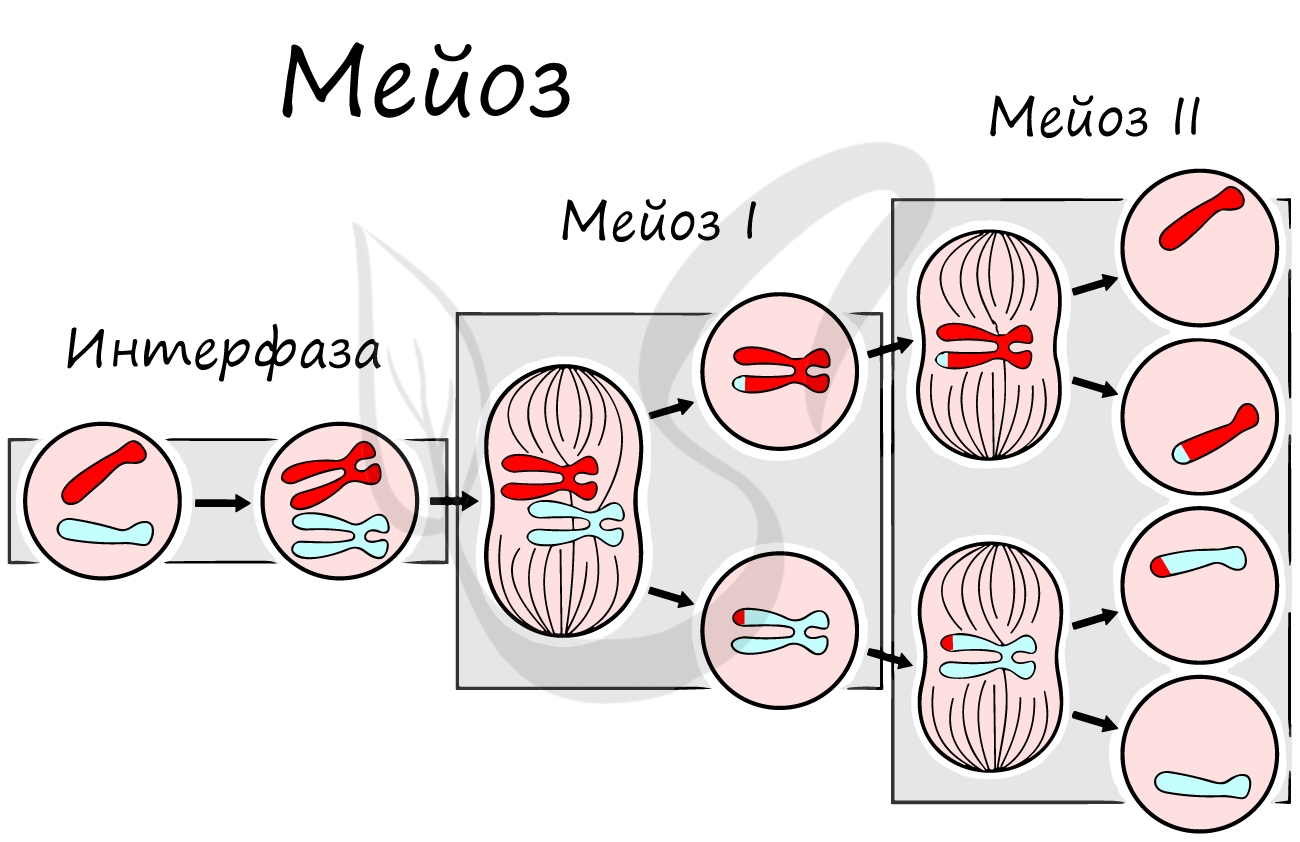
Мейоз
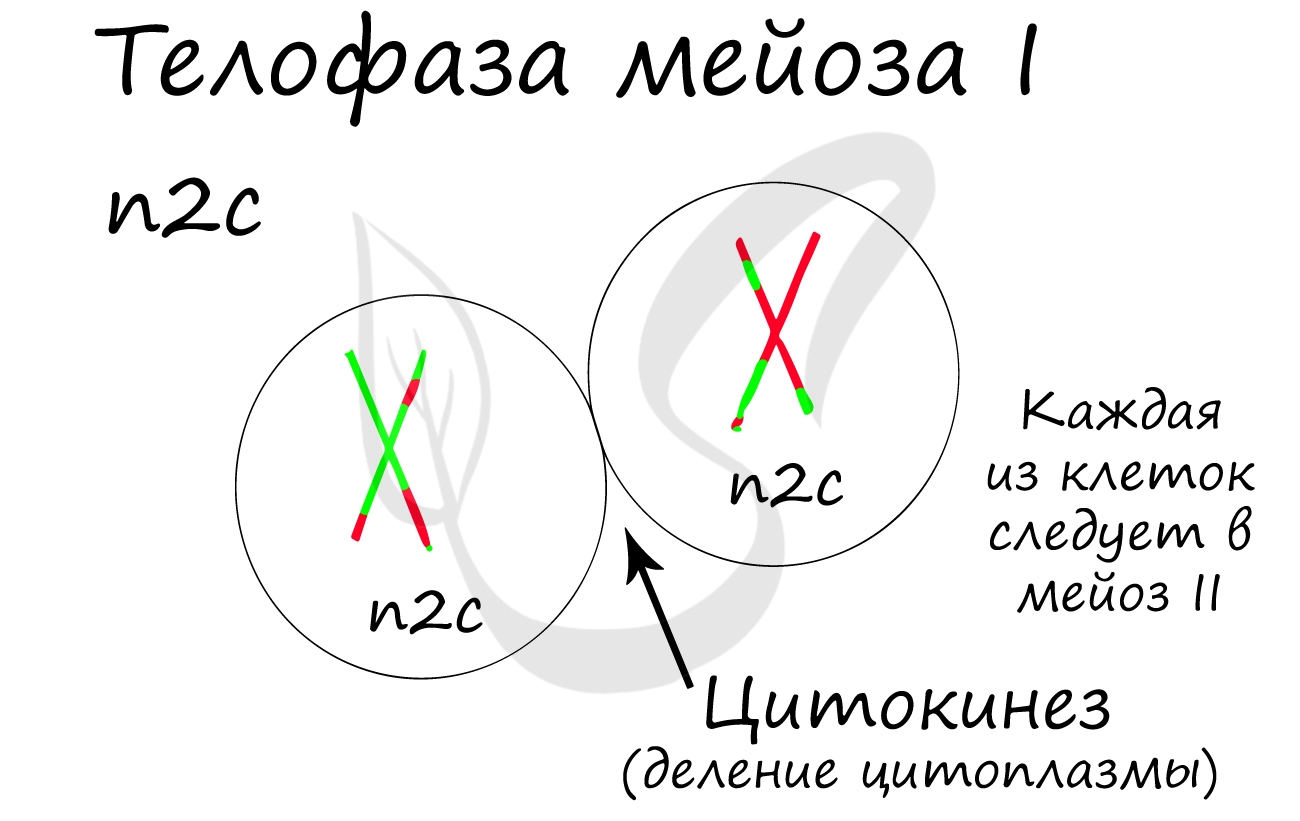
В результате мейоза из диплоидных клеток (2n) получаются гаплоидные (n). Мейоз состоит из двух последовательных делений, между которыми практически отсутствует пауза. Удвоение ДНК перед мейозом происходит в синтетическом периоде интерфазы (как и при митозе).
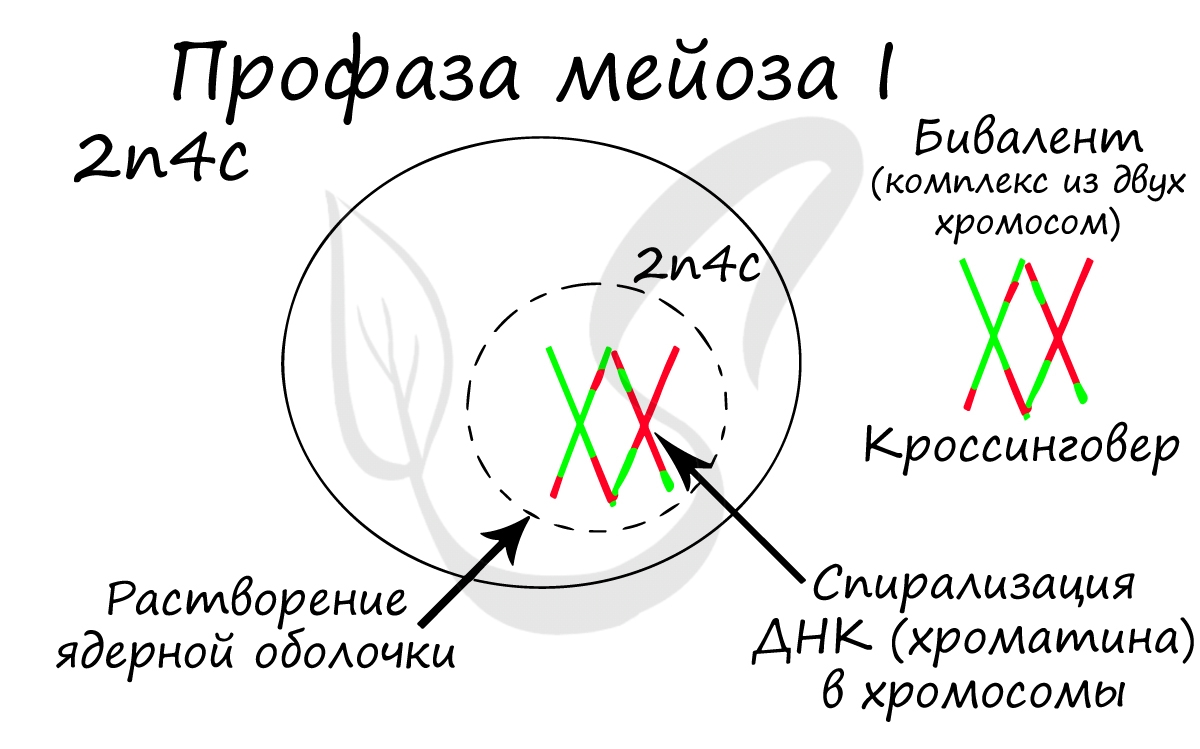
Помимо типичных для профазы процессов (спирализация ДНК в хромосомы, разрушение ядерной оболочки, движение центриолей к полюсам клетки) в профазе мейоза I происходят два важнейших процесса: конъюгация и кроссинговер.
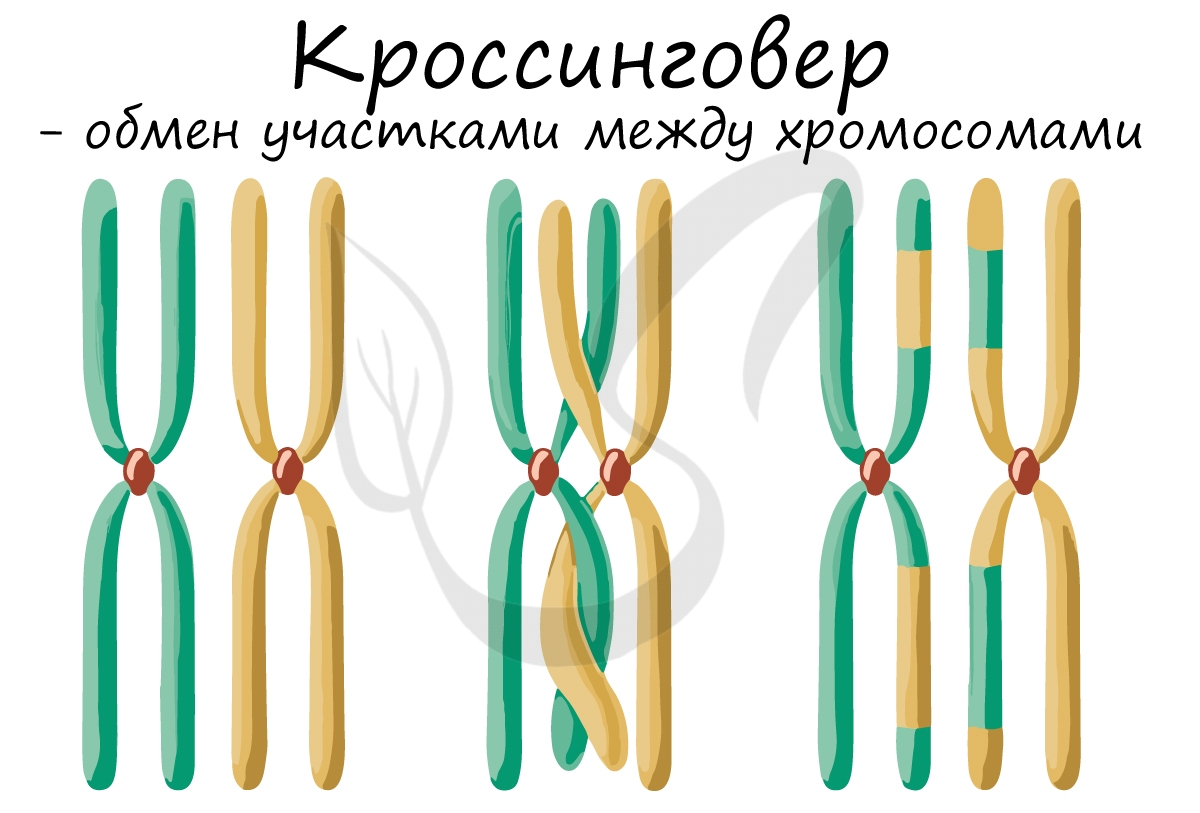
Кроссинговер является важнейшим процессом, в ходе которого возникают рекомбинации генов, что создает уникальный материал для эволюции, последующего естественного отбора. Кроссинговер приводит к генетическому разнообразию потомства.
Биваленты (комплексы из двух хромосом) выстраиваются по экватору клетки. Формируется веретено деления, нити которого крепятся к центромере (кинетохору) каждой хромосомы, составляющей бивалент.
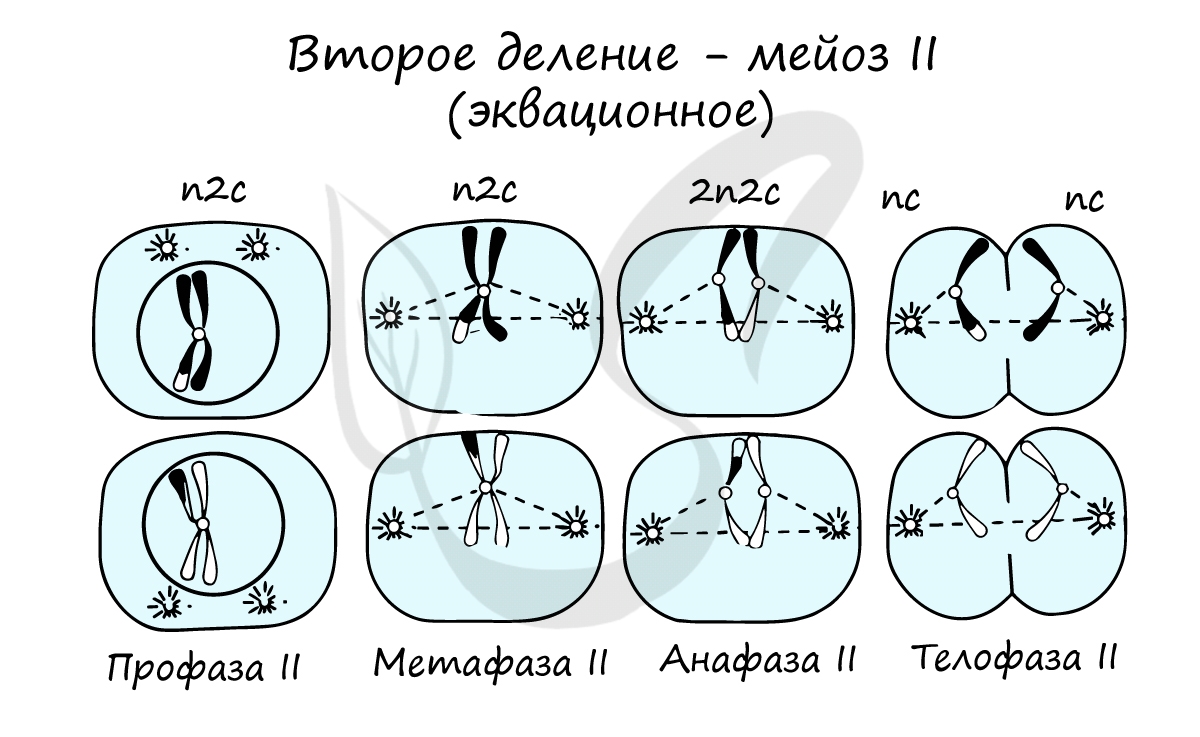
Мейоз II весьма напоминает митоз по всем фазам, поэтому если вы что-то подзабыли: поищите в теме про митоз. Главное отличие мейоза II от мейоза I в том, что в анафазе мейоза II к полюсам клетки расходятся не хромосомы, а хроматиды (дочерние хромосомы).
Сейчас мы возьмем клетку, в которой 4 хромосомы. Попытайтесь самостоятельно описать фазы и этапы, через которые она пройдет в ходе мейоза. Проговорите и осмыслите набор хромосом в каждой фазе.
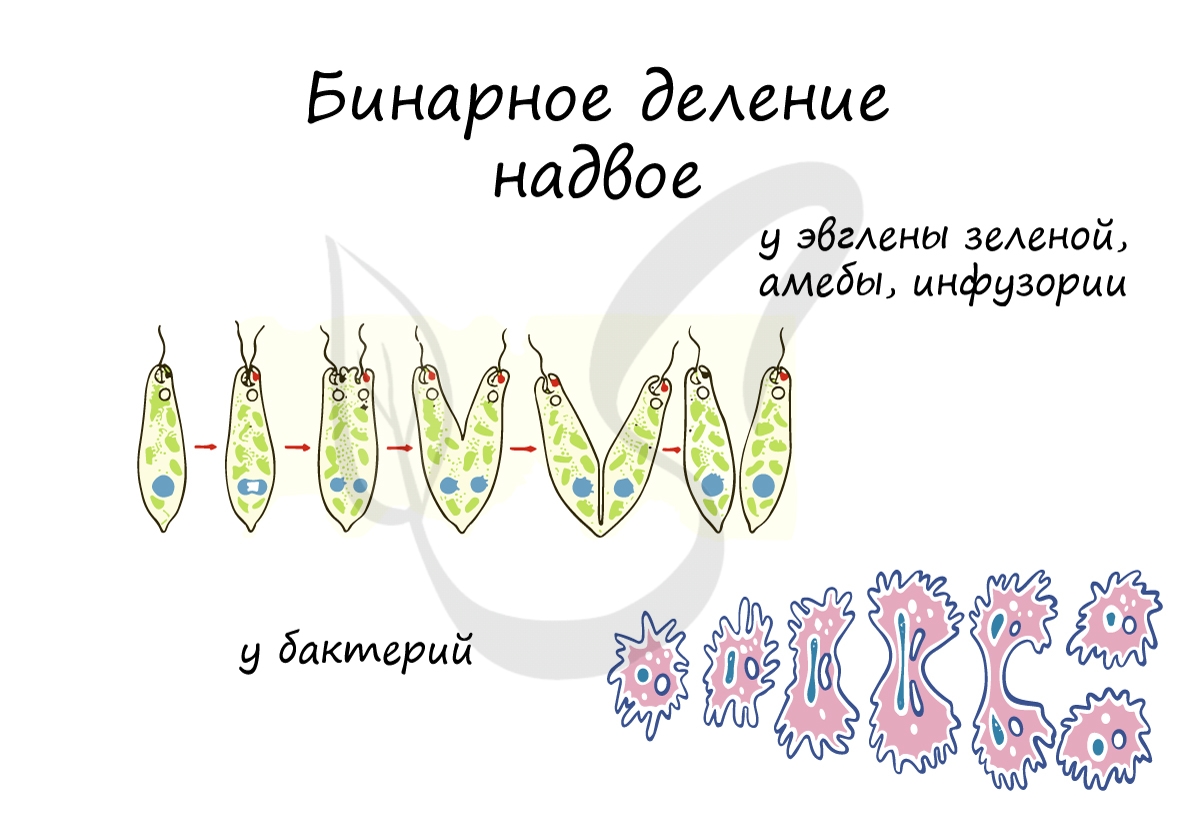
Бинарное деление надвое
При благоприятных условиях бактерии делятся каждые 20 минут. В случае, если условия не столь благоприятны, то больше времени уходит на рост и развитие, накопление питательных веществ. Интервалы между делениями становятся длиннее.
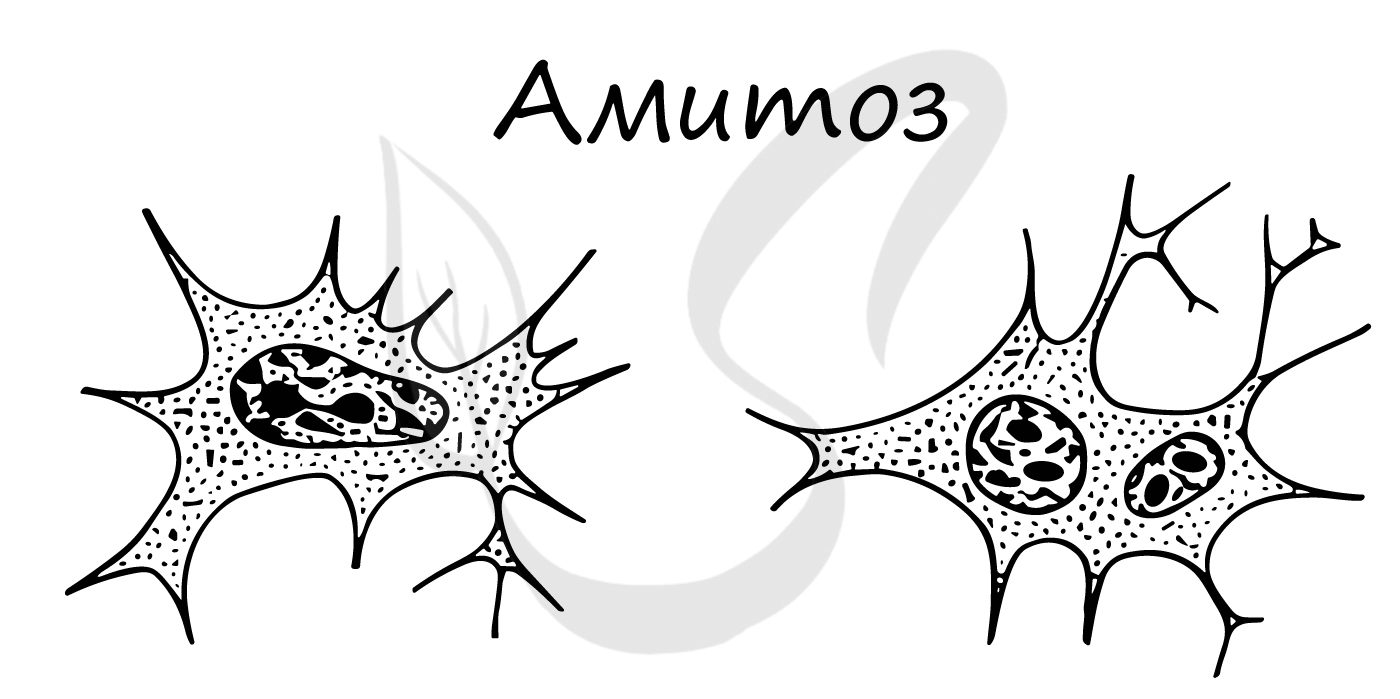
Амитоз встречается в раковых (опухолевых) клетках, воспалительно измененных, в старых клетках.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Count to six and die: количество митозов, как, зачем и почему
Этот пост (если со мной не случится очередного, кхм, творческого перерыва) может начать целую отдельную серию, которую я бы назвала чем-нибудь наподобие «как прочитать и потом понять, что вам там написал морфолог в этой длинной стене текста под названием описание».
Сегодня вот захотелось поговорить о митозах и о том, зачем вообще мы тратим время на их подсчет (а то мне уже начинает казаться, что зря вообще мы его тратим).
Итак, митоз – это фаза клеточного цикла, в которой клетка непосредственно делится, то есть, ядро распадается, хромосомы расходятся, и вот это вот все, что мы с трудом, но припоминаем из курса общей биологии 😊
Из курса же общей биологии, а также из какой-нибудь лекции или книги по патофизиологии опухолевого роста мы помним также, что способность делиться – это нормальная способность большинства клеток и тканей организма, но в опухолях в подавляющем большинстве случаев частота деления гораздо выше, чем в исходной ткани, и, таким образом, на одну и ту же единицу объема количество клеток, находящихся в цикле вообще и в фазе М в частности, будет выше.
Собственно, количество митозов, митотический индекс и прочие Ki67 так или иначе отражают вот это повышение митотической активности в виде числа. Мы все любим цифры, ведь их можно потом обсчитать, стандартизировать, нарисовать графики и так далее. 😉
Митоз из учебника по биологии выглядел как-то так:
Морфолог видит это все примерно так же, как на картинке. То есть, мы видим клетку, у которой вместо ядра отдельные хромосомы, которые поделились на группы (в идеале на две) и куда-то идут.
В цитологии считать митозы сложновато. Это связано, конечно, с очень высоким разбросом количества клеток на единицу площади мазка, а также с в принципе меньшим количеством клеток в образце, чем в гистологии, – слишком много переменных получается, и итоговое число митозов варьирует слишком сильно. Тем не менее любой более-менее опытный цитолог может, хоть и с большими допущениями, сказать вам, много митозов для данной ткани или мало. А уж если их в цитологии ну очень-очень много, то знайте, где-то там в ближайшем будущем гистолог по этому же пациенту просто устанет их все считать. =)
Гистология в этом плане позволяет добиться куда более стабильной концентрации клеток и бОльшего их количества для оценки (в зависимости от объема и качества биоптата, конечно!).
С точки зрения прогнозов, количество митозов может быть независимым прогностическим фактором либо входить в систему оценки степени злокачественности (Grade). Кроме того, для некоторых опухолей количество митозов может влиять на сам диагноз.
Для количества митозов нет универсальных значений типа «много», «мало» или «средне», хотя больше 70-100 это всегда много. Все зависит опять же от того, в какой ткани происходит дело. Эпителиальные ткани и кроветворные элементы и в норме делятся очень активно, а опухоли из них (опять же, не всегда, но как правило) – еще быстрее. Соединительные ткани делятся редко или, чаще, в нормальном организме не делятся вообще, потому и саркомы будут делиться зачастую куда менее активно, чем карциномы. Одно и то же количество митозов в разных тканях будет означать совершенно разное. Для трихобластомы, к примеру, 14 митозов на 10 полей х400 – это ни о чем, и это не меняет диагноза ее как доброкачественной опухоли, для саркомы мягких тканей – немало, и добавляет ей 1 балл в копилку градации по Kuntz, для меланоцитарной опухоли – очень много, переводит ее в разряд однозначно злокачественной и является фактором неблагоприятного прогноза.
Продолжая примеры, в системе оценки мастоцитом кожи по Kiupel, мастоцитома с более чем 7 митозами будет считаться агрессивной, даже если больше никаких критериев для этого нет. (Если кто забыл, то сюда)
Для той же мастоцитомы кожи было показано, что собаки, у которых количество митозов было более 5, имели медиану жизни (MST) 2 месяца, в то время как у собак с количеством митозов менее 5 она составила аж 70. (Пруф)
Меланоцитарная опухоль кожи с количеством митозов более 3 имеет все основания называться меланомой, а не меланоцитомой, с медианой жизни 30 недель, а с количеством митозов менее 3 – 104 недели. Если взять ту же меланому, но в ротовой полости, то из собак с количеством митозов более 4 80% не переживают один год, в то время как при меньшем количестве митозов 90% были живы через год после постановки диагноза. (источники по теме 1, 2, 3, 4)
Для гистиоцитомы количество митозов вообще не имеет значения, потому что она все равно ведет себя доброкачественно и обычно сама регрессирует.
Для опухоли эндокринной ткани, например, карциномы надпочечника, количество митозов также не имеет доказанного значения, потому что даже с 1-2 митозами они умудряются быть инфильтративными и метастатически активными.
Конечно же, все не могло быть слишком просто, и с определением количества митозов есть ряд проблем и затыков, а именно:
— путаница митотического индекса с количеством митозов
— необходимость стандартизации поля, про которую не все, оказывается, знают
— существенная разница между подсчетом в последовательных или случайно выбранных полях
-проблемы чисто технические, связанные с визуализацией митозов и дифференцировкой их от апоптозов, к примеру
Долгое время как в медицинской, так и в ветеринарной литературе существовала некоторая путаница между терминами «количество митозов», «индекс митозов», «индекс митотической активности», «пролиферативная активность», и так далее. Я не буду долго на этой теме останавливаться, но всем, кому интересно, крайне рекомендую поподробнее изучить вот эту статью, я часто буду к ней возвращаться в течение следующих нескольких абзацев.
Из того, что нам наиболее важно. Во-первых, не нужно путать понятие митотический индекс и количество митозов, хотя в огромном (я не шучу) количестве статей, даже в том же Vet Pathol, они перепутаны или указаны так, что не понятно, какой из показателей имелся в виду.
Митотический индекс (МИ) – это отношение количества клеток, находящихся в митозе, к общему количеству клеток в ткани, обычно выраженное в штуках на 1000 клеток.
Количество митозов (КМ) – это, собственно, количество митозов (в штуках), увиденных патологом в какой-то объектив в каком-то количестве как-то взятых полей зрения. Количество митозов считать гораздо проще и быстрее, поэтому именно его вам в подавляющем большинстве случаев укажут в заключении по хирургическому биоптату. Просто потому что сидеть считать еще и тысячи неделящихся клеток долго, дорого и тяжело.
Разумеется, КМ и МИ отнюдь не тождественны и существенно варьируют в зависимости, например, от размера клеток и от количества межклеточного вещества между ними. Сравните лимфому и саркому, снятые, это важно, на одном и том же объективе в одних и тех же условиях, вот тут:
В лимфоме, конечно, что МИ, что КМ гораздо выше, чем в саркоме, но если допустить гипотетически, что МИ у обеих опухолей одинаковый, то КМ у лимфомы будет выше – потому что клетки лимфомы маленькие и межклеточного вещества между ними нет, и в одно и то же поле одного и того же микроскопа попросту войдет больше лимфоцитов, чем фибробластов.
Чтобы не быть голословной, вот в этом медицинском исследовании посчитали количество клеток в РМЖ у человека на 1 поле микросокпа, и значение варьировало от 1200 до 9000. И это в одном и том же РМЖ! А, да, и еще они посчитали CV для количества митозов, и при невысоком КМ (до 11.4 на 10 полей х400, если переводить в привычный нам формат), CV получился… 147%. Специалисты, работающие в КДЛ и привычные к CV не выше 5-10%, наверное сейчас за сердце схватятся.
Мировая общественность почти единодушна в том, что количество митозов надо считать на 10 полей объектива х400, хотя есть рекомендующие считать и на 20, и на 30 (хотя бы даже и в статье выше). И тут встает другая проблема – не все микроскопы одинаковы. Если вы когда-либо участвовали в закупке микроскопов для клиники или просто интересовались вопросом, то знаете, что к каждой части микроскопа прилагается довольно длинный ряд цифирек, характеризующих отдельные его параметры. Среди них нам сегодня очень важен диаметр окуляра, или field number, FN, потому что именно он определяет разницу между площадями полей зрения в разных микроскопах (остальное, слава помидорам, более-менее одинаково у всех микроскопов).
Итак, при использовании одного и того же объектива на двух разных микроскопах, в том, у которого FN больше, площадь поля зрения тоже будет больше. Соответственно, 10 полей на микроскопе с FN 16 будут много меньше, чем с FN 22. Да-да, не все 10 полей х400 одинаково полезны.
В связи с этим у каждого гистопатолога должна быть (да и скорее всего в каком-то виде уже есть) эта табличка:
Ну или хотя бы надо запомнить, сколько полей надо считать именно на ЭТОМ микроскопе, чтобы выдать максимально близкое к стандартным 10 полям х400 на FN 22, что составляет 2.37 мм2. У моего Olympus CX41 FN=20, то есть я считаю всегда реально на 12 полей, а не на 10. Хотя пишу в заключениях про 10, чтобы не путать народ и дальше.
При работе со сканами все еще веселее. Есть некоторые программы, которые обрезают твое поле зрения слайда до кругленького поля, привычного в микроскопе, как например тут:
Но работать в таком виртуальном «поле» может быть не всегда удобно, в зависимости от того, с каким монитором приходится иметь дело. Поэтому пользователю сканов приходится создавать свои собственные «виртуальные поля» и приводить их к заветным 2.37 мм2. Площадь препарата, влезающая в одно «поле» виртуального слайда, зависит не только от увеличения, но и от разрешения экрана. Поэтому самый простой вариант – это измерить площадь «поля» на пригодных для подсчета митозов увеличениях (х20 и х40), разделить на них 2.37 мм2 и получить, сколько же полей нужно просчитать, чтобы получить тот самый стандартизированный КМ (если у вас панели инструментов и прочая навигация частично находятся НАД полем зрения, как в Aperio ImageScope, то недурно их площадь тоже учесть – под ними вы митозов не увидите). Так, на моем теперешнем ноутбуке я считаю митозы либо в 6 полях на х20, либо в 23 полях на х40.
Расчеты просты, очевидны и, кроме того, приведены в той же статье Meuten и ко:
И да, эти расчеты надо переделывать каждый раз, как меняешь разрешение и формат монитора или вообще рабочий комп.
Еще к проблемам стандартизации КМ относится выбор полей, в которых производится подсчет (если, естественно, объем самого биоптата больше заветных 2.37 мм2). Тут есть два подхода. В первом количество митозов считается по 10 последовательно взятым полям (то есть, берем какое-то одно поле в опухоли, обычно по периферии, потому что там и пролиферативная активность выше, и фиксация лучше, считаем митозы в нем, сдвигаем препарат немного в сторону, считаем митозы там и так далее). Во втором сначала просматривается весь препарат полностью, ищутся участки с наибольшим количеством митозов, и дальше подсчет уже идет в них, и не по последовательным, а по взятым в пределах этих «высокомитозных» участков полям. Проблема тут в том, что опухоли по природе своей гетерогенны, то есть, в них всегда есть участки, где клетки делятся с разными скоростями, и количество митозов в них будет разным. При первой методике есть шанс недооценить истинную агрессивность опухоли. При второй – шанс ее переоценить. И вот тут-то апологеты подсчета на 20-30-100 полей могут сказать «а я же говорил. » Действительно, чем больше полей мы возьмем в подсчет, тем ближе к среднему значению по опухоли будет наше количество митозов и, соответственно, ближе к истине оценка агрессивности процесса. Но где взять столько времени и усидчивых людей.
И еще одно. Все помнят про правила фиксации материала для гистологии? Надеюсь, что да, потому что, да, черт побери, фиксация влияет и на это тоже! Чем больше времени прошло между извлечением материала из животного и фиксацией, тем меньше становится количество видимых митозов в ткани и больше – количество апоптозов, которые в некоторых случаях, особенно при лимфомах, не так уж и просто отличить от митозов. Так что операционный материал, забытый на час и не помещенный в формалин, или помещенный, но большим куском и не пропитавшийся фиксатором в центре – та-даа! – наврет вам в отношении реального количества митозов в данной ткани. Как и еще много в чем. (Пруф)
Ну и само собой, чем меньше биоптат, тем меньше вероятность подсчитать количество митозов адекватно. А если площадь опухоли в образце меньше, чем 2.37 мм2, то извините. Максимум можно подсчитать на то количество полей, какое есть.
Что же можно сделать, чтобы улучшить этот древний, но простой и понятный метод исследования? Есть несколько вариантов, каждый из которых достаточно широко используется в медицине и скоро, наверное, докатится до нас. Очень в духе времени – научить считать митозы компьютер. По сравнению с тем, что уже умеют (и успешно делают) ИИ, митозы в общем-то несложны. И, действительно, на самых обычных сканах машина прекрасно справляется с этой задачей, обрабатывая сразу бОльшую площадь слайда, выбирая наиболее репрезентативные поля и считая митозы уже в них. ИИ не устает и не хочет спать. ИИ очень сложно отвлечь телефонным звонком с идиотскими вопросами. Исследования по теме, оценивающие эффективность машин для этого дела, уже есть (для примера хотя бы вот https://arxiv.org/pdf/1902.05414.pdf, можно поискать еще по интернетам, увидите их далеко не одну штуку, тем более что они продолжают выходить вот прямо сейчас, пока я пишу этот очерк). Когда это дойдет до широкого пользователя, особенно для ограниченного финансово ветеринарного – вопрос уже другой…
Пролиферативная активность может быть уточнена также рядом дополнительных методик, несть им числа, включая PCNA, AgNOR, Фельгена и всяческие молекулярно-генетические методики, несть числа им, но я для примера остановлюсь на наиболее часто упоминаемой в последнее время в литературе ИГХ на Ki-67.
Ki-67 «ловит» все клетки, находящиеся в клеточном цикле, то есть, все фазы, кроме G0: G1, S, G2 и М, в то время как количество митозов учитывает только фазу М. Понятно, что таким образом КМ выглядит верхушкой айсберга, в то время как Ki-67 позволяет оценить его объемы, включая подводную часть, куда точнее. Клетки, окрасившиеся Ki-67, можно точно так же считать на поле или на количество клеток в популяции вообще, и для некоторых опухолей были введены свои пороговые значения (меланома, мастоцитома). Точно так же, как и митозы, считать окрашенные клетки можно легко научить компьютер, и, думается мне, это даже попроще, чем с митозами – ведь не надо учиться дифференцировать митоз от кариопикноза.
Таким образом, самое актуальное применение Ki-67 – это если надо уточнить какие-то невысокие цифры по количеству митозов или уточнить пролиферативную активность, когда количество митозов получилось где-то возле порога для данной конкретной опухоли. Помните про пример мастоцитомы? Если я насчитала в ней 34 митоза, я не стану заказывать Ki67, он не даст мне новой информации. Если количество митозов 0-2, я порекомендую Ki-67 как одну из опций, хотя в 95% случаев у такой масто и Ki-67 будет низким. А вот если количество митозов где-то поблизости от порога – то есть, от 4 до 7, в зависимости от ситуации, вот тут рекомендация Ki-67 актуальна, потому что от этого может зависеть окончательная категоризация опухоли как высоко- или низкоагрессивной. (Тут конечно же надо напомнить себе о грехе излишней категоризации, но об этом мы поговорим в другой раз).
Есть, кстати, интересные данные, что в некоторых меланомах у собак индекс Ki67 оказывался непропорционально низким по отношению к количеству митозов. Но это так, к слову.