Что такое энергия ионизации атома
Энергия ионизации
Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные свойства соответствующего простого вещества.
Для многоэлектронного атома существуют также понятия второго, третьего и т. д. ионизационных потенциалов, представляющих собой энергию удаления электрона от его свободных невозбуждённых катионов с зарядами +1, +2 и т. д. Эти ионизационные потенциалы, как правило, менее важны для характеристики химического элемента.
Энергия ионизации всегда имеет эндоэнергетическое значение (это понятно, так как чтобы оторвать электрон от атома, требуется приложить энергию, самопроизвольно это произойти не может).
На энергию ионизации атома наиболее существенное влияние оказывают следующие факторы:
На энергию ионизации оказывают влияние также и менее значительные факторы, такие, как квантовомеханическое обменное взаимодействие, спиновая и зарядовая корреляция и др.
Энергии ионизации элементов измеряется в Электронвольт на 1 атом или в Джоуль на моль.
| Элемент | I1 | I2 | I3 | I4 | I5 | I6 | I7 |
|---|---|---|---|---|---|---|---|
| Na | 495,8 | 4564 | — | — | — | — | — |
| Mg | 737,7 | 1451 | 7730 | — | — | — | — |
| Al | 577,6 | 1817 | 2744 | 11600 | — | — | — |
| Si | 786,5 | 1577 | 3228 | 4350 | 16100 | — | — |
| P | 1011,8 | 1904 | 2910 | 4950 | 6270 | 21200 | — |
| S | 999,6 | 2253 | 3380 | 4565 | 6950 | 8490 | 27000 |
| Cl | 1251,2 | 2296 | 3850 | 5160 | 6560 | 9360 | 11000 |
| Ar | 1520,6 | 2666 | 3946 | 5770 | 7230 | 8780 | 12000 |
Примечания
Ссылки
 Структурная химия Структурная химия | |
|---|---|
| Химическая связь: | Ароматичность | Ковалентная связь | Ионная связь | Металлическая связь | Водородная связь | Донорно-акцепторная связь | Таутомерия | Ван-дер-Ваальсова связь |
| Отображение структуры: | Функциональная группа | Структурная формула | Скелетная формула органических соединений | Химическая формула | Лиганд | Координационная геометрия | Координационная сфера |
| Электронные свойства: | Электроотрицательность | Сродство к электрону | Энергия ионизации | Полярность химических связей | Правило октета |
| Стереохимия: | Асимметрический атом | Изомерия | Конфигурация | Хиральность | Конформация |
Полезное
Смотреть что такое «Энергия ионизации» в других словарях:
ЭНЕРГИЯ ИОНИЗАЦИИ — равна работе, затрачиваемой на удаление одного внеш. эл на из атома (на ионизацию атома), находящегося в осн. энергетич. состоянии. Численно равна ионизационному потенциалу. Физический энциклопедический словарь. М.: Советская энциклопедия.… … Физическая энциклопедия
энергия ионизации — – энергия, необходимая для перевода нейтрального атома в положительно заряженный ион. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
энергия ионизации — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN gap energy … Справочник технического переводчика
энергия ионизации — jonizacijos energija statusas T sritis Standartizacija ir metrologija apibrėžtis Energijos kiekis, kurį reikia suteikti elektronui, kad jis išlėktų iš sužadinto atomo (molekulės) arba kietajame kūne iš kristalo valentinės juostos peršoktų į… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
энергия ионизации — jonizacijos energija statusas T sritis chemija apibrėžtis Mažiausia energija, reikalinga elektronui perkelti iš dalelės į begalybę. atitikmenys: angl. ionization energy rus. энергия ионизации … Chemijos terminų aiškinamasis žodynas
энергия ионизации — jonizacijos energija statusas T sritis fizika atitikmenys: angl. ionization energy; ionizing energy vok. Ionisationsenergie, f; Ionisierungsenergie, f rus. энергия ионизации, f pranc. énergie d’ionisation, f … Fizikos terminų žodynas
энергия ионизации акцептора — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN ionization energy of acceptor … Справочник технического переводчика
энергия ионизации донора — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN ionization energy of donor … Справочник технического переводчика
Энергия ионизации молекул и радикалов — Молекула (радикал) Энергия ионизации, эВ Мольная энергия ионизации, кДж/моль BBr3 10,72 … Химический справочник
энергия ионизации акцептора — akceptoriaus jonizacijos energija statusas T sritis Standartizacija ir metrologija apibrėžtis Energija, kurios reikia akceptoriui jonizuoti. atitikmenys: angl. acceptor ionization energy; acceptor ionizing energy vok. Akzeptor Ionisierungsenergie … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Что такое энергия ионизации? Где она находится в таблице Менделеева?
Содержание:
Энергия ионизации (первый ионизационный потенциал) – минимальная энергия, необходимая для отнятия электрона у нейтрального атома. Она определяет природу и прочность связей. Энергия ионизации отражена в таблице Дмитрия Ивановича Менделеева.
Энергия ионизации в химии – это меньшее напряжение поля, при котором достигается необходимая скорость отрицательных частиц для ионизации атома. Она определяется с помощью бомбардировки электронами атомов.
Формула энергии ионизации
Атомы с различным числом протонов и электронов называются ионами. Если электронов меньше, чем протонов, то ион приобретает положительный заряд и становится катионом. При обратной картине ион заряжен отрицательно и является анионом. Энергия ионизации отражает затраты для превращения атома в катион.
Первый ионизационный потенциал – разность энергий электрона в атоме:
Экранирование
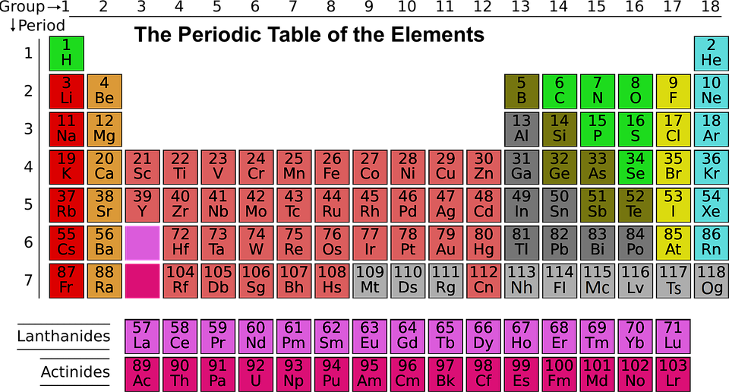
Энергия ионизации в таблице Менделеева
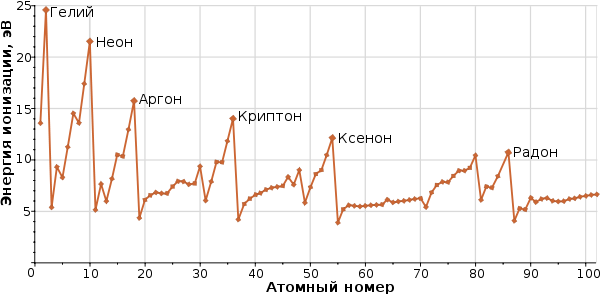
Первый ионизационный потенциал коррелирует с радиусом атома. По мере увеличения атомного радиуса первый ионизационный потенциал уменьшается. Поэтому металлические свойства в периоде слева направо уменьшаются, а в группе сверху вниз – увеличиваются.
Энергия ионизации в таблице Менделеева ведет себя следующим образом:
Например, натрий – щелочной металл (I «А» группа). На его внешнем слое находится только один электрон. Каждый атом стремится к завершению электронного уровня. Натрию до завершения уровня необходимо много электронов, поэтому ему проще отдать свой единственный электрон и принять новую конфигурацию. Таким образом, у этого химического элемента первый ионизационный потенциал низкий.
Хлор – галоген (VII «А» группа). На его внешнем уровне семь электронов, и до завершения уровня не хватает только одного. Хлор не может отдавать электроны, поэтому отнимает их у других элементов. Таким образом, у хлора высокий первый ионизационный потенциал.
| Na | Mg | Al | Si | P | S | Cl | Ar |
| 5,14 | 7,64 | 6 | 8,15 | 11 | 10,36 | 13,01 | 15,8 |
Энергия ионизации не всегда возрастает равномерно. Это связано с тем, что у элементов второй и пятой группы уровни полностью или наполовину заполнены, поэтому для удаления отрицательных частиц требуется больше работы.
Низкая энергия ионизации свидетельствует о высокой энергии активации и протекании быстрых реакций. Первый ионизационный потенциал – важный фактор, который необходимо учитывать при оценивании природы и прочности химических связей и прогнозировании того, как химические вещества будут связываться друг с другом.
Что такое энергия ионизации и от чего зависит
Энергия ионизации — это количество энергии, которое изолированный атом в основном электронном состоянии должен поглотить для освобождения электрона, в результате чего образуется ион.
Эта величина обычно выражается в кДж/моль или количество, необходимое для того, чтобы потерять один электрон.
Образование ионов
Ионы — это атомы, которые получили или потеряли электроны. Образуется ионизирующее излучение со своими положительными и отрицательными особенностями для человека.
Чем больше отрицательно заряженных элементарных частиц потеряно, тем более положительным будет этот ион, тем труднее отделить другие электроны от этого атома.
В общем, чем дальше электрон от ядра, тем легче его изгнать. Другими словами, энергия ионизации является функцией атомного радиуса: чем больше радиус, тем меньше количество работы, необходимой для удаления электрона с внешней орбитали. Например, было бы гораздо легче забрать электроны от более крупного элемента Ca (кальция), чем от того, где они крепче удерживаются к ядру как Cl (хлор).
Например, энергия ионизации натрия (щелочного металла) составляет 496 кДж/моль, тогда как хлора — 1251,1 кДж/моль.
Элементы, находящиеся близко друг к другу в периодической таблице, или элементы, не имеющие большой разницы в энергии ионизации, образуют полярные ковалентные или ковалентные связи. Например, углерод и кислород делают СО2 (углекислый газ) находящиеся близко один к другому на периодической таблице. Они поэтому формируют ковалентное скрепление. Углерод и хлор образуют CCl4 (четыреххлористый углерод) другой молекулой, которая ковалентно связана.
Периодическая таблица и тренд ионизации
Энергия ионизации зависит от атомного радиуса. Так как идя справа налево по периодической таблице, атомный радиус увеличивается, а энергия ионизации уменьшается слева направо в периодах и вниз по группам.
Объяснение шаблона в первых нескольких элементах
Литий — 1s22s1. Свой внешний электрон находится на втором энергетическом уровне, гораздо более удаленнее от ядра. Можно утверждать, что это было бы компенсировано дополнительным протоном в ядре, но электрон не чувствует полной тяги ядра — он экранируется.
Исключения из этой тенденции наблюдаются для щелочноземельных металлов (группа 2: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra), унбинилий (Ubn) и элементов группы азота (группа 5: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi)). Группы 2 и 5 имеют полностью и наполовину заполненную электронную конфигурацию соответственно, поэтому для удаления отрицательно заряженных элементарных частиц из полностью заполненных орбиталей требуется больше работы, чем из неполнозаполненных.
Щелочные металлы (группа I) обладают малой энергией ионизации, особенно по сравнению с галогенами или группой VII.
В дополнение к радиусу (расстоянию между ядром и электронами на самой внешней орбите), количество электронов между ядром, в самой внешней оболочке, также влияет на энергию ионизации.
Этот эффект, при котором полный положительный заряд ядра не ощущается внешними электронами из-за отрицательных зарядов внутренних, частично отменяющих положительный заряд, называется экранированием.
Чем больше электронов защищает внешнюю электронную оболочку от ядра, тем меньше работы требуется для вытеснения отрицательно заряженной элементарной частицы из указанного атома.
Чем выше эффект экранирования требуется меньше приложить работы. Из-за экранирующего эффекта энергия ионизации уменьшается сверху вниз в группе. Из таблицы Менделеева видно что Цезий имеет низкую, а фтор самую высокую энергию ионизации (за исключением гелия и неона).
Для чего необходимо знать про эту величину
Падение энергии ионизации при движении вниз таблицы приводит к снижению энергии активации и, следовательно, к более быстрым реакциям.
Энергия ионизации являются одним из наиболее важных факторов, которые необходимо учитывать при оценке прочности химических связей и прогнозировании того, как химические вещества будут связываться друг с другом. Но это не свободная энергия.
Что представляет ионизация
Почти вся теоретическая химия, связанная с атомными и молекулярными реакциями, является квантовой физикой, которая изучает энергетические изменения, связанные с электронами. Важным понятием, связанным с электронами, является определение что такое ионизация.

Чтобы освободиться от силы притяжения атомного ядра, электрону требуется энергия, которая может поступать из внешних источников. Если этой энергии окажется достаточно образуются ионы.
Ионы-это атомы, которые получили или потеряли электроны.
Процесс расщепления молекул вещества на положительные и отрицательные ионы при растворении вещества называется ионизацией.
Ионизация является эндотермической, то есть атом или молекула увеличивает свою внутреннюю энергию (берет из внешнего источника). Для каждого атома химического элемента, уровни этой энергии для каждой атомной орбитали отличаются.
Что необходимо для процесса расщепления
Для процесса расщепления молекул вещества с образованием ионов необходима энергия ионизации, ионизационный потенциал. Определяется как общее количество энергии, необходимой для освобождения электрона, который вращается во внешней оболочке любого атома.
Кроме того, химики также определяют его как полную энергию, необходимую для освобождения одного моля электронов от одного моля конкретного атома.
В физике предпочитают использовать электронвольты (eV, эВ) на атом, как единицу для потенциала ионизации, в то время как в химии измеряется в терминах кДж/моль (килоджоулей на моль). Например, энергия ионизации водорода 13,5984 эВ (1310 кДж/моль).
Чем ниже энергия, тем выше тенденция атома становиться восстановителем и более реактивным он является. С другой стороны, чем выше энергия ионизации, тем выше тенденция становиться окислителем и менее реактивным.
Энергия, необходимая для выделения одного электрона из внешней энергетической оболочки атома, известна как первый потенциал ионизации, в то время как энергия, необходимая для освобождения от второго, известна как второй потенциал ионизации. Второй потенциал ионизации всегда выше первого. Это происходит потому, что, чем больше убирается электронов из его внешних оболочек, тем сильнее атом удерживает остальные, которые остались.
Сейчас мы подробно поговорим что такое ионизация в процессе.
Процесс образования ионов на примере
Чтобы понять процесс ионизации, рассмотрим структуру хлорида натрия. Хлорид натрия — это поваренная соль которую мы используем в нашей повседневной жизни. Атомные номера Na и Cl равны 11 и 17 соответственно. Это означает, что атом натрия имеет 11 и атом хлора имеет 17 электронов на своих орбитах.
Атом Na имеет только один электрон на своей внешней орбите. В то время как хлор содержит семь на своей внешней орбите. Но мы знаем, что для стабильности атомы обычно требуют восемь электронов на своей внешней орбите. Таким образом, оба указанных атома химически активны. Когда эти атомы собраны вместе, атом Na теряет свои самые внешние электроны, становится положительно заряженным, а атом Cl получает один электрон и становится отрицательно заряженным. Так как атомы получают восемь электронов в их внешней орбиты путем их обмена. Между Na и Cl действует электростатическая сила между и они совместно сделали одну молекулу NaCl.
Как отмечается, ионные связи возникают, когда металл связывается с неметаллом, и эти связи чрезвычайно прочны.
Ионные соединения и твердые тела
Не только соль сформирована ионным скреплением. Соль также пример ионного твердого тела или кристаллического твердого тела которое содержит ионы.
Кристаллический солидис: тип твердого тела в котором составные части аранжированы в простой, определенной геометрической картине которая повторена во всех направлениях.
Существует три типа кристаллического твердого вещества: молекулярное твердое (например, сахароза или столовый сахар), в котором молекулы имеют нейтральный электрический заряд; атомная твердые (алмаз, например, из чистого углерода); и ионные твердые.
Соль не образуется из обычных молекул, как вода или углекислый газ. Внутреннюю структуру соли можно представить в виде повторяющейся серии хлоридных анионов и катионов натрия, плотно упакованных друг с другом, как апельсины в ящике.
Эта плотная упаковка положительных и отрицательных зарядов помогает сформировать плотное скрепление, и поэтому соль необходимо нагреть до высокой температурой прежде чем она расплавится. Твердая соль не проводит электричество, но расплавленная, она становится весьма хорошим проводником. Когда она твердая, ионы плотно упакованы, и таким образом не способствуют движению электрических зарядов; но когда структура нарушена путем плавления или растворения в чем либо движение ионов возможно.
Энергия для процесса
Вода не является хорошим проводником, хотя она, безусловно, позволит протекать через нее электрическому току, поэтому опасно эксплуатировать электроприбор вблизи воды.
Соль при расплавлении становится хорошим проводником, но этого можно добиться и растворением ее в воде.
На примере поваренной соли видно что такое ионизация. Однако это один из видов ионизации, который может быть определен как процесс, в котором один или несколько электронов удаляются из атома или молекулы, чтобы создать ион, или процесс, в котором ионное твердое вещество, такое как соль, диссоциирует на его компонентные ионы при растворении в растворе.
Количество энергии, необходимое для достижения ионизации, называется энергией ионизации или потенциалом ионизации.
Когда атом находится на своем нормальном энергетическом уровне, говорят, что он находится в основном состоянии. В этот момент электроны занимают свои нормальные орбитальные структуры. Между электроном и положительно заряженным ядром, в котором находятся протоны, всегда существует высокая степень притяжения. Энергия, необходимая для перехода электрона на более высокую орбиталь увеличивает общую энергию атома, который находится в возбужденном состоянии.
Возбужденное состояние атома — это просто шаг на пути к его ионизации путем удаления электрона. «Шаг» является подходящей метафорой, потому что электроны не просто дрейфуют вдоль континуума от одного энергетического уровня к другому, как человек поднимается по лестнице. Они делают дискретные шаги, как человек взбирается по лестнице или трапу. Это один из ключевых принципов квантовой механики, передовой области физики, которая также имеет многочисленные приложения к химии. Подобно тому, как говорится о внезапном изменении как о «квантовом скачке», электроны совершают квантовые скачки с одного энергетического уровня на другой.
Из-за высокого притяжения между электроном и ядром первый удаляемый электрон находится на самой внешней орбите. Это количество энергии называется первой энергией ионизации. Удалить второй электрон будет значительно сложнее, так как теперь атом является катионом, а положительный заряд протонов в ядре больше отрицательного заряда электронов. Следовательно, энергия, необходимая для удаления второго электрона намного выше, чем первая.
Образование ионов элементов и соединений
Существуют уровни энергии ионизации для элементов, хотя следует отметить, что водород, поскольку имеет только один электрон, имеет только первую энергию ионизации. Как правило, показатели увеличиваются слева направо вдоль периода или строки периодической таблицы и уменьшаются сверху вниз вдоль столбца или группы.
Причина, по которой энергия ионизации увеличивается вдоль периода, заключается в том, что неметаллы в правой части таблицы имеют более высокую энергию, чем металлам, которые находятся на левой стороне. Величина уменьшается вдоль группы, потому что элементы ниже в таблице Менделеева имеют более высокие атомные номера, что означает больше протонов и, следовательно, больше электронов. Поэтому им легче отказаться от одного из своих электронов, чем от элемента с более низким атомным номером — так же, как миллионеру было бы легче потерять тысячу рублей, чем это было бы для человека, зарабатывающего минимальную заработную плату.
Для молекул в соединениях энергия ионизации обычно связана с элементами, атомы которых составляют молекулу. Подобно тому, как элементы с меньшим количеством электронов, как правило, менее склонны отказаться от одного, так и молекулы с несколькими атомами. Таким образом, энергия ионизации диоксида углерода (СО2), содержащего всего три атома, относительно высока. И наоборот, в больших молекулах, как с большими атомами, есть больше электронов, чтобы отказаться, и поэтому легче отделить один из них от молекул.
Применение процесса
Другим процессом ионизации является ионизация полем, при которой она производится путем воздействия на молекулу очень интенсивного электрического поля. Ионизация поля происходит в ежедневной жизни, когда статическое электричество образует малую искру. Искра фактически поток электронов.
В прикладных лабораториях профессионально известно что такое ионизация и используются точные приборы. Этот процесс гораздо более эффективен, чем электронным ударом и требуется гораздо меньше энергии по отношению к энергии, необходимой для удаления электронов. Технологические достижения медицины широко применяют этот процесс.
Химическая ионизация использует метод подобный ионизации удара электрона, за исключением того, что вместо электронов, луч используется для того чтобы бомбардировать и ионизировать образец. Ионы используемые в этой бомбардировке типично малые молекулы, как в метане, пропане или аммиаке. Тем не менее, молекулярный ион гораздо больше чем электрон, и эти столкновения высокореактивны.
Многие масс-спектрометры используют источник, способный как к электронному удару, так и к химической ионизации.
Ионизация может обеспечиваться электромагнитным излучением, длина волны которого короче длины волн видимого света, т. е. ультрафиолетовым светом, рентгеновскими лучами или гамма-лучами.
Также существует фотоионизация малых молекул, как то кислород (O2). Фотоионизация происходит в верхних слоях атмосферы, где ультрафиолетовое излучение от Солнца вызывает ионизацию кислорода и азота (N2) в их молекулярных формах.
Вот, что такое ионизация в популярном виде.