Что такое энергетический подуровень
Что такое энергетический уровень в химии?
Строение веществ было интересно людям с той поры, как возникла возможность не беспокоиться о пропитании и изучать окружающий мир. Такие явления, как засухи, наводнения, молнии, ужасали человечество. Незнание их объяснений порождало веру в различных злых богов, требующих жертв. Именно поэтому люди начали изучать природные явления, стремясь к их предсказанию, и углубляться в строение веществ. Они изучили строение атома и ввели следующие два важных понятия в химии: энергетический уровень и подуровень.
Предпосылки к открытию мельчайших химических веществ

О маленьких частицах, из которых состоят вещества, догадались еще древние греки. Они сделали странное открытие: мраморные ступени, по которым за несколько десятилетий прошло множество людей, изменили свою форму! Это привело к выводу о том, что ступня прошедшего забирает какую-то частичку камня с собой. Данное явление далеко от понимания существования энергетического уровня в химии, но именно с него все началось. Наука начала прогрессивно развиваться и углубляться в строение химических элементов и их соединений.
Начало изучения строения атома
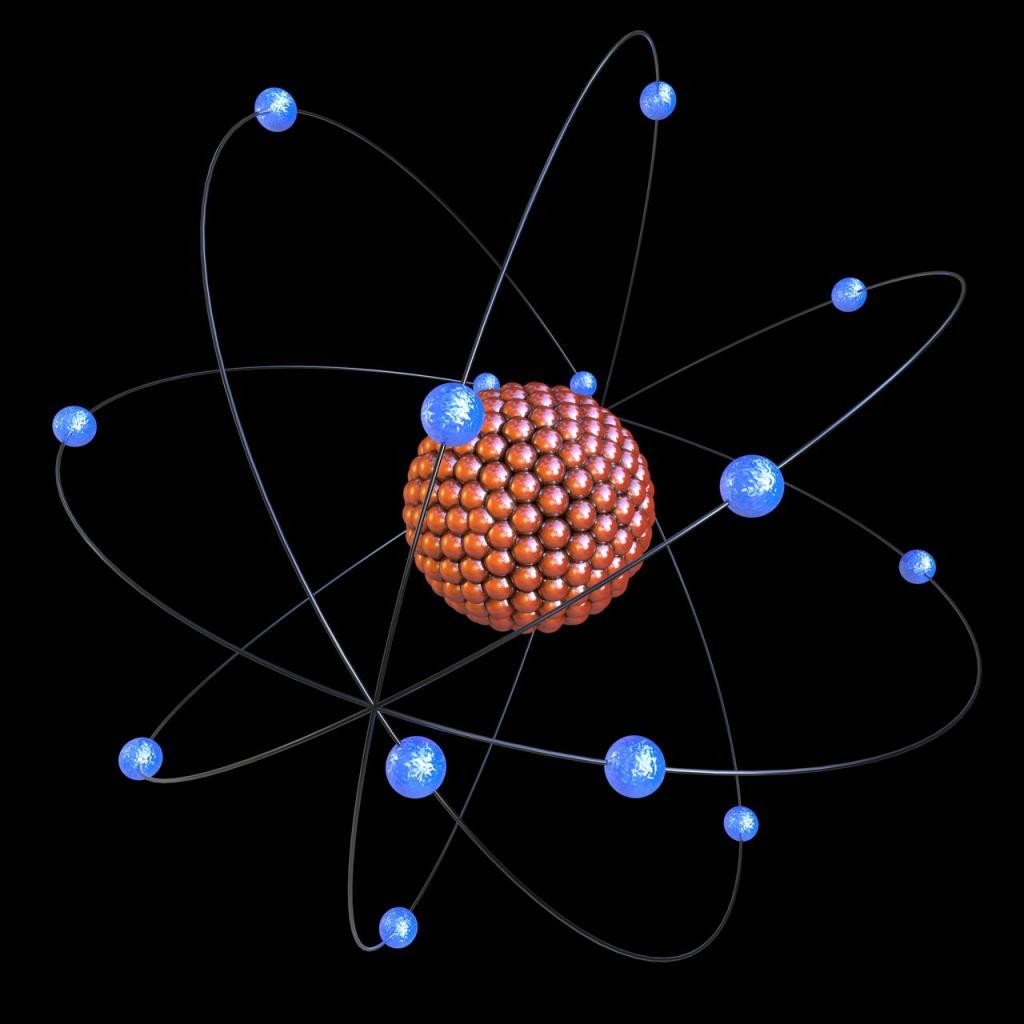
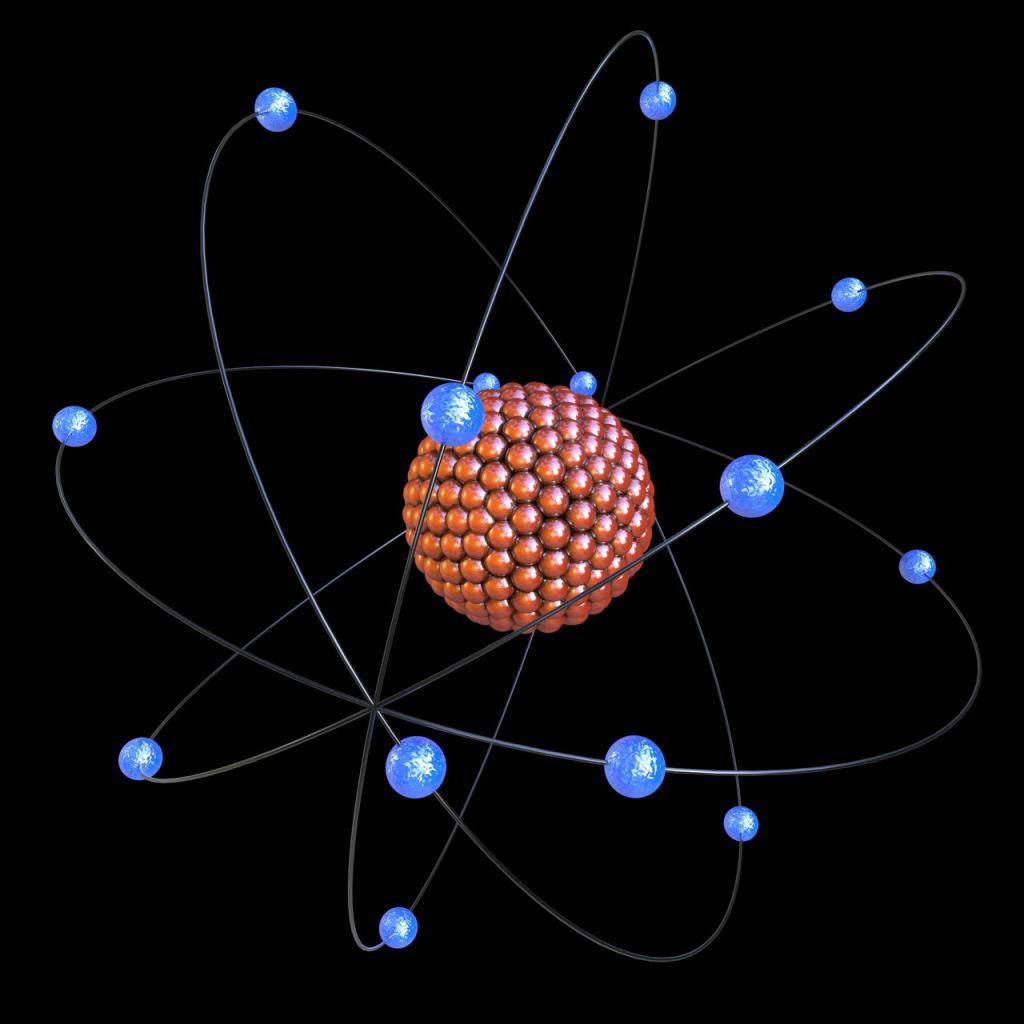
В начале XX века посредством опытов с электричеством был открыт атом. Он считался электронейтральным, но имел положительные и отрицательные составные частицы. Ученые хотели выяснить их распределение внутри атома. Было предложено несколько моделей, одна из которых даже имела название «булочка с изюмом». Британский физик Эрнест Резерфорд провел опыт, который показал, что в центре атома расположено положительное ядро, а отрицательный заряд находится в маленьких электронах, вращающихся вокруг него.
Открытие энергетического уровня в химии стало большим прорывом в изучении строения веществ и явлений.
Энергетический уровень
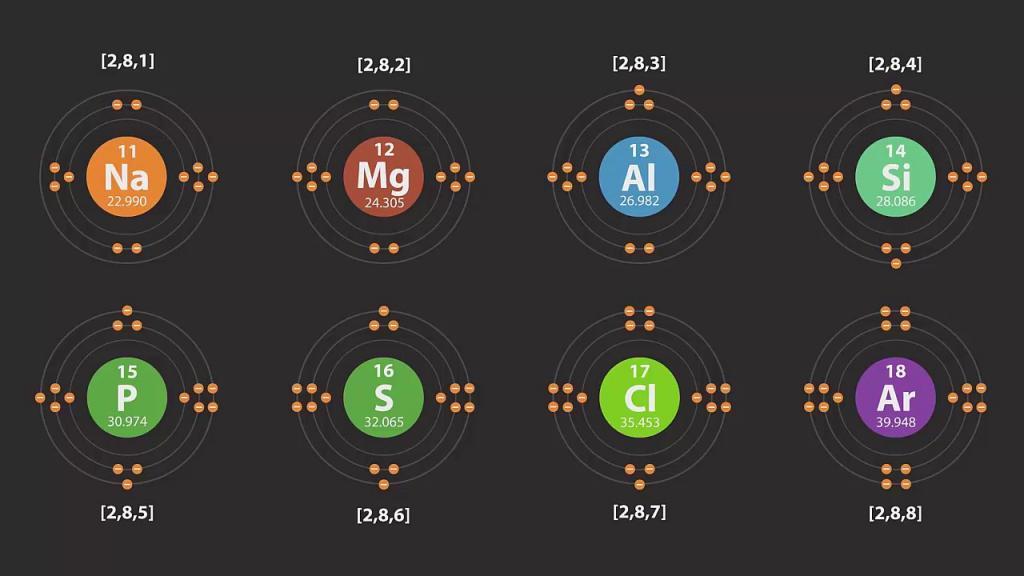
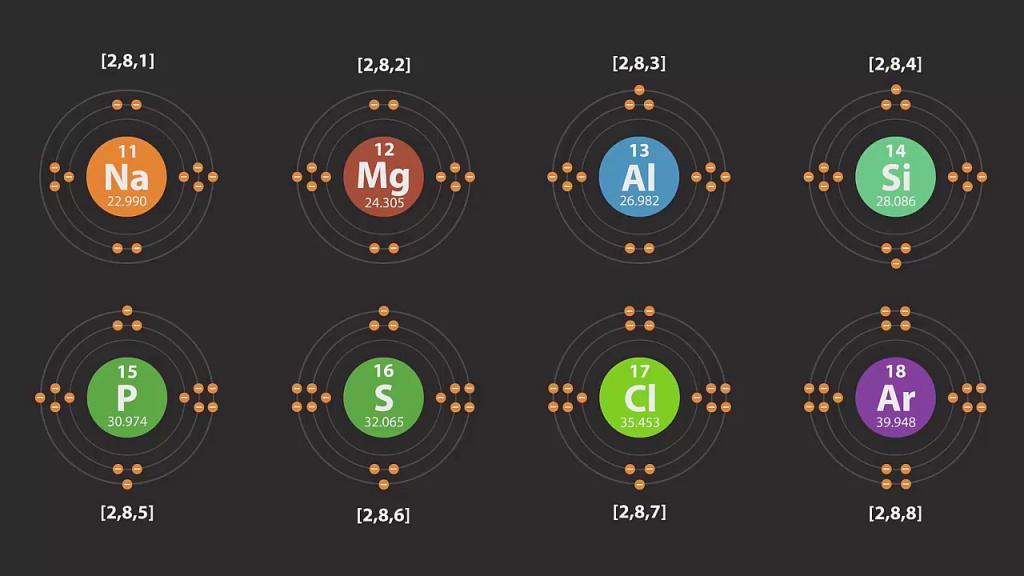
У каждого атома есть уровень, находящийся от его ядра дальше других. Он является крайним, или последним, и называется внешним энергетическим уровнем. Число электронов на нем для элементов главных подгрупп равняется номеру группы.
Для построения схемы атома и его энергетических уровней в химии нужно следовать такому плану:
Примеры схем строения энергетических уровней некоторых элементов смотрите ниже.
Энергетические подуровни
В атомах, помимо энергетических уровней, существуют еще и подуровни. На каждом уровне, в зависимости от числа электронов на нем, заполняются определенные подуровни. От того, как подуровень заполняется, различают четыре типа элементов:
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
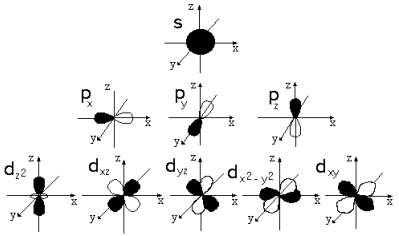
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Строение электронной оболочки атома
Атом состоит из ядра и электронной оболочки.
Электронная оболочка атома – это совокупность всех электронов в данном атоме.
Химические свойства элементов определяются строением электронных оболочек их атомов.
В 20-х годах ХХ в. ученые установили, что электрон имеет двойственную природу: он является одновременно частицей и волной (имеет свойства частицы и свойства волны).
Представление о двойственной природе электрона привело к созданию квантово-механической теории строения атома.
Согласно этой теории, электрон (как и другие микрочастицы) не имеет определенной траектории движения. Можно говорить только о вероятности нахождения электрона в разных частях атомного пространства.
Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (равна 90%), называется атомной орбиталью.
Каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве.
Для характеристики орбиталей и электронов используются квантовые числа.
Энергия и размер орбитали и электронного облака характеризуются главным квантовым числом n.
Главное квантовое число принимает значения целых чисел от 1 до ∞(бесконечности): n = 1, 2, 3, 4, 5, 6, 7…∞
Орбитали, которые имеют одинаковое значение n, близки между собой по энергии и по размеру.
Совокупность орбиталей, которые имеют одинаковое значение главного квантового числа, — это энергетический уровень.
Энергетические уровни обозначаются большими буквами латинского алфавита.
Совокупность электронов, которые находятся на одном энергетическом уровне, — это электронный слой.
На одном энергетическом уровне могут находиться орбитали (электронные облака), которые имеют различные геометрические формы.
Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l.
Для орбиталей данного энергетического уровня побочное (орбитальное) квантовое число принимает значения целых чисел от 0 до n-1.
Орбитали, для которых l = 0, имеют форму шара (сферы) и называются s-opбиталями (условно изображаются в виде окружности):
s –орбитали имеются на всех энергетических уровнях.
На K-уровне (на первом энергетическом уровне) имеется только s-орбиталь.
Орбитали, для которых l=1, имеют форму гантели и называются р-орбиталями:
р-Орбитали имеются на всех энергетических уровнях, кроме первого (K) уровня.
Орбитали с большими значениями l имеют более сложную форму и обозначаются так:
l = 2: d-орбитали;
l = 3: f-орбитали.
d-Орбитали есть на всех энергетических уровнях, кроме первого (K) и второго (L) уровней.
f-Oрбитали есть на всех энергетических уровнях, кроме первого (K), второго (L) и третьего (М) уровней.
Энергия орбиталей (Е), которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова:
Итак, каждая орбиталь и электрон, который находится на этой орбитали, характеризуются тремя квантовыми числами: главным n, побочным l и магнитным m1.
Электрон характеризуется еще одним — спиновым квантовым числом (от англ. to spin — кружить, вращать).
Спиновое квантовое число (спин электрона) ms, характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и – 1/2.
Схематично это можно показать так:
Электрон со спином +1/2 — условно изображают так: ↑; со спином —1/2: ↓
Принцип Паули гласит:
В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Поэтому на одной орбитали не может быть больше двух электронов; эти два электрона имеют одинаковый набор трех квантовых чисел (n, l, m1) и должны отличаться спинами (спиновым квантовым числом ms:
Два электрона, которые находятся на одной орбитали, называются спаренными (или неподеленной электронной парой). Спаренные электроны являются электронами с противоположными (антипараллельными) спинами.
Что такое энергетический уровень в химии?
Строение веществ было интересно людям с той поры, как возникла возможность не беспокоиться о пропитании и изучать окружающий мир. Такие явления, как засухи, наводнения, молнии, ужасали человечество. Незнание их объяснений порождало веру в различных злых богов, требующих жертв. Именно поэтому люди начали изучать природные явления, стремясь к их предсказанию, и углубляться в строение веществ. Они изучили строение атома и ввели следующие два важных понятия в химии: энергетический уровень и подуровень.
Предпосылки к открытию мельчайших химических веществ

О маленьких частицах, из которых состоят вещества, догадались еще древние греки. Они сделали странное открытие: мраморные ступени, по которым за несколько десятилетий прошло множество людей, изменили свою форму! Это привело к выводу о том, что ступня прошедшего забирает какую-то частичку камня с собой. Данное явление далеко от понимания существования энергетического уровня в химии, но именно с него все началось. Наука начала прогрессивно развиваться и углубляться в строение химических элементов и их соединений.
Начало изучения строения атома
В начале XX века посредством опытов с электричеством был открыт атом. Он считался электронейтральным, но имел положительные и отрицательные составные частицы. Ученые хотели выяснить их распределение внутри атома. Было предложено несколько моделей, одна из которых даже имела название «булочка с изюмом». Британский физик Эрнест Резерфорд провел опыт, который показал, что в центре атома расположено положительное ядро, а отрицательный заряд находится в маленьких электронах, вращающихся вокруг него.
Открытие энергетического уровня в химии стало большим прорывом в изучении строения веществ и явлений.
Энергетический уровень
У каждого атома есть уровень, находящийся от его ядра дальше других. Он является крайним, или последним, и называется внешним энергетическим уровнем. Число электронов на нем для элементов главных подгрупп равняется номеру группы.
Для построения схемы атома и его энергетических уровней в химии нужно следовать такому плану:
Примеры схем строения энергетических уровней некоторых элементов смотрите ниже.
Энергетические подуровни
В атомах, помимо энергетических уровней, существуют еще и подуровни. На каждом уровне, в зависимости от числа электронов на нем, заполняются определенные подуровни. От того, как подуровень заполняется, различают четыре типа элементов:
Энергетический уровень, подуровень, орбиталь, типы орбиталей.



Энергетический уровень – совокупность всех орбиталей с одним и тем же значением n. Число уровней, на котором находятся электроны в основном состоянии атома, совпадает с номером периода, в котором располагается элемент: 1, 2, 3 …
Энергетический подуровень – совокупность энергетических состояний электрона в атоме, характеризующихся одними и теми же значениями квантовых чисел n и l. Подуровни обозначаются: s, p, d, f …
I энергетический уровень – 1 подуровень
II энергетический уровень – 2 подуровеня
III энергетический уровень – 3 подуровеня
Орбиталь – область пространства, наиболее вероятного пребывания электрона в электр. Поле ядра атома. Орбитали характеризуются квантовыми числами.
Принцип Паули и следствие из него:
В атоме не может быть 2-х электронов, которые бы имели одинаковый набор всех 4-х квантовых чисел.
Следствием этого принципа является тот факт, что в атоме последовательно заполняются все орбитали.
Принцип наименьшей энергии:
Принцип определяет последовательность заполнения орбиталей электронами, в основном состоянии атома каждый электрон располагается так, чтобы его энергия была минимальной.
Основное состояние – это наиболее устойчивое состояние атома, в котором электроны занимают орбитали с наименьшей энергией.
Правило Гунда:
В основном состоянии атом имеет максимально возможное число неспаренных электронов в пределах определенного подуровня. Например, если на 2p-подуровне находятся три электрона. То они должны находиться на 3-х разных орбиталях:
 |  |  |
В этом случае суммарный спин максимален и равен 3/2.
Электронные формулы (конфигурации) атомов:
Электронная конфигурация – формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
Для легких орбиталей любой период начинается с s-орбитали, а заканчивается p-орбиталью (кроме 1-го). Если присутствуют несколько тяжелых орбиталей, то сначала заполняется та, чья pi меньшая.
Последовательность заполнения орбиталей электронами определяется принципом наименьшей энергии: в основном состоянии атома каждый электрон располагается так, чтобы его энергия была минимальной.
Физический смысл периодического закона состоит в том, что при последовательном возрастании зарядов ядер главного квантового числа, периодически повторяется сходные валентные электронные структуры атомов, и как следствие, периодически повторяются химические свойства элементов
Периодическая система элементов:
Периодическая система элементов – классификация химических элементов, графически изображаемая в виде периодической таблицы. Она состоит из семи периодов (десяти рядом) и восьми групп.
В этой системе Менделеев разделил все элементы на периоды и расположил один период под другим так, чтобы сходные по свойствам и типу образуемых соединений элементы приходились друг под другом.