что делают при цитокиновом шторме
Цитокиновый шторм при коронавирусе
Важное о коронавирусе
Коронавирусная инфекция в первую очередь опасна своими осложнениями. Вирус агрессивно действует на ткани, негативно влияет на работу иммунной системы, провоцирует сердечно-сосудистые и неврологические нарушения. Одним из грозных последствий заболевания врачи называют цитокиновый шторм при ковиде, который протекает очень тяжело и может быть потенциально смертельным.
Что такое цитокиновый шторм при коронавирусе
Медики описывают это состояние как системную воспалительную реакцию, которая протекает бесконтрольно и характеризуется чрезмерной выработкой воспалительных цитокинов. Если объяснять простыми словами, цитокиновый шторм — слишком активная работа иммунной системы, когда организм начинает атаковать сам себя.
Чтобы было понятнее, стоит поговорить о том, что такое цитокины. Так называются регуляторные белковые молекулы, которые вырабатываются иммунными клетками, контролируют процессы воспаления и клеточной защиты от чужеродных веществ и патогенных возбудителей. В норме они синтезируются в умеренном количестве, помогают организму справляться с болезнями.
Если таких молекул образуется слишком много, вместо реакции с вирусами или бактериями, они начинают взаимодействовать с собственными тканями организма, вызывая ухудшение здоровья и отягощая симптомы коронавируса.
Кандидат биологических наук, врач-иммунолог Борис Донской для описания гиперцитокинемии приводит метафору с физической нагрузкой: “Вы требуете от сердца «обслужить» дополнительную нагрузку? Оно будет пытаться выполнить ваше требование, запустив «режим» высокого пульса в 200 ударов в минуту и высокого давления. Но не каждое сердце может это выдержать и на определенном этапе функционирования в таком режиме оно само себя и убьет. Примерно то же происходит и при цитокиновом шторме”.
Причины шторма
Гиперцитокинемия возникает не только при коронавирусной инфекции. Она сопровождает многие тяжелые заболевания, которые приводят к нарушениям защитных сил организма и развитию аутоагрессии. Ученые предполагают, что провоцирующим фактором шторма является недостаток отдельных фракций Т-лимфоцитов, отвечающих за регуляцию иммунного ответа, на фоне чего формируется неконтролируемый выброс провоспалительных агентов.
Причины неадекватного цитокинового выброса:
Недавно американские ученые установили еще одно возможное звено патогенеза выброса цитокинов. Врачи выявили, что увеличение уровня молекул микроРНК miR-155 повышает риск развития синдрома, причем такая особенность более характерна для мужчин.
Кто в группе риска
Чаще всего патология возникает у пожилых пациентов, у которых нарушен нормальный иммунный ответ и не хватает Т-лимфоцитов, которые могли бы регулировать образование цитокинов. В такой ситуации формируется “порочный круг”, когда повышенное количество цитокинов стимулирует новые клетки иммунные системы, которые в свою очередь продуцируют очередные порции провоспалительных молекул.
Парадоксально, что в группе риска также находятся молодые люди спортивного телосложения. Врач Олег Назар поясняет ситуацию: “Кстати, у спортсменов тоже может не хватать иммунных клеток, потому что белок, из которого они строятся, идет на постройку мышечной массы”. Вероятность развития шторма в этой группе еще больше повышается, если человек недополучает белок, придерживается вегетарианского рациона.
Выделяют и другие факторы риска:
Симптомы цитокинового шторма
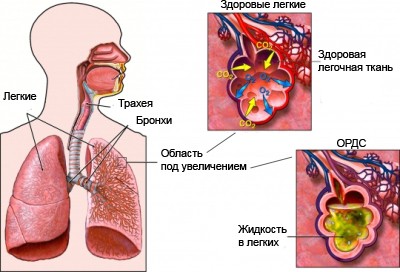
Патологическая иммунная реакция негативно влияет на все органы и системы, но первыми повреждаются легкие — развивается острый респираторный дистресс-синдром. Как объясняет медицинский директор “СберЗдоровье” Владислав Мохаммед Али: “Цитокиновый шторм — это каскад биохимических реакций, в котором задействованы факторы, «отвечающие» за воспалительные процессы в организме. При цитокиновом шторме поражаются в первую очередь легкие, но также страдают и другие органы”.
У человека с гиперцитокинемией на фоне КОВИД-19 могут быть такие клинические проявления:
Как выявляют
По клиническим проявлениям невозможно с точностью определить заболевание, поэтому пациенту назначают лабораторное тестирование. Результаты анализов крови при цитокиновом шторме:
Дополнительно при гиперцитокинемии проводится КТ легких, в котором обнаруживают очаговые инфильтраты или тотальное поражение паренхимы по типу “матового стекла”.
На какой день начинается
Чаще всего выброс цитокинов происходит на фоне пневмонии при коронавирусе, но может возникать и при легком течении КОВИД-19. Самым опасным считается период с 8 по 10 день заболевания. В это время при положительном сценарии происходит регресс симптоматики, а в случае неблагоприятного течения возникают осложнения.
Обратите внимание! Зачастую перед появлением признаков цитокинового шторма при коронавирусе возникает временное улучшение состояния, что вводит пациента в заблуждение.
Сколько длится
Продолжительность нарушений зависит от своевременности и полноты терапии, исходного состояния иммунной системы, наличия сопутствующих болезней у коронавирусного пациента. Если проявления замечены на ранней стадии, комплексной терапией их удается купировать за 2-3 суток, а в тяжелых случаях пациенты лечатся в течение 3-4 недель.
Что происходит в результате цитокинового шторма?
При гиперцитокинемии симптомы вызваны не самим вирусом, а вторичными реакциями, которые он запустил при взаимодействии с иммунными клетками. В результате накопления большого количества провоспалительных агентов поражается ткань альвеол, наблюдается интерстициальное воспаление и пропотевание жидкости из сосудов в ткани, из-за чего нарушается газообмен.
Цитокиновый синдром при коронавирусной инфекции всегда сопровождается тяжелыми нарушениями дыхания и гипоксией, что приводит к неврологическим и полиорганным нарушениям.
Еще один механизм негативного влияния гиперцитокинемии — повреждение тромбоцитов и эритроцитов. При этом нарушается свертываемость крови, могут возникать тромбозы или спонтанные кровотечения.
Лечение цитокинового шторма при ковиде
При наличии хотя бы одного настораживающего признака и подозрении на гиперцитокинемию пациента немедленно госпитализируют в стационар. Терапию начинают после сокращенного обследования, врачи стараются как можно раньше начать патогенетические препараты.
В протоколах по ведению цитокинового шторма при коронавирусе указаны такие группы медикаментов:
Помимо этих лекарств, пациенту могут назначать противовирусные, кардиотропные, общеукрепляющие препараты. Для предупреждения вторичной бактериальной инфекции используются антибиотики пенициллинового ряда или макролида.
Сосудистые нарушения при выбросе цитокинов зачастую сопровождаются снижением артериального давления и шоковым состоянием. Для его коррекции вводятся вазопрессоры (Норадреналин, Добутамин).
Можно ли остановить цитокиновый шторм
С гиперцитокинемией возможно бороться в условиях интенсивной терапии с применением большого количества специфических медикаментов. Чем раньше будет диагностирована болезнь и чем быстрее начнется лечение, тем больше у человека шансов полностью выздороветь.
К сожалению, цитокиновый синдром не всегда поддается лечению. Это патологическое состояние составляет до 70% причин смерти коронавирусных пациентов.
Последствия цитокинового шторма
Цитокиновая буря негативно влияет на весь организм, вызывая такие патологические состояния:
Все указанные последствия при гиперцитокинемии могут возникать в короткие сроки, поэтому очень важно знать, как проявляется цитокиновый шторм при коронавирусе, чтобы вовремя обратиться к врачу.
Как предотвратить цитокиновый шторм при COVID-19
Учитывая сложные патогенетические механизмы и множество провоцирующих факторов, специфические профилактические меры при гиперцитокинемии отсутствуют. Чтобы минимизировать риски для пациента, необходимо проводить правильное и комплексное лечение типичного сценария коронавируса, выполняя все предписания клинических рекомендаций Минздрава РФ.
Профессор Медицинской школы Университета Кейс Вестерн (США) Майкл Ледерман обращает внимание на раннюю диагностику иммунных нарушений, которая поможет избежать развернутой клинической картины цитокиновой бури. Врач указывает на решающее значение уровней Д-димера, СРБ интерлейкинов, который нужно оценивать в динамике. Это позволяет с высокой точностью спрогнозировать начало гиперцитокинемии и вовремя предпринять меры.
Советы врачей при цитокиновом шторме
Врач-терапевт Людмила Лапа предостерегает пациентов, что в список лекарств, которые нельзя принимать при COVID-19, входят витамины. Эти на первый взгляд безобидные препараты могут вызывать нарушения в иммунном ответе и запустить каскад патологических реакций.
Профессор МГМСУ им. Евдокимова Андрей Мальвин напоминает о важности регулярного контроля сатурации у пациентов, которые лечатся дома. По словам специалиста, снижение показателя менее 95% — фактор риска развития цитокинового шторма, поэтому такому больному нужно немедленно связаться с врачом для принятия решения о госпитализации.
Кандидат медицинских наук, аллерголог-иммунолог Дарья Фомина на онлайн-конференции, посвященной гиперцитокинемии при ковиде. подчеркнула важность раннего назначения иммуносупрессивной терапии. Врач пояснила, что в таком случае появляется шанс на более быстрое выздоровление пациентов и снижается вероятность жизнеугрожающих осложнений.
Отзывы переболевших с цитокиновым штормом
Я раньше в эту заразу не особо верил, думал, что это обычный грипп, как мы каждый год болеем. Но теперь, когда пролежал 3 недели в больнице, понимаю, что все намного страшнее. У меня сначала была пневмония, но без сильной одышки и кислород в крови в норме, поэтом лечился дома. Через неделю резко подскочила температура, стала сильно болеть грудь и был постоянный кашель. Меня забрали в больницу, там сделали анализы и выяснили, что кроме воспаления легких есть цитокиновая буря. Мне уже было так плохо, что почти все время лежал под кислородной маской, постоянно кололи лекарства. Через неделю полегчало, но выписался только через 3 недели.
Валерий, 48 лет
Я переболела в средней форме, все время была дома. Купила себе пульсоксиметр, постоянно следила за кислородом и была на связи с врачом по вайберу. А вот мужу моему не повезло. Его забрали в стационар с двусторонней пневмонией, потом сказали, что начался шторм и нужно давать гормоны. Он был сначала на кислороде, а потом несколько дней на ИВЛ. Всего лечение заняло более 1,5 месяцев. Сейчас муж уже дома, но очень слабый, у него обострились проблемы с почками.
Ольга, 57 лет
Вот уж не думала, что у меня будет ковид, да еще и в тяжелой форме, поскольку я вообще редко болею, несколько лет закаляюсь и занимаюсь спортом. Но болезнь оказалась очень коварной. Меня из дома забрали на скорой с температурой под 40 градусов и сильной одышкой. В больнице лечили противовирусными и гормонами. На фоне цитокинового шторма были сильно повреждены легкие, поэтому я неделю лежала с кислородной маской. К счастью, вроде бы все обошлось, после выздоровления никаких осложнений у меня не нашли.
Диана, 25 лет
Мы с мужем оба тяжело переболели, в больнице провели почти месяц, и большую часть времени были на кислороде. Как нам терапевт уже потом объяснил, кроме пневмонии и проблем с сердцем, начался цитокиновый шторм, поэтому были осложнения на все органы. У меня после ковида начались проблемы с почками, и врач сказал, что это тоже из-за цитокинов.
Наталья, 63 года
Цитокиновый шторм после коронавируса — опасное и потенциально смертельное осложнение, возникающее при неадекватной реакции иммунной системы и накоплении в крови провоспалительных веществ. Состояние проявляется фебрильной лихорадкой, дыхательной недостаточностью, нарушениями свертываемости крови, патологиями внутренних органов. При гиперцитокинемии нужно как можно раньше начинать лечение иммуносупрессорами, чтобы сохранить жизнь и здоровье пациенту.
Видео о главных ошибках в лечении ковида
Что делают при цитокиновом шторме
В связи с пандемией коронавируса все чаще мы стали слышать про цитокиновый шторм, который является следствием заражения вирусными инфекциями, в том числе SARS-CoV-2. Что это такое? Почему он появляется при COVID-19? Давайте разбираться вместе.
Начнем с того, что такое цитокины. Цитокины – группа информационных гормоноподобных белков и пептидов, которые выделяются клетками иммунной системы и некоторыми другими. При атаке вирусной инфекции, организм начинает усиленно вырабатывать эти молекулы. Они выполняют четыре функции:
• управляют различными иммунными реакциями (гомеостаз, восстановление);
• регулируют гемопоэз (кровотворение).
Избыточная выработка цитокиновых молекул приводит к цитокиновому шторму.
Цитокиновый шторм – агрессивная иммунная реакция организма на вирусную инфекцию и лекарственные препараты, влекущее за собой системное воспаление и нарушение правильной работы иммунитета. При цитокиновом шторме в организме нарушается функция свертываемости крови, вырабатывается избыточное количество медиаторов воспаления, а также очагов разрушения собственных клеток и тканей. При усилении этих процессов иммунная реакция становится неконтролируемой – интерфероны, хемокины, ФНО (факторы некорза опухоли) и другие молекулы из группы цитокинов начинают активно высвобождаться.
При развитии цитокинового шторма, в ответ на атаку вируса, возникает иммуно-воспалительная реакция, из-за которой уровень цитокинов резко возрастает – именно поэтому заболевание имеет в названии слово «шторм». Лимфоциты атакуют не только инфекционный возбудитель, но и жизненно важные клетки, в результате чего прекращается работа целых органов.
Главная опасность цитокинового шторма при COVID-19 – иммунная недостаточность, т.к. она облегчает присоединение бактериальных инфекций. Воспалительный процесс и системное повреждение тканей может привести к нарушению работы внутренних органов и смерти.
На данный момент механизм развития цитокинового шторма до конца не изучен, однако COVID-19 является одной из причин его возникновения. Вы можете постараться избежать заражения путем вакцинации и соблюдения всех мер предосторожности. Будьте здоровы.
Критический анализ концепции «цитокиновой бури» у пациентов с новой коронавирусной инфекцией COVID-19. Обзор литературы
1 ГБУЗ «Городская клиническая больница №40» ДЗМ, Москва, Россия
2 ФГАОУ ВО «Национальный исследовательский медицинский университет им. Н.И. Пирогова» МЗ РФ, Москва, РФ
Для корреспонденции: Самойленко Валерий Вячеславович — канд. мед. наук, заведующий терапевтическим отделением ГБУЗ ГКБ № 40 ДЗМ, Москва, Россия; e-mail: vvsamdoctor@gmail.com
Для цитирования: С.С. Бобкова, А.А. Жуков, Д.Н. Проценко, В.В. Самойленко, И.Н. Тюрин. Критический анализ концепции «цитокиновой бури» у пациентов с новой коронавирусной инфекцией COVID-19. Обзор литературы. Вестник интенсивной терапии им. А.И. Салтанова. 2021;1:57–68. DOI: 10.21320/1818-474X-2021-1-57-68
Реферат
Актуальность. Новая коронавирусная инфекция, вызванная вирусом SARS-CoV-2, характеризуется системной гипервоспалительной реакцией с выраженным повышением содержания провоспалительных цитокинов, получившей название «цитокиновая буря». По современным представлениям, «цитокиновая буря» является ведущей причиной развития тяжелой клинической картины COVID-19 и прогрессирования заболевания до полиорганной недостаточности.
Цель исследования. Проведение критического анализа концепции «цитокиновой бури» у пациентов с COVID-19 на основании данных литературы.
Результаты. При сравнении цитокинового ответа при COVID-19 и других синдромах, характеризующихся феноменом «цитокиновой бури», в частности гемофагоцитарного лимфогистиоцитоза и синдрома высвобождения цитокинов, выявляются существенные различия, и поэтому патогенез возникновения нарушений цитокинового ответа при COVID-19 нуждается в дальнейшем уточнении. К настоящему времени накоплены клинические данные, свидетельствующие о потенциальной пользе применения противовоспалительной иммуномодулирующей терапии у пациентов с тяжелым течением COVID-19. Несмотря на проведенные многочисленные исследования по оценке эффективности и безопасности таргетной терапии иммуномодулирующими препаратами, однозначных выводов и рекомендаций по их применению нет. Кроме того, результаты ряда работ ставят под сомнение ведущую роль «цитокиновой бури» в патогенезе прогрессирования COVID-19.
Заключение. Имеющиеся данные позволяют предположить, что нарушение регуляции цитокинового ответа является одним из механизмов, лежащих в основе прогрессирования COVID-19 и развития органной недостаточности. В то же время выраженность данных нарушений у части больных не позволяет объяснить развитие тяжелых осложнений, в связи с чем необходим поиск альтернативных патогенетических механизмов.
Ключевые слова: COVID-19, SARS-CoV-2, цитокины, «цитокиновая буря», гипервоспалительный синдром, иммуномодулирующая терапия
Поступила: 08.02.2021
Принята к печати: 05.03.2021
Функции цитокинов
Цитокины представляют собой уникальную группу эндогенных полипептидных медиаторов межклеточного взаимодействия, включающую в настоящее время около 300 молекул, объединенных в несколько семейств. История изучения цитокинов насчитывает несколько десятилетий, но сам термин «цитокины» был предложен в 1974 г. Стэнли Коэном, предположившим, что гуморальные факторы, секретируемые из клетки, не являются исключительной особенностью лимфоцитов и моноцитов, как считалось ранее, когда данные вещества подразделялись на лимфокины и монокины [1]. В 1990 гг. было открыто субъединичное строение цитокиновых рецепторов и сформировано понятие «цитокиновая сеть». Таким образом, система цитокинов представляет собой универсальную регуляторную сеть медиаторов, предназначенных для контроля процессов пролиферации, дифференцировки и функциональной активности клеточных элементов в кроветворной, иммунной и в других системах организма [2, 3].
По механизму действия цитокины можно условно подразделить на следующие группы:
Цитокины ответственны за развитие местных защитных реакций в тканях с участием различных типов клеток крови, эндотелия, эпителия и соединительной ткани. На местном уровне цитокины регулируют все последовательные этапы развития воспаления и адекватность ответа на внедрение патогена. Адекватность воспалительного ответа степени повреждения является основным условием сохранения защитной функции воспалительной реакции [6–8].
«Цитокиновая буря»
Гиперпродукция цитокинов приводит к развитию системной воспалительной реакции, нарушению функции отдаленных органов, при этом дальнейшее нарастание концентрации может служить причиной развития ряда критических состояний, в частности, септического шока и полиорганной недостаточности [9–11].
В последние годы для образного описания потенциально фатальной, неконтролируемой генерализованной воспалительной реакции, вызванной нарушением регуляции цитокинов с их массивным высвобождением и избыточным поступлением в периферическую кровь, стал широко применяться термин «цитокиновая буря» [12–14], впервые использованный в 1993 г. Джеймсом Феррарой у пациентов с реакцией «трансплантат против хозяина» [15]. До начала пандемии, вызванной новой коронавирусной инфекцией, феномен «цитокиновой бури» был описан при целом ряде вирусных инфекций [16, 17], включая цитомегаловирусный пневмонит [18], лихорадку денге [19], хантавирусную инфекцию [20], грипп [21–23], тяжелый острый респираторный синдром (Severe acute respiratory syndrome, SARS) [24–26] и ближневосточный респираторный синдром (Middle East respiratory syndrome, MERS) [26].
Для объяснения патофизиологических механизмов возникновения феномена «цитокиновой бури» было предложено несколько теорий [27, 28].
Теория «суперантигена». В обычных условиях активация Т-клеток происходит только тогда, когда специфический антиген, связанный с молекулами главного комплекса гистосовместимости II класса, взаимодействует с рецепторами Т-клеток (ТКР), что приводит к активации специфического клона Т-клеток, который начинает пролиферировать. Однако некоторые бактерии обладают способностью образовывать суперантиген (стафилококковый токсин), который связывается с Vβ-областью ТКР. Это связывание не характеризуется какой-либо специфичностью, в результате чего происходит активация значительного количества T-клеток (до 20 % общего количества Т-клеток организма), что, в свою очередь, приводит к массивному высвобождению цитокинов и развитию феномена «цитокиновой бури» [29]. Классическим примером данного механизма является синдром инфекционно-токсического шока при стафилококковой или стрептококковой инфекции [30].
Нарушение цитолитического пути. CD8 T-клетки (цитотоксические T-клетки) и естественные киллеры (NK-клетки) играют важную роль в защите от внутриклеточных инфекций, в частности вирусных. Данный процесс представляет собой уничтожение инфицированных клеток за счет высвобождения перфорина и гранзимов — цитотоксических белков, содержащихся в гранулах Т-лимфоцитов и NK-лимфоцитов естественных киллеров (цитолитический путь). Нарушение цитолитического пути приводит к избыточному образованию цитокинов (ведущую роль играет ИФН-γ), и наиболее характерным примером развития феномена «цитокиновой бури» по данному механизму является гемофагоцитарный лимфогистиоцитоз [31].
Дефекты врожденного иммунитета. Toll-подобные рецепторы (TLR), опосредующие распознавание молекулярных структур патогенов, экспрессируются на клетках разных типов, инициируя развитие иммунных реакций при связывании с различными лигандами. Дефекты путей передачи, связанных с TLR, могут приводить к аберрантной активации иммунной системы и развитию феномена «цитокиновой бури» [32].
Иммунодефицитные состояния. Пациенты с первичным иммунодефицитом обладают ограниченными возможностями для полной элиминации патогена из организма. Персистирующая инфекция запускает механизм высвобождения цитокинов, что приводит к развитию гемофагоцитарного лимфогистиоцитоза. Например, данный синдром развивается на фоне инфекции вирусом Эпштейна—Барр у пациентов с лимфопролиферативным синдромом, сцепленным с Х-хромосомой [33, 34].
Патогенетические варианты синдрома «цитокиновой бури»
Феномен «цитокиновой бури» является в большей степени описательным термином, который охватывает различный спектр клинических проявлений и изменений лабораторных показателей и не имеет четко определенных диагностических критериев. В то же время в рамках данного феномена можно выделить несколько его патогенетических вариантов, представленных вполне сложившимися клинико-лабораторными синдромами.
Синдром высвобождения цитокинов, СВЦ (Cytokine release syndrome, CRS). Термин был впервые использован в 1980-х гг. для описания клинических проявлений «цитокиновой бури» после инфузии муромонаба-CD3 (OKT3) [35]. В последующем этот термин занял прочное место при описании осложнений, связанных с противоопухолевой терапией модифицированными Т-клетками с химерным антигенным рецептором к CD19 (Chimeric Antigen Receptor T-Cell, СAR-T) и моноклональными антителами [36, 37]. При развитии СВЦ наблюдается быстрое и массивное освобождение цитокинов в кровоток, источником которых являются как CAR Т-клетки, так и вторичные клетки-эффекторы. Клиническими проявлениями СВЦ выступают высокая лихорадка, общее недомогание, усталость, миалгия, тошнота, анорексия, тахикардия/гипотония, сердечная дисфункция, почечная и печеночная недостаточность и диссеминированная внутрисосудистая коагуляция. Тяжелое течение СВЦ может привести к полиорганной недостаточности и летальному исходу [38].
Что касается диагностических критериев СВЦ, то они включают в себя типичные клинические проявления (наиболее существенные — лихорадка, а также наличие не менее одного признака органной токсичности: гипотония, гипоксемия, неврологические проявления), лабораторные критерии «цитокиновой бури» (повышение активности С-реактивного белка, ИЛ-6, ферритина и т.д.) и недавнее лечение любым биологическим препаратом [39].
В настоящее время существует несколько классификаций СВЦ, например, классификация по степени тяжести в Общих терминологических критериях для обозначения нежелательных явлений (Common Terminology Criteria for Adverse Events, CTCAE v.5), Lee Grading Scale, MD Anderson Grading Scale, Penn Grading Scale, на основании которых выделяют 4 степени тяжести синдрома. Наиболее часто используется классификация CTCAE v5.0, в соответствии с которой 1-я степень тяжести включает в себя лихорадку; 2-я степень — артериальную гипотонию, для коррекции которой достаточно введение жидкости, и гипоксемию, отвечающую на респираторную поддержку с фракцией вдыхаемого кислорода (FiO2) 0,4; 4-я степень — жизнеугрожающее состояние. СВЦ имеет собственный код в МКБ-10 — D89.83. В 2017 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) одобрило применение препарата тоцилизумаб для лечения вызванного CAR T-клетками тяжелого или жизнеугрожающего синдрома высвобождения цитокинов у пациентов от двух лет и старше [40].
Гемофагоцитарный лимфогистиоцитоз, или гемофагоцитарный синдром, ГФС (Hemophagocytic lymphohistiocytosis, HLH), представляет собой тяжелую генерализованную воспалительную реакцию, в патогенезе которой ключевую роль играет активация макрофагов, цитотоксических лимфоцитов и естественных киллеров (NK-клеток), развитие лавинообразной гиперцитокинемии с тяжелыми вторичными тканевыми повреждениями. Впервые ГФС был описан J.W. Farquhar и А.Е. Claireaux в 1952 г. [41]. В соответствии с актуальной классификацией Международного гистиоцитарного общества первичный и вторичный ГФС относятся к H-группе гистиоцитозов. Первичный ГФС относится к аутосомно-рецессивным, генетически обусловленным заболеваниям, обычно развивается у детей первых лет жизни. Вторичный ГФС развивается на фоне инфекционного, опухолевого или аутоиммунного процесса. В 1979 г. Risdall et al. описали развитие ГФС на фоне вирусной инфекции [42]. К настоящему времени описано развитие вторичного ГФС у пациентов с инфекцией, вызванной вирусами Эпштейна—Барр, простого герпеса, гриппа, гепатита, иммунодефицита человека, а также цитомегаловирусной, парвовирусной, аденовирусной и коронавирусной инфекциями [43–45]. Клинически вторичный, или реактивный, ГФС проявляется, как правило, упорной лихорадкой, увеличением печени и селезенки, развитием полиорганной недостаточности, цитопении и вторичных инфекций. Для диагностики вторичного ГФС были разработаны критерии H-Score [46] (табл. 1).
Таблица 1. Диагностические критерии вторичного ГФС (H-Score) [46]
Table 1. H-score diagnostic criteria for secondary HLH [46]
Параметры
Баллы
Температура тела, °С:
гепато- ИЛИ спленомегалия
Количество угнетенных ростков кроветворения (гемоглобин 9 /л, и/или тромбоциты 9 /л):
Содержание ферритина в сыворотке крови, нг/мл:
Содержание триглицеридов в сыворотке крови, ммоль/л:
Содержание фибриногена в плазме, г/л:
Содержание аспартатаминотрансферазы сыворотки, МЕ/л:
2000 нг/мл и повышение содержания любого другого маркера воспаления или 2) повышение содержания ≥ 4 маркеров воспаления, включая C-реактивный белок > 70 мг/л; ферритин > 700 нг/мл, D-димер > 1000 нг/мл, триглицериды > 265 мг/дл, АСТ > 59 ЕД/л, ЛДГ > 300 ЕД/л, лимфопения 8000 клеток/мкл [67]. Диагностические критерии The COVID-19 Pandemic Health System REsilience PROGRAM (REPROGRAM) consortium включают в себя: повышение содержания одного из маркеров воспаления (ферритин > 1000 нг/мл, С-реактивный белок > 25 мг/л и повышение содержания ИЛ-6); наличие дыхательной недостаточности, двусторонней пневмонии и прогрессирующее увеличение потребности в неинвазивной респираторной поддержке; d-димер >1000 нг/мл, ЛДГ > 300 ЕД/л, лимфопения 0,5 нг/мл и АСТ > ЕД/л [68]. Наиболее сложную систему диагностических критериев синдрома «цитокиновой бури» при COVID-19 предложила исследовательская группа Temple University [69] (табл. 2).
Таблица 2. Диагностические критерии синдрома «цитокиновой бури» Temple University COVID-19 Research Group [69]
Table 2. Temple University COVID-19 Research Group diagnostic criteria for “cytokine storm” in COVID-19 [69]
Обязательные критерии:
1) клинические проявления инфекции;
2) лабораторное подтверждение инфекции;
3) характерные изменения на КТ;
4) ферритин > 250 нг/мл;
+ по 1 критерию из каждой группы дополнительных критериев:
группа I
группа II
группа III
альбумин 11,4 клеток/мкл
тропонин I > 1,09 нг/мл
анион. разн. 106 ммоль/л;
мочевина : креатинин > 29
АЛТ — аланинаминотрансфераза; анион. разн. — анионная разница; АСТ — аспартатаминотрансфераза, ЛДГ — лактатдегидрогеназа; мочевина : креатинин — соотношение мочевина/креатинин; СРБ — С-реактивный белок.
Кроме того, в рамках феномена «цитокиновой бури» при COVID-19 были сформулированы диагностические критерии еще двух самостоятельных клинико-лабораторных синдромов: мультисистемного воспалительного синдрома у взрослых (Multisystem Inflammatory Syndrome in Adults [MIS-A]) и гипервоспалительного синдрома [70] (табл. 3 и 4).
Таблица 3. Диагностические критерии мультисистемного воспалительного синдрома [71]
Table 3. Diagnostic criteria for Multisystem Inflammatory Syndrome in Adults (MIS-A) [71]
1. Тяжелые клинические проявления заболевания у пациентов ≥ 21 года, требующие стационарного лечения.
2. Подтвержденная коронавирусная инфекция, вызванная вирусом SARS-CoV-2.
3. Выраженное нарушение функции одной или более систем, кроме дыхательной (например, гипотензия или шок, артериальный или венозный тромбоз/эмболия, острое повреждение печени.
4. Лабораторные признаки выраженной воспалительной реакции (например, повышение содержания С-реактивного белка, ферритина, D-димера или ИЛ-6).
5. Отсутствие тяжелого поражения органов дыхания (для исключения ситуации, когда органная дисфункция и воспаление связано с тканевой гипоксией.
Критерии применимы к пациентам со слабо или умеренно выраженными респираторными симптомами; не применимы — к пациентам с альтернативным диагнозом, например бактериальным сепсисом.
Таблица 4. Диагностические критерии гипервоспалительного синдрома [72]
Table 4. Diagnostic criteria for hyperinflammatory syndrome in COVID-19 [72]
Лихорадка
· Температура тела > 38,0 °C
Активация макрофагов
· Повышение содержания ферритина ≥ 700 мкг/л
Гематологические нарушения
· Отношение нейтрофилы : лимфоциты ≥ 10 ИЛИ 2 признака: содержание гемоглобина ≤ 9,2 г/дл И тромбоцитов ≤ 110 × 10 9 /л
Коагулопатия
· Содержание D-димера ≥ 1,5 мкг/мл
Повреждение печени
· ЛДГ ≥ 400 ЕД/л ИЛИ АСТ ≥ 100 ЕД/л
Цитокинемия
· Содержание ИЛ-6 ≥ 15 пкг/мл, ИЛИ триглицеридов ≥ 150 мг/дл, ИЛИ С-реактивного белка ≥ 15 мг/дл
АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза, ЛДГ — лактатдегидрогеназа.
Широкое принятие концепции «цитокиновой бури» привело к кардинальной смене парадигмы лечения инфекционных заболеваний: впервые в комплексном лечении вирусной инфекции стали активно применяться лекарственные средства супрессивной иммунотерапии с механизмом прицельного лечебного воздействия, блокирующего эффекты цитокинов [73–75]. Попытки коррекции избыточного цитокинового ответа при вирусных инфекциях предпринимались и раннее, но при обосновании различных вмешательств применение моноклональных антицитокиновых антител не рассматривалось [76, 77]. Энтузиазм по поводу иммуномодулирующего подхода в лечении COVID-19, по-видимому, в значительной степени был связан с клиническим опытом лечения синдрома высвобождения цитокинов, который часто подменяют термином «цитокиновая буря». В связи с этим не вызывает удивления тот факт, что первым препаратом таргетной биологической терапии стал тоцилизумаб [78]. В то же время применение данного препарата для лечения гипериммунного воспалительного ответа у пациентов с COVID-19 неоднозначно с нескольких позиций.
Во-первых, весь предшествующий опыт применения тоцилизумаба охватывал только неинфекционные заболевания, поэтому чисто теоретически подавление воспаления с помощью блокады рецепторов ИЛ-6 может не только продлить период виремии, но и способствовать прогрессированию вирусного поражения [79, 80].
Во-вторых, взяв за аналогию синдром высвобождения цитокинов, где применение тоцилизумаба получило одобрение, нельзя упускать из виду другой патогенетический вариант «цитокиновой бури» — ГФС/САМ, при котором применение тоцилизумаба не является предпочтительным вследствие увеличения риска развития бактериальной инфекции [81], длительного периода полувыведения, а также снижения содержания С-реактивного белка и ферритина в отсутствие клинического ответа, что может ввести в заблуждение при оценке эффекта от лечения [82].
Кроме того, при применении тоцилизумаба возможно развитие парадоксальной реакции, проявляющейся реактивацией вторичного ГФС [82]. По мнению некоторых исследователей, цитокиновый ответ у пациентов с COVID-19 в большей степени напоминает таковой при сепсисе, чем при ГФС/CAM на фоне онкогематологических или иммуновоспалительных заболеваний, поэтому, хотя ИЛ-6 является составным компонентом цитокинового каскада, его роль в развитии органной дисфункции не ясна, а эффект от блокады его рецепторов может оказаться очень ограниченным [83].
Несмотря на то что тоцилизумаб вошел в национальные рекомендации по лечению COVID-19 в России, Китае, Италии, Испании, Греции, Швейцарии, Ирландии, Польши, Турции, Израиля, Японии, Египта, Ирана и еще ряда стран (по показаниям, отличающимся от утвержденных в инструкции показаний для применения — off label), до настоящего времени данные о его эффективности и безопасности при применении у пациентов с COVID-19 носят противоречивый характер. В то время как данные о положительном эффекте применения получены преимущественно на основании обсервационных исследований и описания серии наблюдений [84–88], результаты опубликованных рандомизированных контролируемых исследований менее впечатляющие [89–93] (табл. 5).
Таблица 5. Рандомизированные контролируемые исследования тоцилизумаба при COVID-19
Table 5. Randomized controlled studies with tocilizumab in COVID-19
RCT-TCZ-COVID-19 [94]
BACC Bay group [95]
COVACTA [96]
CORIMUNO-TOCI-1 [97]
TOCIBRAS [98]
EMPACTA [99]
REMAP-CAP [100]
Количество пациентов, получавших тоцилизумаб
Доля пациентов, получавших системные кортикостероиды, %
Различия в смертности
Анализ объединенных результатов данных исследований не выявил положительного влияния тоцилизумаба в отношении снижения смертности (ОШ 0,91, 95% ДИ 0,72–1,14) [101]. В результате систематического обзора исследований тоцилизумаба при COVID-19 Cortegiane et al. пришли к заключению, что в настоящее время не имеется убедительных данных в отношении пользы применения тоцилизумаба у пациентов с тяжелым течением COVID-19. Авторы отметили низкое качество многих исследований, связанное с большим количеством систематических ошибок [102]. Действительно, несмотря на достаточно большое количество исследований, посвященных изучению применения тоцилизумаба у пациентов с COVID-19, их результаты не позволяют сделать однозначный вывод. Отчасти это связано со значительными различиями в первичных конечных точках, критериях включения, сроках введения препарата, а также гетерогенностью выборки и небольшим количеством пациентов. Возможно, результаты исследования RECOVERY, предварительные результаты которого продемонстрировали положительный эффект тоцилизумаба, позволят завершить дискуссию в отношении данного вопроса [101]. Пока, на основании имеющихся данных, можно сделать несколько выводов: 1) применение тоцилизумаба в виде монотерапии не оказывает достоверного положительного эффекта пациентам с COVID-19; 2) тоцилизумаб в сочетании с системными кортикостероидами может оказывать положительный эффект у пациентов с тяжелым течением COVID-19; 3) терапия тоцилизумабом не приводит к значительному увеличению инфекционных осложнений.
Таким образом, в настоящее время в контексте феномена «цитокиновой бури» необходимо проведение дополнительных исследований, целью которых является получение убедительного ответа на вопрос: какое влияние оказывает на патогенез развития осложнений при COVID-19 повышение содержания цитокинов и насколько нейтрализация их биологических эффектов путем прицельного лечебного воздействия приносит пользу больным.
Критика концепции «цитокиновой бури» при COVID-19
В отношении концепции «цитокиновой бури», как ведущего патогенетического механизма прогрессирования COVID-19, существуют и противоположные мнения. О важной роли, которую играют цитокины в воспалительном ответе, сопровождающем вирусные инфекции, известно давно [94, 95]. При этом также не подвергается сомнению тот факт, что у части пациентов возникает избыточная воспалительная реакция, определяющая тяжесть течения заболевания [96, 97]. В то же время некоторые авторы полагают, что имеющихся в настоящее время данных недостаточно, чтобы однозначно определить значение нарушения цитокинового ответа у пациентов с COVID-19 [98]. В работе Mudd P.A. et al. было показано, что, хотя у пациентов с COVID-19 имеются различные нарушения иммунного ответа, классический фенотип «цитокиновой бури» наблюдается всего у 3–4 % пациентов, при этом выраженность цитокинемии значительно ниже, чем при других состояниях, сопровождающихся повышением содержания цитокинов. Исходя из полученных данных, авторы делают вывод, что использование термина «цитокиновая буря» для описания нарушений цитокинового ответа при COVID-19 не является корректным [99]. Nigrovic P.A. справедливо отмечает, что стандартизированные шкалы для диагностики состояний, сопровождающихся феноменом «цитокиновой бури» (например, H-Score) мало подходят для пациентов с COVID-19. Развернутая клиническая картина COVID-19, хотя и включает в себя повышение содержания воспалительных маркеров, но их концентрация практически никогда не достигает значений, наблюдающихся при синдроме высвобождения цитокинов или ГФС, при этом для пациентов с COVID-19 не характерны гепато- и спленомегалия, а лимфопения, возможно, возникает вследствие прямого действия вируса [100]. Более того, в ряде работ убедительно показано, что гипериммунный воспалительный ответ у пациентов с COVID-19 имеет существенные отличия от феномена «цитокиновой бури», наблюдающегося у пациентов с вторичным ГФС [101, 102]. По мнению группы китайских исследователей, избыточная продукция цитокинов может являться лишь «верхушкой айсберга» сложных патогенетических механизмов, лежащих в основе прогрессирования COVID-19, и не быть причиной клинического ухудшения состояния пациентов [103].
С другой стороны, содержание ИЛ-6 у пациентов с COVID-19 значительно ниже, по сравнению с пациентами с пневмонией, вызванной другими инфекционными агентами [104], ОРДС, сепсисом и особенно с синдромом высвобождения цитокинов как осложнением противоопухолевой терапии, в частности CAR-T [72, 105]. По мнению Leisman D.E. et al., спектр воспалительных маркеров у пациентов с COVID-19 значительно отличается от такового при ОРДС, сепсисе и классическом синдроме высвобождения цитокинов; роль повышения содержания цитокинов остается не ясной, поэтому от термина «цитокиновая буря» при описании воспалительного ответа у больных с COVID-19 предпочтительнее отказаться. Авторы полагают, что необходимо сместить акцент с концепции «цитокиновой бури» на поиск альтернативных патогенетических механизмов развития органной дисфункции, таких как эндоваскулит, прямое повреждающее действие вируса, лимфодеплеция и т. д. [72]. В пользу последней теории, или концепции «иммунологического коллапса», свидетельствуют результаты работы Remy K.E. et al., которые показали, что у пациентов с COVID-19 имеются выраженные нарушения механизмов иммунной защиты, проявляющиеся как в уменьшении количества эффекторных иммунных клеток, так и в нарушениях функции Т-клеток и моноцитов [106]. В связи с чем ряд авторов предлагают акцентировать внимание не только на коррекции избыточного цитокинового ответа, но и на восстановление функции Т-клеток [107, 108].
Заключение
Таким образом, имеющиеся данные позволяют предположить, что нарушение регуляции цитокинового ответа является одним из возможных патогенетических механизмов, лежащих в основе прогрессирования COVID-19 и развития органной недостаточности. Что касается терминологии, в частности оправданности использования термина «цитокиновая буря», то в данном случае, на наш взгляд, следует прислушаться к Рене Декарту, советовавшему не спорить, а договариваться о значениях слов [109]. Продвигаясь в данном направлении, необходимо установить единые пороговые критерии для лабораторных показателей, выбранных в качестве биологических маркеров синдрома «цитокиновой бури», и определить однозначные диагностические критерии. С другой стороны, хотелось бы обратить внимание на необходимость более широкого взгляда на патогенез COVID-19, не ограничивающегося только концепцией «цитокиновой бури».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Бобкова С.С., Жуков А.А., Проценко Д.Н., Самойленко В.В., Тюрин И.Н. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.