что делать если у новорожденного герпес
Герпес новорожденного
Герпетическая инфекция – самая распространенная вирусная инфекция человека, существующая в организме преимущественно в латентной форме и проявляющаяся на фоне иммунодефицитных состояний поражениями кожи, слизистых оболочек, глаз, печени и ЦНС. Это наиболее часто диагностируемая инфекция среди врожденных и неонатальных болезней.
Актуальность. Инфицированность взрослого населения вирусами простого герпеса достигает 90-95%. За последние годы во всем мире констатируют увеличение количества случаев заболевания герпетической инфекцией новорожденных. Смертность от неонатального герпеса достигает 50-70%. Здоровыми остаются только 15%, многие дети в последующем страдают тяжелыми неврологическими заболеваниями.
Этиология. Вирус простого герпеса входит в семейство герпес-вирусов, подразделяется на вирус простого герпеса 1 типа – лабиальный и вирус простого герпеса 2 типа — генитальный. Наиболее опасен для плода генитальный герпес.
Вирус простого герпеса состоит из трех основных компонентов: нуклеотида, капсида и липидосодержащей оболочки. Геном представлен линейной двухнитчатой ДНК.
Эпидемиология. Естественным хозяином вируса простого герпеса является человек. Пути передачи инфекции:
— половой (является основным для вируса простого герпеса 2 типа);
— контактный (при прохождении плода через родовые пути матери во время родов частота инфицирования составляет 40-50%, заболеваемость – 20%, смертность – 40%);
-вертикальный (риск трансмиссии при первичной инфекции беременной составляет 50%, при первом клиническом проявлении непервичной инфекции – до 33%, при рецидиве герпетической инфекции– до 3%);
Наиболее часто плоду заболевание передается во время родов от матери, у которой инфицированы родовые пути и, нередко, имеется хроническая инфекция мочевых путей. Входными воротами могут быть травмированные кожные покровы, слизистые губ, ротовой полости, носа, конъюнктивы и гениталий. Вертикальная передача инфекции от матери к плоду может происходить через поврежденную и даже неповрежденную плаценту. Заражение сопровождается репликацией вируса на месте инвазии. Далее он способен распространяться неврогенно, лимфо- и гематогенно. Излюбленной локализацией являются сенсорные ганглии, где инфекция может длительно сохраняться.
Клиническая картина. Симптомы. Проявления врожденной герпесной инфекции зависят от сроков заражения. Установлена достоверная связь герпесной инфекции с пороками развития желудочно-кишечного тракта, сердца, мочеполовой системы, скелета, врожденных рубцовых деформаций кожи. Вирус герпеса может вызывать органическое поражение ЦНС (микро- и гидроцефалию, ДЦП, эпилепсию), цирроз печени, неонатальныйгепатит, тяжелые поражения глаз, легких, кожи и слизистых. Инкубационный период колеблется от 2-х до 30 дней. Выделяют 3 клинических формы герпесной инфекции у новорожденных:
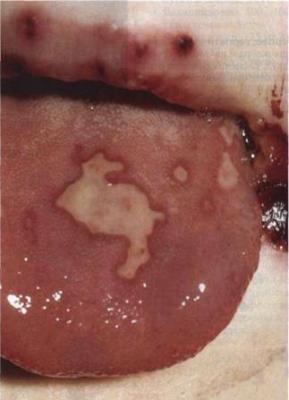
1) Локализованная форма с поражением кожи и слизистых полости рта, глаз – встречается у 20-40 % больных. Характеризуется наличием единичных или множественных везикулярных элементов на различных участках тела при отсутствии признаков системной воспалительной реакции. Пузырьки размером 1,5-2 мм на фоне эритемы и отека. Чаще всего они появляются на 5-14-й дни жизни. При их вскрытии образуются эрозии с гладким дном. На месте эрозий может быть нестойкая пигментация, процесс заживления длится примерно 10-14 дней. Возможно развитие герпетических кератоконъюнктивита, хориоретинита, эрозий роговицы, увеита, эписклерита или иридоциклита. В ряде случаев наблюдается специфический неврит зрительного нерва. При отсутствии специфического лечения у 50-70% новорожденных локализованная кожная форма может привести к генерализации процесса или к поражению центральной нервной системы.
2) Генерализованная форма составляет от 20 до 50% случаев неонатального герпеса. Начало болезни чаще на 5-11-й день жизни, однако возможно и более раннее проявление в первые 24-48 часов жизни. Клинические симптомы неспецифичны и напоминают неонатальный сепсис: вялость, срыгивания, повышение или снижение температуры тела, выраженное нарушение микроциркуляции, апноэ, цианоз, одышка, иногда признаки пневмонии. Характерным является вовлечение в патологический процесс печени и надпочечников. Наблюдаются увеличение селезенки, гипогликемия, гипербилирубинемия, ДВС-синдром, признаки инфекционно-токсического шока. У 50-60% больных отмечаются симптомы герпетического менингоэнцефалита. Специфические высыпания на коже и слизистых появляются на 2-8-ой дни от начала заболевания, однако, у 20% новорожденных с генерализованной формой ГИ кожных элементов не обнаруживают.
3) Герпетические поражения центральной нервной системы (энцефалит, менингоэнцефалит) составляют около 30% случаев. Развитие клинических симптомов заболевания в большинстве случаев наблюдается на 2-3-й неделе жизни (12-17-й дни жизни). Заболевание начинается с подъема температуры тела, вялости, чередующейся с эпизодами повышения возбудимости, тремора, снижения аппетита, вслед за которыми быстро развиваются плохо купирующиеся фокальные или генерализованные судороги. Ликвор вначале может быть не изменен, затем обнаруживается увеличение содержания белка и цитоз лимфоцитарного или смешанного характера. У 40-60 % больных отсутствуют специфические герпетические высыпания на коже и слизистых. При антенатальном заражении возможно рождение детей с микроцефалией, гидроцефалией, наличием внутричерепных кальцификатов.
Диагностика герпесной инфекции:
• Особое значение имеет оценка специфического анамнеза матери (хроническая соматическая патология, эрозия шейки матки, сальпингоофорит, кольпит, самопроизвольные аборты, неразвивающаяся беременность, антенатальная гибель плода, герпетические высыпания на коже и слизистых у матери во время данной беременности).
• Клинический осмотр больного: у детей, родившихся от матерей с острой или рецидивирующей герпесной инфекции, осмотр кожи и слизистых оболочек необходимо проводить с особой тщательностью с целью раннего выявления герпетических элементов.
• При возникновении у новорожденного судорог неясной этиологии показано проведение люмбальной пункции. При герпетическом менингоэнцефалите в ликворе отмечаются высокая концентрация белка и лимфоцитоз/ моноцитоз.
• При возникновении у новорожденного клиники сепсиса, при котором не удается добиться эффекта от целенаправленной антибактерильной терапии, необходимо проводить лабораторные исследования на герпесную инфекцию.
• Дополнительные клинико-лабораторные и клинико-инструментальные исследования (клинический и биохимический анализы крови и мочи, нейросонография, компьютерная томография головного мозга, по показаниям – ЭЭГ, коагулограмма, компьютерная томография, рентгенограмма органов грудной клетки) позволяют оценить состояние отдельных органов, систем и степень их вовлечения в патологический процесс.
• Герпетическая этиология заболевания должна быть подтверждена специальными лабораторными методами:
— «золотым стандартом» является выделение вируса из крови, ликвора, содержимого везикул и других локусов (носоглотка, конъюнктива) в культуре тканей (чувствительность до 100%, специфичность 100%, длительность анализа не менее 5 дней);
— цитологическая диагностика, основанная на исследовании под микроскопом тканевых препаратов, окрашенных по методу Райт-Гимза, Папаниколау;
— содержимое везикул можно исследовать прямым иммунофлюоресцентным методом для обнаружения антигена вируса простого герпеса;
— обнаружение генома вируса в крови и ликворе методом полимеразной цепной реакции (чувствительность метода – 95%, специфичность – 90-100%, время анализа – 1-2 дня);
— выявление специфических антител класса IgG и IgM к ВПГ методом ИФА в крови, ликворе (что имеет большое значение для диагностики данной инфекции, возбудитель которой отличается чрезвычайно выраженной тропностью к нервной системе), моче, содержимом из носоглотки. Особую диагностическую ценность приобретает у новорожденных и детей грудного возраста метод «парных сывороток», взятых для исследования с интервалом в 10-14 дней. Увеличение титра иммуноглобулинов в 4 и более раз за этот период подтверждает диагноз герпесной инфекции.
• Патоморфология плаценты. Макроскопически оболочки плаценты желтоватые, мутные. При гистологическом исследовании выявляется базальный децидуит. Типичные герпетические клетки имеют крупные размеры, в ядре – базофильные включения, окруженные ободком просветления. Цитоплазма клеток вначале слабо базофильна, затем резко ацидофильна. Во всех поврежденных ворсинах происходит активация фиксированных макрофагов (клеток Гофбауэра-Кащенко). В базальной пластинке обнаруживаются кровоизлияния, отложения фибрина и образование тромбов, множественные очаги некроза и кальциноза.
Лечение герпесной инфекции. При всех формах неонатальной герпесной инфекции показана специфическая противовирусная терапия, поскольку локализованная форма может предшествовать генерализации инфекции. У новорожденных при локализованных формах заболевания применяют ацикловир внутривенно в дозе 45 мг/кг/сут.; при генерализованной форме инфекции и менингоэнцефалите – в дозе 60 мг/кг/сут. Энтеральное введение ацикловира у новорожденных детей может быть недостаточно эффективным. Длительность лечения: локализованная форма – 10-14 дней; генерализованная форма и менингоэнцефалит – не менее 21 дня. При герпетическом поражении глаз можно использовать 1% раствор йоддиоксиуридина, 3% раствор видарабина, 1-2 % раствор трифлуридина. Поврежденную кожу обрабатывают мазью «Ацикловир», «Завиракс» 3 раза в день.
Среди растительных препаратов, обладающих заметным противовирусным действием, в лечении герпетической инфекции чаще других используются производные солодки и зверобоя. Этисредства применяются в основном местно. Так, эпиген, производимый на основе солей глицирризиновой кислоты, заметно сокращает сроки заживления кожно-слизистых поражений.
При генерализованной форме инфекции в условиях иммунодефицитного состояния в комплексной терапии новорожденных, в том числе недоношенных детей, могут быть использованы полиспецифические внутривенные иммуноглобулины (Октагам, Интраглобин, Сандоглобин, Пентаглобин) и иммуноглобулины с высоким титром антител к вирусу простого герпеса. Неотъемлемой частью патогенетической терапии герпесной инфекции является также использование препаратов интерферонового ряда: Виферон-1 в свечах (доза 150 000 МЕ 1 раз в сутки per rectum в течение 5 дней). Поддержание жизненно важных функций организма ребенка при генерализованной форме неонатального герпеса проводится в соответствии с общими принципами интенсивной терапии. Важное место в лечении герпетического менингоэнцефалита занимает адекватная противосудорожная терапия. Прекращать вскармливать ребенка грудным молоком не имеет смысла, так как даже при первичной инфекции у матери проникновение ВПГ в молоко маловероятно. Исключение составляют случаи, когда у матери герпетические высыпания располагаются на груди.
Профилактика герпесной инфекции.
1) Выявление беременных высокого риска:
а) тщательный сбор анамнеза с целью выявления эпизодов генитального герпеса;
б) тщательное клиническое обследование родовых путей, промежности и вульвы в процессе наблюдения в женских консультациях и перед началом родов; в) вирусологическое подтверждение герпесподобных генитальных поражений у всех женщин, планирующих беременность.
2) Ведение беременности и родов должно основываться на клинических принципах и анамнезе:
а) у женщин с первичным клиническим эпизодом герпесной инфекции менее чем за 6 недель до родов, необходимо плановое кесарево сечение;
б) если эпизод имел место более, чем за 6 недель до родов, возможно родоразрешение через естественные родовые пути; для снижения риска обострения заболевания к моменту родов целесообразно применение ацикловира с 36 недель беременности;
в) диссеминированная и тяжелая первичная материнская инфекция требуют терапии ацикловиром вне зависимости от срока беременности;
г) при наличии генитального герпеса у матери и родов естественным путем новорожденные подлежат обследованию и проведению профилактической терапии ацикловиром. При получении отрицательного результата лабораторного обследования на герпесную инфекцию и отсутствии клинических проявлений заболевания противовирусная терапия прекращается.
Исходы неонатальной герпесной инфекции. При раннем назначении антивирусной терапии летальность при генерализованных формах инфекции составляет менее 50%, тогда как при отсутствии специфического лечения – 90%; при менингоэнцефалитах – 14%. Частота неврологических осложнений колеблется от 10 до 43%; рецидивы кожных проявлений в первые 6 месяцев жизни наблюдаются у 46% детей.
Герпетические инфекции у детей
Герпесвирусные инфекции (ГВИ) относятся к наиболее распространенным вирусным болезням человека. Инфицированность и заболеваемость ими каждый год возрастает. Во всех странах мира 60-90% населения инфицированы тем или иным герпесвирусом.
Этиология
Герпесвирусы в своем составе содержат двунитчатую ДНК, имеют глико-липопротеиновую оболочку. Размеры вирусных частиц от 120 до 220 нм.
На сегодня описано 8 типов герпесвирусов, которые выявлены у человека:
На основе биологических свойств вирусов сформированы 3 подсемейства герпесвирусов: (альфа-герпесвирусы, бетта-герпесвирусы и гамма-герпесвирусы). К a-герпесвирусам относятся HSV-1, HSV-2, VZV.
К бета-герпесвирусам относятся CMV, HHV-6, HHV-7. Они, как правило, медленно размножаются в клетках, вызывают увеличение пораженных клеток (цитомегалия), способны к персистенции, преимущественно в слюнных железах и почках, могут вызывать врожденные инфекции. К гамма-герпесвирусам относятся ЕBV и HHV-8.
Вирус простого герпеса 1 и 2 типов
Термин «герпетическая инфекция» (ГИ) обычно употребляется относительно заболеваний, которые вызываются HSV-1 и HSV-2. Источником HSV-инфекции являются больные люди различными формами заболевания, в том числе и латентной, а также вирусоносители.
HSV-1 передается воздушно-капельным и контактным путем. Попавший на кожу во время кашля, чихания вирус, находящийся в капельках слюны, выживает в течение часа. На влажных поверхностях (умывальник, ванна и прочее) он сохраняет жизнеспособность в течение 3-4 часов, что нередко является причиной вспышек заболеваний в детских дошкольных учреждениях. Заражение может осуществляться при поцелуях, а также через предметы обихода, которые инфицированы слюной больного или вирусоносителя. HSV-2 передается половым или вертикальным путем. При последнем инфицирование происходит во время родов (контакт с родовыми путями матери), трансплацентарно или через цервикальный канал в полости матки. В связи с тем, что при генерализации инфекции имеет место вирусемия, возможен также трансфузионный или парентеральный путь передачи HSV-2 инфекции. HSV-2 вызывает, как правило, генитальный и неонатальный герпес.
Наибольшая восприимчивость у детей к ГИ в возрасте от 5 месяцев до 3 лет. В зависимости от механизма заражения различают приобретенную и врожденную форму ГИ. Приобретенная ГИ может быть первичной и вторичной (рецидивирующая), локализованной и генерализованной. Также выделяют латентную форму ГИ.
Ни одна инфекция не имеет такого многообразия клинических проявлений, как герпесвирусная. Она может вызывать поражение глаз, нервной системы, внутренних органов, слизистой оболочки желудочно-кишечного тракта, полости рта, гениталий, может являться причиной онкологических заболеваний, имеет определенное значение в неонатальной патологии и возникновении гипертонии. Распространение вируса в организме происходит гематогенным, лимфогенным, нейрогенным путем.
Частота первичной герпесвирусной инфекции возрастает у детей после 6 месяцев жизни, когда полученные от матери антитела исчезают. Пик заболеваемости приходится на возраст 2—3 года. Нередко ГИ встречается и у новорожденных детей, по данным ряда авторов диагностируется у 8% новорожденных с общесоматической патологией и у 11% недоношенных детей.
По данным ВОЗ, заболевания, обусловленные вирусом простого герпеса (HSV), занимают второе место после гриппа среди причин смертности от вирусных инфекций. Решение проблемы диагностики и лечения герпесвирусной инфекции с проявлениями на слизистой оболочке полости рта — одна из важнейших задач практической медицины.
В последнее десятилетие во всем мире значение герпесвирусных заболеваний как проблемы общественного здравоохранения постоянно растет. Представители семейства герпесвирусов человека поражают до 95% населения мира.
К первичным формам ГИ относятся: инфекция новорожденных (генерализованный герпес, энцефалиты, герпес кожи и слизистых), энцефалиты, гингивостоматиты, герпетиформная экзема Капоши, первичный герпес кожи, глаз, герпетический панариций, кератиты. Первичная ГИ возникает вследствие первичного контакта человека с HSV. Как правило, это происходит в раннем детском возрасте (до 5 лет). У взрослых в возрасте 16-25 лет, которые не имеют противовирусного иммунитета, первичная ГИ чаще может быть обусловлена HSV-2. Латентно переносят заболевание 80-90% первично инфицированных детей, и только в 10-20% случаев наблюдаются клинические проявления болезни.
Вторичными, рецидивирующими формами ГИ является герпес кожи и слизистых оболочек, офтальмогерпес, герпес половых органов.
Эпштейн-Барр-вирусная инфекция
Инфекционное заболевание, которое вызывается вирусом Эпштейн-Барр (ЕBV) и характеризуется системным лимфопролиферативным процессом с доброкачественным или злокачественным течением.
ЕBV выделяется из организма больного или вирусоносителя с орофарингеальным секретом. Передача инфекции происходит воздушно-капельным путем через слюну, часто во время поцелуев матерью своего ребенка, поэтому иногда ЕBV-инфекцию называют «болезнью поцелуев». Дети нередко заражаются ЭБВ через игрушки, загрязненные слюной больного ребенка или вирусоносителя, при пользовании общей посудой, бельем. Возможен гемотрансфузионный путь передачи инфекции, а также половой. Описаны случаи вертикальной передачи ЕBV от матери к плоду, предполагают, что вирус может быть причиной внутриутробных аномалий развития. Контагиозность при ЕBV-инфекции умеренная, что, вероятно, связано с низкой концентрацией вируса в слюне. На активацию инфекции влияют факторы, снижающие общий и местный иммунитет. Возбудитель ЕBV-инфекции имеет тропизм к лимфоидно-ретикулярной системе. Вирус проникает в В-лимфоидные ткани ротоглотки, а затем распространяется по всей лимфатической системе организма. Происходит инфицирование циркулирующих В-лимфоцитов. ДНК-вируса проникает в ядра клеток, при этом белки вируса придают инфицированным В-лимфоцитам способность беспрерывно размножаться, вызывая так называемое «бессмертие» В-лимфоцитов. Этот процесс является характерным признаком всех форм ЕBV-инфекции.
ЕBV может вызывать: инфекционный мононуклеоз, лимфому Беркитта, назофарингеальную карциному, хроническую активную ЕBV-инфекцию, лейомиосаркому, лимфоидную интерстициальную пневмонию, «волосатую» лейкоплакию, неходжкинскую лимфому, врожденную ЕBV-инфекцию.
Варицелла-зостер-инфекция
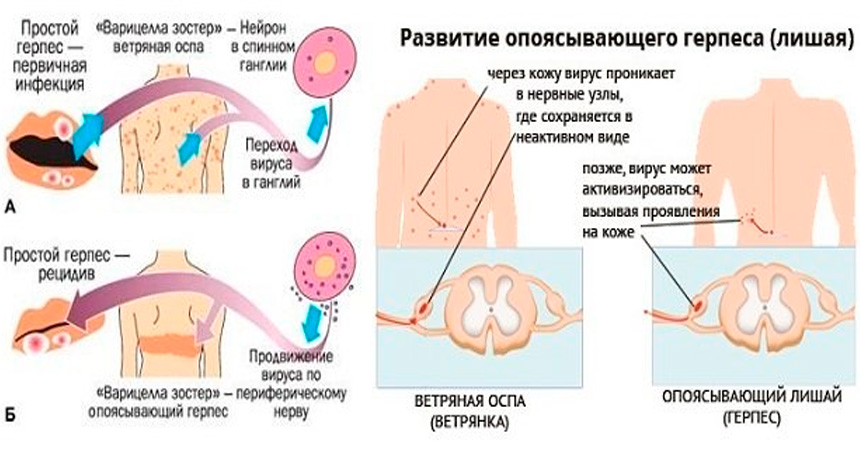
Varicella-zoster вирус вызывает ветряную оспу и опоясывающий герпес. Источником инфекции при ветряной оспе может быть только человек, больной ветряной оспой или опоясывающим герпесом, включая последние 24-48 часов инкубационного периода. Реконвалесценты ветряной оспы остаются заразными на протяжении 3-5 дней после прекращения высыпаний на коже. Через третье лицо заболевание не передается. Возможно внутриутробное заражение ветряной оспой в случае заболевания беременной. Ветряная оспа может встречаться в любом возрасте, но в современных условиях максимальное количество больных приходится на детей в возрасте от 2 до 7 лет. Опоясывающий герпес развивается после первичного инфицирования вирусом Varicella-zoster, после перехода инфекции в латентную форму, при которой вирус локализуется в спинальных, тройничном, сакральном и других нервных ганглиях. Возможна эндогенная реактивация инфекции.
Цитомегаловирусная инфекция
Инфекционное заболевание, которое вызывается цитомегаловирусом (CMV) и характеризуется разнообразными клиническими формами (от бессимптомной до тяжелой генерализованной с поражением многих органов) и течением (острым или хроническим). Факторами передачи CMV могут быть практически все биологические субстраты и выделения человека, в которых содержится вирус: кровь, слюна, моча, ликвор, вагинальный секрет, сперма, амниотическая жидкость, грудное молоко. Потенциальным источником инфекции являются органы и ткани в трансплантологии, а также кровь и ее продукты в трансфузиологии. Пути передачи CMV-инфекции: воздушно-капельный, половой, вертикальный и парентеральный.
Различают врожденную и приобретенную формы CMV-инфекции. Врожденная CMV-инфекция. При антенатальном инфицировании плода заражение происходит преимущественно трансплацентарно. При интранатальном инфицировании CMV поступает в организм при аспирации инфицированных околоплодных вод или секретов родовых путей матери.
У детей более старшего возраста приобретенная CMV-инфекция в 99% случаев протекает в субклинической форме. Наиболее частым проявлением такой формы CMV-инфекции у детей в возрасте старше года является мононуклеозоподобный синдром. Как правило, наблюдается клиника острого респираторного заболевания в виде фарингита, ларингита, бронхита.
Инфекции, вызванные шестым, седьмым и восьмым типами герпесвирусов Герпесвирусы шестого типа (HHV-6) могут явиться причиной эритематозной и розеолезной сыпи (внезапная экзантема), поражений ЦНС и костного мозга у иммуноскомпроментированных детей. Герпесвирусы седьмого типа (HHV-7) вызывают экзантему новорожденных
Важное значение имеет исследование специфических антител различных подклассов: IgM, IgG1-2, IgG3 и IgG4 к герпес-вирусам. Выявление в сыворотке крови детей специфических иммуноглобулинов М, IgG3, IgG1-2 в титре > 1:20, вирусного антигена и специфических иммунных комплексов с антигеном свидетельствует об остроте инфекционного процесса (активная фаза), а определение только специфических IgG4 расценивается как латентная фаза инфекции или носительство материнских антител.
Лечение
Герпетической инфекции проходит в 3 этапа:
Во всех случаях препараты, их комбинация и длительность подбираются индивидуально с учетом проявлений заболевания, особенности иммунной системы ребенка, возраста, течения заболевания.
Герпесвирусные инфекции у детей: современные возможности терапии
В статье рассматриваются некоторые аспекты этиопатогенеза герпесвирусных заболеваний у детей, современные подходы к лекарственной терапии и профилактике рецидивов.
This article discusses some aspects of the pathogenesis of herpes-associated diseases in children, modern approaches to drug therapy and relapse prevention.
В последние годы среди основных возбудителей вирусных инфекций у детей особое место занимают герпес-вирусы, что связано с их повсеместным распространением, широким разнообразием, полиорганностью поражения, многообразием клинических проявлений, а также высокой частотой хронического течения. Герпес-ассоциированные заболевания входят в число наиболее распространенных и плохо контролируемых инфекций человека. Это связано с тем, что герпес-вирусы могут длительно бессимптомно циркулировать в организме человека с нормальной иммунной системой, а при иммуносупрессии способствовать развитию тяжелых заболеваний, вплоть до угрожающих жизни генерализованных инфекций. Так, по данным Всемирной организации здравоохранения (World Health Organization, WHO), смертность от герпетической инфекции составляет около 16% и находится на втором месте после гепатита среди вирусных заболеваний [1].
Для синтеза вирусных белков и образования оболочки вируса, его капсида и ДНК «дочерних» вирионов необходимы аминокислоты, липопротеиды и нуклеозиды клетки-хозяина. По мере истощения внутриклеточных резервов эти молекулы поступают в инфицированную клетку из межтканевых пространств. В связи с тем, что герпес-вирусы напрямую зависят от интенсивности внутриклеточного обмена организма человека, они колонизируют преимущественно клетки эпителия, слизистых оболочек, крови и лимфоидной ткани, которые обладают наиболее высоким темпом обмена веществ.
Вирионы герпес-вирусов термолабильны — они инактивируются в течение 30 мин при температуре 50–52 °C, в течение 20 ч — при температуре 37,5 °C, но хорошо переносят лиофилизацию. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, на влажных медицинских материалах (вата и марля) — до их высыхания при комнатной температуре (до 6 ч). Уникальность герпес-вирусов заключается в том, что они способны непрерывно или циклично размножаться в инфицированных клетках тропных тканей (персистенция), а также пожизненно сохраняться в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных нервных ганглиев (латенция) и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов. Однако способность к персистенции и латенции у различных штаммов неодинаковая: наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна–Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами вирусов. Основной путь инфицирования — воздушно-капельный, при прямом контакте или через предметы обихода (общие посуда, полотенца, носовые платки и пр.). Отмечается также оральный, генитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции. ВПГ 1-го и 2-го типов, цитомегаловирус входят в число возбудителей TORCH-инфекций, способствуют развитию серьезных заболеваний новорожденных и детей младшего возраста. Вирусы простого герпеса, цитомегаловирус, вирус Эпштейна–Барр рассматриваются как индикаторы СПИДа в связи с их частым обнаружением при данном заболевании [3, 4]. С герпес-вирусами связывают развитие синдрома хронической усталости (Chronic fatigue syndrome — CFS) [5].
Клинически герпес-инфекция у детей может протекать в виде ветряной оспы (вирус варицелла зостер), инфекционного мононуклеоза (вирус Эпштейна–Барр), внезапной экзантемы (вирус герпеса человека 6-го и 7-го типов), афтозного стоматита (ВПГ 1-го или 2-го типа), мононуклеозоподобного синдрома (цитомегаловирус). У подростков и взрослых людей часто инфекция протекает бессимптомно, что объясняется как биологическими свойствами штаммов, так и индивидуальными особенностями иммунного ответа. Часто при снижении иммунореактивности организма герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому течению основного заболевания, развитию осложнений. Велика роль герпесвирусных инфекций, особенно цитомегаловирусной, в формировании младенческой смертности. Наибольшую угрозу для жизни и здоровья детей представляют герпетические нейроинфекции — летальность при них достигает 20%, а инвалидизация — 50%. Тяжело протекают офтальмогерпес (развитие катаракты или глаукомы — до 50%), генитальный герпес, генерализованная форма Эпштейна–Барр-вирусной инфекции (инфекционного мононуклеоза) [1, 6].
Герпесвирусная инфекция относится к трудноконтролируемым заболеваниям. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения данной патологии, средств, обеспечивающих полное излечение, не существует. Это обусловлено генотипическими особенностями возбудителя, формированием резистентности герпес-вирусов и молекулярной мимикрией.
Открытые с помощью методов молекулярной биологии механизмов репликации герпес-вирусов, а также изучение взаимодействия вируса с клеткой позволили создать целый ряд эффективных химиотерапевтических средств, обладающих противогерпетической активностью. Однако, эффективно купируя острые проявления инфекции, они не предотвращают рецидивирования, не всегда снижают частоту рецидивов.
Учитывая, что при герпес-ассоциированных инфекциях, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния, для повышения эффективности лечения в схемы терапии наряду с противовирусными препаратами приходится включать препараты, способствующие коррекции иммунного статуса больного. Все это диктует необходимость правильно подбирать лекарственное средство, его дозу и длительность приема, при необходимости использовать комбинацию различных препаратов, избегая при этом полипрагмазии. Определенную сложность терапии в детском возрасте вызывают возрастные ограничения для ряда лекарственных средств, наличие нежелательных лекарстввенных реакций (НЛР) и противопоказаний.
В настоящее время для лечения герпесвирусных заболеваний и профилактики рецидивов используют следующие группы препаратов (табл.).
При лечении герпес-инфекций следует придерживаться комплексного подхода. Длительность и интенсивность терапии определяются возрастом больного, клинической формой заболевания, тяжестью его течения, а также наличием осложнений и сопутствующей патологии. Лечебно-профилактические мероприятия следует разделять на несколько этапов.
Следует отметить, что сочетанное применение противовирусных препаратов и иммунобиологических средств имеет ряд преимуществ. Во-первых, комплексная терапия обеспечивает синергидный эффект. Во-вторых, позволяет снизить дозу противовирусного химиопрепарата, уменьшая вероятность развития НЛР, сокращая его токсическое воздействие на организм и снижая вероятность возникновения устойчивых штаммов герпес-вирусов. Кроме того, это значительно сокращает продолжительность острого периода болезни и сроки лечения.
Одним из препаратов, показавшим свою эффективность при лечении герпес-ассоциированных заболеваний у детей, является инозин пранобекс. Инозин пранобекс — это синтетическое комплексное производное пурина, обладающее иммуностимулирующей активностью и неспецифическим противовирусным действием. Препарат восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию иммуноглобулина G, интерферонов, интерлейкинов (ИЛ-1 и ИЛ-2), снижает образование провоспалительных цитокинов (ИЛ-4 и ИЛ-10), потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Механизм противовирусного действия препарата связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации, усилении подавленного вирусами синтеза мРНК лимфоцитов, что сопровождается угнетением биосинтеза вирусной РНК и трансляции вирусных белков.
Инозин пранобекс малотоксичен, хорошо переносится, в России рекомендован в виде таблеток детям с 3-летнего возраста (масса тела более 15 кг). За рубежом он доступен и в форме сиропа и не имеет возрастных ограничений. Препарат назначается по 50–100 мг/кг/сут внутрь в 3–4 приема в течение всего острого периода болезни (5–10 дней в зависимости от длительности вирусемии и выраженности синдрома интоксикации). В качестве поддерживающей терапии для восстановления иммунологических показателей возможно назначение препарата по иммуномодулирующей схеме (50 мг 2 раза в день в течение 14–28 дней). Доказана высокая эффективность курсовой терапии инозином пранобексом (50 мг/кг массы тела в сутки в 3–4 приема внутрь, три курса лечения по 10 дней с интервалом 10 дней) [7], комбинированной курсовой терапии с использованием инозина пранобекса и рекомбинантного интерферона α-2β (3 курса по 10 дней с интервалом 14 дней) у детей с микст-вирусными инфекциями [8].
Применение инозина пранобекса как препарата с иммунотропным и противовирусным действием на различных этапах лечебно-профилактических мероприятий позволяет избежать полипрагмазии, тем самым снизить медикаментозную нагрузку на организм и уменьшить риск нежелательных эффектов.
Литература
Т. А. Бокова, доктор медицинских наук, профессор
ГБУЗ МО МОНИКИ им. М. Ф. Владимирского, Москва
.jpg)
_575.gif)