Озон с чем реагирует
Газ озон: химические, физические свойства, формула, отличия и другое
Содержание:
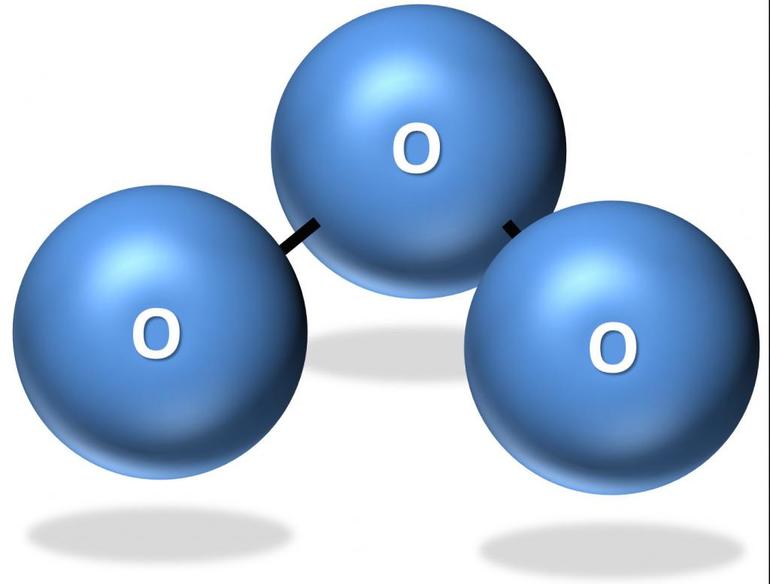
Кислород – элемент VIA группы. Для него свойственны две аллотропные модификации с разными химическими формулами – кислород О2 и озон О3. Они отличаются не только составом молекул, но и различными характеристиками.
В конце XVIII века ученый Мартин Ван Марум провел эксперимент, в результате которого получил озон. Он через воздушное пространство пропускал электричество. Таким образом, образовался озон – это голубоватый газ с необычным запахом. Ученый предполагал, что полученный газ представляет собой электрическую материю.
В 1840 году ученый Кристиан Фридрих Шенбейн раскрыл структуру и свойства озона. Полученный газ он назвал «озоном» (с греч. языка «пахнуть»). Кристиан Фридрих Шенбейн провел эксперимент, где озон вытеснил йод из иодида калия.
Получение озона
Существует несколько способов получения молекул озона.
Физические свойства озона
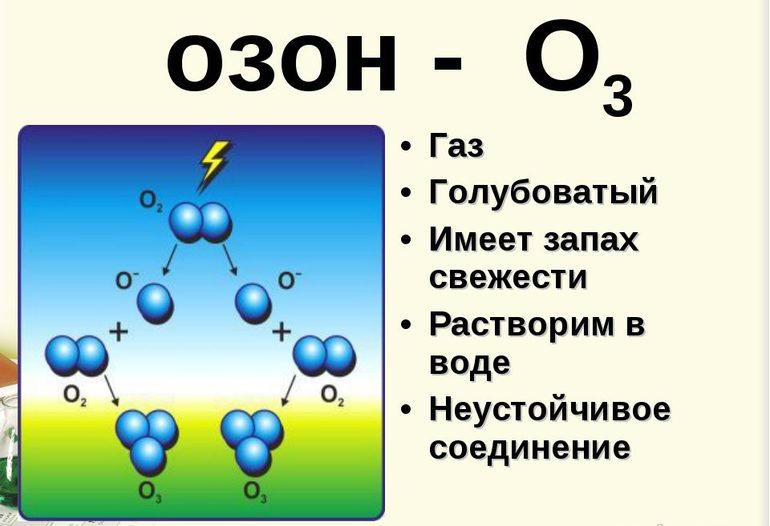
Озон – бесцветный (в толстых слоях голубоватый) газ. Он почти в два раза тяжелее воздуха. Озон обладает специфическим запахом свежести.
Озон растворим в воде. Примеси позволяют растворяться еще быстрее. Если озон находится в состоянии газа, то он выступает в роли диамагнетика. Если озон – это жидкость, то проявляет свойства слабого парамагнетика.
Озон ядовит и губителен для бактерий. Его используют при обеззараживании воздуха и воды.
Химические свойства озона
Озон обладает сильными окислительными свойствами по сравнению с кислородом. Он реагирует с рядом веществ.
Если озон находится в состоянии газа, то реакция с сероводородом выглядит следующим образом:
H2S + O3 = SO2 + H2O
Озон способен взаимодействовать со ртутью при обычных условиях. В результате металл теряет блеск и способность липнуть к стеклу.
Токсичность озона
При умеренных концентрациях озон безвреден. Реакции с озоном характеризуются формированием свободных радикалов кислорода, которые губительны для организма при высоком содержании. Чрезмерное воздействие озона часто приводит к гибели. Озон особенно губителен для органов дыхания.
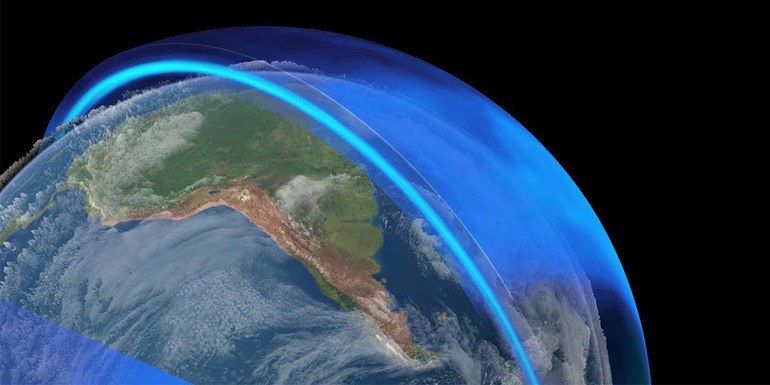
Озоновый слой в верхних слоях атмосферы
Озоновый слой – слой в верхней части атмосфера Земли, который состоит из бесцветного нестабильного газа. Он располагается на высоте 15-20 км над поверхностью планеты. Стратосфера – слой атмосферы, в котором содержится много озона.
Озон образуется в результате воздействия ультрафиолета на кислород. Слой газа задерживает все формы поступающей ультрафиолетовой коротковолновой радиации.
Озоновый экран защищает от вредного излучения, длина волн которого 290-320 нм. Это излучение может спровоцировать рак кожи. Озоновый слой появился на Земле около 600 млн лет назад в результате процесс фотосинтеза. Благодаря озоновому слою первые живые организмы смогли выйти из океана на сушу.
Дыры в озоновом слое
Озоновые дыры – локальное истощение озонового слоя. Самая большая озоновая дыра находится над Антарктидой. Если озоновый слой полностью исчезнет, то все живое на планете погибнет.
Озоновые дыры возникают по многим причинам, главная из которых – загрязнение окружающей среды. Озоновый слой разрушается под воздействием хлора, водорода, кислорода, брома и других продуктов сгорания. Выбросы фабрик, заводов и различных производств негативно влияют на выработку озона в верхних слоях атмосферы.
Реактивные самолеты выбрасывают окислы азота. Чем выше мощность турбореактивного двигателя, тем больше разрушающего вещества попадает в атмосферу. Ежегодно в воздух выбрасывается более 1 млн т соединений азота, из которых треть выбрасывают самолеты.
Защита озонового слоя
До 1989 года на производствах часто применялись галогенированные углеводороды, которые разрушают озоновый слой. Монреальская конвенция разработала программу по сокращению использования хлорфторуглеродов, которые быстро испарялись и достигали стратосферы. Они разлагаются на компоненты и разрушают озоновый слой. Из этих соединений раньше изготавливали аэрозоли, растворители и др.
Озоновые дыры произвольно создаются и исчезают. Это связано с некоторыми природными явлениями и даже климатическими особенностями. Газ озон образуется в результате воздействия ультрафиолета на кислород. Во время полярной ночи дыры образуются из-за того, что солнце не заходит несколько недель и ультрафиолет постоянно влияет на кислород. Во время полярного дня озоновый слой восстанавливается и воздействие ультрафиолета на живые организмы снижается.
Дыры могут формироваться в период активности Солнца. В результате этого они появляются и пропадают. Иногда это занимает несколько дней, реже растягивается на несколько месяцев.
Свойства озона, его взаимодействие с различными веществами и области применения
Растворимость и расщепление озона в водной среде
Озон является газом, прекрасно растворяющимся в воде, причем этот показатель растет с понижением температуры. Его растворимость намного выше, чем у азота и кислорода, хотя и меньше, чем у хлора и его диоксида. При растворении озона в воде также идет и его разложение, протекающее с одновременным взаимодействием с загрязняющими веществами, имеющимися в воде. Реакции расщепления озона в водной среде связаны с его взаимодействием с молекулами воды и гидроксид-ионами. В результате этих реакций идет выделение молекул двухатомного кислорода, обладающего так же высокими окислительными свойствами, и образование ионов водорода и гидроксида, а так же перекиси водорода. При диссоциации перекись водорода образует ионы водорода и частицы свободных радикалов, ускоряющих процесс разложения озона, а так же приводящие к началу цепных реакций разложения примесей. К ним таким частицам относятся радикалы супер-кислорода, состоящие из двух атомов и имеющие отрицательный заряд. Тормозом процесса разложения являются ионы карбонатов и гидрокарбонатов, нейтрализующие при взаимодействии ионы гидроксида путем образования углекислого газа и воды. Таким образом, процессы, протекающие при растворении озона в водной среде, проходят одновременно по нескольким механизмам. По выводам из практики принимается, что при растворении в воде одна половина озона существует в виде молекул, а вторая распадается с образованием гидроксильных радикалов.
Взаимодействие озона с различными веществами и механизмы протекания этих процессов
Взаимодействие загрязняющих веществ с озоном происходит за счет прямой реакции с молекулами озона или же с радикалами, появляющимися в процессе его распада. Более активно озон взаимодействует с анионами, чем с нейтральными и катионными веществами.
Озон, являясь активным окислителем, взаимодействует со многими органическими и неорганическими веществами. Из галогенов с озоном не реагирует фтор и практически не вступает во взаимодействие хлор. Бром окисляется озоном сначала до гипобромита, а затем и до броматных соединений. При этом образующийся бромид может параллельно взаимодействовать с веществами органического происхождения и аммиаком. Йод окисляется озоном очень быстро с образованием йодатов и йодноватистой кислоты. Соли галогеносодержащих кислот уже не поддаются озоновому окислению. Практически нейтральными к озону являются азот и его соединения, в том числе аммиак и ионы аммония, а так же нитраты, за исключением аминов, хорошо взаимодействующих с гидроксильными радикалами. Токсичные цианиды легко окисляются озоном в цианаты, дальнейшее окисление которых происходит очень медленно и ускоряется только в присутствии ионов меди, замедляясь при наличии в растворе ионов железа. Сера и сульфитные при взаимодействии с озоном окисляются до сульфатов. Что же касается реакций с металлами, то озон достаточно активно окисляет железо и марганец, кобальт и никель, образуя оксиды и гидроксиды, удаляемые из раствора при флокуляции или фильтрации. Практически пассивен в отношении озона хром, хотя при определенных условиях он может быть окислен им до максимальной степени окисления, шестивалентного хрома.
Применении озона
Благодаря своим свойствам, озон широко используется для очищения воды от фенолов, нефти и нефтепродуктов, поверхностно-активных веществ, аминов, железа и марганца, растворенного сероводорода, а также многих других веществ органического и неорганического происхождения, которые не могут быть эффективно удалены при использовании других методов очистки водной среды. Кроме того, с помощью озонового окисления проводится полное обеззараживание воды даже при значительном бактериальном ее загрязнении, в том числе и от патогенных микроорганизмов, устойчивых к действию хлора и хлоросодержащих дезинфектантов.
Это определяет так же и области его применения, к которым относится очистка воды, применяемой в оборотном водоснабжении, в схемах очищения сточных вод как бытового, так и производственного характера, при очистке нефотесодержащих стоков и сточных вод пищевой промышленности, характеризуемых высоким содержанием органических веществ.
Озон (газ)
Токсичный, голубоватого цвета, пахучий газ с сильной окислительной способностью, образованный из трех атомов кислорода (O3).
Озон возникает естественным образом в верхних слоях атмосферы, где он образуется в результате фотохимической реакции. Он также образуется в результате электрических разрядов и химических реакций, в результате которых кислород выделяется при охлаждении. В нижних слоях атмосферы он является токсичным загрязнителем для животных и растений. Однако в стратосфере он образует защитный слой для жизни на Земле, поглощая ультрафиолетовое излучение Солнца.
1. Физические и химические свойства
2. Используется
Озон используется благодаря своим окислительным и бактерицидным свойствам для дезинфекции воздуха в замкнутых пространствах, стерилизации воды, отбеливания текстиля и выдержки вина и древесины. При лечении ран (озонотерапия) он применяется в виде струи или в водном растворе, в одной или нескольких дозах в зависимости от полученного результата. Он используется в приготовлении высыхающих масел и в синтезе некоторых растительных эссенций.
3. Атмосферный озон
3.1. Стратосферный озон и преимущества озонового слоя
3.2. Тропосферный озон и его влияние на живые организмы
На высоте ниже 10 км уровни озона очень низкие, порядка 0,03 миллионных долей. Однако, в отличие от своей полезной роли в стратосфере, озон действует у земли как окислитель, который нарушает фотосинтез и может вызвать повреждение растений (коричневые пятна на листьях, соответствующие некрозу). В районах с высоким уровнем загрязнения, где его уровень может быть намного выше, озон непосредственно влияет на здоровье человека, особенно на дыхательную систему и слизистые оболочки. Озон раздражает легкие, вызывая кашель, респираторный дискомфорт, а иногда даже отек легких. Лечение после тяжелых ингаляций заключается в строгом покое под наблюдением врача.
Количество озона в атмосфере выражается как «уменьшенная толщина», т.е. вертикальная толщина столба, в котором был бы собран весь газ, при нормальной температуре и давлении. В среднем эта толщина составляет 2,5 мм.
4. Озоновая дыра
4.1. Открытие озоновой дыры
4.2 Происхождение и последствия
Если некоторые природные факторы, такие как выброс сернистых газов при извержениях вулканов, всегда способствовали частичному и временному разрушению озонового слоя, то опасность, которую представляют промышленные выбросы хлора, ученые осуждают с 1980 года. Хлорфторуглероды (ХФУ), используемые в качестве аэрозольных пропеллентов, хладагентов или пенообразователей в некоторых жестких пенопластах, являются основной причиной разрушения озонового слоя. Многие другие химические вещества, такие как галоны (галогенизированные производные углеводородов), используемые в огнетушителях, а также некоторые растворители, такие как четыреххлористый углерод или бромистый метил, также способствуют образованию озоновой дыры. Все эти соединения чрезвычайно стабильны и могут оставаться в атмосфере в течение 50-100 лет. Они попадают на полюса и высвобождают свои атомы хлора (или брома), которые разрушают озон.
Истощая озоновый слой, человеческая деятельность поставила под угрозу нашу естественную защиту от солнца. Истощение стратосферного озона приводит к увеличению количества ультрафиолетового излучения, достигающего земли. Эти лучи могут повреждать ДНК человека, вызывать рак кожи и катаракту, а также другие заболевания. Они также оказывают вредное воздействие на растения и фитопланктон.
4.3. Международная осведомленность
С 1985 года (Венская конвенция) несколько международных конференций ознаменовали собой глобальное осознание необходимости защиты стратосферного озонового слоя и обеспечения ограничения воздействия человеческой деятельности на климат. Основные страны-производители ХФУ отказались от производства и использования этих озоноразрушающих газов. Сегодня гидрофторуглероды (ГФУ) и перфторуглероды (ПФУ), второе поколение заменителей ХФУ, безопасны для озонового слоя (хотя для его восстановления потребуются годы), но они являются мощными парниковыми газами, способствующими глобальному потеплению.
История открытия
Озон был открыт в 1785 году. Нидерландский физик Мартин Ван Марум обнаружил вещество во время проводимых им опытов. Учёный пропустил через воздух электрический ток, после чего возник незнакомый запах. В результате реакции получился неизвестный газ синеватого цвета. По окислительным свойствам вещество оказалось сильнее кислорода. Кроме того, неизвестный газ воздействовал на ртуть при нормальных условиях и заставлял её терять характерный блеск и прилипать к стеклу.
Ван Марум полагал, что это была некая электрическая материя. Но он не считал его открытие важным. Только через половину столетия этим газом снова заинтересовались учёные.
Немец Кристиан Фридрих Шенбейн тщательно изучил нераскрытую материю и её свойства. В 1840 году он дал веществу название «озон», что на греческом означает «пахнуть». Такое наименование было связано со специфическим запахом газа. По ошибке многие считают, что именно Шенбейн был первооткрывателем этой материи. Учёный провёл эксперимент, в ходе которого озон вытеснял иод из иодида калия. Эта качественная реакция позволяет определить наличие вещества при помощи иодкрахмальной бумаги, которая приобретает синий оттенок.
В 1860 году было доказано, что при превращении кислорода в озон объём газа уменьшался. Для опытов химики Тэт и Эндрюс использовали стеклянную трубку с манометром, наполненную O2, с впаянными в неё проводниками из платины, которые способствовали получению электрического заряда.
Способы получения
Газ образуется во многих процессах, которые сопровождаются выделением атомарного кислорода. Озон формируется при разложении пероксидов, окислении фосфора и т. д.
В промышленной сфере вещество получают в специальном оборудовании, которое называют озонатор. Через воздух проводят электрическую искру, которая даёт реакцию 3O2→cur2O3. Получившийся газ отделяют фракционной перегонкой.
В лабораторных условиях используют пероксид бария, который обрабатывают концентрированной серной кислотой. В результате реакции получаются сульфат бария и озон.
В медицинских учреждениях, где вещество применяют для оздоровления пациентов, средство получают путём облучения кислорода ультрафиолетом. Именно этим способом газ образуется и в атмосфере нашей планеты под воздействием солнца.
Вещество в атмосфере
В атмосфере Земли озон находится в объёме 4 млрд тонн. Его концентрация растёт с удалением от поверхности планеты. Максимальное количество газа находится в стратосфере. Озоновый слой наблюдается на высоте 20−25 км от Земли. Хотя озона в атмосфере не так много, его хватает для обеспечения жизни на планете. Газ создаёт особый защитный слой, который не даёт опасным ультрафиолетовым лучам достичь поверхности Земли.
В последние годы специалисты уделяют много внимания появлению «озоновых дыр». В этих областях наблюдается значительно уменьшенный объём стратосферного вещества. Через такой тонкий газовый слой до Земли доходит жёсткое ультрафиолетовое излучение. Озон могут разрушать пыль, газы и различные естественные факторы.
Кроме того, существуют искусственные причины, воздействующие на озоновый слой. Например, фирмы создают фреоны с атомами хлора, которые используются в холодильной технике и для заполнения аэрозольных баллончиков. Эти соединения попадают в воздух, а затем постепенно поднимаются и достигают озонового слоя. Под воздействием солнечной радиации фреоны разлагаются и разрушают его.
Также следует учитывать тот факт, что сегодня люди вдыхают больше озона, чем в далёком прошлом. Это связано с загрязнением воздуха большими объёмами метана и оксидов азота.
Физические особенности
Основные физические свойства озона:
O 3 растворяется в воде в 10 раз быстрее, чем кислород. А с наличием примесей реакция ускоряется в несколько раз. В виде газа озон выступает диамагнетиком, а в жидком состоянии — слабым парамагнетиком. Производная кислорода отлично растворяется во фреонах с образованием стабильных растворов, которые возможно перевозить. Жидкий озон можно смешивать с азотом, аргоном, метаном, фтором, углекислотой и тетрахлоруглеродом в том же агрегатном состоянии.
Химическая природа
Молекулы озона отличаются неустойчивостью. После образования они существуют около 10−30 минут, а затем начинают разлагаться, образуя кислород и большой объём тепла. Если температура окружающей среды будет высокой, тогда процесс реакции ускорится. Тот же эффект наблюдается и при понижении атмосферного давления.
Среди химических свойств озона следует выделить его высокую реакционную способность. Он окисляет металлы (за исключением платины, золота и иридия), органические вещества, а также повышает степень окисления у оксидов. Действующим началом газа в качестве окислителя выступает атомарный кислород, который образуется при распаде молекулы озона. Однако в некоторых случаях в окислении участвуют все три атома элемента. Озон считается сильным окислителем, хотя уступает в этом плане фтору и фториду кислорода.
Если смешать озон с концентрированным раствором аммиака, получится нитрит аммония с выделением белого дыма. Вещество также способно «чернить» изделия из серебра, образуя AgO и Ag2O3.
Молекула газа становится стабильнее, если она превращается в отрицательный ион О3-. Такие анионы содержатся в озонидах (озонокислых солях). Соединения разлагаются во время хранения или при избытке H2O. Озонокислые соли хорошо растворяются в жидком аммиаке.
Газ способен уменьшать токсичность некоторых веществ. Например, он может окислить цианиды до цианатов, которые безопаснее для живых организмов.
Области использования
В Российской Федерации озон относится к группе вредных веществ первого класса опасности. Сильные окислительные свойства делают его опасным для здоровья человека. Однако вещество широко используется в разных сферах.
Основные области применения озона:
Озон применяется для дезинфекции одежды и помещений, озонирования растворов медицинского назначения. Также вещество используется в качестве дезинфицирующего средства при очистке воздуха и воды от вредных микроорганизмов.
Озонирование воды имеет много преимуществ перед хлорированием, поскольку в обработанной жидкости отсутствуют токсины. Кроме того, озон лучше растворяется в воде.
Если верить заявлениям озонотерапевтов, здоровье пациентов значительно улучшается, когда лечение включает пероральное или внутривенное применение вещества. Однако пока нет объективных клинических подтверждений терапевтического эффекта. Сегодня озонотерапию используют только в некоторых частных клиниках развитых стран, где она не считается лечебным методом. Поскольку доказано мутагенное и токсическое действие этого вещества, пациентов лечат озоном только с их согласия и лишь в тяжёлых случаях.
С начала XXI века многие компании начали выпускать бытовые озонаторы. Такие устройства предназначены для дезинфекции помещений. Перед их использованием необходимо прочитать инструкцию по применению техники. Поскольку некоторые фирмы не пишут в аннотациях о мерах безопасности при работе с озонаторами, не рекомендуется приобретать их продукцию.
Влияние на здоровье человека
Некоторые считают, что озон, как и кислород, полезен для организма. Многие люди любят гулять после дождя, когда в воздухе остаётся этот газ из-за грозы. Озон действительно разрушает токсические соединения и очищает кислород от вредных примесей. Из-за этого воздух после дождя свежий и приятный, а небо приобретает привлекательный лазурный оттенок.
Наличие в воздухе озона позволяет легче дышать, но сильный окислитель способен вызвать отравление и привести к летальному исходу. Негативные последствия происходят при превышении определённого порога концентрации и времени вдыхания этого вещества. Газ может вызывать мигрень, головокружения, раздражение слизистых органов зрения и обоняния, снижение артериального давления. Чрезмерное вдыхание вещества нередко способствует тому, что организм перестаёт сопротивляться бактериальным инфекциям дыхательной системы.
Учёные считают, что предельно допустимая концентрация (пдк) озона в воздухе составляет 0,1 мкг/л. Если человек проведёт несколько часов в помещении, где в воздухе будет содержаться больше 0,4 мкг/л вещества, у него появятся болезненные ощущения в груди, кашель и бессонница. Кроме того, возможно снижение остроты зрения. Более тяжёлые последствия наблюдаются при концентрации озона в воздухе свыше 2 мкг/л.
Опасный газ может образовывать с кислородом другое опасное вещество — пероксиацетилнитрат. Органическое соединение затрудняет дыхание и вызывает слезоточивость. Высокие концентрации этого вещества могут привести к параличу сердца.
Занимательные факты
Озон вызывает большой интерес не только у учёных, но и у обычных людей. Хотя это вещество ещё не полностью изучено, о нём уже имеется немало занимательной информации:
Вещество продолжают изучать не только из-за озоновых дыр, которые могут повлиять на будущее людей и всех других живых организмов. Хотя озон опасен, учёные считают, что он способен заменить многие лечебные средства при борьбе с тяжёлыми заболеваниями.
Озон с чем реагирует
- Сидит, значится, один мужик, рыбачит. Час сидит, два — не клюет. Скучно ему, да и холодно. Ну, он открыл бутылку водочки, налил в походный стаканчик 150, и только собрался эдак с чувством ее, мамочку, выкушать — клюет! Ну, мужик засуетился, неловко так подсек, и крохотный карасик ему прямо в стаканчик — плюх! Мужик брезгливо так выбросил карасика обратно в воду, водочку без кайфа заглотнул, насадил новую наживку, забросил удочку… И тут как поперло: судаки, лещи, щуки! Мужик еле успевает вытаскивать. И вот лежит в его корзине огромный сом и говорит:
— Ну, карасик, ну провокатор! Наливают, говорит, потом отпускают…
История открытия
В 1785 г. голландский физик Ван Ма-рум, проводя опыты с электричеством, обратил внимание на запах при образовании искр в электрической машине и на окислительные способности воздуха после пропускания через него электрических искр.
В 1840 г. немецкий ученый Шейнбейн занимаясь гидролизом воды пытался с помощью электрической дуги разложить её на кислород и водород. И тогда он обнаружил, что образовался новый, доселе не известный науке газ со специфическим запахом. Имя “озон” было присвоено газу Шейнбейном из-за характерного запаха и происходит от греческого слова “озиен”, что значит “пахнуть”.
22 сентября 1896 г. изобретатель Н. Тесла запатентовал первый генератор озона.
Химические свойства озона.
Следует отметить прежде всего два основных свойства озона:
Озон в отличие от атомарного кислорода является относительно устойчивым соединением. Он самопроизвольно разлагается при высоких концентрациях, при этом чем выше концентрация, тем выше скорость реакции разложения. При концентрациях озона 12-15 % озон может разлагаться со взрывом. Следует также отметить, что процесс разложения озона ускоряется с ростом температуры, а сама реакция разложения 2О3>3О2 + 68 ккал экзотермична и сопровождается выделением большого количества тепла.
Озон является одним из сильнейших природных окислителей. Окислительный потенциал озона составляет 2,07 В (для сравнения у фтора 2,4 В, а у хлора 1,7 В).
Озон окисляет все металлы за исключением золота и группы платины, доокисляет оксиды серы и азота, окисляет аммиак с образованием нитрита аммония.
Озон активно вступает в реакцию с ароматическими соединениями с разрушением ароматического ядра. В частности озон реагирует с фенолом с разрушением ядра. Озон активно взаимодействует с насыщенными углеводородами с разрушением двойных углеродных связей.
Взаимодействие озона с органическими соединениями находит широкое применение в химической промышленности и в смежных отраслях. Реакции озона с ароматическими соединениями легли в основу технологий дезодорации различных сред, помещений и сточных вод.
Технологическое применение озона
В последние 20 лет области применения озона значительно расширились и во всем мире ведутся новые разработки. Столь бурному развитию технологий с использованием озона способствует его экологическая чистота. В отличие от других окислителей озон в процессе реакций разлагается на молекулярный и атомарный кислород и предельные оксиды. Все эти продукты, как правило, не загрязняют окружающую среду и не приводят к образованию канцерогенных веществ как, например, при окислении хлором или фтором.
Вода:
В 1857 г. с помощью созданной Вернером фон Сименсом «совершенной трубки магнитной индукции» удалось построить первую техническую озоновую установку. В 1901 г. фирмой «Сименс» построена первая гидростанция с озонаторной установкой в Висбанде.
Исторически применение озона началось с установок по подготовке питьевой воды, когда в 1898 году в городе Сан Мор (Франция) прошли испытания первой опытно-промышленной установки. Уже в 1907 году был построен первый завод по озонированию воды в городе Бон Вуаяж (Франция) для нужд города Ниццы. В 1911 году была пущена в эксплуатацию станция озонирования питьевой воды в Санкт-Петербурге.
В настоящее время 95% питьевой воды в Европе проходит озонную подготовку. В США идет процесс перевода с хлорирования на озонирование. В России действуют несколько крупных станций (в Москве, Нижнем Новгороде и других городах).
Воздух:
Применение озона в системах очистки воды доказано в высшей степени эффективным, однако до сих пор не создано таких же эффективных и доказано безопасных воздухоочистительных систем. Озонирование считается нехимическим способом очистки и поэтому популярно среди населения. Вместе с тем, хроническое воздействие микро-концентраций озона на организм человека достаточно не изучено.
При очень незначительной концентрации озона воздух в помещении чувствуется приятным и свежим, а неприятные запахи ощущаются гораздо слабее. В противоположность распространенному мнению о благоприятном воздействии этого газа, которое приписывают в некоторых проспектах богатому озоном лесному воздуху, в действительности озон даже при большом разбавлении представляет собой очень токсичный и опасный раздражающий газ. Даже малые концентрации озона могут оказывать раздражающее действие на слизистые оболочки и вызывать нарушения центральной нервной системы, что ведет к появлению бронхита и головных болей.
ПРИНЦИП ДЕЙСТВИЯ.
Озон образуется из кислорода. Существует несколько способов получения озона, среди которых наиболее распространенными являются: электролитический, фотохимический и электросинтез в плазме газового разряда. Дабы избежать нежелательных окисей предпочтительнее получать озон из чистого медицинского кислорода используя электросинтез. Концентрацию получаемой озоно-кислородной смеси в таких аппаратах легко варьировать — либо задавая определенную мощность электрического разряда, либо регулируя поток входящего кислорода (чем быстрее кислород проходит через озонатор, тем меньше озона образуется).
Электролитический метод синтеза озона осуществляется в специальных электролитических ячейках. В качестве электролитов используются растворы различных кислот и их соли (H2SO4, HClO4, NaClO4, KClO4). Образование озона происходит за счет разложения воды и образования атомарного кислорода, который присоединяясь к молекуле кислорода образует озон и молекулу водорода. Этот метод позволяет получить концентрированный озон, однако он весьма энергоемкий, и поэтому он не нашел широкого распространения.
Фото-химический метод получения озона представляет из себя наиболее распространенный в природе способ. Образование озона происходит при диссоциации молекулы кислорода под действием коротковолнового УФ излучения. Этот метод не позволяет получать озон высокой концентрации. Приборы, основанные на этом методе, получили распространение для лабораторных целей, в медицине и пищевой промышленности.
Электросинтез озона получил наибольшее распространение. Этот метод сочетает в себе возможность получения озона высоких концентраций с большой производительностью и относительно невысокими энергозатратами.
В результате многочисленных исследований по использованию различных видов газового разряда для электросинтеза озона распространение получили аппараты использующие три формы разряда:
ЭФФЕКТ СТЕРИЛИЗАЦИИ.
К стерилизующим достоинствам озона относят широкий спектр его биоцидного действия при низкой концентрации, возможность использования для обеззараживания труднодоступных поверхностей, более короткий период полураспада в сравнении с другими газами, а также наличие дезодорирующего эффекта.
Механизм инактивации воздушной микрофлоры озоном очень похож на действие озона в воде. Сперва озон воздействует на оболочку микроорганизмов путем реакции с двойными связями липоидов. Затем, благодаря способности разрушать дегидрогеназы клетки, озон воздействует на ее дыхание. В результате нарушения проницаемости оболочки и изменения растворимости белков клетка лизируется. Обнаружено проникновение озона внутрь микробной клетки, вступление его в реакцию с веществами цитоплазмы и превращение замкнутого плазмида ДНК в открытую ДНК, что снижает пролиферацию бактерий.
Противовирусное действие озона связывается с разрушением вирусных частиц, инактивацией обратной транскриптазы и влиянием на способность вируса связываться с клеточными рецепторами. Капсулированные вирусы более чувствительны к действию озона, чем некапсулированные. Это объясняется тем, что капсула содержит много липидов, которые легко взаимодействуют с озоном.
Наблюдается известное различие между разными видами микроорганизмов по их сопротивляемости действию озона. Довольно быстро погибают возбудители ангины, дифтерии, различные плесени. Как правило, наиболее устойчивы микробы, покрытые оболочкой, как например туберкулезная палочка и микробные споры.
Эффективность стерилизующего действия озона зависит от его концентрации, экспозиции, температуры, влажности, вида микроорганизма, pH и исходной обсемененности обеззараживаемого воздуха.
Озон в низких концентрациях (около 0,2 мг/м3) не очень эффективен для уничтожения бактерий, т.к. они восстанавливаются спустя некоторое время после обработки. В этих случаях озон оказывает лишь поверхностное действие (контактируя с внешней оболочкой клетки) и незначительно проникает вглубь. Для полной инактивации микрофлоры помещения необходима высокая концентрация озона и длительное время для контакта с микроорганизмами.
Оксиды азота (N2О, N2O5, NO и др.) усиливают бактерицидные свойства озона, которые в значительной степени зависят от влажности воздуха. При относительной влажности воздуха ниже 45 % озон почти не оказывает бактерицидного действия, а оптимум его активности лежит между 60-80 % влажности.
В профессиональных целях для стерилизации воздуха помещения в присутствии людей генератор озона служить не может, поскольку концентрация озона в несколько раз превышает ПДК для человека. Высокая концентрация выделяющегося озона приводит к деструкции полимеров и натуральной резины, окислению металлов и порче электронного оборудования.
ЭФФЕКТ ФИЛЬТРАЦИИ.
Способность озона окислять органический и неорганический материал еще окончательно не доказана и его эффективность при удалении загрязняющих веществ типа пыльцы, пыли, оксида углерода, формальдегидов из воздуха весьма сомнительна (вопреки заявлениям некоторых производителей). Озон, как показывает практика, взаимодействуя с другими загрязняющими веществами, способен произвести даже более вредные химические соединения чем те, которые намеревались удалить из воздуха.
На основе проведённых испытаний Федеральная Торговая Комиссия США выпустила специальное постановление 5 января 1998 г., в котором производителям озонаторных установок запретили заявлять в рекламе о способности их устройств очищать воздух.
В 1997 г. компании-производители озонаторов Living Air Corporation, Alpine Industries Inc.(ныне “Ecoguest”), Quantum Electronics Corp. и другие, нарушившие предписание ФТК США, решением судов были наказаны в административном порядке, включая запрет на дальнейшую деятельность некоторых из них на территории США. В тоже время частные предприниматели, продававшие генераторы озона c рекомендациями использовать их в помещениях с людьми, получили тюремные сроки заключения от 1 до 6 лет.
В настоящее время некоторые из этих западных компаний успешно развивают активную деятельность по реализации своей продукции в России.
Недостатки озонаторов:
Любая система стерилизации, использующая озон, требует тщательного контроля техники безопасности, тестирование константы концентрации озона газоанализаторами, а также аварийного управления чрезмерной концентрацией озона.
Озонатор не рассчитан для работы в:
Применение озонаторов для стерилизации воздуха в помещениях:
РЕЗЮМЕ.
Озонирование высокоэффективно для стерилизации поверхностей и воздушной среды помещения, однако эффект очистки воздуха от механических примесей отсутствует. Невозможность использования метода в присутствии людей и необходимость проводить обеззараживание в герметичном помещении серьезно ограничивает сферу его профессионального применения.