Омез или ганатон что лучше
Сочетанная терапия ингибитором протонной помпы и антацидом: когда это необходимо.
История применения средств для подавления синтеза и нейтрализации соляной кислоты насчитывает не одно тысячелетие [1], однако первые препараты, эффективно блокирующие желудочную секрецию, появились около 100 лет назад, а наиболее эффективные средства, бло
История применения средств для подавления синтеза и нейтрализации соляной кислоты насчитывает не одно тысячелетие [1], однако первые препараты, эффективно блокирующие желудочную секрецию, появились около 100 лет назад, а наиболее эффективные средства, блокирующие «протонную помпу», — только в последние десятилетия. Сегодня известно, что секреция соляной кислоты париетальными клетками слизистой оболочки желудка обусловлена трансмембранным переносом протонов, который осуществляется при помощи протонного насоса — Н+К+-АТФазы. Ингибиторы протонной помпы (ИПП) избирательно накапливаются в кислой среде секреторных канальцев париетальной клетки, где их концентрация в 1000 раз превосходит концентрацию в крови. В секреторных канальцах эти лекарственные средства претерпевают ряд изменений, в результате которых переходят в активную форму и образуют прочные ковалентные связи с определенными участками Н+К+-АТФазы, исключая возможность конформационных переходов фермента, и блокируют его работу.
По своей химической структуре ИПП относятся к классу бензимидазолов, отличающихся друг от друга радикалами в пиридиновом и бензимидазольном кольцах. Существует несколько препаратов этой группы: омепразол, лансопразол, пантопразол, рабепразол и эзомепразол. Именно ИПП обладают самым мощным эффектом среди всех антисекреторных средств. Для сравнения — процент снижения интрагастральной кислотности при применении ранитидина 300 мг или фамотидина 40 мг составляет 69% и 70% соответственно. Степень и продолжительность повышения значений рН являются прогностическими факторами при заболеваниях, связанных с избыточной продукцией кислоты. Так, оптимальными условиями для заживления язвы двенадцатиперстной кишки является поддержание рН > 3 в течение 18 часов в сутки, для заживления рефлюкс-эзофагита — > 4, для эрадикации инфекции H. pylori — > 5.
Блокаторы Н2-рецепторов гистамина уступают ИПП, в силу более выраженного антисекреторного эффекта последних, позволяющего достигать оптимальных значений рН при лечении кислотозависимых заболеваний. Помимо этого, длительный прием блокаторов Н2-рецепторов гистамина сопровождается увеличением числа париетальных клеток, а также рецепторов как к гистамину, так и гастрину (рис. 1). Уступая в эффективности и безопасности ИПП, блокаторы Н2-рецепторов гистамина в настоящее время занимают позиции, ограниченные непереносимостью/толерантностью к ИПП.
Казалось бы, назначив ИПП, можно забыть и о блокаторах Н2-рецепторов гистамина, и об антацидах. Однако не совсем правильно было бы сводить патогенез химического повреждения слизистой оболочки верхних отделов желудочно-кишечного тракта к воздействию только кислотного фактора. Немалая роль принадлежит также компонентам дуоденального содержимого — желчным кислотам, лизолецитину. Эти вещества, ретроградно попадающие в просвет желудка и пищевода, наносят существенный вред слизистой оболочке, «неадаптированной» к их воздействию, а желчные кислоты дополнительно стимулируют секрецию сока поджелудочной железы.
В чем же секрет терапевтической актуальности антацидов на протяжении нескольких столетий. По своей химической природе антацидные средства — это основания, вступающие в реакцию с соляной кислотой, в результате чего образуются хлориды, вода и иногда углекислый газ. При повышении рН до 3,5 антациды связывают ионы водорода на 99%, что сопровождается значительным уменьшением их диффузии в слизистую оболочку и препятствует прямому повреждающему действию соляной кислоты. Антациды препятствуют проявлению агрессивных свойств соляной кислоты, уже выделившейся в просвет желудка.
Сила действия антацидных препаратов определяется их кислотонейтрализующей активностью (КНА), которая выражается в миллиэквивалентах (количество 1N соляной кислоты, титруемое до рН 3,5 определенной дозой препарата за установленное время). КНА различных антацидов варьируется в широких пределах (табл.).
Скорость наступления антацидного эффекта определяется скоростью растворения препарата и его лекарственной формой. Быстрое развитие буферного эффекта характерно для натрия гидрокарбоната, кальция карбоната, а также гидроксида магния, которые достаточно легко растворяются в желудке. Суспензии обычно растворяются быстрее, чем твердые лекарственные формы. На продолжительность действия антацидов существенно влияет скорость их эвакуации из желудка, которая определяется, в свою очередь, наличием или отсутствием пищи в желудке. Антацидный препарат, принятый через час после еды, дольше задерживается в желудке и обеспечивает более продолжительный эффект.
В настоящее время существует две основные группы антацидов. Классификация антацидов базируется на их способности к всасыванию. В соответствии с этим антациды условно разделяют на всасывающиеся (растворимые) и невсасывающиеся. Всасывающиеся антациды могут оказывать системные эффекты, невсасывающиеся действуют преимущественно в желудочно-кишечном тракте.
Таким образом, интегральный механизм действия современных антацидных средств складывается из:
Итак, ИПП и антациды имеют различные точки приложения: ИПП наиболее эффективно подавляют продукцию соляной кислоты, а антациды нейтрализуют уже синтезированные агрессивные молекулы желудочного сока, связывают пепсин и желчные кислоты, оказывая помимо этого и цитопротективное действие. В каких же клинических ситуациях наиболее оправдана данная комбинация.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ)
Монотерапия невсасывающимися антацидами может быть оправдана в случае впервые выявленной неэрозивной формы ГЭРБ у молодых, когда изменение образа жизни и терапия антацидами может быть достаточно [3]. Вместе с тем антациды и алгинаты должны быть рекомендованы больным в режиме «по требованию» [4], а также (при смешанном либо щелочном рефлюксате) в качестве компонента комплексной курсовой терапии в сочетании с ИПП и прокинетиками (рис. 2). Среди антацидных средств, назначаемых в комбинации с ИПП, наибольшая доказательная база накоплена в отношении Маалокса [5]. Оптимальное соотношение гидроксидов алюминия и магния (0,9 в суспензии и 1,0 в таблетках) обеспечивает взаимодополняющее действие компонентов препарата, определяющее быстрый и продолжительный антацидный эффект и, как правило, легкое послабляющее действие. Маалокс не только активно нейтрализует соляную кислоту, что обусловливает скорость наступления положительного эффекта, но и способен адсорбировать ее, пролонгируя антацидное действие (на период не менее 3 часов). Буферное действие препарата обеспечивает достижение внутрижелудочного рН 3,0–3,5, что не только предотвращает развитие вторичной гиперсекреции, характерной для более высокого повышения рН, но и позволяет использовать его при кислотозависимых заболеваниях вместе с антисекреторными препаратами. Сочетанная терапия ГЭРБ ИПП и Маалоксом отвечает основным целям терапии пациентов с ГЭРБ, так как способствует более полному и частому устранению симптомов заболевания, то есть более раннему и частому наступлению клинической ремиссии, эндоскопической, гистологической ремиссии, а также улучшению качества жизни пациентов вследствие стихания основных симптомов заболевания [7].
Язвенная болезнь
Комбинация ИПП с антацидом показана при длительно незаживающих язвах для усиления цитопротективного эффекта (рис. 3). Современные невсасывающиеся антациды оказывают цитопротективное действие, обусловленное увеличением синтеза простагландина Е2, стимуляцией секреции бикарбонатов и защитной мукополисахаридной слизи, улучшением микроциркуляции и фиксацией эпителиального фактора роста в зоне язвенного дефекта. Таким образом, комбинированная терапия с антацидом позволяет наиболее эффективно стимулировать локальные репаративно-регенераторные процессы, клеточную пролиферацию и ангиогенез.
Хронический панкреатит
В настоящее время к кислотозависимым заболеваниям относят не только те, при которых соляная кислота выступает как реализующий фактор, но и заболевания, при которых соляная кислота поддерживает течение (прогрессирование) болезни и в лечении которых без блокаторов секреции (или связывания кислоты) обойтись нельзя. При хроническом панкреатите вследствие внешнесекреторной недостаточности или нарушения выделения панкреатического сока нередко наблюдается значительное снижение продукции бикарбонатов поджелудочной железой, что приводит к нарушению нормального процесса «защелачивания» дуоденального содержимого. Последствием этого может являться нарушение высвобождения и активации частиц ферментных препаратов, покрытых энтеросолюбильной оболочкой. Кроме того, при низких значениях рН происходит преципитация желчных солей и нарушение эмульгации жира, что снижает его доступность для расщепления липазой.
В соответствии с этим для достижения более высоких значений рН в двенадцатиперстной кишке и повышения эффективности ферментной терапии целесообразно одновременное назначение антацидов за 30 мин до и через 1 ч после еды и антисекреторных препаратов. В ряде исследований было продемонстрировано, что Маалокс обладает умеренной пепсиноадсорбирующей активностью, что, с одной стороны, усиливает его терапевтический эффект, а с другой — не «выключает» желудок из процесса гидролиза компонентов химуса. Он также адсорбирует желчные кислоты и лизолецитин, что позволяет предотвращать пептическое поражение слизистой оболочки желудка и пищевода у больных с дуоденогастральным и дуоденогастроэзофагеальным рефлюксом и при несинхронном попадании в двенадцатиперстную кишку химуса, желчи и секрета поджелудочной железы у больных, перенесших холецистэктомию или эндоскопическую папиллосфинктеротомию. Эти свойства препарата полезны больным с хроническим рецидивирующим панкреатитом, возникшим вследствие билио- или дуоденопанкреатического рефлюкса, т. к. желчные кислоты, попавшие в проток поджелудочной железы, участвуют в интрапанкреатической активации трипсиногена, а лизолецитин имеет выраженное панкреотоксическое действие [8].
В последние годы появились отдельные сообщения о возможности развития синдрома «рикошета» кислотной гиперсекреции (rebound acid hypersecretion) после прекращения 8-недельного курса ИПП [9], что делает целесообразным комбинацию с антацидами на этапе отмены ИПП [10].
Таким образом, антациды сохраняют свою актуальность и в эру ИПП, позволяя в комбинации с ними существенно повысить эффективность терапии пациентов с кислотозависимыми заболеваниями.
Литература
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство
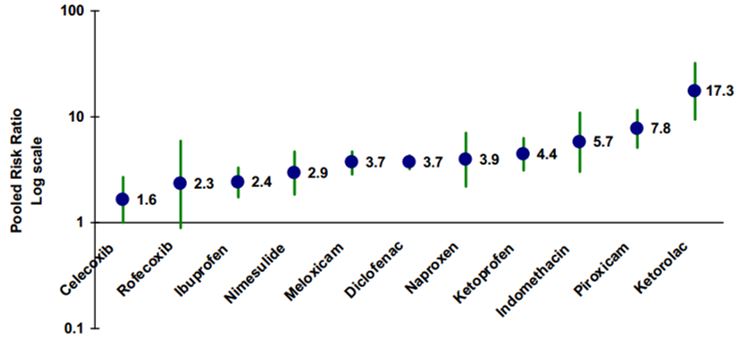
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
Новый подход к повышению эффективности ингибиторов протонной помпы у больного гастроэзофагеальной рефлюксной болезнью
Ингибиторы протонной помпы наиболее эффективны для лечения гастроэзофагеальной рефлюксной болезни. Особенности фармакокинетики и фармакодинамики декслансопразола в форме капсул с модифицированным высвобождением улучшают контроль кислотопродукции при однок
Proton pump inhibitors are the most efficient for treatment of gastroesophageal reflux disease. Characteristics of pharmacokinetics and pharmacodynamics of dexlansoprazole in the form of capsules with modified release improve acid-production control in single batching, regardless of the meal.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — это состояние, развивающееся, когда рефлюкс содержимого желудка вызывает появление беспокоящих пациента симптомов и/или развитие осложнений. ГЭРБ проявляется широким спектром пищеводных (прежде всего, изжогой и регургитацией) и внепищеводных симптомов (ассоциированные с рефлюксом бронхиальная астма, кашель, ларингит и др.). Осложнениями ГЭРБ являются рефлюкс-эзофагит, стриктуры, пищевод Барретта, аденокарцинома пищевода [1]. Распространенность ГЭРБ в Москве составляет 23,6%, в городах России 11,3–14,3% [2]. В странах Западной Европы она колеблется от 10% в Испании и Великобритании до 17% в Швеции, в США — от 13% до 29% [3]. В основе патогенеза ГЭРБ лежат моторные нарушения, ведущие к дисфункции антирефлюксных механизмов и возникновению патологического гастроэзофагеального рефлюкса, источником которого является «кислотный карман» — слой небуферизованной кислоты, образующийся на поверхности содержимого желудка после приема пищи [4].
Появление ингибиторов протонной помпы (ИПП) произвело революцию в лечении кислотозависимых заболеваний. Они признаны наиболее эффективными препаратами для лечения ГЭРБ [5].
Эффект ИПП при ГЭРБ основан на подавлении кислотопродукции желудка, в результате которого уменьшается объем и снижается повреждающий потенциал «кислотного кармана», что создает условия для купирования симптомов и заживления повреждений слизистой оболочки пищевода [6]. Вероятность устранения изжоги возрастает по мере угнетения секреции соляной кислоты, что определяет преимущества ИПП перед блокаторами Н2-рецепторов и прокинетиками (ОР изжоги при назначении прокинетиков 0,86; 95% ДИ 0,73–1,01; блокаторов Н2-рецепторов — 0,77; 95% ДИ 0,60–0,99; ИПП — 0,37; 95% ДИ 0,32–0,44) [7]. Четырехнедельный прием ИПП обеспечивает заживление рефлюкс-эзофагита у 90% больных [8]. ИПП наиболее эффективны для поддержания эндоскопической ремиссии ГЭРБ [9].
Вместе с тем все более существенной проблемой становится неэффективность ИПП. Принято считать, что стандартные дозы ИПП не обеспечивают полного разрешения симптомов у 10–40% больных. Неэффективность объясняется влиянием множества факторов, среди которых недостаточное подавление кислотопродукции, связанное с особенностями фармакокинетики ИПП, и проблемы комплаенса — несоблюдение больным рекомендаций врача по дозе и времени приема ИПП [10, 11].
ИПП необратимо блокируют активные протонные помпы [13]. Протонные помпы становятся активными только после встраивания в мембрану секреторного канальца париетальной клетки в ответ на стимуляцию. Оптимальным считается прием ИПП за 30 мин до приема пищи, что позволяет обеспечить максимальную концентрацию препарата в крови в период максимальной стимуляции кислотопродукции принятой пищей. Такой режим приема соблюдают лишь 46% больных. Среди пациентов, нарушающих оптимальный режим приема ИПП, значительная часть больных принимает лекарство более чем за час до еды (39%), после еды (30%), перед сном (28%) или по необходимости (3%), что снижает эффективность лечения [14]. Однако и в случае оптимального приема ИПП клетка сохраняет значительный запас неактивных помп, около 25% которых ежедневно синтезируется. В первый прием ИПП ингибируются те протонные помпы, которые активны в данный момент, во второй прием — те, которые стали активными после приема первой дозы, и так далее. Этот процесс циклично повторяется до достижения динамического равновесия, когда в среднем к третьему дню приема ИПП заблокированными оказываются примерно 70% помп [15].
Все традиционные ИПП обладают относительно коротким периодом полувыведения из плазмы крови (1–2 часа) и ограниченное время находятся в системном кровотоке [16]. Поэтому при однократном приеме системное воздействие ИПП постепенно снижается, по истечении суток циркулирующие молекулы ИПП в плазме отсутствуют, а секреция кислоты восстанавливается за счет активации новых помп [17]. Кроме того, период обновления помп у всех людей разный, и если он короткий, контроль кислотопродукции обеспечить труднее [18]. По этим причинам первый прием ИПП полностью купирует изжогу лишь у 30% больных, а у большинства пациентов в течение первых 2 дней лечения изжога не уменьшается [19]. Показано, что существенное преимущество в скорости купирования изжоги и улучшении качества жизни больных на первой неделе лечения, в период достижения оптимального антисекреторного эффекта ИПП, имеет комбинированная терапия ИПП и альгинатами [20].
Антисекреторные эффекты стандартных доз ИПП при длительном лечении сопоставимы [21]. Повышение эффективности терапии возможно при увеличении длительности нахождения ИПП в системном кровотоке, для достижения которой предложен ряд подходов [22]. Один из них — увеличить разовую дозу при применении препарата 1 раз в день. Однако существующие ИПП обеспечивают почти максимальное подавление активных протонных помп, поэтому увеличения разовой дозы недостаточно для повышения продолжительности контроля секреции желудка и прироста клинического эффекта [23]. Консенсус по лечению ГЭРБ Американской гастроэнтерологической ассоциации (American Gastroenterological Association, AGA) рекомендует в случае неэффективности лечения ИПП один раз в день увеличить кратность приема ИПП до двух раз в день [24]. Однако увеличение кратности приема снижает приверженность режиму лечения [25]. Кроме того, по данным наблюдательных исследований, длительное применение ИПП в высоких дозах может быть ассоциировано с повышенным риском остеопороза, переломов бедра и позвоночника, избыточного бактериального роста, колита, вызванного Clostridium difficile, и внебольничной пневмонии, а также увеличивает стоимость лечения [26, 27]. Поэтому предпочтительно назначение препарата один раз в день, что определяет потребность в ИПП, обладающем лучшими фармакокинетическими/фармакодинамическими характеристиками [28].
Одним из решений этой задачи стало создание энантиомеров ИПП, первый из которых эзомепразол — S-изомер омепразола. Более медленный метаболизм, чем у R-омепразола, обеспечивает его высокую концентрацию в плазме [29] и значительно более выраженное подавление кислотопродукции эзомепразолом в дозе 40 мг, чем омепразол в дозе 20 мг, лансопразол 30 мг, рабепразол 20 мг или пантопразол 40 мг [30]. Это объясняет клинические преимущества эзомепразола у больных ГЭРБ, у которых, несмотря на прием стандартной дозы ИПП в течение 8 недель, сохранялись симптомы. При замене ИПП на эзомепразол в дозе 40 мг было получено достоверное уменьшение частоты возникновения и выраженности изжоги, регургитации и боли в эпигастрии [31]. При этом время с рН > 4 в желудке после однократного приема эзомепразола составило только 58,43% суток, а период полувыведения эзомепразола из плазмы не отличается от других ИПП [32]. Следовательно, создание самой по себе энантиомерной формы может быть недостаточно для обеспечения длительного контроля секреции кислоты, необходимого для достижения оптимального эффекта.
Изучаются новые ИПП, обладающие большей мощностью и более длительными периодами полувыведения. Так, исследования тенатопразола у здоровых добровольцев показали, что это вещество на основе, отличной от бензимидазола, имеет более длительный период полувыведения (приблизительно 8 часов после однократного и 14 — после многократного применения), что приводит к примерно 20-кратному увеличению площади под кривой «концентрация/время» (AUC), и оказывает более выраженный ингибиторный эффект [33].
Повышение эффективности ИПП возможно за счет добавления компонентов, стимулирующих активацию протонных помп, что повышает скорость достижения эффекта и устраняет необходимость приема за 20–30 минут до еды. Так, омепразол немедленного высвобождения (Омез® Инста) представляет собой комбинацию из порошка омепразола без энтерального покрытия и гидрокарбоната натрия, который защищает действующее вещество от разрушения при контакте с соляной кислотой. Быстрое развитие эффекта связано с активацией протонных помп через механизм обратной связи секреции соляной кислоты при повышении внутрижелудочного pH гидрокарбонатом натрия [34].
Более длительное нахождение ИПП в плазме крови можно обеспечить путем использования препаратов с модифицированным высвобождением. Оно реализовано в лекарственной форме декслансопразола, представляющего собой энантиомер лансопразола с модифицированным высвобождением. Лансопразол и его энантиомеры не отличаются по их способности ингибировать протонные помпы. Вместе с тем R- энантиомер (декслансопразол) после приема лансопразола внутрь составляет 80% от его концентрации в крови, обеспечивает снижение выведения и в пять раз увеличивает системное воздействие по сравнению с капсулами с S-энантиомером [35]. Декслансопразол с модифицированным высвобождением представляет собой лекарственную форму декслансопразола, в котором используется новая технология двойного замедленного высвобождения. Использование технологии двойного высвобождения позволяет разделить высвобождение препарата в желудочнокишечном тракте (ЖКТ) на два этапа, благодаря чему он длительно остается в плазме и ингибирует вновь активированные протонные помпы. Капсулы декслансопразола с технологией двойного высвобождения содержат смесь из двух типов гранул, каждый из которых обладает своим pH-зависимым профилем растворимости. Один тип гранул обеспечивает быстрое высвобождение препарата в проксимальной части двенадцатиперстной кишки, гранулы второго типа высвобождаются в дистальном отделе тонкой кишки. В результате фармакокинетический профиль декслансопразола с использованием технологии двойного высвобождения характеризуется наличием двух пиков, в отличие от традиционных ИПП, для которых характерно наличие одного пика (рис. 1). Первый пик наблюдается через 1–2 часа после применения препарата, что соответствует пику концентрации при приеме лансопразола (показатель tmax). Второй пик отмечается через 4–5 часов после приема декслансопразола [36]. Декслансопразол с использованием технологии двойного высвобождения характеризуется большей AUC и увеличением максимальной концентрации (Cmax) при сравнении с лансопразолом. Средние значения Cmax и AUC декслансопразола после одно- и многократного применения пропорциональны дозе препарата. Для декслансопразола средние значения AUC были в 3–7 раз выше, а средние значения Cmax — в 1,5–3 раза выше, чем для лансопразола 30 мг.
Декслансопразол обеспечивал более длительное воздействие препарата по сравнению с лансопразолом 30 мг, о чем свидетельствует более позднее наступление tmax и существенное повышение концентрации препарата в плазме через 3–8 ч после его приема внутрь (рис. 2). Воздействие декслансопразола на 5 день сопоставимо с воздействием в 1-й день независимо от режима терапии, следовательно, фармакокинетика препарата после его приема внутрь не зависит от времени [37].
Следствием этого является удлинение среднего времени нахождения молекулы в системном кровотоке (MRT): для декслансопразола с использованием технологии двойного высвобождения от 5,6 до 6,4 часа, для традиционной лекарственной формы лансопразола с однократным высвобождением от 2,8 до 3,2 часа. Это указывает на то, что использование технологии двойного высвобождения позволяет повысить продолжительность воздействия за счет увеличения среднего времени всасывания [38]. Таким образом, декслансопразол с использованием технологии двойного высвобождения обладает улучшенным фармакодинамическим профилем по сравнению с традиционными системами доставки лекарств, обычно используемыми в лекарственных формах ИПП.
Более длительное поддержание концентрации декслансопразола в плазме обеспечивается его высвобождением на протяжении продолжительного времени, поскольку высвобождение препарата происходит в разных отделах ЖКТ в два этапа. Более длительное всасывание препарата не оказывало влияния на его период терминального полувыведения, а применение декслансопразола один раз в день не приводило к значимой кумуляции [37]. У пациентов, получавших декслансопразол на протяжении до 12 месяцев, наблюдалось повышение уровня гастрина сыворотки, характерное для ИПП, не зависевшее от дозы препарата [38]. Клинически значимых изменений лабораторных показателей, показателей жизнедеятельности и результатов биопсии желудка не наблюдалось [39].
Критерием клинической эффективности ИПП при лечении кислотозависимых заболеваний являются среднее значение рН и процент времени с pH > 4 в теле желудка за 24 часа после приема препарата. После приема внутрь декслансопразола с технологией двойного высвобождения были отмечены достоверно более высокие показатели pH среднего и времени с pH > 4, чем после приема лансопразола 30 мг (рис. 3). На 5-й день при применении декслансопразола отмечалось потенциально клинически значимое повышение среднего уровня pH (> 0,5) и доли времени с pH 4 (более 10% за период от 16 до 24 часов). Таким образом, при использовании декслансопразола воздействие и pH-контроль были длительнее по сравнению с лансопразолом 30 мг [40]. Эмпирические модели на основе информационных критериев Akaike позволяют оценить соотношение между долей времени, когда концентрация препарата в плазме остается выше пороговой, и долей времени, на протяжении которого pH больше 4 после многократного применения декслансопразола и лансопразола внутрь [40]. В соответствии с этим критерием пороговая концентрация должна составлять 125 нг/мл [41]. При применении декслансопразола в дозах от 30 мг концентрация препарата в плазме крови была выше пороговой в 2–3 раза дольше, чем при использовании лансопразола в дозе 30 мг (рис. 4).
Заключение
Появление ИПП установило новый стандарт лечения больных гастроэзофагеальной рефлюксной болезнью. Несмотря на их эффективность, важной проблемой стало появление случаев недостаточного ответа на лечение. Понимание ключевых механизмов неэффективности ИПП поставило задачу их преодоления, для чего потребовалось появление лекарственной формы, однократный прием которой вне зависимости от приема пищи позволил бы длительно контролировать кислотопродукцию желудка. Декслансопразол — препарат Дексилант®, в котором реализован новый метод доставки действующего вещества, позволяет решить некоторые проблемы ИПП с традиционным методом доставки и повысить клиническую эффективность [42]. Особенностью лекарственной формы декслансопразола с технологией двойного высвобождения является наличие двух пиков концентрации в плазме крови, в результате чего терапевтическая концентрация препарата сохраняется дольше по сравнению с традиционной лекарственной формой лансопразола, позволяя оптимизировать воздействие препарата на внутрижелудочный pH и улучшить клинический ответ на лечение.
Литература
Д. С. Бордин, доктор медицинских наук
ЦНИИГ ГБУЗ МКНЦ ДЗМ, Москва
.jpg)
.gif)
.gif)
_575.gif)
.gif)