Октреотид или ланреотид что лучше
Проблема неэффективности аналогов соматостатина в лечении нейроэндокринных опухолей
Аналоги соматостатина (АСС) играют ключевую роль в лечении диссеминированных высокодифференцированных НЭО, как функционирующих, так и нефункционирующих. Воздействуя на рецепторы соматостатина, они ингибируют гормональную активность НЭО и оказывают прямой антипролиферативный эффект, увеличивая медиану времени до прогрессирования.
В настоящее время считается, что антипролиферативный эффект осуществляется путем связывания с рецепторами соматостатина и с системным воздействием, что приводит к угнетению таких клеточных функций, как секреция, подвижность и пролиферация.
АСС являются терапией первой линии при функционально активных НЭО, включая опухоли с проявлениями карциноидного синдрома и других функционально активных НЭО.
Препараты пролонгированного действия (ланреотид 120 мг глубоко подкожно 1 раз в 28 дней, октреотид 20-30 мг внутримышечно 1 раз в 28 дней) используются в течение длительного времени при успешном контроле симптомов, вызванных гиперсекрецией функционально активных НЭО.
АСС рекомендуются в качестве первой линии системной терапии при высокодифференцированных НЭО для контроля роста опухоли. Согласно рекомендациям ENETS 2016 года, АСС можно использовать в качестве первой линии системной терапии при НЭО G1 и G2 (Ki67
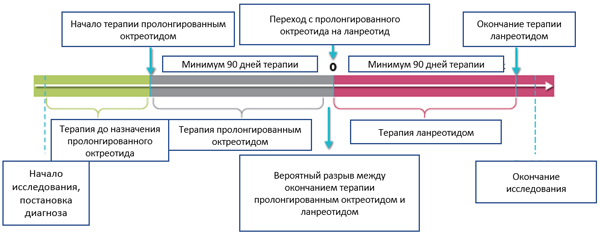
Причинами перехода были: прогрессирование (n=20; 22%), изменение формы введения препарата (n=14; 15,4%), предпочтение пациента (n=9; 9,9%), не указана причина перехода (n=33; 36,3%)
После постановки диагноза ГЭП НЭО пациенты начинали терапию октреотидом в среднем через 17 мес. и получали октреотид в среднем в течение 38,4 мес.
Клинически подтвержденное прогрессирование на момент начала терапии ланреотидом наблюдалось у 24,2% пациентов.
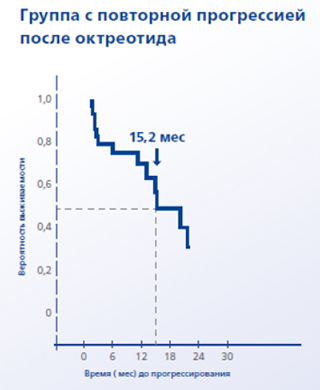
В группе с повторной прогрессией после перехода с пролонгированного октреотида на ланреотид время до повторного прогрессирования составило 15,2 мес.
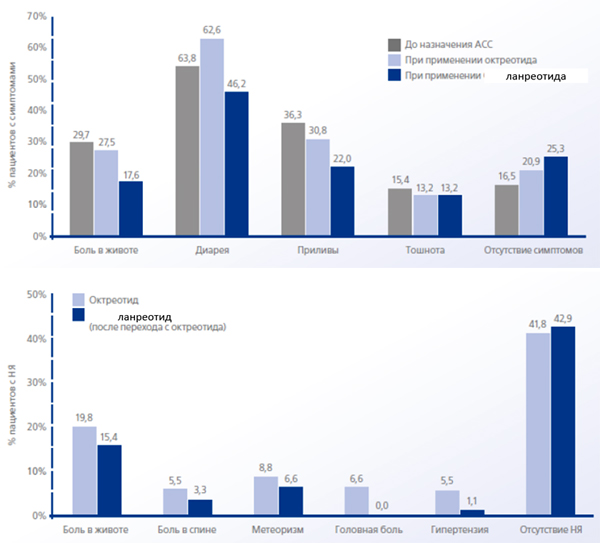
Частота встречаемости ассоциированных с заболеванием симптомов и нежелательных явлений:
Таким образом, выбор терапии для лечения нейроэндокринных опухолей зависит от локализации, морфологических и функциональных особенностей. Основные алгоритмы и подходы к лечению были опубликованы в клинических рекомендациях ENETS 2016 года. Аналоги соматостатина (ланреотид и октреотид) являются первой линией терапии для высокодифференцированных опухолей, тогда как химиотерапия – стандарт лечения низкодифференцированных НЭО.
Терапия нейроэндокринных опухолей
ЗАБОЛЕВАЕМОСТЬ
Клинико-патогенетическая характеристика основных НЭО
| Тип опухоли | Секретируемые гормоны или амины | Клиническая симптоматика |
| Карциноид | Серотонин | Карциноидный синдром: приливы, диарея, бронхоспазм, гипертензия, поражение сердца. |
| Гастринома | Гастрин | Синдром Золлингера-Эллисона, тяжелые пептические язвы |
| ВИПома | Вазоинтестинальный полипептид | Тяжелая диарея («панкреатическая холера», синдром Вернера-Моррисона) |
| Инсулинома | Инсулин | Гипогликемия |
| Глюкагонома | Глюкагон | Диабет, мигрирующая некротическая эритема, раздражение и покраснение языка |
| Соматостатинома | Соматостатин | Дисфункция желчного пузыря, ЖКБ, нарушенная толерантность к глюкозе |
КАРЦИНОИД
Одна из наиболее часто встречающихся опухолей диффузной нейроэндокринной системы!
Опухоль секретирует:
Это приводит к развитию карциноидного синдрома.
КАРЦИНОИДНЫЙ СИНДРОМ
Проявления:
Синдром обусловлен развитием фиброзных изменений в эндо- и миокарде правых отделов сердца с поражением клапанов.
Характерны стеноз и недостаточность трехстворчатого клапана и клапана легочной артерии.
КАРЦИНОИДНЫЙ КРИЗ
КЛАССИФИКАЦИЯ НЭО (ВОЗ, 2002 г.)
Характеристика высокодифференцированных НЭО
К ним относятся различные карциноиды передней, средней и задней кишки, феохромоцитома, медуллярный рак щитовидной железы.
Характеристика низкодифференцированных НЭО
К ним относится мелкоклеточный рак легкого и других органов.
Характеристика смешанных экзокринных и эндокринных карцином
КЛАССИФИКАЦИЯ КАРЦИНОИДНЫХ ОПУХОЛЕЙ (ВИЛЬЯМС И САНДЛЕР, 1963)
Классификация в зависимости от наличия или отсутствия карциноидного синдрома
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Рентгенологические методы
Эндоскопические методы
Ультразвуковые методы
Спиральная КТ с контрастным усилением и МРТ
РАДИОИЗОТОПНАЯ ДИАГНОСТИКА
НЭО на поверхности клеток имеют рецепторы, обладающие высоким сродством к гормону соматостатину. В 87% случаев они присутствуют как в первичной опухоли, так и в метастазах. В связи с этим в последние годы для определения локализации опухоли и метастазов используется радиоизотопный метод с меченным 111 In Октреотидом. Введенный внутривенно Октреотид, 111 In через 24-48 ч. определяется на соматостатиновых рецепторах и позволяет визуализировать соматостатинпозитивную опухоль, а также определить возможность применения аналогов соматостатина для лечения.
Метод с применением Октреотида, 111 In обладает чувствительностью 87%, специфичностью 75% и частотой совпадения диагнозов 87%.
Лечение
Хирургическое лечение
Основной метод лечения НЭО – хирургический. Возможные варианты оперативного вмешательства определяют по локализации опухоли, наличию или отсутствию метастазов и осложнений опухолевого процесса. Однако контроль симптомов при хирургическом лечении достигается не всегда!
Немедикаментозное лечение
Контроль за проявлениями карциноидного синдрома: исключение стрессов, алкоголя, соблюдение диеты.
Медикаментозное лечение
Биотерапия:
Химиотерапия:
Комбинированная химиотерапия:
Симптоматическая терапия:
Механизм действия ОКТРЕОТИДА-ДЕПО
При карциноидных опухолях применение Октреотида-депо может приводить к уменьшению выраженности симптомов заболевания, в первую очередь, таких как приливы и диарея. Во многих случаях клиническое улучшение сопровождается снижением концентрации серотонина в плазме и экскреции 5-гидроксииндолуксусной кислоты с мочой.
При опухолях, характеризующихся гиперпродукцией вазоактивного интестинального пептида (ВИПомы), применение Октреотида-депо приводит у большинства больных к уменьшению тяжелой секреторной диареи, которая характерна для данного состояния, что, в свою очередь, приводит к улучшению качества жизни больного. Одновременно происходит уменьшение сопутствующих нарушений электролитного баланса, например, гипокалиемии, что позволяет отменить энтеральное и парентеральное введение жидкости и электролитов. По данным компьютерной томографии у некоторых больных происходит замедление или остановка прогрессирования опухоли, и даже уменьшение ее размеров, особенно метастазов в печень. Клиническое улучшение обычно сопровождается уменьшением (вплоть до нормальных значений) концентрации вазоактивного интестинального пептида (ВИП) в плазме.
При глюкагономах применение Октреотида-депо в большинстве случаев приводит к заметному уменьшению некротизирующей мигрирующей сыпи, которая характерна для данного состояния. У больных, страдающих диареей, Октреотид-депо вызывает ее уменьшение, что сопровождается повышением массы тела. При применении Октреотида-депо часто отмечается быстрое снижение концентрации глюкагона в плазме, однако при длительном лечении этот эффект не сохраняется. В то же время симптоматическое улучшение остается стабильным длительное время.
При гастриномах/синдроме Золлингера-Эллисона Октреотид-депо, применяемый в качестве монотерапии или в комбинации с блокаторами H2-рецепторов и ингибиторами протонного насоса, может снизить образование соляной кислоты в желудке и привести к клиническому улучшению, в т.ч. и в отношении диареи. Возможно также уменьшение выраженности и других симптомов, вероятно связанных с синтезом пептидов опухолью, в т.ч. приливов. В некоторых случаях отмечается снижение концентрации гастрина в плазме.
У больных с инсулиномами Октреотид-депо уменьшает уровень иммунореактивного инсулина в крови. У больных с операбельными опухолями Октреотид-депо может обеспечить восстановление и поддержание нормогликемии в предоперационном периоде. У больных с неоперабельными доброкачественными и злокачественными опухолями контроль гликемии может улучшаться и без одновременного продолжительного снижения уровня инсулина в крови.
У больных с редко встречающимися опухолями, гиперпродуцирующими рилизинг-фактор гормона роста (соматолибериномами), Октреотид-депо уменьшает выраженность симптомов акромегалии. Это, по-видимому, связано с подавлением секреции рилизинг-фактора гормона роста и самого гормона роста. В дальнейшем возможно уменьшение размеров гипофиза, которые до начала лечения были увеличены.
Обнаружено, что применение Октреотида-депо в дозах 30 мг и выше оказывает антипролиферативный эффект, связанный с прямым цитотоксическим действием препарата на опухоль при взаимодействии с соматостатиновыми рецепторами, а также с угнетением образования сосудов, питающих опухоль.
Режим дозирования
При эндокринных опухолях ЖКТ и поджелудочной железы для больных, у которых подкожное введение Октреотида обеспечивает адекватный контроль проявлений заболевания, рекомендуемая начальная доза Октреотида-депо составляет 20 мг каждые 4 недели.
Подкожное введение Октреотида следует продолжать еще в течение 2 недель после первого введения Октреотида-депо.
Для больных, не получавших ранее Октреотид подкожно, рекомендуется начинать лечение именно с подкожного введения Октреотида в дозе 0.1 мг 3 раза/сут. в течение относительно короткого периода времени (примерно 2 недели) с целью оценки его эффективности и общей переносимости. Только после этого назначают Октреотид-депо по вышеприведенной схеме.
В случае, когда терапия Октреотидом-депо в течение 3 мес. обеспечивает адекватный контроль клинических проявлений и биологических маркеров заболевания, возможно снизить дозу Октреотида-депо до 10 мг, назначаемых каждые 4 недели.
В тех случаях, когда после 3 мес. лечения Октреотидом-депо удалось достичь лишь частичного улучшения, дозу препарата можно увеличить до 30 мг каждые 4 недели.
На фоне лечения Октреотидом-депо в отдельные дни возможно усиление клинических проявлений, характерных для эндокринных опухолей ЖКТ и поджелудочной железы. В этих случаях рекомендуется дополнительное подкожное введение Октреотида в дозе, применявшейся до начала лечения Октреотидом-депо. Это может происходить, главным образом, в первые 2 мес. лечения.
Октреотид-депо – препарат первой линии для монотерапии или комбинированной терапии высокодифференцированных нейроэндокринных опухолей ЖКТ и поджелудочной железы, эффективно купирующий гормональные синдромы за счет подавления гиперсекреции гормонов этими опухолями, повышая качество жизни и выживаемость больных.
Ланреотид в терапии нейроэндокринных опухолей желудочно-кишечного тракта
Ланреотид (Соматулин Аутожель), используемый в терапии диссеминированных высоко- и умеренно дифференцированных нейроэндокринных опухолей желудочно-кишечного тракта, хорошо переносится пациентами и способствует значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими вариантами терапии на любом этапе лечения. Ланреотид считается препаратом выбора лекарственной терапии нейроэндокринных опухолей при наличии и в отсутствие клинических проявлений.
Ланреотид (Соматулин Аутожель), используемый в терапии диссеминированных высоко- и умеренно дифференцированных нейроэндокринных опухолей желудочно-кишечного тракта, хорошо переносится пациентами и способствует значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими вариантами терапии на любом этапе лечения. Ланреотид считается препаратом выбора лекарственной терапии нейроэндокринных опухолей при наличии и в отсутствие клинических проявлений.
Нейроэндокринные опухоли (НЭО) представляют собой разнородную группу злокачественных новообразований, которые развиваются из нейроэндокринных клеток, выполняющих регуляторную функцию и расположенных диффузно по всему организму [1]. НЭО относительно редки (заболеваемость колеблется от 2,5 до 5 случаев на 100 000 населения в год) и составляют около 0,5% всех злокачественных новообразований.
Чаще НЭО появляются в желудочно-кишечном тракте (ЖКТ) и дыхательной системе [2].
В настоящее время в установлении нейроэндокринного происхождения опухоли ведущую роль играют иммуногистохимическая характеристика (хромогранин А, синаптофизин) и выявление в клетках специфических продуктов секреции [3].
Европейским обществом по изучению нейроэндокринных опухолей (European Neuroendocrine Tumor Society – ENETS) введена дополнительная система определения степени злокачественности НЭО ЖКТ и поджелудочной железы (Grade – G1, G2, G3), основанная на оценке пролиферативной активности опухолевых клеток (количества митозов и индекса Ki-67). Алгоритм выбора лечения зависит от типа и распространенности опухоли и ориентирован на классификацию Всемирной организации здравоохранения (ВОЗ) 2010 г. и рекомендации ENETS 2016 г.
При НЭО используются оперативное лечение, лекарственная терапия, лучевая терапия, радиочастотная абляция и химиоэмболизация [1]. Процент использования лекарственной терапии с каждым годом растет в связи с регистрацией новых препаратов и показаний к их применению [3].
Лекарственная терапия высокодифференцированных НЭО (G1, Кi-67 ≤ 2%) включает в себя биотерапию, предусматривающую использование аналогов соматостатина (октреотид и ланреотид), интерферонов альфа и их комбинации, а также таргетных препаратов (эверолимуса при любой локализации и сунитиниба при НЭО поджелудочной железы). В лечении НЭО с умеренным потенциалом злокачественности (G2, Кi-67 3–20%) кроме биотерапии и таргетных препаратов применяются схемы со стрептозоцином (в России заменяется препаратом Араноза). Высокоэффективны также схемы химиотерапии на основе оксалиплатина (режимы XELOX и FOLFOX). Химиотерапия признана основным видом лечения при низкодифференцированных НЭО (G3, Кi-67 > 20%). Основные схемы – «цисплатин + этопозид» или «цисплатин + иринотекан», альтернативные – «темозоломид + капецитабин + бевацизумаб» или «оксалиплатин + капецитабин» [1, 4].
Препаратами выбора при биотерапии НЭО считаются ланреотид (Соматулин® Аутожель®) и октреотид (Сандостатин ЛАР) [5].
Первоначально аналоги сандостатина применяли для купирования нейроэндокринного синдрома, который наблюдается у 19,9% пациентов с НЭО в России [2].
В международном рандомизированном двойном слепом плацебоконтролируемом базовом исследовании фазы III CLARINET доказан антипролиферативный эффект ланреотида в отношении НЭО ЖКТ и поджелудочной железы. Статистически достоверная разница более значимого увеличения выживаемости без прогрессирования на фоне применения ланреотида по сравнению с плацебо продемонстрирована у пациентов с высокодифференцированной НЭО ЖКТ и поджелудочной железы. Исследование CLARINET не выявило нарушений качества жизни в группе активной терапии. Полученные результаты послужили основанием для применения ланреотида в целях опухолевого контроля НЭО [4, 6, 7].
Женщина, 49 лет. Заболела остро, в ноябре 2011 г. с клиническими симптомами острого аппендицита доставлена бригадой скорой помощи в стационар по месту жительства. В день поступления ей выполнена аппендэктомия. При осмотре в брюшной полости обнаружен серозный выпот, катаральный отросток, в восходящем отделе ободочной кишки пальпируется опухоль до 5 см. Гистологически – аппендицит, опухолевого роста не выявлено. В послеоперационном периоде по поводу гипертермии выполнено дренирование острого жидкостного скопления в месте операции. По данным компьютерной томографии (КТ) органов брюшной полости установлены множественные метастазы в печени округлой формы от 5 до 22 мм. Проведена трепан-биопсия печени. Гистологически – НЭО ЖКТ (G2, Кi-67 10%). Гастроскопия и колоноскопия – онкопатология не выявлена. Результаты магнитно-резонансной томографии (МРТ) брюшной полости подтвердили множественное метастатическое поражение печени, а также опухоль восходящего отдела ободочной кишки. Нейронспецифическая енолаза – 8,93 нг/мл. Состояние пациентки удовлетворительное, нейроэндокринного синдрома нет. Диагноз: НЭО G2 восходящего отдела ободочной кишки, метастазы в печени, стадия IV.
С 12 января по 18 июня 2012 г. проведено восемь курсов химиотерапии по схеме ЕР (цисплатин 75 мг/м 2 внутривенно капельно в первый день + этопозид 120 мг/м 2 внутривенно капельно в первый–третий день каждые три недели).
Лечение пациентка перенесла относительно удовлетворительно, наблюдалась гематологическая и эметогенная токсичность 2-й степени.
При контрольной МРТ брюшной полости от 3 июля 2012 г. при оценке опухоли по критериям RECIST констатирована стабилизация процесса. С 13 июля 2012 г. больную перевели на поддерживающую биотерапию – интерферон альфа 3 млн МЕ три раза в неделю подкожно с контрольным обследованием каждые три месяца.
При проведении очередной МРТ брюшной полости 14 января 2013 г. констатировано прогрессирование заболевания (увеличение размеров метастатических очагов в печени). Общее состояние не страдало, ECOG 0.
С февраля 2013 г. назначена таргетная терапия препаратом эверолимус 10 мг/сут ежедневно. На фоне лечения состояние ухудшилось, появились жалобы на общую слабость, одышку при физической нагрузке, отечность левой ноги до уровня тазобедренного сустава, приливы и диарею три-четыре раза в день. ECOG 2.
При выполнении контрольной КТ 11 сентября 2013 г. зафиксировано прогрессирование заболевания (появление новых очагов в печени и легких и увеличение размеров ранее диагностированных метастазов).
С 10 октября 2013 г. пациентке была начата биотерапия препаратом ланреотид (Соматулин® Аутожель®) в монорежиме в дозе 120 мг внутримышечно один раз в 28 дней с оценкой эффекта каждые шесть месяцев. После первых двух введений препарата отмечались клинически выраженная положительная динамика, купирование всех симптомов, установленных на момент начала терапии. Жалоб нет, ECOG 0.
Через шесть месяцев при оценке опухоли по критериям RECIST результаты контрольной КТ грудной клетки и брюшной полости показали стабилизацию процесса (см. рисунок).
Оценка состояния в марте 2016 г.: жалоб нет, пациентка продолжает работать, ведет активный образ жизни. Гематологической и негематологической токсичности на протяжении всего периода лечения не зафиксировано. Стабилизация процесса сохраняется. Планируется продолжить биотерапию ланреотидом до прогрессирования с оценкой эффекта (мультиспиральная КТ грудной клетки и брюшной полости) каждые шесть месяцев.
Рассмотренный клинический случай иллюстрирует потенциальный благоприятный эффект в отношении результатов лечения НЭО ЖКТ при назначении ланреотида (Соматулин® Аутожель®) с целью контроля опухоли. Следует также отметить, что ланреотид продемонстрировал эффективность в четвертой линии лекарственной терапии НЭО в период прогрессирования заболевания на фоне таргетной терапии. Это позволяет использовать аналоги соматостатина не только в первой линии терапии высоко- и умеренно дифференцированных НЭО, но и на любом этапе лечения данной категории больных.
Пациентка продолжает получать ланреотид, стабилизация процесса сохраняется. Согласно результатам исследований, данная терапия способствует увеличению медианы общей выживаемости, значительному увеличению времени до прогрессирования, сохранению качества жизни и социального статуса больных [5, 6, 8].
Учитывая системное воздействие НЭО на организм, при выборе и проведении терапии необходимо обращать особое внимание на лечение симптомов заболевания. Одной из основных целей терапии любой диссеминированной опухоли является увеличение продолжительности качественной жизни.
Безусловный приоритет в лечении диссеминированных НЭО остается за лекарственной терапией. С введением в клиническую практику аналогов соматостатина началась новая эра в лечении пациентов. В рандомизированных исследованиях показано, что биотерапия способствует увеличению выживаемости больных и улучшению качества их жизни, поскольку позволяет контролировать симптомы заболевания практически у всех пациентов [6, 9].
Достаточно высокая клиническая эффективность ланреотида и октреотида по сравнению с химиотерапией объясняется двояким механизмом действия. С одной стороны, блокируется активность веществ, продуцируемых опухолью, что позволяет контролировать симптомы заболевания. С другой – аналоги соматостатина оказывают антипролиферативный эффект, влияя как на саму опухоль (снижение пролиферации, индукция апоптоза), так и на ее окружение (ингибирование ангиогенеза и циркулирующих факторов роста, иммуномодулирующее действие).
Опубликованные в 2009 г. результаты крупного рандомизированного исследования фазы III (PROMID) подтвердили эффективность аналогов соматостатина у больных высокодифференцированными метастатическими НЭО ЖКТ. 73% из них имели метастазы в печени. Применение октреотида снизило риск прогрессирования на 66%, среднее время до прогрессирования увеличилось с 6,0 до 14,3 месяца. Антипролиферативный эффект октреотида не зависел от функционального статуса опухоли и был одинаков для секретирующих и несекретирующих опухолей.
Наилучшие результаты были получены, когда метастатическое поражение печени не превышало 10% ее объема, а первичный очаг был удален. При нерезектабельных метастазах, наличии множественных внепеченочных очагов заболевания методом выбора признана консервативная терапия. Наиболее безопасным и патогенетически оправданным вариантом консервативной терапии высокодифференцированных НЭО является использование аналогов соматостатина [3, 5, 6, 9, 10].
В 2013 г. были впервые представлены результаты двойного слепого рандомизированного плацебоконтролируемого исследования фазы III CLARINET. Это крупнейшее на сегодняшний день многоцентровое исследование, в котором оценивали эффект ланреотида у пациентов с НЭО ЖКТ с Ki-67 менее 10%. В 96-недельном исследовании участвовали 204 пациента с метастатическими НЭО ЖКТ или поджелудочной железы. Как показали результаты, у больных, получавших плацебо, средняя выживаемость без прогрессии составила 18,0 месяца. У 33,0% пациентов рост опухоли присутствовал или они умерли в течение 96 недель. В то же время средняя выживаемость без прогрессирования у пациентов, принимавших Соматулин®, не была достигнута. У 65% пациентов рост опухоли отсутствовал и они не умерли в течение 96 недель (р 0,001). Это свидетельствовало о 53%-ном снижении риска развития заболевания или смерти, основанном на отношении пределов функций риска 0,47 (95%-ный доверительный интервал 0,30–0,73). Такие статистически и клинически значимые антипролиферативные эффекты Соматулина наблюдались у широкой популяции пациентов с метастатическими НЭО ЖКТ или поджелудочной железы и степенью злокачественности G1 или G2 (классификация ВОЗ) независимо от величины опухоли печени (менее или более 25%). Результаты измерения качества жизни не отличались между группами Соматулина и плацебо. Полученные данные о безопасности соответствуют известному профилю безопасности Соматулина [4, 6, 7].
Следующим этапом в развитии лекарственного лечения НЭО скорее всего станет использование комбинаций современных схем с таргетной терапией, а также регистрация новых препаратов.
В настоящее время проводятся клинические испытания аналога соматостатина нового поколения – пасиреотида. Препарат характеризуется более широким спектром действия (sst1, sst2, sst3, sst5), что повышает эффективность терапии и позволяет в ряде случаев преодолевать рефрактерность к аналогам соматостатина первого поколения. Клинические исследования фазы II показали, что пасиреотид позволяет контролировать симптомы карциноидного синдрома, такие как диарея и приливы, у 27% больных с НЭО тонкой кишки, резистентных к стандартным дозам аналогов соматостатина первого поколения [10].
Немаловажен и вопрос о переносимости лекарственного лечения. Отсутствие гематологической и негематологической токсичности в рассмотренном клиническом случае позволило сохранить качество жизни и социальный статус пациентки на протяжении всего периода лечения [6, 7].
Ланреотид (Соматулин® Аутожель®) хорошо переносится пациентами и приводит к значительному увеличению выживаемости без прогрессирования и общей выживаемости. Ланреотид – препарат выбора лекарственной терапии НЭО с наличием клинических проявлений и при их отсутствии [4, 6, 10].