Оксид титана что такое
Оксид титана (двуокись титана)
Понятие и общие сведения
Титан является металлом четвертой группы, который при соединении с кислородом может образовывать до 15 различных оксидов. Однако, наиболее характерен для него диоксид или оксид титана (IV), или двуокись титана.
В зависимости от вида кристаллической решетки титановый диоксид образует следующие минералы:
— Рутил, обладающий тетрагональной кристаллической решеткой.
— Анатаз, имеющий тетрагональную решетку.
— Брукит, характеризующийся ромбической решеткой.
Кроме того, известны две другие модификации титаноксида высокого давления: ромбическая и гексагональная. В лаборатории под давлением 60 000 бар синтезировали еще одну модификацию двуокиси титана с наиболее высокой твердостью из известных.
Свойства
Оксиды титана различных степеней окисления сильно отличаются друг от друга по своим физико-химическим характеристикам. Рассмотрим свойства наиболее распространенных оксидов.
Монооксид (оксид титана II) формулой TiO представляет собой кристаллы, обладающие цветом в гамме от золотисто-желтого до коричнево-фиолетового цвета. Это вещество не растворимо в воде, но растворимо в разбавленных соляной и серной кислотах. В случае нагревания в воздушной среде монооксид окисляется до двуокиси титана TiO2. Это свойство используется в катализаторах, где находит применение окись титана (II).
Сесквиоксид (оксид титана III), химически описываемый как Ti2O3, выглядит как кристаллы темно-фиолетового или черного цвета. Не является устойчивым соединением, при сильном нагреве до испарения диссоциирует на два других оксида TiO и TiO2. В среде воздуха подвергается окислению лишь при очень высокой температуре. Не реагирует с водой и неорганическими кислотами. Растворяется при нагреве в концентрированной серной кислоте с выходом сульфата титана (III) фиолетового цвета.
Двуокись титана (оксид титана IV) формулой TiO2 – это, как ни странно, в кристаллической форме представляют собой неокрашенные кристаллы, желтеющие при нагревании, однако вновь теряющие цвет при последующем охлаждении. Диоксид титана не растворим в воде, набухает в неорганических кислотах и разбавленных растворах щелочей. С трудом растворим в концентрированных серной кислоте и щелочных растворах. При нагревании в азотной кислоте образуется карбид титана (III) TiN. Титаноксид (IV) восстанавливают до оксидов титана (III и II) нагревая первый в среде водорода, углерода, щелочных или щелочноземельных металлов – натрия, магния, кальция и т.д. При нагревании в среде газообразного хлора и восстановителей, например углерода получается хлорид титана (IV).
Получение
Титаноксид (IV) производят различными способами, например путем прокаливания кислородсодержащих солей и оснований, гидролизом или сжиганием титансодержащих соединений и другими способами.
Чаще всего двуокись титана получают прокаливанием гидроокиси, полученной после гидролиза сульфатных растворов или сжиганием хлорида титана (IV) при температурах от 1200 градусов С. Высокочистый диоксид титана получается при помощи гидролиза титанорганических веществ с последующим прокаливанием.
Из полученной таким образом двуокиси титана можно произвести оксиды с более низкими степенями окисления при помощи частичного восстановления водородом или элементарным титаном при температурах порядка 1500 градусов С по схеме:
Оксиды с большим количеством атомов титана и наличествующими связями типа Ti-Ti, например Ti6O, Ti3O, Ti2O образуются в ходе растворения кислорода в непосредственно в титане. В случае повышения температуры более 300 градусов С такие соединения окисляются далее вплоть до двуокиси титана.
Применение титаноксида
Титан образует множество оксидов, однако подавляющее большинство применений имеет только оксид титана (IV) или двуокись. Среди других подобных соединений она является важным керамическим материалом и важнейшим пигментом.
Рис.1. Гранулированный суперконцентрат пигмента TiO2.
Суть применения двуокиси титана в современной индустрии базируется на способности мелкодисперсного порошка оксида с размером частиц от 20 до 50 нанометров демонстрировать очень высокую отражательную способность. Это свойство позволяет применять диоксид титана в качестве белого пигмента при изготовлении красок, известных как «титановые белила». Кроме того, пигмент повсеместно применяется при производстве эмалей, окраске бумаги, пластмасс и эластомеров, синтетических волокон, керамической продукции, стекла и многого другого. Титановые краски имеют ряд преимуществ перед аналогами и прежде всего ранее широко применяющимися свинцовыми белилами:
— отсутствие токсичности (кроме порошкообразной формы – см. ниже),
— имеют более высокие эксплуатационные характеристики, надежность и долговечность.
В промышленности производства и переработки пластмасс и эластомеров диоксид титана является одним из самых важных пигментов. Он применяется в основном в двух формах:
Порошкообразной форме для приготовления смесей, применяемых при экструзии изделий из ПВХ (оконные и дверные профили, подоконники, водостоки, сайдинг, отделочные панели и т.д.). Также применяется для приготовления пластизолей и при других нераспространенных применениях.
В виде гранулированных суперконцентратов пигментов на основе различных полимеров, чаще всего полиэтилена, сэвилена, полипропилена, полистирола. Такая форма, с наполнением оксидом титана до 80% суперконцентрата, широко используется при литье под давлением, выдувном формовании, экструзии гранулированных пластмасс.
Также двуокись титана используется при приготовлении жидких красителей для пластмасс, опудривании гранул непосредственно пигментами и т.д.
Рис.2. Типичное изделие из ПВХ окрашенное в массе
Возможный вред здоровью
В действующих стандартах указано, что пыль диоксида титана обладает раздражающим действием. Она в определенных концентрациях может стать причиной бронхитов, пневмосклероза и прочих болезней легких человека. Предельно-допустимая концентрация титаноксида в воздухе рабочей зоны составляет 10 мг/куб.м, в атмосферном воздухе 0,5 мг/куб.м, в воде 0,1 мг/литр.
Вредность и теоретическая опасность диоксида титана привела к пристальному вниманию к этому соединению со стороны законодателей ряда стран, прежде всего государств Евросоюза. В 2019 году в новостных лентах стали появляться сообщения об ограничении использования титаноксида и его возможном запрете в будущем. В частности, Европейское Химическое Агентство в 2017 году подтвердило опасность порошкообразного титаноксида. В сентябре 2019 года эксперты Competent Authorities for REACH and CLP предложили Европейской Комиссии внести двуокись титана в перечень потенциально опасных веществ. Пока речь идет только о пигменте в порошкообразной форме, однако и это наносит большой ущерб полимерной отрасли, т.к. порошок TiO2 практически незаменим при экструзии в частности ПВХ-профилей.
Объявления о покупке и продаже оборудования можно посмотреть на
Обсудить достоинства марок полимеров и их свойства можно на
Зарегистрировать свою компанию в Каталоге предприятий
Оксид титана
Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 — амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана идёт лишь около 5 % титановой руды). [1]
Содержание
Строение
Оксид титана существует в виде нескольких модификаций. В природе встречаются кристаллы с тетрагональной сингонией (анатаз, рутил) и ромбической сингонией (брукит). Искусственно получены ещё две модификации высокого давления — ромбическая IV и гексагональная V.
| Модификация/Параметр | Рутил | Анатаз | Брукит | Ромбическая IV | Гексагональная V | |
|---|---|---|---|---|---|---|
| Параметры элементарной решётки, нм | a | 0,45929 | 0,3785 | 0,51447 | 0,4531 | 0,922 |
| b | — | — | 0,9184 | 0,5498 | — | |
| c | 0,29591 | 0,9486 | 0,5145 | 0,4900 | 0,5685 | |
| Число формульных единиц в ячейке | 2 | 4 | 8 | |||
| Пространственная группа | P4/mnm | I4/amd | Pbca | Pbcn | ||
Нахождение в природе
Третье в мире по запасам рутила месторождение находится в Рассказовском районе Тамбовской области. Крупные месторождения находятся также в Чили (Cerro Bianco), канадской провинции Квебек, Сьерра-Леоне.
Свойства
Физические, термодинамическе свойства
Чистый диоксид титана — бесцветные кристаллы (желтеет при нагревании). Для технических целей применяется в раздробленном состоянии, представляя собой белый порошок. Не растворяется в воде и разбавленных минеральных кислотах (за исключением плавиковой).
Температура плавления, кипения и разложения для других модификаций не указана, т.к. они переходят в рутильную форму при нагревании (см. выше).
| Модификация | Интервал температуры, K | |||||
|---|---|---|---|---|---|---|
| 298—500 | 298—600 | 298—700 | 298—800 | 298—900 | 298—1000 | |
| рутил | 60,71 | 62,39 | 63,76 | 64,92 | 65,95 | 66,89 |
| анатаз | 63,21 | 65,18 | 66,59 | 67,64 | 68,47 | 69,12 |
| Модификация | ΔH°f, 298, кДж/моль [6] | S°298, Дж/моль/K [7] | ΔG°f, 298, кДж/моль [8] | C°p, 298, Дж/моль/K [9] | ΔHпл., кДж/моль [10] |
|---|---|---|---|---|---|
| рутил | -944,75 (-943,9 [3] ) | 50,33 | -889,49 (-888,6 [3] ) | 55,04 (55,02 [3] ) | 67 |
| анатаз | -933,03 (938,6 [3] ) | 49,92 | -877,65 (-888,3 [3] ) | 55,21 (55,48 [3] ) | 58 |
Вследствие более плотной упаковки ионов в кристалле рутила увеличивается их взаимное притяжение, снижается фотохимическая активность, увеличиваются твёрдость (абразивность), показатель преломления (2,55 — у анатаза и 2,7 — у рутила), диэлектрическая постоянная.
Химические свойства
Диоксид титана амфотерен, то есть проявляет как осно́вные, так и кислотные свойства (хотя реагирует главным образом с концентрированными кислотами).
Медленно растворяется в концентированной серной кислоте, образуя соответствующие соли четырёхвалентного титана:
В концентрированных растворах щелочей или при сплавлении с ними образуются титанаты — соли титановой кислоты (амфотерного гидроксида титана TiO(OH)2)
То же происходит и в концентрированных растворах карбонатов или гидрокарбонатов:
C перекисью водорода даёт ортотитановую кислоту:
При нагревании с аммиаком даёт нитрид титана:
При сплавлении с оксидами, гидроксидами и карбонатами образуются титанаты и двойные оксиды:
При нагревании восстанавливается углеродом и активными металлами (Mg, Ca, Na) до низших оксидов.
При нагревании с хлором в присутствии восстановителей (углерода) образует тетрахлорид титана.
Нагревание до 2200 °C приводит сначала к отщеплению кислорода с образованием синего Ti3O5 (то есть TiO2·Ti2O3), а затем и тёмно-фиолетового Ti2O3.
Гидратированный диоксид TiO2·nH2O [гидроксид титана(IV), оксо-гидрат титана, оксогидроксид титана] в зависимости от условий получения может содержать переменные количества связанных с Ti групп ОН, структурную воду, кислотные остатки и адсорбированные катионы. Полученный на холоде свежеосажденный TiO2·nH2O хорошо растворяется в разбавленных минеральных и сильных органических кислотах, но почти не растворяется в растворах щелочей. Легко пептизируется с образованием устойчивых коллоидных растворов. При высушивании на воздухе образует объёмистый белый порошок плотностью 2,6 г/см³, приближающийся по составу к формуле TiO2·2H2O (ортотитановая кислота). При нагревании и длительной сушке в вакууме постепенно обезвоживается, приближаясь по составу к формуле TiO2·H2O (метатитановая кислота). Осадки такого состава получаются при осаждении из горячих растворов, при взаимодействии металлического титана с HNO3 и т. п. Их плотность
3,2 г/см³ и выше. Они практически не растворяются в разбавленных кислотах, не способны пептизироваться.
При старении осадки TiO2·nH2O постепенно превращается в безводный диоксид, удерживающий в связанном состоянии адсорбированные катионы и анионы. Старение ускоряется кипячением суспензии с водой. Структура образующегося при старении TiO2 определяется условиями осаждения. При осаждении аммиаком из солянокислых растворов при рН Токсические свойства, физиологическое действие, опасные свойства
TLV(предельная пороговая концентрация, США): как TWA (среднесменная концентрация, США) 10 мг/м³ A4 (ACGIH 2001).
Добыча и производство
Полная статья получение оксида титана(IV)
Мировое производство диоксида титана на конец 2004 года достигло приблизительно 5 миллионов тонн. [11]
Основными производители и экспортёры диоксида титана:
В последние годы чрезвычайно быстро растет производство диоксида титана в Китае.
В России пигментный диоксид титана не производят, но производят технические марки, используемые в металлургии. На территории СНГ диоксид титана производится на Украине предприятиями «Сумыхимпром», город Сумы, «Крымский титан», г. Армянск) и КП «Титано-магниевый комбинат» (г. Запорожье). Сумский государственный институт минеральных удобрений и пигментов (МИНДИП) в своих научно-исследовательских работах особое место уделяет технология получения оксида титана (IV) сульфатным способом: исследование, разработка новых марок, модернизация технологии и аппаратурного оформления процесса.
Как указано выше, диоксид титана встречается в виде минералов, однако этого источника недостаточно, поэтому значительная его часть производится. Существуют два основных промышленных метода получения TiO2: из ильменитового (FeTiO3) концентрата и из тетрахлорида титана.
Производство диоксида титана из ильменитового концентрата
Технология производства состоит из трёх этапов:
Производство диоксида титана из тетрахлорида титана
Существуют три основных метода получения диоксида титана из его тетрахлорида:
Применение
Основные применения диоксида титана:
Другие применения — в производстве резиновых изделий, стекольном производстве (термостойкое и оптическое стекло), как огнеупор (обмазка сварочных электродов и покрытий литейных форм), в косметических средствах (мыло и т.д.), в пищевой промышленности (пищевая добавка E171).
Цены и рынок
Нормативы
В настоящее время диоксид титана по ГОСТ 9808-84 не выпускается.
По данным техническим условиям работает ГАК «Титан» (г. Армянск).
По данным техническим условиям работает ОАО «Сумыхимпром» (г. Сумы).
Использованная литература
Ссылки
Разное: Воск (E900-909) • Глазурь (E910-919) • Восстановитель (E920-929) • Газ для упаковки (E930-949) • Заменители сахара (E950-969) • Вспениватель (E990-999)
Примечания
Полезное
Смотреть что такое «Оксид титана» в других словарях:
Оксид титана(IV) — Общ … Википедия
Оксид титана(II) — Общие Систематическое наименование Оксид титана(II) Традиционные названия Окись титана Химическая формула TiO Физические свойства Состояние ( … Википедия
оксид титана — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN titanium oxide … Справочник технического переводчика
Оксид титана (IV) — Порошок оксида титана Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана… … Википедия
Оксид титана(III) — Общие Систематическое наименование Оксид титана(III) Традиционные названия трёхокись титане Химическая формула Ti2O3 Физические свойства … Википедия
Дигидроксид-оксид титана — Общие Систематическое наименование Дигидроксид оксид титана Традиционные названия Метатитановая кислота, β титановая кислота Химическая формула TiO(OH)2 Физические свойст … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
ТИТАНА СЕМЕЙСТВО — ПОДГРУППА IVB. СЕМЕЙСТВО ТИТАНА ТИТАН, ЦИРКОНИЙ, ГАФНИЙ К переходным металлам относятся также элементы семейства титана Ti, Zr и Hf, отличающиеся удивительным сходством свойств. Последние два элемента (Zr и Hf) особенно близки по свойствам.… … Энциклопедия Кольера
Оксид цинка — Оксид цинка … Википедия
Оксид цинка(II) — Оксид цинка Общие Систематическое наименование Цинка оксид Химическая формула ZnO Отн. молек. масса N а. е. м. Молярная масса … Википедия
Диоксид титана — влияние на организм человека

Что это за вещество? Насколько хорошо изучен диоксид титана? Где он содержится и применяется? Почему учёное сообщество заговорило о нём именно сейчас? Есть ли риск навредить здоровью, используя продукты с его содержанием? Давайте разбираться.
Что такое диоксид титана
Другие названия этого вещества — оксид титана (IV), двуокись титана, титановые белила, титановый ангидрид, а также пищевой краситель E171. Это химическое соединение в виде мелкодисперсного кристаллического порошка белого цвета, не имеющего запаха. При нагревании диоксид титана меняет цвет на жёлтый. В воде, кислотах, щелочах не растворяется.
Формула диоксида титана — TiO2. В природе он находится в составе минералов — рутил, анатаз и брукит. На территории Российской Федерации самое крупное месторождение находится в Тамбовской области.
Физические свойства диоксида титана:
До недавнего времени специалисты оценивали токсичность диоксида титана как низкую. Инертность этого химического соединения препятствует выделению ядовитых веществ в окружающую среду, не оказывает вредного воздействия на человека при непосредственном контакте.
По степени влияния на организм диоксид титана относится к 4 классу опасности, то есть является малоопасным.
На основании приведённых данных, титановый ангидрид во всём мире используется в продукции, произведённой для людей, как безопасное соединение.
Влияние на организм человека
Российские эксперты оценивают вопрос об опасности диоксида титана, как требующий более систематических научных изысканий. Они сходятся во мнении, что пока не существует многоцентровых рандомизированных исследований, доказывающих опасность диоксида титана как канцерогена, способного вызывать развитие рака.
Благодаря своей химической инертности вещество не вступает во взаимодействие с желудочным соком. То есть диоксид титана не подвергается процессу пищеварения и в неизмененном виде выводится из организма. Его способность к биоаккумуляции (накапливанию в тканях) оценивается как слабая.
Согласно ДСТУ ГОСТ 30333:2009, в данных паспорта безопасности диоксида титана, отмечается отсутствие у него патологического действия:
Канцерогенное действие считается недоказанным по причине недостаточного количества данных.

На промышленных объектах предусмотрены меры профилактики отравлений диоксидом титана. Для предохранения органов дыхания применяют противопылевые респираторы, маски. При производстве продукта в обязательном порядке используют защитные костюмы, рукавицы, каски, обувь, очки. Проводится регулярный контроль опасного воздействия.
Применение
О популярности диоксида титана говорит тот факт, что ежегодно в мире его производится более пяти миллионов тонн.
В пищевой промышленности
Международная классификации пищевых добавок определяет диоксид титана индексом E171. В России использование этих компонентов в производственном масштабе регламентируют Санитарно-эпидемиологические правила и нормативы СанПиН 2.3.2.1293–03 (с изменениями, внесёнными в 2010 году).

Его применяют в качестве отбеливателя при изготовлении следующих блюд и компонентов:
Из списка понятно, что диоксид титана активно используют в кулинарии. В кондитерской промышленности примером может служить сахарная глазурь, пудра, зефир, белый шоколад. Продолжают список:
Е171 применяют как пищевой краситель. Для придания аппетитного цвета и вида его добавляют в мясной фарш. Жирорастворимый диоксид титана используют в качестве красителя для придания нужного оттенка шоколаду, глазури.
Кроме того, двуокись титана входит в состав упаковочной плёнки, которая защищает продукты от действия ультрафиолета. Это его качество называется укрывистость.
Е171 не привносит в состав продуктов полезные свойства. Назначение пищевой добавки — улучшить их внешний вид, сделать его более привлекательным, а значит востребованным.
В производстве косметики
В индустрии красоты применяют высокоочищенный диоксид титана мелкодисперсной структуры. Раздроблённый до мельчайших частиц порошок используют для изготовления защитных кремов, тональных основ, пудры. Свойство светонепроницаемости позволяет защитить кожу от агрессивного действия солнечных лучей.
Важна и визуальная функция вещества. В качестве пигмента диоксид титана входит в состав помады, придавая ей густоту, вязкость, а также пудры, обеспечивая осветляющий эффект и игру оттенков.
Диоксид титана химически инертен и не влияет на здоровье кожи. Кремы для лица и тональные основы с его содержанием — гипоаллергенные. Но, преимущество двуокиси титана в виде мелкодисперсности, может стать причиной поражения кожи. При низком качестве косметического продукта мелкие частицы способны сыграть роль фотокатализатора. Вместо защиты, они усиливают действие ультрафиолета на кожу.
Интересный факт — после нанесения солнцезащитного средства, неприятный эффект липкости объясняется присутствием в составе диоксида титана. В более качественных косметических средствах этот эффект нейтрализуется его применением в размельчённом состоянии до наночастиц.
Важно знать, что у людей с жирной и проблемной кожей, средства с диоксидом титана могут вызывать высыпание прыщей.
В производстве мыла E171 применяют для достижения эффекта белоснежности. Мелкодисперсные частицы не проникают внутрь кожных покровов и не задерживаются на её поверхности.
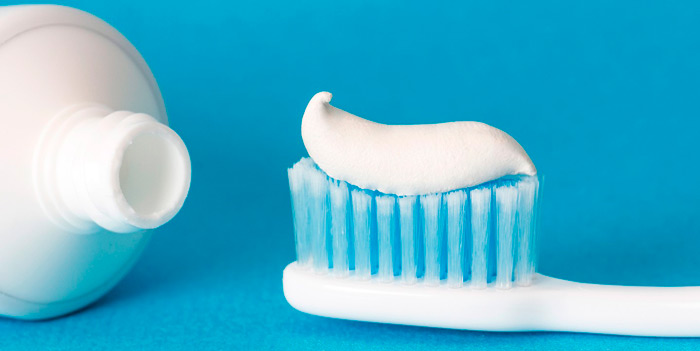
В зубной пасте
Диоксид титана в составе зубной пасты выполняет несколько функций:
Какая зубная паста не содержит диоксид титана? Например, Rembrandt «Антитабак и кофе», специально созданная для курильщиков и людей, которые часто употребляют крепкий чай и кофе.
В медицине
Диоксид титана использует в производстве витаминов, микроэлементных комплексов, таблетированных средств, добавляют мелкодисперсный порошок в состав кремов, суппозиториев, паст. Ничтожно малое количество вещества не влияет на структуру препарата, при этом придаёт ему белизну и продлевает срок действия.
Если есть показания во время беременности медицинские специалисты назначают витаминные комплексы, в составе которых также есть диоксид титана.
В других отраслях промышленности
Двуокись титана называют чудо-материалом. Его применяют в различных отраслях производства многих стран. Мировой рынок титанового ангидрида в последние годы оценивался приблизительно в 5 млн тонн.
Основные области применения, следующие.
В последнее время на рынке появился новый продукт — цветные титановые пигменты. Они не содержат диоксида титана, при этом сохраняют конкурентоспособность.
Последние исследования свойств диоксида титана
Стоит отметить, что исследования в области токсичности пищевых добавок, а именно в отношении E171, проводятся в США уже с 1969 года. Одно из последних опубликовано в выпуске EFSA Journal 28 июня 2016 г. Результат изучения подтвердил безопасность диоксида титана при текущем уровне потребления.
Однако есть и тревожные данные. Так, а 2015 году американские учёные опубликовали результаты экспериментов на лабораторных мышах — их поили специально приготовленной мелкодисперсной суспензией диоксида титана. Итоги опытов таковы — поражение митохондрий в клетках головного мозга. Основная функция митохондрий — выработка энергии для поддержания клеточных процессов. В результате — нарушения функций центральной нервной системы.
А также общественное мнение тревожно отреагировало на недавно опубликованные результаты опытов учёных INRA (Французский национальный институт сельскохозяйственных исследований). Изыскания проводились на трёх группах крыс и морских свинок, которые получали пищевой краситель в воде. Доза соответствовала суточному потреблению E171 человеком. Длился эксперимент 100 дней. Результаты исследования можно обобщить следующими фактами:
Учёные на основании результатов сделали следующие выводы:
Токсикологи считают, что диоксид титана может оказывать канцерогенное действие, проникая через дыхательные пути. Особое беспокойство научного сообщества вызывает природа наночастиц. Учёные говорят о новом механизме проявления токсичности в виде физико-химической реакции. Это позволяет TiO2 накапливаться в различных тканях и вызывать окислительный стресс.
С другой стороны, статистические данные подтверждают быстрое увеличение темпов промышленности, основанной на применении наноразмерных систем. Предполагаемый рост расширения внутреннего рынка диоксида титана в ряде стран, в том числе и в России составляет от 4 до 9% ежегодно.
Какой можно сделать вывод? Диоксид титана — это химическое соединение, которое имеет уникальные свойства. Практически нет такой области, где бы вещество ни использовалось. Медицинские специалисты различных стран уже более 50 лет проводят исследования на предмет выявления канцерогенного действия на организм человека. И не только тех людей, кто занят на производстве с использованием диоксида титана. Ведь TiO2 входит в состав зубной пасты, косметических средств, лекарственных препаратов, используется как пищевая добавка E171. Однако пока нет однозначного вывода учёных о вреде этого химического соединения. Ведь результаты, полученные на крысах, нельзя однозначно экстраполировать на человека. Они лишь указывают направление для дальнейших многоцентровых рандомизированных исследований. Точные ответы на тревожные вопросы можно получить, лишь объединив усилия мирового сообщества.