Оксид кальция что это
Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Оксид кальция
| Оксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Молярная масса | 56.077 г/моль |
| Плотность | 3.37 г/см³ |
| Термические свойства | |
| Температура плавления | 2570 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -635,09 кДж/моль |
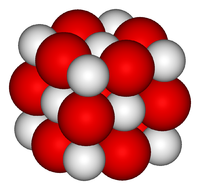
Окси́д ка́льция (окись кальция, негашёная и́звесть или «кипелка», «кираби́т») — белое кристаллическое вещество, формула CaO.
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь или «пушонка») находят обширное использование в строительном деле.
Содержание
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Физические свойства
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:

Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли:

Применение
Основные объёмы используются в строительстве при производстве Силикатного кирпича. Раньше известь, так же использовали в качестве известкового цемента — при смешивании с водой, оксид кальция переходит в гидроксид, который далее, поглощая из воздуха углекислый газ, сильно твердеет, превращаясь в карбонат кальция. Однако в настоящее время известковый цемент при строительстве жилых домов стараются не применять, так как полученные строения обладают способностью впитывать и накапливать сырость.
Категорически недопустимо использование известкового цемента при кладке печей — из-за термического разложения и выделения в воздух удушливого диоксида углерода.
Некоторое применение также находит в качестве доступного и недорогого огнеупорного материала — плавленный оксид кальция имеет некоторую устойчивость к воздействию воды, что позволяет его использовать в качестве огнеупора там, где применение более дорогих материалов нецелесообразно.
В небольших количествах оксид кальция также используется в лабораторной практике для осушения веществ, которые не реагируют с ним.
В промышленности для удаления диоксида серы из дымовых газов, как правило используют 15% водяной раствор. В результате реакции гашеной извести и диоксида серы получается гипс СaСO3 и СаSO4. В эксперементальных установках добивались показателя в 98% отчиски дымовых газов от диоксида серы.
Так же используется в «самогреющей» посуде. Контейнер с небольшим количеством оксида кальция помещается между двух стенок стакана, а при прокалывании капсулы с водой начинается реакция с выделением тепла.
Оксид кальция. Свойства и меры предосторожности
Оксид кальция — неорганическое соединение с 
Негашеная известь называется так для отличия от гашеной извести, когда при соединении оксида кальция с водой проходит бурная реакция — известь «гасится» водой. Получается гашеная известь Ca(OH)2, востребованная во многих областях.
Жженой известью реактив называют с отсылкой на способ получения: известь (карбонат кальция CaCO3) обжигают до тех пор, пока она не начинает разлагаться, в результате чего получается жженая известь (окись кальция).
Обычно негашеной или жженой известью называют техническую квалификацию реактива.
Получить окись кальция можно разными методами.
• Промышленный способ описан выше: разложением известняка CaCO3 при нагревании.
• Разложением при нагревании гидроокиси кальция или солей кальция (солей определенных кислот, содержащих кислород). Например, разложением нитрита кальция Ca(NO3)2 получают CaO высокой чистоты.
• Прямым окислением (сжиганием) кальция в воздухе.
 |  |  |
| Полнолицевая маска «ЗМ» серии 6900 | Кальций окись «ч» | Перчатки «Неотоп» химостойкие (Ansell) (9,5-10) |
Свойства
Реагент представляет собой порошкообразное вещество белого или сероватого цвета без запаха. Структура кристаллов подобна структуре поваренной соли. Реактив гигроскопичен, поглощает из воздуха влагу и углекислый газ. Хорошо растворяется в глицерине, не растворяется в этиловом спирте. В воде не растворяется, а вступает с ней в химическую реакцию. Не горит. Токсичен.
С химической точки зрения очень активное соединение, осно́вный оксид. Реагирует с водой с образованием щелочи Ca(OH)2 и выделением большого количества тепла. В реакции с кислотами и кислотными оксидами образует соли. Взаимодействует с углеродом (получается карбид CaC2). Вступает в реакцию с метиловым спиртом, оксидами металлов, с металлами, с хлором, бромом и другими галогенами, углекислым газом, серой, фосфором, кремнием и многими другими веществами.
Меры предосторожности
Негашеная известь — едкое вещество, которое относится ко 2-му (высокоопасному) классу веществ. Особенно опасно смешивать оксид с водой. Во-первых, можно обжечься; во-вторых, образующаяся щелочь разъедает кожу. Но даже без воды оксид действует на кожу как щелочь: вытягивает влагу из кожи, разрушает белки, омыляет жиры, вызывает химический ожог.
Опасность представляют известковая пыль, ее пары и аэрозольные частицы. Они попадают в органы дыхания, вызывая раздражение и кашель. При попадании в легкие могут вызвать пневмонию. Проглатывание оксида кальция вызывает ожог пищевода и желудка.
Очень опасен реактив для слизистых носа и особенно глаз. Способен вызвать язвы слизистой носа и даже прободение носовой перегородки.
Пострадавшему от контакта с химикатом обязательно следует вызвать скорую помощь. До приезда скорой нужно хорошо промыть место поражения: кожу, глаза, пищевод.
При работе с оксидом кальция (как на производствах, так и в быту) следует использовать защитную одежду; респиратор; очки; перчатки, стойкие к щелочам. На предприятиях обязательно контролируют ПДК реактива в воздухе. Рабочее место должно располагаться в помещении с общей принудительной вентиляцией. Места высокого риска пыления дополнительно снабжаются локальной вытяжной вентиляцией.
Хранят реактив в герметичной упаковке 
В лабораториях работы следует проводить в вытяжном шкафу. Хранят реактив в герметичных стеклянных или пластиковых сосудах с обязательными предупреждающими этикетками.
Окись кальция
Окись кальция
| Оксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Молярная масса | 56.077 г/моль |
| Физические свойства | |
| Плотность вещества | 3.37 г/см³ |
| Состояние (ст. усл.) | твердое |
| Термические свойства | |
| Температура плавления | 2627 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия (ст. усл.) | -635,09 кДж/моль |
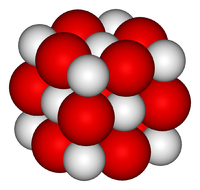
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
И при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
Применение
Полезное
Смотреть что такое «Окись кальция» в других словарях:
окись кальция — Регулятор кислотности пищевого продукта, получаемый обжигом извести в печах при температурах от 900 °С до 1200 °С, содержащий основного вещества СаО не менее 95,0 % по остатку от сжигания, фторидов не более 50 мг/кг, бария не более 300… … Справочник технического переводчика
Кальция окись — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция оксид — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Окись этилена — Окись этилена … Википедия
Окись азота — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
Кальция окись — негашёная известь, кипелка, CaO, соединение кальция с кислородом; бесцветные кристаллы, плотность 3,4 г/см3, tпл 2585 °С. Технический продукт белое пористое вещество. К. о. жадно реагирует с водой с выделением большого количества тепла и… … Большая советская энциклопедия
Окись дифенилена — (oxyde de biphénylène, Di[Bi]phenylenoxyd) находится (около 0,3%) в смоле (Stupp, Stuppfett,), получающейся при перегонке без доступа воздуха ртутной руды в Идрии (Гольдшмидт и Шмидт); образуется при перегонке трехфенильного эфира ортофосфорной… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ОКСИД КАЛЬЦИЯ — окись кальция, негашеная известь, кипелка СаО бесцветные кристаллы; плотность 3400 кг/м3; tпл=2585° С; обладает основными свойствами. Технический продукт белое пористое вещество. Оксид кальция жадно реагирует с водой с образованием… … Металлургический словарь
ГОСТ 21639.3-93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния — Терминология ГОСТ 21639.3 93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния оригинал документа: 8.2 Аппаратура, реактивы и растворы Спектрофотометр атомно абсорбционный любого типа с источником излучения… … Словарь-справочник терминов нормативно-технической документации
Оксид кальция — Общие … Википедия
Оксид кальция
Оксид кальция (пищевая добавка Е529) — химическое вещество с формулой CaO. Внешне выглядит как твёрдые белые или серовато-белые гигроскопичные массы, зерна или порошок без запаха. Температура плавления 2630 °C, с водой энергично образует гашёную известь Ca(OH)2; растворим в глицерине; нерастворим в этаноле.
Вещество в большом количестве встречающееся в земной коре и широко используемое в промышленности.
Пищевая добавка Е529 относится к улучшителям муки и хлеба синтетического происхождения, используется в технологических целях в процессе производства пищевых продуктов.
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ, на практике в виде корки на металле:
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Применение
Пищевая добавка
Катализатор гидролиза жиров — процесс идёт под давлением 0,6–0,8 МПа в присутствии катализатора (0,1–0,3 % от массы жира). Используется в качестве катализатора переэтерификации глицерином рафинированных жиров, а также саломасов из хлопкового или подсолнечного масла; расход катализатора — 0,3 % от массы жира, температура процесса 210–220 °C. Является питательной средой для дрожжей, поэтому входит в состав некоторых комплексных хлебопекарных улучшителей.
Другие сферы применения
В настоящее время в основном используются в производстве строительных материалов, высокоглиноземистого цемента, силикатного кирпича и тд.
До второй половины ⅩⅩ века известь широко использовали в качестве строительной побелки — прокалённый мел или известняк (оксид кальция) при смешивании с водой образует ярко-белую гашеную известь (Ca(OH)2), обладающую хорошими адгезионными свойствами к различным поверхностям. Далее известь медленно поглощает из воздуха углекислый газ, покрываясь коркой карбоната кальция. В настоящее время известковый цемент при строительстве жилых домов практически не применяется в виду значительной гигроскопичности (склонности поддерживать высокую влажность, провоцирующую рост плесени), уступив место более эффективным материалам.
В лабораторной практике оксид кальция используется как дешёвый и эффективный агент для осушения растворителей и жидких веществ.
В промышленности водный раствор используют в одном из способов удаления диоксида серы из дымовых газов. В результате реакции гашеной извести Ca(OH)2 и диоксида серы получается осадок сульфита кальция CaSO3. В настоящее время вытеснен современными абсорберами на основе четвертичных аммонийных соединений, способных обратимо связывать SO2 и CO 2.
Использовался в «саморазогревающейся» посуде. Оксид кальция, помещённый между двух стенок ёмкости, при прокалывании капсулы с водой реагирует с ней с выделением тепла.
Польза и вред
Научные данные о пользе применения пищевой добавки Е529 для здоровья человека в настоящий момент отсутствуют.
В производстве, при работе с оксидом кальция, необходимо соблюдать меры, предусмотренные техникой безопасности (носить защитные перчатки и очки).
Оксид кальция относится к высокотоксическим веществам (класс опасности 2). Это едкое вещество, особенно опасен при смешивании с водой.
В виде пыли или капель взвеси раздражают слизистые, вызывая чихание и кашель.
Действие CaO, подобно действию щелочи, состоит в омылении жиров, поглощении из кожи влаги, растворении белков, раздражении и прижигании тканей.
Сильно действует на слизистую глаз. На слизистой рта и носа наблюдаются поверхностные изъязвления; иногда прободение носовой перегородки.
Страдают также глубокие дыхательные пути. Вдыхание известковой пыли может вызвать воспаление лёгких.
Беременность и грудное вскармливание
Применение при беременности
Адекватных и хорошо контролируемых исследований о возможности применения оксида кальция у беременных женщин не проведено.
Применение в период грудного вскармливания
Специальных исследований о возможности применения оксида кальция в период грудного вскармливания не проведено.
Особые указания
В Российской Федерации, Евросоюзе пищевая добавка Е529 разрешена для применения в пищевой промышленности. Не входит в перечень разрешённых на Украине.
Гигиенические нормы
В Российской Федерации разрешён в качестве улучшителя муки и хлеба в пищевые продукты согласно ТИ в количестве согласно ТИ (п. п. 3.2.15,3.7.7 СанПиН 2.3.2.1293-03); в качестве осветляющего, фильтрующего материала, флокулянта и сорбента в сахарной промышленности, максимальное остаточное количество согласно ТИ (п. 5.1.23 СанПиН 2.3.2.1293-03); в качестве катализатора гидрогенизации пищевых масел, максимальное остаточное количество меньше 0,1 мг/кг (п. 5.2.15 СанПиН 2.3.2.1293-03).



