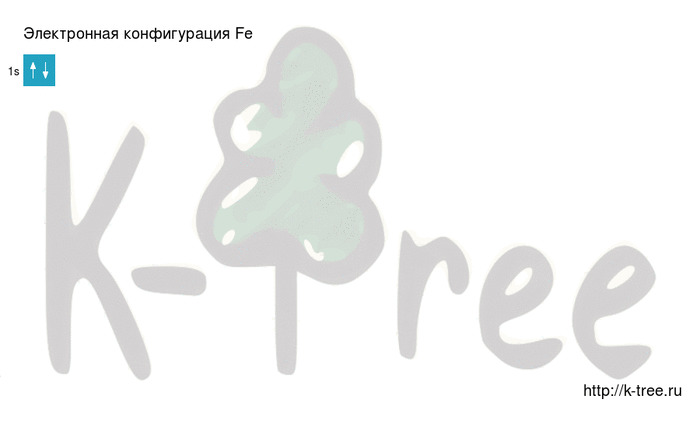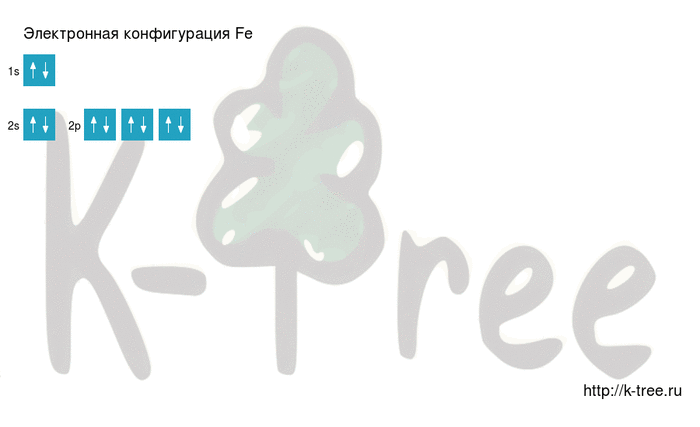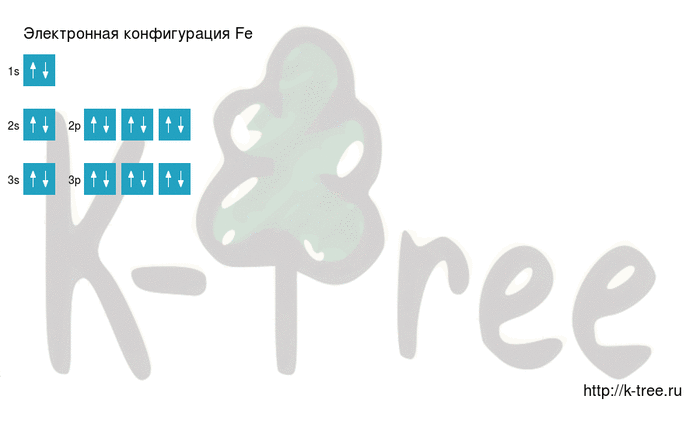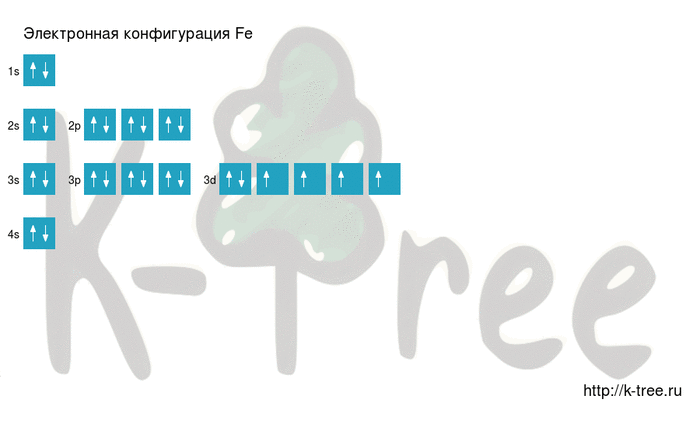какая валентность у феррума
Таблица валентности.
В таблице валентности приведены значения валентности элементов периодической таблицы Менделеева. Что такое валентность?
Точками здесь обозначаются неподеленные пары электронов, однако в структурных формулах их отмечают не каждый раз.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность. Чтобы проще было понимать и не путаться, ниже приведена таблица валентностей всех элементов периодической таблицы.
Цифра положительной валентности элемента соответствует количеству отданных атомом электронов, а отрицательной валентности – количеству электронов, которые атом должен забрать себе для завершения внешнего энергетического уровня.
Значение, приведенное в скобках таблицы валентности, перечисляет менее распространенные валентности. Если у элемента указана только одна цифра, значит он может иметь только одну валентность.
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число
Русское / Английское наименование
Валентность железа
Общие сведения о валентности железа
Валентность железа в соединениях
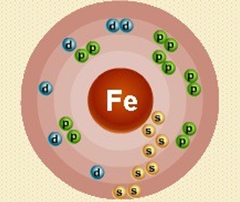
Железо – двадцать шестой по счету элемент Периодической таблицы Д.И. Менделеева. Оно находится в четвертом периоде в VIIIВ группе. В ядре атома железа содержится 26 протонов и 30 нейтронов (массовое число равно 56). В атоме железа есть четыре энергетических уровня, на которых находятся 26 электронов (рис. 1).
Рис. 1. Строение атома железа.
Электронная формула атома железа в основном состоянии имеет следующий вид:
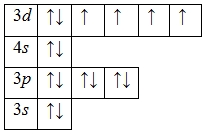
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Примеры решения задач
| Задание | Железная окалина Fe3O4массой 10 г была сначала обработана 150 мл соляной кислоты (плотность 1,1 г/мл) с массовой долей хлороводорода 20%, а затем в полученный раствор добавили избыток железа. Определите состав раствора (в % по массе). |
| Решение | Запишем уравнения реакций, которые протекают согласно условию задачи: |
Определим количество вещества хлороводорода (молярная масса равна 36,5 г/моль):
msolution (HCl) = Vsolution (HCl) × ρ;
msolution (HCl) = 150 × 1,1 = 165 г.
msolute (HCl) = ω (HCl) / 100% ×msolution (HCl);
msolute (HCl) = 20 / 100% × 165 = 33г.
n(HCl) = msolute (HCl) / M (HCl);
n (HCl) = 33 / 36,5 = 0,904 моль.
Рассчитаем количество вещества Fe3O4(молярная масса равна 232 г/моль) и вещество, находящееся в избытке:
n (HCl) = 8 × 0,043 = 0,344 моль.
По условию, количество вещества хлороводорода равно 0,904 моль. Следовательно, HCl находится в избытке и будет протекать ещё одна реакция:
Определяем количество моль FeCl2 и FeCl3, образовавшихся в ходе реакции (1) и количество вещества HCl, прореагировавшее с Fe3O4:
Рассчитаем количество вещества HCl, которое не прореагировало в реакции (1), и количество моль FeCl2, образовавшееся в ходе реакции (3):
nremaining (HCl) = 0,904 — 0,344 = 0,53 моль;
Определяем количество вещества FeCl2, образовавшееся во второй реакции, общее количество моль и массу FeCl2 (молярная масса равна 127 г/моль):
nsum (FeCl2) = 0,043 + 0,129 + 0,28 = 0,452 моль;
m (FeCl2)= 0,452 × 127 = 57,404 г.
Определяем количество моль и массу железа (молярная масса равна 56 г/моль) железа, вступившего в реакции (2) и (3):
n3 (Fe) :nremaining (HCl) = 1:2, значит n2 (Fe)= 1/2× nremaining (HCl) = 0,28 моль;
nsum (Fe) = 0,043 + 0,28 = 0,323 моль;
m (Fe)= 0,28 × 56 = 18,088 г.
Вычислим количество моль и массу водорода (молярная масса равна 2г/моль), выделившегося в реакции (3):
Определим массу полученного раствора и массовую долю хлорида железа (II) в нем:
m ’ solution = 165 + 10 + 18,088 – 0,56 = 192,528 г;
ω (FeCl2)=57,404 / 192,528 × 100% = 29,82%.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Таблица валентности химических элементов
Таблица валентности химических элементов.
Таблица валентности химических элементов:
Ниже приводится таблица валентности химических элементов с примерами соединений.
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Таблица валентности химических элементов:
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Железо Fe
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема железа
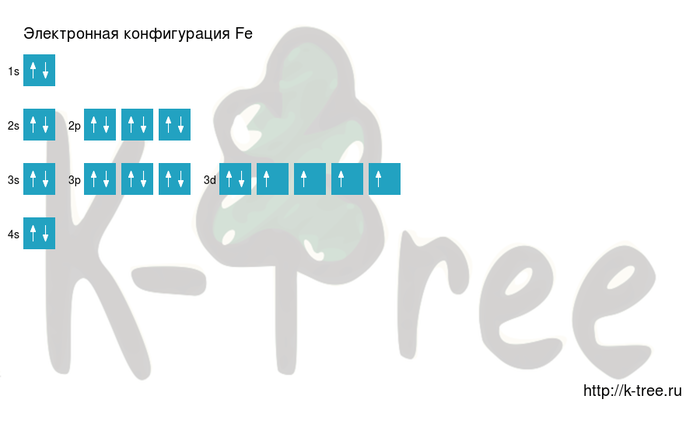
Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Короткая запись:
Fe: [Ar]4s 2 3d 6
Порядок заполнения оболочек атома железа (Fe) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Железо имеет 26 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации, для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Валентность железа. Какая валентность у железа?
Электронная схема железа
Порядок заполнения оболочек атома железа (Fe) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Железо имеет 26 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Видео
Рассмотрение подробностей другого типа соединения
Феррум со значением 3 также отличается по цвету, он будет красно-коричневым, из распространенных наименований стоит отметить окись железа, сурик, пигмент красного оттенка, краситель для пищи и крокус. В природе также можно встретить это вещество, оно представлено в виде такого минерала, как гематит. Подобный оксид с водой взаимодействовать не сможет, единственными соединениями будут щелочь и кислоты. Некоторые строительные материалы достаточно удачно окрашивают с помощью этого состава, сюда относятся:
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Физические свойства
Прежде чем переходить к валентности железа, необходимо подробнее рассмотреть его физические свойства, так сказать, приглядеться к нему поближе.
Этот металл имеет серебристый цвет, достаточно пластичный, но способен к увеличению твердости путем его взаимодействия с другими элементами (например, с углеродом). Также он обладает магнитными свойствами.
Во влажной среде железо может корродировать, то есть ржаветь. Хотя абсолютно чистый металл устойчивее к влаге, но если в нем есть примеси, именно они провоцируют коррозию.
Железо хорошо взаимодействует с кислотной средой, даже может образовывать соли железной кислоты (при условии сильного окислителя).
В воздушной среде быстро покрывается оксидной пленкой, которая защищает его от взаимодействий.
Органические вещества, содержащие Fe
Железо и его свойства крайне важны и полезны в повседневной жизни людей, хозяйственной и промышленной деятельности. Но еще соединения железа выполняют значимые функции в теле человека. Чаще всего биологическую роль выполняют именно органические вещества, содержащие Fe. Пожалуй, самым важным веществом в теле человека, содержащим железо, является гемоглобин. Гемоглобин является белком, который осуществляет транспортировку кислорода по крови и обеспечивает постоянный газообмен. Fe входит в состав многих ферментов и белков нашего тела. Этот элемент также влияет и на наш иммунитет. Не зря при нехватке железа человек чувствует себя уставшим и сонным. При снижении концентрации Fe повышается вероятность заражения инфекционными заболеваниями. Поэтому важно следить за тем, чтобы в рационе было достаточно продуктов, содержащих железо — бобы, крупы, орехи, сухофрукты, морская капуста.
Свойства Fe
Физические свойства
Химические свойства
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
Важные подробности
Железо можно смело относить к единицам с переменными показателями, значения могут колебаться не только между 2 и 3, но и достигать даже шести. Подобными изучениями занимаются специалисты отрасли неорганической химии, но каждому человеку подобные знания обязательно пригодятся. Если рассматривать механизм кратко и брать во внимание простые частицы, то данный элемент способен причислять 31 позицию из списка, это пункты с 4 по 7 периоды таблицы Менделеева. Поскольку порядковый номер будет постепенно расти, то свойства феррума несколько изменятся. Кроме возрастания атомного радиуса, получится заметить переменную валентность, это обусловлено незавершенностью подуровня. Чаще можно увидеть более устойчивые соединения с показателями 2 и 3, а самыми ненадежными считаются значения от четырех до шести, но они встречаются достаточно редко.
Валентность железа в соединениях
Железо – двадцать шестой по счету элемент Периодической таблицы Д.И. Менделеева. Оно находится в четвертом периоде в VIIIВ группе. В ядре атома железа содержится 26 протонов и 30 нейтронов (массовое число равно 56). В атоме железа есть четыре энергетических уровня, на которых находятся 26 электронов (рис. 1).
Рис. 1. Строение атома железа.
Электронная формула атома железа в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Железо в организме человека
Как отмечалось в начале статьи, вещество железо является важной составляющей человеческого организма.
Когда этого элемента является недостаточно, то могут возникнуть следующие последствия:
Накапливается железо, как правило, в селезенке и печени, а также почках и поджелудочной железе.
В рационе человека должны быть продукты, содержащие железо:
Недостаток железа в крови, приводит к снижению гемоглобина и развитию такого заболевания, как железодефицитная анемия.