какая вакцина прошла 3 фазу испытаний в мире
Комментарии к результатам 3 фазы клинических испытаний вакцины Спутник V опубликованы в журнале The Lancet
Статья опубликована 02.02.2021 под названием «Sputnik V COVID-19 vaccine candidate appears safe and effective». Заявленная эффективность: 91,6%.
Под катом краткий пересказ основных положений статьи.
TL;DR: авторы журнала считают, что всё хорошо (статья написана не сотрудниками НИЦЭМ им. Н. Ф. Гамалеи).
Disclaimer: Я не специалист в данной области (но я не могу пройти мимо, раз уж до сих пор никто из специалистов здесь эту новость не опубликовал), и могу некоторые термины перевести неправильно. Прошу специалистов прислать правки, если в этом тексте есть ошибки.
В начале статьи рассказывается о том, что вакцина использует гетерологические (heterologous) рекомбинантные частицы аденовирусов 26 (Ad26) и 5 (Ad5) в качестве векторов (вирусов-доставщиков) и встроенного в них гена протеина S, кодирующего шип вируса SARS-CoV-2. Вакцина состоит из двух доз, которые вводятся с разницей в 21 день.
Ранее такая технология была применена в НИЦЭМ им. Н. Ф. Гамалеи при разработке вакцины от Эболы.
На использовании рекомбинантных частиц аденовирусов также основаны вакцины Oxford–AstraZeneca (она использует аденовирус ChAdOx), вакцина от компании Johnson & Johnson (она использует только Ad26) и китайской компании CanSinoBIO (она использует только Ad5).
Вирусы переносчики являются модифицированными и не могут вызывать инфицирование (productive infection). Они проникают в клетку, заставляют её производить белок оболочки коронавируса и на этом останавливаются (так как они не могут продолжать нормальный для вирусов жизненный цикл). Однако высокочувствительные методы диагностики выявляют, что небольшое количество генов аденовирусов всё же производится.
Далее заражённые клетки уничтожаются иммунитетом организма.
Аденовирусы широко используются в качестве векторов для вакцины, так как они позволяют транспортировать много полезной нагрузки (payload), и, хотя они не могут размножаться, они надёжно позволяют вызвать иммунный ответ.
Недостатком векторных вакцин является требование больших доз, обычно y 10¹⁰ или 10¹¹ частиц. Из-за этого вакцину трудно производить в больших количествах.
Далее идёт про вторую фазу (здесь это публиковалось, поэтому я опущу).
Результат третьей фазы клинических испытаний:
Более 20000 участников, из них 75% получили настоящую вакцину.
Участники испытаний имеют возраст 18+, 60% мужчины, почти все белые.
Сопутствующие заболевания (Comorbidities), являющиеся известным риском осложнений для COVID-19 были у, примерно, четверти.
В группе плацебо заболели (получили подтверждённый диагноз заражения SARS-CoV-2) 62 человека из 4902 (1,3%).
В группе привитых заболели (считаются заболевшие, начиная с 21 дня после введения первой дозы) 16 человек из 14964 (0,1%).
Вакцина защищает все группы населения, включая группу 60+.
Случились три смерти среди привитых, все они болели тяжёлыми сопутствующими заболеваниями и были обречены независимо от вакцинирования.
Ни у кого не выявлено серьёзных побочных эффектов (adverse event, понимаю точно ли оно означает «побочный эффект»), связанных с вакциной, но были выявлены не связанные с вакциной у 45 участников из группы привитых и у 23 участников из группы плацебо.
Таким образом, на основе подтверждённых заражений (считаются только заражения после 21 дня с момента введения первой дозы), эффективность вакцины 91,6% (95% доверительный интервал: 85,6–95,2).
Вакцина Sputnik-V критиковалась за неподобающую спешку, нарушений правил (corner cutting, видимо имеются в виду нарушения правил клинических испытаний) и непрозрачность. Однако представленные результаты (видимо, в редакцию журнала) понятны и соответствуют методам доказательной медицины, что означает, что ещё одна вакцина теперь может присоединиться к борьбе с распространением коронавирусной инфекцией.
Центр Гамалеи подал документы для постоянной регистрации «Спутника V»
Центр имени Н.Ф.Гамалеи, разработавший вакцину от коронавируса «Спутник V», завершил пострегистрационные испытания и подал необходимые документы для постоянной регистрации препарата. Об этом заявил директор центра Александр Гинцбург, передает «РИА Новости».
«Да, они завершились, документы поданы и они сейчас рассматриваются», — рассказал глава Центра.
«Спутник V» зарегистрировали в России 11 августа прошлого года до окончания исследований. Он стал первой в мире зарегистрированной вакциной от COVID-19. Препарат создан на платформе аденовирусных вирусов человека.
Разработчик начал третий этап пострегистрационных исследований в начале сентября прошлого года. Минздрав ожидал провести третью и четвертую фазы испытаний до конца декабря 2022 года. В них планировалось задействовать 40 тыс. человек; причем около 10 тыс. из них, согласно плану, получили вместо препарата плацебо — вещество, не имеющее лечебных свойств.
Третий этап испытаний завершился в конце сентября, в исследованиях приняли участие в том числе пожилые люди старше 60 лет. По словам главы Минздрава Михаила Мурашко, вакцина во время испытаний зарекомендовала себя как эффективная и безопасная. «Были задействованы более 23 тыс. человек, фактически мы видим хороший профиль безопасности», — указал он.
«Спутник V» пока не одобрен для применения Всемирной организацией здравоохранения (ВОЗ). Там полагают, что препарат может получить одобрение к концу этого года в случае подписания некоторых важных документов. «Если документы будут подписаны в ближайшие пару дней, после чего оценка возобновится, то очень возможно, что инспекция также произойдет до конца года и процесс может быть завершен», — сообщила представитель ВОЗ Сумия Сваминатан.
Кроме того, в России проходят испытания «Спутника V» на подростках 12–17 лет, они начались в июле. Исследования проходят на базе двух столичных медучреждений — Морозовской детской больницы и Детской больницы им. Башляевой при участии 100 добровольцев; позднее к ним присоединятся еще 250 подростков. Гинцбург отмечал, что несовершеннолетним введут тот же препарат, что и взрослым, но в меньшей дозировке. По его словам, к середине июля только у двоих медики выявили повышенную температуру.
«Спутник» и ложь во спасение. Почему у работоспособной вакцины плохая репутация
Илья Ясный
руководитель научной экспертизы Inbio Ventures
«Спутник V» — вакцина, которая спасла немало жизней, и повод для гордости: Россия одна из немногих стран, справившаяся с самостоятельной разработкой. С другой стороны, процесс разработки, производства и распространения вакцины сопровождается таким количеством нарушений, дезинформации и некомпетентности, что репутация у препарата неоднозначная. Фактически в нем, как в капле воды, отразились проблемы российской науки, фармацевтики и пиара. Руководитель научной экспертизы Inbio Ventures Илья Ясный анализирует факты и домыслы вокруг «Спутника» и разбирается, почему Европа и ВОЗ до сих пор не одобрили российскую вакцину.
Дисклеймер: автор и его семья привились «Спутником».
Прежде всего, необходимо различать три вещи:
Предыстория: Эбола и уголовное дело
Публичная история Спутника V началась 20 апреля 2020 года, когда директор института Гамалеи Александр Гинцбург на совещании у Путина заявил, что клинические исследования вакцины могут начаться 1 июня, а регистрация возможна с 15 июня. Конечно, постановление правительства разрешает сокращенный порядок исследований лекарств в период пандемии, но две недели на клинические исследования — это, мягко говоря, оптимистичный прогноз.
Правда, Гинцбург и другие сотрудники постоянно ссылаются на то, что платформа, на которой сделан «Спутник», хорошо изучена, и это уже третья вакцина, полученная по данной технологии. Действительно, раньше в России была зарегистрирована вакцина от Эболы, однако сделано это было в нарушение всяких правил по результатам фазы ½, результаты фазы 3 так и не были нигде опубликованы, а разрешение на исследование вписано в реестр задним числом.
Есть еще одна пикантная подробность: на самом деле «Спутник» — не третья, а четвертая попытка института Гамалеи создать векторную вакцину: первой была АдеВак-Флю, о которой сейчас Гинцбург не упоминает. Возможно, потому что деньги на ее создание были разворованы, а в хищении 424 млн рублей у Роснано обвиняется бывший сотрудник центра Гамалеи Рустам Атауллаханов. Гинцбургу и его заместителю Денису Логунову посчастливилось быть на этом процессе свидетелями.
Поспешная регистрация
В мае 2020 года разразился скандал с исследованием вакцины на сотрудниках института Гамалеи еще до тестирования на животных. Директор Гинцбург заявил, что это не имеет никакого отношения к клиническим исследованиям. Правда, по всем международным правилам, незарегистрированные новые препараты должны вводиться людям только в рамках клинических исследований: они должны подписывать информированное согласие, оформлять страховку и тщательно наблюдаться, потому что их здоровье и жизнь подвергаются повышенной опасности.
Наконец, регистрация вакцины 11 августа без каких-либо опубликованных данных стала настоящей сенсацией не только у нас, но и за рубежом, и оказала неоднозначное влияние на имидж вакцины. Все, что было доступно в течение двух месяцев — скупые данные из плохо написанной инструкции, из которых, однако, было понятно, что обе дозы вакцины в жидком виде получили ровно двадцать человек. Это не тянет даже на исследование фазы 2, не то что на регистрационное. Для сравнения, на тот момент детали по первым двум фазам исследований западных вакцин: Pfizer/BioNTech, AstraZeneca, Moderna уже были опубликованы в рецензируемых научных журналах, причем там участвовало в десятки раз больше человек, но никто не торопился регистрировать вакцину по этим предварительным данным.
Кроме того, сопровождающие регистрацию заявления о том, что это первая в мире зарегистрированная вакцина от коронавируса, не соответствуют действительности: 25 июня китайская вакцина CanSino была зарегистрирована для применения у военных. Также нелепо заявление разработчика Логунова о том, что временная регистрация необходима для вакцинации групп риска. Оно противоречит и мировой практике, и российскому руководству по клиническим исследованиям.
Публикации и испытания
В сентябре 2020 года в журнале Lancet вышла публикация результатов исследований фазы 1/2, которая подверглась резкой критике со стороны итальянского борца с лженаукой Энрико Буччи и других ученых с обвинениями в фальсификации данных. Группа Логунова ответила на критику, однако первичные данные, по которым можно было с уверенностью судить об отсутствии фальсификации, так и не были предоставлены. Но и помимо этой критики в статье много недостатков. Некоторое беспокойство с этической точки зрения вызвало то, что в исследовании принимали участия военные — это зависимая группа, и необходима особая внимательность, чтобы обеспечить добровольность и информированность участников.
СТАТЬИ ПО ТЕМЕ
«Спутник» выходит из тени. Что прояснила статья в The Lancet о российской вакцине
В сентябре же началось исследование фазы 3. В отличие от всех ведущих производителей вакцин, протокол «Спутника» опубликован не был. Между тем протокол — это ключевой документ клинического исследования, в нем описывается схема эксперимента, заранее указывается, какой результат и по какому критерию исследователи считают успешным, сколько для этой цели нужно добровольцев и прочие подробности. Мне удалось ознакомиться с августовским черновиком протокола. На первый взгляд он неплохо написан и похож на протоколы западных компаний, однако есть некоторые важные нюансы: описание того, заболел человек ковидом или нет, недостаточно детально и довольно субъективно, что во многом оставляет решение за врачом. Это позволяет манипулировать данными, если знать, кто в группе плацебо, а кто — вакцины. При том, что вакцина чаще вызывает побочные реакции, такой подход может привести к завышению ее эффективности.
Решение, заболел участник исследования ковидом или нет, во многом остается за врачом
В протоколе «Спутника», в отличие от протоколов других компаний, отсутствовали промежуточные точки анализа. Между тем ждать 180 дней после включения в исследования последнего пациента — это и впрямь слишком долго, поэтому из публикации о фазе 3 мы узнаём, что промежуточные анализы были внесены туда в ноябре. Изменение протокола третьей фазы, когда исследование уже идет, может привести к получению невалидных результатов, и требуется большая осторожность и хорошие обоснования, что всё сделано правильно. Как нетрудно догадаться, в статье это никак не комментируется.
Неясна ситуация и с эффективностью «Спутника» против новых штаммов. В центре Гамалеи, конечно, утверждают, что он эффективен против них, не приводя никаких доказательств (ждите, мол, публикацию в мае). Независимые ученые проанализировали сыворотку привитых аргентинцев и установили, что она хуже нейтрализует южноафриканский вариант вируса.
Производство
Одновременно c фазой 3 начинается масштабирование производства вакцины и к процессу подключаются Генериум, Биокад, Р-Фарм и другие компании. Передача производства в коммерческие компании повысила надежду, что вакцина будет качественной, но одновременно поставила вопрос о сопоставимости продуктов, произведенных на разных площадках. Скажем, продукт, произведенный в институте Гамалеи в реакторах объемом 5 л для целей клинического исследования совсем не обязан быть таким же, как произведенный в Генериуме в реакторе 1000 л для массового применения. Их сопоставимость требует отдельных исследований. О неполной сопоставимости косвенно свидетельствуют разные указания о хранении и применении для продукта разных производителей в инструкции на препарат.
Дальше обещания по количеству доз постоянно обгоняли реальные темпы производства. Впрочем, в том, что производство не удалось сразу масштабировать, нет ничего удивительного — в России не было опыта самостоятельного производства и масштабирования качественных инновационных препаратов, а к закупке оборудования для масштабирования приступили только в конце сентября. Итого на 12 мая в России произведено 33 млн доз, из которых экспортировано 15 млн. Так, Мексика получила 1,9 млн доз из положенных по контракту 24 млн. Минздрав Мексики заявил, что это из-за проблем с производством второй дозы, но РФПИ утверждает, что это неверная информация.
Наконец, в конце ноября были объявлены предварительные результаты третьей фазы для всех ведущих вакцин, в том числе для «Спутника». Как и у Pfizer и Moderna, эффективность «Спутника» оказалась на уровне 95%. Данные были опубликованы в виде пресс-релизов, но для западных вакцин более подробная информация стала довольно быстро доступной после одобрения вакцин в США и ЕС — агентства на этих территориях, в отличие от Минздрава РФ, публикуют подробную информацию и от производителя, и от регулятора, а в США доступно еще и видео заседания научного комитета. Подробностей о «Спутнике» пришлось подождать до февраля 2021 года, когда вышла статья в журнале Lanсet о результатах фазы 3. Впервые результаты исследования третьей фазы российского препарата были опубликованы в таком престижном международном журнале. Правда, и к этой публикации у исследователей возникли вопросы, которые во многом могли бы быть сняты предоставлением протокола исследования и первичных данных. В частности, выяснилось, что реактогенность вакцины вовсе не изучали. По руководству после прививки нужно собирать информацию о реакции на вакцину в течение нескольких суток, опрашивая пациентов. В протоколе это не было предусмотрено.
Сопоставимость вакцин, произведенных на разных площадках, нужно отдельно исследовать
Тем не менее в ноябре-декабре 2020 года начали накапливаться сведения из Telegram-каналов о привитых «Спутником». И у пожилых, и у людей с сопутствующими заболеваниями не наблюдалось серьезных побочных эффектов, вырабатывались антитела. Это в итоге и убедило меня посоветовать родителям привиться. Конечно, такая ситуация ненормальна, источником достоверной информации о лекарствах должны быть не соцсети, а официальные данные.
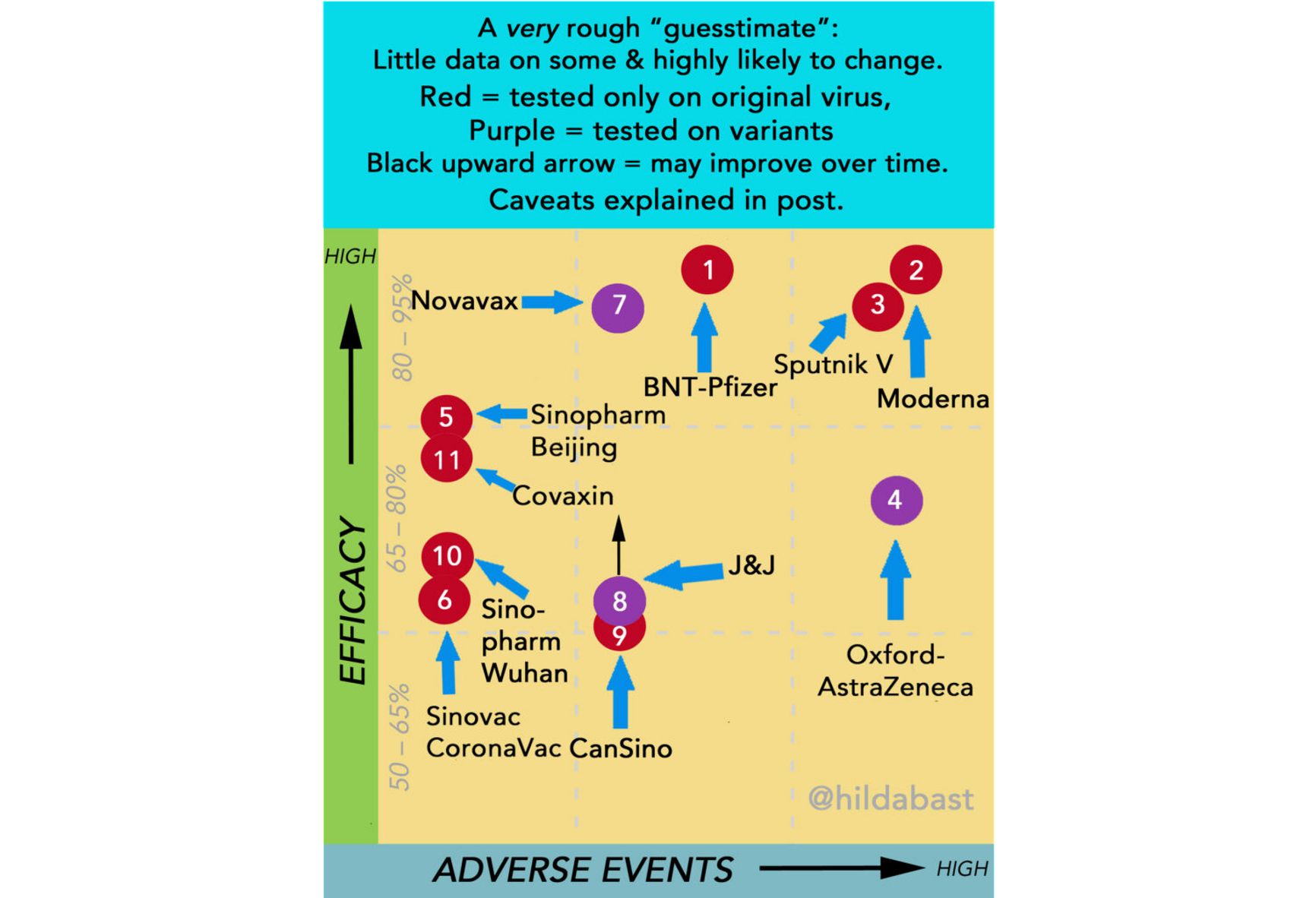
Правда, теперь у нас есть данные реального применения из Аргентины и Сан-Марино (но не из России). Надежно можно оценить разве что безопасность вакцины — количество побочных эффектов в сан-маринском исследовании находится на верхней границе других вакцин. Исследовательница Хильда Бастиан, одна из основателей Кокрейновского общества и эксперт по доказательной медицине, проводит сравнение вакцин по эффективности и безопасности, оговариваясь, что это ориентировочный график, потому что сравнивать данные из разных исследований напрямую не вполне корректно. На рисунке приведены данные на середину мая.
Как мы видим, у «Спутника» высокая заявленная эффективность, но и высокий уровень побочных эффектов. Число новых случаев ковида в Сан-Марино снизилось до нуля, при том, что «Спутником» там прививалось 80% населения.
Экспорт за рубеж
К «Спутнику» стали проявлять интерес в других странах — к ноябрю 2020 года заявки поступили из 50 стран на общий объем 1,2 млрд доз. Однако уже в декабре начались первые трения — Турция отказалась покупать «Спутник V» по причине несоответствия доклинических исследований надлежащей лабораторной практике (GLP, Good Laboratory Practice). Эти стандарты обеспечивают качественное выполнение исследований на животных, в первую очередь на токсичность. Если они не выполняются, нельзя быть уверенным, что препарат хорошо проверили на безопасность.
В ответ Гинцбург заявил, что «лабораторное производство сертифицировано по стандартам Минпромторга, но не по европейским сертификационным органам. У нас нет европейского сертификата, а имеем российский, как и вся наша промышленность». Это очень странный ответ — в претензии Турции речь шла вовсе не о производстве, а о доклинических исследованиях. Лабораторное производство не сертифицируется, лицензируется только промышленное производство. Стандарты лицензирования Минпромторга — это почти копия европейских стандартов.
Турция заявила, что проведет собственные исследования вакцины. Проделав это, турки одобрили вакцину 30 апреля и закупили 50 млн доз. Также они организуют собственное производство.
Вообще, для контекста важно понимать, что весь мир делится на две большие зоны — страны, где приняты самые современные нормы в отношении лекарств, разрабатываемые ICH (The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, Международный совет по гармонизации технических требований к лекарствам для медицинского применения), и остальные страны. Наиболее сильное и современное регулирование в США, ЕС, Японии, Швейцарии, Канаде. Важно подчеркнуть, что эти руководства — не бюрократические преграды на пути производителей, выстроенные злой «бигфармой», а стройная, научно обоснованная, выстраданная после многих инцидентов система, обеспечивающая население этих стран безопасными, эффективными и качественными лекарствами.
Две страны Евросоюза вступили в переговоры с РФПИ о поставках «Спутника», несмотря на отсутствие одобрения со стороны ЕМА и ВОЗ: Венгрия и Словакия. Венгрия одобрила вакцину еще в январе 2021-го, но продолжала свои внутренние проверки. В феврале началась массовая вакцинация населения. Со Словакией получилось сложнее: одобрение вакцины и решение о закупке «Спутника» привело к политическому скандалу внутри страны. Затем, получив первые образцы вакцины, словаки заявили, что они не соответствуют тому, что было опубликовано в The Lancet, а данных из досье недостаточно, чтобы судить о безопасности и эффективности вакцины.
В ответ РФПИ потребовал вернуть поставленные 200 000 доз, ссылаясь на нарушение словаками контракта, в соответствии с которым вакцину могли тестировать только в сертифицированных ЕС лабораториях. Тогда Словакия опубликовала контракт, из которого видно, что там нет таких указаний. Однако 9 мая Словакия сообщила, что дозы, отправленные на тестирование в Венгрию, оказались удовлетворительного качества, и 26 мая одобрила вакцину для применения в стране. А чешский регулятор ранее заявлял, что данных в досье недостаточно, и они прекращают рассмотрение документов.
Наверное, самый громкий скандал разразился в Бразилии. Тамошнее регуляторное агентство ANVISA заявило, что пока не разрешит регистрацию «Спутника V» по причине неполноты данных и сразу нескольких моментов, которые беспокоят агентство:
РФПИ пообещал подать на ANVISA в суд за клевету. Но часть этих замечаний была понятна и до ANVISA, и их в любом случае придется устранить до того, как ЕМА или ВОЗ одобрят вакцину. Если РФПИ и Гамалея хотят зарегистрировать вакцину в Евросоюзе (а им было выдано такое распоряжение, как говорится, «на самом верху»), им придется пустить аудиторов ЕМА даже на такой сверхсекретный объект, как центр Гамалеи.
Между тем в Бразилии местная компания União Química наладила собственное производство «Спутника» по лицензии и подала на регистрацию. Так же поступила и индийская Dr. Reddy’s, причем индусы еще и провели собственное клиническое исследование, а также налаживают самое масштабное производство «Спутника» в мире.
Пиар черный и белый
Тут самое время упомянуть о позиции, которую занимают пиарщики РФПИ при любой попытке критиковать вакцину и даже просто сравнить ее с другими аналогами. С самого начала фонд сделал ставку не на открытость и готовность к диалогу, а на защитно-агрессивную позицию, причем с акцентом на принижение достоинств других вакцин и безапелляционные заявления о 97-процентной эффективности «Спутника». Так, в пресс-релизе написано, что заболеваемость среди 3,8 миллионов привитых россиян в январе-марте 2021 года составила 0,027%. Это означает, что среди дважды привитых «Спутником V» заболело 1026 человек. При этом, согласно информации Мосгорздрава, около 1000 человек к 31 марта заболело только среди миллиона привитых москвичей. Противоречие в цифрах очевидно.
На все упомянутые выше сигналы из разных стран представители РФПИ отвечали, что это «фейк-ньюс», была подключена и риторика «информационной атаки» на «Спутник» со стороны Госдепа США и подконтрольных ему организаций. Правда, государственная пропаганда США дала повод: согласно отчету Департамента здравоохранения США за 2020 год, они «убеждали Бразилию отказаться от российской вакцины». Отчет стыдливо удален с сайта Департамента, но кэш всё помнит.
Что касается очернения конкурентов, самая вопиющая история — с табличкой из Венгрии. В Twitter РФПИ была опубликована таблица с заражениями и смертями после вакцинации различными препаратами, из которой можно сделать вывод, что после вакцинации Pfizer/BioNTech смертность в почти в 20 раз, чем после «Спутника».
В России завершилась третья фаза испытаний «Спутник V»
Московский Центр им. Гамалеи завершил третью фазу испытаний вакцины от коронавируса «Спутник V», в котором в том числе участвовали пожилые люди. Об этом на заседании президиума координационного совета при правительстве по борьбе c коронавирусом заявил министр здравоохранения Михаил Мурашко.
«Мы проводили III фазу клинического исследования вакцины «Гам-КОВИД-Вак», или «Спутник V», которая завершилась с участием пациентов старше 60 лет», — сказал он.
Мурашко сообщил, что испытания показали высокую эффективность и безопасность вакцины, готовится итоговый отчет. «Получив уже новые данные о больших, даже огромных объемах исследования, в котором были задействованы более 23 тыс. человек, фактически мы видим хороший профиль безопасности, и институт Гамалеи разрабатывает новые показания для вакцинации и использования вакцины», — сказал министр.
Минздрав выдал разрешение на проведение III и IV фазы постклинических исследований «Спутника V» в августе. Они начались 25 августа и должны закончиться в декабре 2022 года, в них примут участие 40 тыс. человек. Около 10 тыс. добровольцев должны получить не препарат, а плацебо — вещество без явных лечебных свойств, говорил глава Центра им. Гамалеи Александр Гинцбург.
Российскую вакцину «Спутник V» зарегистрировали в России 11 августа 2020 года. Она стала первым в мире зарегистрированным препаратом от COVID-19. Применение этой вакцины для пожилых Минздрав одобрил в конце декабря.
Предварительные результаты III фазы испытания вакцин от COVID-19
1. Pfizer и BioNTech, совместная разработка США и Германии (9 ноября, затем обновление 18 ноября).
— Эффективность иммунизации: 95% (изначально более 90%).
— Количество проанализированных случаев: 170 (изначально 94).
— Всего участников в III фазе: 45 тысяч человек.
Результаты по эффективности иммунизации были сделаны на основе ограниченных данных. По мере наблюдений за добровольцами они могут снижаться. Однако, скорее всего, эффективность иммунизации будет явно больше 50%.
2. Sputnik V (читается «спутник ви»), Россия (11 ноября).
— Эффективность иммунизации: 92%.
— Количество проанализированных случаев: 20.
— Всего участников в III фазе: 40 тысяч человек.
— Температура хранения: 2 – 8 °C (для обычных холодильников).
— Тип вакцины: векторная вакцина (аденовирус).
— Слишком малое количество проанализированных случаев. Чем меньше проанализированных случаев, тем меньше уверенности в том, что вакцина действительно эффективна на 92% процента, как было заявлено в пресс-релизе.
— Протокол исследования вакцины Sputnik V не был обнародован (не этот ( https://clinicaltrials.gov/ct2/show/NCT04530396 )), в отличие от протокола вакцины Pfizer / BioNTech и некоторых других вакцин, которые находятся на III фазе испытаний.
3. Moderna, США (16 ноября).
— Эффективность иммунизации: 94,5%.
— Количество проанализированных случаев: 95.
— Всего участников в III фазе: около 30 тысяч человек.
— Тип вакцины: РНК-вакцина.
Плюс: предотвращает тяжелые инфекции (у двух других вакцин про это пока неизвестно).
Минус: слишком низкая температура для хранения, что может усложнить доставку вакцины в отделённые регионы и сделать стоимость вакцины дороже.
4. AstraZeneca, Великобритания (23 ноября). Её также называют оксфордской вакциной.
— Эффективность иммунизации: 70% (в одной группе — 62%, во второй — 90%).
— Количество проанализированных случаев: 131.
— Всего участников в III фазе: более 23 тысяч человек (рассчитывается привлечь до 60 тысяч человек).
— Температура хранения: 2 – 8 °C (для обычных холодильников).
— Тип вакцины: векторная вакцина (аденовирус).
Плюс: большие мощности для производства вакцины. К концу 2020 года планируется изготовить 200 млн доз, за месяц можно производить по 100–200 млн доз.
— Имеет шанс предотвращать передачу вируса даже от бессимптомных носителей.
— Защищает от серьёзных симптомов от COVID-19 (среди тех, кто получал вакцину, не было ни одного случая госпитализации или тяжелого COVID-19).
и вообще какие минусы могут быть у американской вакцины, и плюсов у российской вакцины тоже быть неможет
очередной новорег рассказывает (копипастит) как Россия погибает, как никогда.
ТС, ты явно не в курсе последнего скандала с вакциной Пфайзер.
Спутник по последним данным больше 95%.
Лично наша семья ждет чумаковскую, которая больше подходит для моих бабуль и деда, у них в анамнезе диабет и шунтирование.
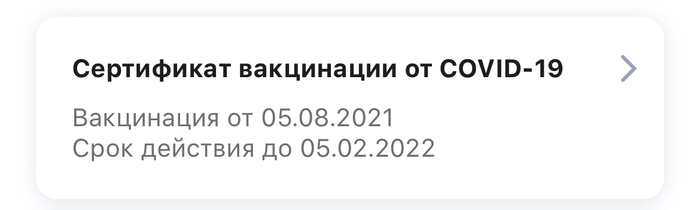
Прививочный сертификат теперь действует полгода
Срок действия прививочного сертификата резко изменили с года до полугода. Без предупреждения.
У меня вернули год.
Какой-то сверхразум похоже апдейты базы писать не умеет. У них там в Госуслугах процессы разработки в жопе полнейшей похоже находятся.
Теперь вопрос звучит другой у меня:
А не пора ли менять менеджмент ГосУслуг если они допускают такие сбои при релизах на самом крупном Гос портале, у которого аудитория теоретическая больше 100 млн человек и который несет такую важность?
Без шуток теперь от него зависят жизни людей.
Трансвакцинация
«Это из-за Pfizer!»: антипрививочники использовали видео больной девушки в своей пропаганде
23-летняя Хенди Херман, страдающая тяжелым недугом, оказалась в центре неприятного скандала, который спровоцировал идейный противник вакцинации из Иерусалима. О произошедшем она рассказала в понедельник, 1 ноября в интервью Ynet.
У девушки нередко случаются припадки, которые похожи на приступ эпилепсии. Таким образом проявляются симптомы расстройства, называемого PNES (Диссоциативные конвульсии). Это заболевание неизлечимо, и нередко тяжелые и неконтролируемые приступы происходят в общественных местах или в транспорте.
Один из таких случаев случился с Хенди во время поездки в трамвае.
Во время припадка, который невозможно контролировать, я не могу реагировать на действия окружающих, но могу слышать, что происходит вокруг меня».
На этом инцидент не был исчерпан. Тот же мужчина, спустя три дня, разместил видеоролик в социальных сетях. Причем сопроводил его лживым комментарием о том, что девушке якобы сделали вакцинацию сутками ранее.
Несмотря на плохое самочувствие девушка не намерена сдаваться, она подала жалобу в полицию и ищет адвокатов, которые помогут ей в судебной тяжбе.
Антиваксер кричит в видео:
Лукашенко заявил, что в Беларуси не будет западных вакцин, чтобы люди «не ехали на Запад»
Александр Лукашенко 26 октября съездил в Лидскую центральную районную больницу, где лечат пациентов с COVID-19. Во время визита он заявил, что в Беларуси не будет «западных» вакцин (Pfizer, Moderna и других, которые производятся в странах Европы и США), потому что привитые ими люди смогут беспрепятственно выехать на Запад.
Pfizer ссылается на израильские данные: среди новых зараженных растет число привившихся первыми
В конце минувшей недели компания Pfizer вызвала немало внимания и жесткой критики в США после того, как официально попросила разрешения прививать ранее вакцинированных граждан третьей, усиливающей, дозой вакцины от коронавируса.
Означает ли это, что привившиеся первыми находятся под угрозой повышенного заражения?
Все аспекты этой проблемы рассматриваются в воскресенье, 11 июля, в статье «Едиот ахронот».
Федеральное управление США по контролю за лекарствами и продуктами (FDA) и американский центр контроля и профилактики заболеваний (CDC) выпустили совместное заявление, в котором, если вкратце, говорится, что американцам, привившимся двумя дозами вакцины, на данном этапе не нужна третья прививка. В заявлении также говорится, что не фармакологические компании должны решать, когда понадобится третья доза и понадобится ли она вообще.
Сегодня уже можно сказать, о каких именно данных идет речь. В последнее время д-р Арик Хасс представил собранную в Минздраве информацию о заражении индийской мутацией (вирусом «Дельта»). Данные были озвучены членам группы по борьбе с эпидемией, работающей при министерстве. Согласно этим данным, среди новых зараженных появляется все больше привитых в самом начале массовой вакцинации.
Важно отметить, что даже эти новые данные не опровергают факт, что вакцинация защищает от развития заболевания в тяжелой форме. После презентации д-ра Хасса многие в Минздраве отметили, что исследование было основано на слишком небольшой выборке, чтобы можно было сделать из этого однозначные выводы. Однако в последние дни в Минздраве полагают, что речь идет о тенденции, на которую нельзя не обратить внимание.
Компания Pfizer сообщила также (и эта фраза была спрятана глубоко внутри текста их заявления), что данные из Израиля «соответствуют результатам третьего этапа клинических испытаний вакцины». Иными словами, Pfizer говорит, что столкнулась с новыми заражениями и внутри своих контрольных групп, на основании которых изначально делались выводы об эффективности прививок.
Центральной проблемой в анализе этих данных является факт, что в Израиле первыми были вакцинированы люди с ослабленной иммунной системой – пожилые и люди с хроническими заболеваниями. Поэтому можно было предположить, что в этих категориях будут новые зараженные. Однако даже учитывая этот факт и возраст привитых, авторы израильского исследования убеждены, что заражения среди привитых не связаны с тем, что вирус может пробивать защиту от вакцин (это предположение было опровергнуто и в результате лабораторных опытов), а то, что влияние вакцины ослабевает со временем.
Большинство израильских исследователей, не работающих напрямую с Минздравом, выражают скептицизм по поводу подобных выводов. Так, проф. Ран Балицер написал в связи с заявлением Pfizer на основе данных израильского Минздрава: «Мы еще не видели убедительного доказательства необходимости третьей дозы для всех. Цитата, согласно которой большинство заражений привитых произошли с получившими прививку в январе-феврале, доказательством служить не может. Причина – около 80% вакцинированных израильтян были привиты первой дозой именно в эти месяцы».
Американские ученые также подвергли резкой критике заявление Pfizer, как минимум один из них назвал его «оппортунистским». Cпециалисты FDA и СDC также были однозначны, отметив, что там анализируют данные фармацевтических компаний, но решение по поводу третьей дозы не будет принято исключительно на основе их рекомендаций.