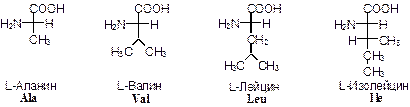какая аминокислота не имеет ассиметричного атома с
Аминокислоты и биосинтез белка
АМИНОКИСЛОТЫ БЕЛКОВ
БИОСИНТЕЗ БЕЛКА НА РИБОСОМЕ
Известно более 200 природных аминокислот, которые можно классифицировать по-разному. Структурная классификация исходит из положения функциональных групп на альфа-, бета-, гамма- или дельта- положении аминокислоты.
Кроме этой классификации, существуют еще и другие, например, классификация по полярности, рН уровню, а также типу группы боковой цепи (алифатические, ациклические, ароматические аминокислоты, аминокислоты, содержащие гидроксил или серу, и т.д.).
В виде белков аминокислоты являются вторым (после воды) компонентом мышц, клеток и других тканей человеческого организма. Аминокислоты играют решающую роль в таких процессах, как транспорт нейротрансмиттеров и биосинтезе.
Общая структура аминокислот. Альфа аминокислоты. Изомеризация аминокислот.
Аминокислоты – биологически важные органические соединения, состоящие из аминогруппы (-NH2) и карбоновой кислоты (-СООН), и имеющие боковую цепь, специфичную для каждой аминокислоты. Ключевые элементы аминокислот – углерод, водород, кислород и азот. Прочие элементы находятся в боковой цепи определенных аминокислот.
В структуре аминокислот боковая цепь, специфичная для каждой аминокислоты, обозначается буквой R. Атом углерода, находящийся рядом с карбоксильной группой, называется альфа-углерод, и аминокислоты, боковая цепь которых связана с этим атомом, называются альфа-аминокислотами. Они представляют собой наиболее распространенную в природе форму аминокислот.
По свойствам боковых цепей аминокислоты подразделяются на четыре группы. Боковая цепь может делать аминокислоту слабой кислотой, слабым основанием, или эмульсоидом (если боковая цепь является полярной), или гидрофобным, плохо впитывающим воду, веществом (если боковая цепь неполярна).
АЛЬФА-АМИНОКИСЛОТЫ
Аминокислоты, имеющие как амин-, так и карбоксильную группу, прикрепляются к первому (альфа-) атому углерода имеют особое значение в биохимии. Они известны как 2-, альфа или альфа-аминокислоты (общая формула в большинстве случаев H2NCHRCOOH, где R представляет собой органический заместитель, известный как «боковая цепь»); часто термин «аминокислота» относится именно к ним.
Это 22 протеиногенных (то есть «служащих для строительства белка») аминокислоты, которые сочетаются в пептидные цепи («полипептиды»), обеспечивая построение широкого спектра белков. Они являются L-стереоизомерами («левыми» изомерами), хотя у некоторых бактерий и в некоторых антибиотиках встречаются некоторые из D-аминокислот («правых» изомеров).
Рис. 2. Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ АМИНОКИСЛОТ
Рис. 3. Оптические изомеры аминокислоты аланина
БИОСИНТЕЗ БЕЛКА НА РИБОСОМЕ
СТАНДАРТНЫЕ АМИНОКИСЛОТЫ
(протеиногенные)
Прим.: В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин и пирролизин. Это так называемые 21-я и 22-я аминокислоты.
Аминокислоты являются структурными соединениями (мономерами), из которых состоят белки. Они объединяются между собой, формируя короткие полимерные цепи, называемые пептидами длинной цепи, полипептидами или белками. Эти полимеры являются линейными и неразветвленными, каждая аминокислота в цепи присоединяется к двум соседним аминокислотам.
Рис. 5. Рибосома в процессе трансляции (синтеза белка)
Рис. 6 Стадии элонгации полипептида.
Двадцать две аминокислоты естественно включены в полипептиды и называются протеиногенными, или природными, аминокислотами. Из них 20 кодируются с помощью универсального генетического кода.
Белки имеют 4 уровня своей структурной организации: первичная, вторичная, третичная и четвертичная. Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков.Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями.Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Рис. 8. Структурная организация белков
НЕСТАНДАРТНЫЕ АМИНОКИСЛОТЫ
(Не-протеиногенные)
Функции аминокислот
БЕЛКОВЫЕ И НЕ БЕЛКОВЫЕ ФУНКЦИИ
Из-за своей биологической значимости аминокислоты играют важную роль в питании и обычно используются в пищевых добавках, удобрениях и пищевых технологиях. В промышленности аминокислоты используются при производстве лекарств, биоразлагаемого пластика и хиральных катализаторов.
1. Аминокислоты, белки и питание
О биологической роли и последствиях дефицита аминокислот в организме человека см. информацию в таблицах незаменимых и заменимых аминокислот.
При введении в организм человека с пищей, 20 стандартных аминокислот либо используются для синтеза белков и других биомолекул, либо окисляются в мочевину и углекислый газ в качестве источника энергии. Окисление начинается с удаления аминогруппы через трансаминазу, а затем аминогруппа включается в цикл мочевины. Другой продукт трансамидирования – кетокислота, которая входит в цикл лимонной кислоты. Глюкогенные аминокислоты также могут быть преобразованы в глюкозу посредством глюконеогенеза.
БЕЛКИ
Рис. 9. Белки не только пища. Типы белковых соединений.
Каждый живой организм состоит из белков. Различные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит белков в организме опасен для здоровья. Каждый белок уникален и существует для специальных целей.
ПИТАНИЕ И БЕЛКИ
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Стоит подчеркнть, что современная наука о питании утверждает, что белок должен удовлетворять потребности организма в аминокислотах не только по количеству. Данные вещества должны поступать в организм человека в определенных соотношениях между собой.
2. Небелковые функции аминокислот
Нейромедиатор аминокислоты

В организме человека многие аминокислоты используются для синтеза других молекул, например:
Тем не менее, все еще известны не все функции других многочисленных нестандартных аминокислот. Некоторые нестандартные аминокислоты используются растениями для защиты от травоядных животных. Например, канаванин является аналогом аргинина, который содержится во многих бобовых, и в особо крупных количествах в Canavalia gladiata (канавалия мечевидная). Эта аминокислота защищает растения от хищников, например насекомых, и при употреблении некоторых необработанных бобовых может вызывать заболевания у людей.
Классификация протеиногенных аминокислот
Рассмотрим классификацию на примере 20 протеиногенных α-аминокислот, необходимых для синтеза белка
Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показать дополнительные способы классификации. Названия аминокислот обычно сокращаются до 3-х буквенного обозначения (см. рис. полипептидной цепи вверху страницы). Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты.
1. По строению бокового радикала выделяют:
Ароматические соединения (арены)
— циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.
Различают бензоидные (арены и структурные производные аренов, содержат бензольные ядра) и небензоидные (все остальные) ароматические соединения.
Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность;
2. По полярности бокового радикала
Существуют неполярные аминокислоты (ароматические, алифатические) и полярные (незаряженные, отрицательно и положительно заряженные).
3. По кислотно-основным свойствам
По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты.
4. По незаменимости
По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е.их синтез происходит в недостаточном количестве, особенно это касается детей.
Какая аминокислота не имеет ассиметричного атома с
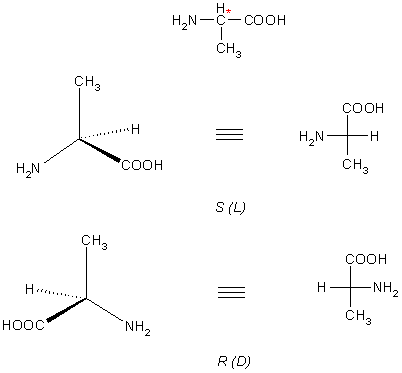
В большинстве α-аминокислот α-углеродный атом хирален (см. главу Стереохимия). Это обусловливает существование их в виде двух оптических изомеров – R— и S-энантиомеров, или, по устаревшей номанклатуре D— и L-энантиомеров. Примечательно, что все природные аминокислоты, входящие в состав белков человека, принадлежат L-ряду, поэтому аминокислоты D-ряда часто называют «непригодными».
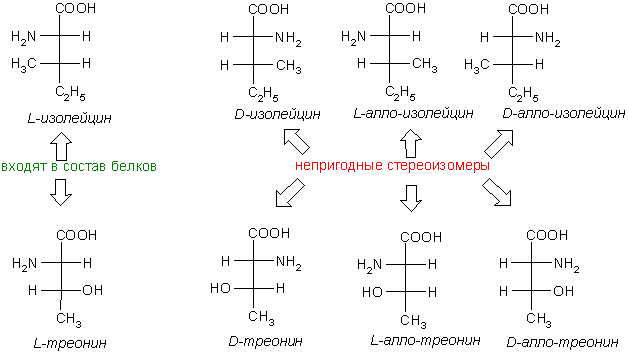
Некоторые α-аминокислоты (изолейцин, треонин) содержат два хиральных атома и существуют в виде 4 стереоизомеров (2 пар энантиомеров), при этом в белковых молекулах встречается только один из них.
Однако D-α-аминокислоты встречаются в составе пептидов, продуцируемых микроорганизмами, например, в природных антибиотиках грамицидине и полимиксине. Кроме того, остатки D-α—аминокислот входят в состав биополимеров клеточной стенки бактерий. Так, D-глутаминовая кислота содержится в оболочке бактерий сибирской язвы – против этого вида бактерий бессильны расщепляющие ферменты человека и животных.
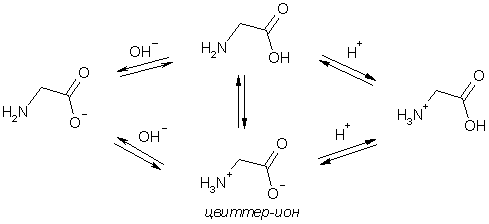
Присутствие в молекулах аминокислот функциональных групп кислотного (СООН) и основного (NH2) характера обусловливает амфотерность этих соединений. В водном растворе алифатические аминокислоты существуют в виде равновесной смеси биполярного иона (его называют цвиттер-ионом), катионной и анионной формы. Положение равновесия зависит от рН среды и строения аминокислоты – главным образом от наличия в составе молекулы дополнительных кислотных или основных центров. Значение рН, при котором концентрация биполярных ионов максимальна, катионная и анионная формы находятся в равных и минимальных концентрациях, называется изоэлектрической точкой (рI). Каждая аминокислота имеет индивидуальное значение рI. В этой точке суммарный заряд молекулы равен 0 и биполярные ионы не перемещаются в электрическом поле. При рН ниже pI катион аминокислоты (аммониевая форма) движется к катоду, а при рН выше pI анион аминокислоты (карбоксилат анион) перемещается к аноду. На этом основано разделение аминокислот методом электрофореза.
Ароматические аминокислоты не образуют цвиттер-ионов, так как основность их аминогруппы понижена из-за сопряжения с бензольным кольцом.
Значения pI некоторых α-аминокислот
Какая аминокислота не имеет ассиметричного атома с
Как следует из рис. 5-2, все стандартные аминокислоты, кроме одной, содержат в 

Таким образом, асимметрический 
Рис. 5-3. Глицин, единственная аминокислота, у которой нет асимметрического атома углерода. R-группа, представляющая собой атом водорода, выделена красным цветом.
Если не считать глицина, не имеющего асимметрического атома углерода (рис. 5-3), все остальные 19 аминокислот, образующиеся при гидролизе белков в достаточно мягких условиях, обладают оптической активностью, т.е. способны вращать плоскость поляризации света в том или ином направлении. Благодаря тому что в аминокислотах валентные связи вокруг 
Таблица 5-2. Удельное вращение некоторых аминокислот, выделенных из белков. Все эти аминокислоты имеют L-конфигурацию, но одни из них правовращающие, а другие левовращающие.
Оптическая активность стереоизомера количественно выражается величиной удельного вращения, которую можно определить, измерив угол поворота плоскости поляризации при прохождении света через раствор чистого стереоизомера с известной концентрацией в кювете поляриметра при заданной длине пути света в растворе:
Угол вращения плоскости поляризации, град
Длину оптического пути выражают в дециметрах и обязательно указывают температуру и длину волны используемого света (обычно это D-линия в спектре натрия, X = 589 нм). В табл. 5-2 приведены значения удельного вращения для нескольких аминокислот; обратите внимание, что среди них есть как левовращающие. так и правовращающие.
Аминокислоты. Свойства аминокислот.
Аминокислоты, белки и пептиды являются примерами соединений, описанных далее. Многие биологически активные молекулы включают несколько химически различных функциональных групп, которые могут взаимодействовать между собой и с функциональными группа друг друга.
Аминокислоты.
В природе встречаются в основном α-кислоты. В состав белков входят 19 аминокислот и ода иминокислота (С5Н9NO2):
Самая простая аминокислота – глицин. Остальные аминокислоты можно разделить на следующие основные группы:
1) гомологи глицина – аланин, валин, лейцин, изолейцин.
2) серосодержащие аминокислоты – цистеин, метионин.
3) ароматические аминокислоты – фенилаланин, тирозин, триптофан.
4) аминокислоты с кислотным радикалом – аспарагиовая и глутаминовая кислота.
5) аминокислоты с алифатической гидрокси-группой – серин, треонин.
6) аминокислоты с амидной группой – аспарагин, глутамин.
7) аминокислоты с основным радикалом – гистидин, лизин, аргинин.
Во всех аминокислотах (кроме глицина) атом углерода связан с 4-мя разными заместителями, поэтому все аминокислоты могут существовать в виде 2-х изомеров (энантиомеров). Если L и D – энантиомеры.
Физические свойства аминокислот.
Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде и мало растворимые в неполярных растворителях.
Получение аминокислот.
1. Замещение атома галогена на аминогруппу в галогензамещеных кислотах:
Химические свойства аминокислот.
Аминокислоты – это амфотерные соединения, т.к. содержат в своём составе 2 противоположные функциональные группы – аминогруппу и гидроксильную группу. Поэтому реагируют и с кислотами и с щелочами:
Кислотно-основные превращение можно представить в виде:
Реагирует с азотистой кислотой:
Реагируют со спиртами в присутствие газообразного HCl:
Качественные реакции аминокислот.
Окисление нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтый цвет.
2. При нагревании с концентрированной азотной кислотой протекает нитрование бензольного кольца и образуются соединения желтого цвета.
L-аминокислота D-аминокислота



Рис. 1.4. L и D оптические изомеры α-аминокислот
Считают, что кислота относится к L-ряду, если в написании фишеровской проекции аминогруппа расположена слева (рис. 1.4).
Все природные аминокислоты, входящие в состав белков, относятся именно к L-ряду.
Вся белковая жизнь на земле – «левая». Есть и «исключения», но они только подтверждают правило. Оказывается, D-аминокислоты крайне редко, но все же встречаются в природе.
Например, они присутствуют в оболочке бактерии, которая является возбудителем сибирской язвы. Именно поэтому оболочка бактерии не разрушается ферментами, разрывающими белковые цепи L-аминокислот.
Из 20 α—аминокислот, входящих в состав белков:
1) 17 обладают одним ассиметричным атомом углерода;
2) одна не содержит ассиметричного атома углерода: глицин;
3) две имеют два ассиметричных атома углерода: изолейцин и треонин.
1.5.1.3. Классификация α-аминокислот
В настоящее время существуют различные классификации
α-аминокислот.
В зависимости от строения бокового радикала аминокислоты подразделяют на:
1) неполярные (гидрофобные), содержат неполярный гидрофобный радикал (линейную или разветвленную углеводородную цепочку или ароматическое кольцо);
Наиболее распространенные α-аминокислоты приведены на Рис. 1.5:
ЕПОЛЯРНЫЕ АМИНОКИСЛОТЫ