как понять какую степень окисления может проявлять элемент
Степени окисления элементов. Как найти степени окисления?
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Не смешивайте понятия «валентность» и «степень окисления»!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
Небольшой тест на тему «Степень окисления»
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Урок №66. Валентность и степень окисления. Правила определения степеней окисления элементов
I. Валентность
II. Степень окисления
Степень окисления (СО) – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
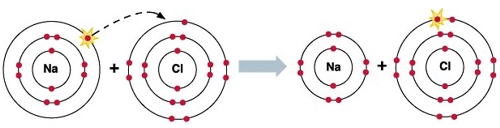
Рассмотрим строение атомов фтора и натрия:
— Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
— Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
— Оба атома имеют незавершённый внешний уровень.
— Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
Процесс отдачи электронов атомом, называется окислением .
Атом, отдающий электроны и повышающий свою степень окисления, окисляется и называется восстановителем .
Процесс принятия электронов атомом, называется восстановлением .
Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется окислителем .
Правила определения степени окисления атома
3. В сложных веществах степень окисления фтора -1
5. Элементы IA, IIA, IIIA групп отдают электроны и проявляют высшую «+» степень окисления, равную номеру группы
Э 0 -ne — →Э +n
Э 0 -ne — →Э +n
Э 0 +ne — →Э -n
7. Элементы VIIIA группы (инертные или благородные газы) проявляют степень окисления равную 0
8. Степень окисления атомов в простых веществах равна 0
F 2 0 , S 0 , O 3 0
9. В сложном веществе алгебраическая сумма СО всех атомов, с учётом их индексов, равна 0; а в сложном ионе его заряду.
H +1 N +5 O 3 -2 ((+1)*1)+((+5)*1)+((-2)*3)=0
(S +6 O 4 -2 ) -2 ((+6)*1)+((-2)*4)=-2
10. Металлы главных подгрупп IА-IIIА групп проявляют СО
+n = N группы
11. Металлы главных подгрупп групп IV-VII и металлы побочных подгрупп проявляют переменную степень окисления +n, согласно правилу №9 (с учётом рядом стоящего аниона – см. «Таблица растворимости веществ в воде»)
1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Х=6 или (+6), следовательно, у серы CО +6, т.е. S +6
1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Х=5 или (+5), следовательно, у фосфора CО +5, т.е. P +5
1. Проставим известную степень окисления у водорода, а СО азота примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Степени окисления элементов
Степень окисления является важной характеристикой состояния атома в молекуле.
В соединениях с ионной связью степени окисления элементов равны зарядам ионов. Например:
Степень окисления хлора = —1
Степень окисления фтора = —1
В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степени окисления элементов равны нулю.
В соединениях с ковалентной полярной связью степень окисления элемента — это условный заряд его атома в молекуле, если считать, что молекула состоит из ионов, т. е. рассматривать ковалентные полярные связи как ионные связи. При этом считают, что общие электронные пары полностью переходят к атомам элементов с большей ЭО.
Любая молекула является электронейтральной, поэтому алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.
Некоторые элементы во всех сложных веществах имеют постоянную степень окисления:
Элементы с постоянной степенью окисления Степень окисления
б) Элементы II группы (кроме Hg): Be, Mg, Ca, +2
Водород и кислород в большинстве сложных веществ имеют постоянные степени окисления, но есть исключения:
Все другие элементы в различных соединениях имеют разные степени окисления, т.е. являются элементами с переменной степенью окисления.
Например, определим степени окисления углерода в различных соединениях. Одновременно напишем графические формулы этих соединений, чтобы показать валентность углерода.
Вы видите, что степень окисления углерода изменяется от – 4 до +4, а валентность углерода во всех соединениях равна IV.
Степени окисления могут иметь и дробные значения. Например:
Необходимо знать, что:
1.Металлы во всех сложных соединениях имеют только положительные степени окисления.
2.Неметаллы могут иметь и положительные, и отрицательные степени окисления. В соединениях с металлами и водородом степени окисления неметаллов всегда отрицательные.
З. Высшая (максимальная) степень окисления элемента, как правило, равна номеру группы, в которой находится элемент в периодической системе.
4.Низшая (минимальная) степень окисления металлов равна нулю. Низшая степень окисления неметаллов обычно равна: — (8 — номер группы, в которой находится элемент).
5.Значения степеней окисления элемента между высшей и низшей степенями окисления называются промежуточными.
Например, элемент-неметалл азот (V группа) может иметь следующие степени окисления:
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Электроотрицательность. Степень окисления и валентность химических элементов
Содержание:
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Для определения валентности применяются определенные правила:
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
Степень окисления для «чайников»
Степень окисления или окислительное число дает количественную характеристику состояния атома в соединении.
| Степень окисления — условный заряд атома в соединении, если предположить, что соединение состоит только из ионов |
Исходя из вышесказанного, в окислительно-восстановительных реакциях вычисляют неизвестную степень окисления элементов, исходя из двух моментов:
Составляем и решаем уравнение:
| Высшая степень окисления — наибольшее положительное ее значение |
Высшая степень окисления является очень важной количественной характеристикой элемента, чаще всего, она равна номеру группы элемента в Периодической таблице:
| Низшая степень окисления — наименьшее возможное ее значение для данного элемента |
Если элемент имеет три и более возможных степеней окисления, то все остальные степени окисления, лежащие между высшей и низшей, называются промежуточными или средними.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе