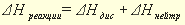как понять какая реакция эндотермическая или экзотермическая
Экзотермические и эндотермические реакции.
Химическая реакция заключается в разрыве одних и образовании других связей,поэтому она сопровождается выделением или поглощением энергии в виде теплоты,света, работы расширения образовавшихся газов.
По признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические.
— химическая реакция, при которой происходит выделение теплоты.
Например, в реакции горения метана
Тот факт, что в этой реакции выделяется теплота, можно отразить в уравненииреакции:
Это так называемое
Здесь символ «+Q» означает,что при сжигании метана выделяется теплота. Эта теплота называется
Термохимическое уравнение реакции
— уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения.
Тепловой эффект таких реакций отрицательный.
Наряду с тепловым эффектом термохимические процессы очень часто характеризуют разностью энтальпий ∆H продуктов реакции и исходных веществ.
— это определенное свойство вещества, оно является мерой энергии, накапливаемойвеществом при его образовании.
Процессы, протекающие при постоянном давлении,встречаются гораздо чаще, чем те, которые протекают при постоянном объеме, так как большинство из них проводится в открытых сосудах. Доказано, что в химических процессах, протекающих при постоянном давлении, выделившееся (или поглощенное) тепло есть мера уменьшения (или соответственно увеличения) энтальпии реакции ∆ H.
Термохимические уравнения.
На первых этапах изучения химии вы часто пользовались равным по абсолютной величине и противоположным по знаку обозначением,например:
В справочных таблицах обычно приводят не значениявеличины Q, а значения величины ∆H, измеренные приопределенных условиях (чаще всего при 298 К); их обозначают ∆H0.
Теплота образования химических соединений.
Теплотой образования соединения называется количество теплоты, которое выделяется или поглощаетсяпри образовании одного моля химического соединения из простых веществ пристандартных условиях (р = 10 5 Па, T = 298 К).
Тепловые эффекты химической реакции. Основные законы термохимии.
Количество теплоты, которое выделяется или поглощается врезультате реакций между определенными количествами реагентов, называют тепловым эффектом химическойреакции и обычно обозначают символом Q.
вещества называется тепловой эффект сгорания 1 моля этого вещества
Изменение энтальпии ∆Н зависит отдавления и температуры. Поэтому для того, чтобы облегчить сравнениетермохимических данных для различных реакций, были приняты определенныестандартные состояния (условия).
При написании термохимических уравнений твердое вещество, жидкость и газобязательно обозначаются символами (тв), (ж) и (г) соответственно, посколькуизменение энтальпии зависит от агрегатного состояния реагирующих веществ ипродуктов реакции.
Стандартное состояние всегда относится к 298 К.
Так, например,термохимическое уравнение образования воды из водорода и кислорода записываетсяследующим образом:
Значение 286 кДж является теплотой образования воды встандартных условиях и означает, что при образовании 1 моля воды выделяется 286 кДж теплоты: Отметим, что значение теплоты образования газообразнойводы уже будет иным.
Закон Гесса и его следствия.
Важнейшим законом, на котором основано большинство термохимических расчетов, является закон Гесса (его называют также законом суммы тепловых эффектов).
Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Как понять какая реакция эндотермическая или экзотермическая
Глава 2. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
2.1. Теоретическая часть
Раздел химии, изучающий тепловые эффекты химических реакций называется термохимией. Все химические процессы сопровождаются выделением или поглощением теплоты. Реакции, сопровождающиеся выделением теплоты из системы в окружающую среду, называются экзотермическими, сопровождающиеся поглощением теплоты из окружающей среды, называются эндотермическими. Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называется теплотой реакции Qр, а противоположная ему по знаку величина, описывающая изменение состояния системы в результате протекания реакции энтальпией реакции 
В качестве основной единицы измерения теплоты в системе СИ установлен джоуль. В качестве единицы измерения теплоты встречается также калория, равная 4,184 Дж. В настоящее время она сохраняется как внесистемная единица для сравнения результатов современных работ с экспериментальными и справочными данными, накопленными за многие предыдущие годы.
Для описания тепловых явлений в химических реакциях принято пользоваться так называемыми термохимическими уравнениями. Термохимические уравнения записываются как обычные уравнения химических реакций, но с указанием величины и знака теплового эффекта реакции. В случае экзотермических реакций с правой стороны уравнения отмечают количество выделившейся теплоты со знаком «плюс», а в случае эндотермических реакций — количество поглощенной теплоты со знаком «минус». При этом у формулы каждого вещества индексом указывается его физическое состояние: газообразное (г), жидкое (ж), кристаллическое (к) или раствор (р-р).Существует термодинамический способ записи термохимических уравнений — когда в самом уравнении тепловой эффект не указывается, а изменение энтальпии реакции (
В данной реакции Q > 0, соответственно, 
Расчеты тепловых эффектов химических реакций основаны на применении закона Гесса (1836 г.): Тепловой эффект химической реакции при постоянном давлении и объеме, не зависит от способа ее проведения, а зависит лишь от начального и конечного состояния реагирующих веществ.
Например, растворение безводного сульфата меди:






Значения теплоты растворения безводной соли Q и кристаллогидрата Q2 известны и составляют 66,11 и –11,5 кДж соответственно. Тогда тепловой эффект реакции образования кристаллогидрата может быть рассчитан по формуле:
Q1 = Q – Q2 = 66,11 кДж – (–11,51 кДж) = 77,69 кДж, (2.5)
соответственно энтальпия равна 
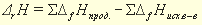
Например, значение энтальпии реакции между растворами сильной кислоты и сильного основания может быть получено по табличным данным энтальпий образования исходных веществ., если представить эту реакцию:, например
может быть получено по табулированным энтальпиям образования в виде реакций между ионами, поскольку эта реакция в действительности является реакцией между ионами H + и OH – :
Табличные значения энтальпий образования (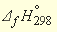




–285,84 – (–229,94) = –55,9 кДж/моль
При нейтрализации слабой кислоты сильным основанием или сильной кислоты слабым основанием тепловой эффект реакции будет зависеть от того, какая слабая кислота или слабое основание вступает в реакцию. (Другими словами от природы этих веществ). Это связано с тем, что слабые кислоты и основания существуют в растворах преимущественно в виде молекул. Например, при нейтрализации уксусной кислоты щелочью:
в действительности идет следующая реакция:
которой соответствует энтальпия 
В то же время реакцию (2.8) можно представить в виде суммы двух процессов:
1) диссоциации кислоты
CH3COOH = CH3COO + Н + 
2) и нейтрализации возникающих при этом ионов H + :
H + + ОН – = Н2О 
Тогда, по закону Гесса, энтальпия ее равна сумме энтальпий этих реакций:
Следовательно, если известныизмерить энтальпии реакций нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием, то по этим данным можно найти энтальпияю реакции диссоциации слабой кислоты может быть рассчитана по этим данным:
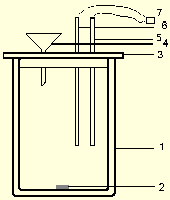
Общий вид используемой калориметрической установки
Рис.2.2 Схематическое изображение калориметрического стакана.
Если калориметрическая установка работает с компьютером, то сбор данных и построение графика осуществляется автоматически.
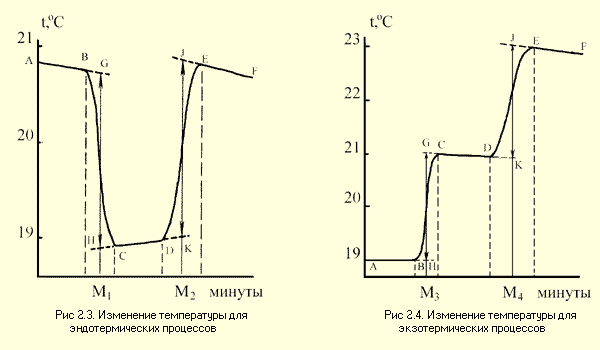
Примерные графики изменения температуры для экзотермических и эндотермических процессов представлены на рис.2.3 и 2.4.
Каждый калориметрический опыт начинают с определения температурного хода калориметрической системы. Для этого в течение нескольких минут измеряют температуру установки (участок АВ на рис. 2.3 и 2.4).
Участок ВС на графиках соответствует собственно реакции: экзндотермической на рис. 2.3 и экзотермической на рис.2.4. В результате реакции наблюдается значительное изменение температуры калориметра (
Наличие небольшого наклона на графике температурной зависимости в начальном (АВ) и конечном (СD) периодах, свидетельствует о том, что во время опыта имеет место некоторый теплообмен калориметра с окружающей средой. В расчетах теплообмен учитывается следующим образом. Прямая AB экстраполируется вправо, а прямая CD влево. Интервал времени от B до C делится пополам и через эту точку проводится перпендикуляр к оси абсцисс до пересечения его с экстраполированными участками прямых АВ и СД (точки H,G). Величина отрезка HG соответствует изменению температуры калориметрической системы 
Тепловой эффект химической реакции может быть рассчитан по формуле
Q = K
Количество тепловой энергии qэл,, сообщенное калориметрической системе при нагреве,, вычисляется по формуле Джоуля:
Тепловое значение калориметра:
K = qэл/
Подставив значение K в формулу (2.11), получаем значение теплового эффекта реакции.
Измеренный тепловой эффект следует отнести к 1 моль вещества, для чего необходимо разделить его на число молей (n ) того из участников реакции, который находится в недостатке, тогда:
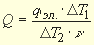
Увеличивается или уменьшается при этом энтальпия системы? Чему равно изменение энтальпии?
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами.. Экспериментально определить теплоты растворения кристаллогидрата CuSO4• 5H20O и безводной соли CuSO4. Оценить достоверность полученных результатов.
Дистиллированная вода, безводный CuSO4, CuSO4• 5H20O.
Калориметрическая установка, технические весы, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл.
2.2.4. Порядок выполнения эксперимента
Опыт 1. Определение теплоты растворения кристаллогидрата CuSO4•5H2O.
Начинающим рекомендуется работать вдвоем. Один студент следит за показаниями температуры и времени на дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» и диктует эти данные второму студенту, который заносит данные в таблицу 1 в рабочем журнале.)
Взвесьте с точностью до сотых 15 г CuSO4•5H2O.
В калориметрический стакан с помощью мерной колбы налейте 150 мл дистиллированной воды, температура которой должна быть близка к комнатной. Оставьте небольшое количество воды (
Опустите в калориметрический стакан сердечник магнитной мешалки и включите в розетку 220 В блок питания.
Нажмите кнопку включения на блоке питания (при этом на блоке питания должна загореться красная лампочка).
Нажмите и удерживайте в течение 2 сек. кнопку «ВКЛ» (рис.2 Приложения) на измерительном преобразователе «ЭКСПЕРТ-001-3» (при этом начнет светиться его жидкокристаллический дисплей). Первая надпись на ж/к дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» показывает уровень зарядки собственных аккумуляторов преобразователя. При величине менее 30 % необходимо зарядить аккумуляторы при помощи сетевого адаптера.
Вращая ручку включения магнитной мешалки, добейтесь оптимальной скорости вращения сердечника магнитной мешалки.
Выберите время работы электрического нагревателя (с) при определении теплового значения калориметра. Для этого на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3» нажмите кнопку «Ф2» и далее кнопку «ЧИСЛ». Цифровыми кнопками наберите время работы нагревателя, с. Рекомендуемое время 200 с. После установки времени нагрева два раза нажмите кнопку «ВВОД».
Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР».
Начните выполнение опыта, нажав кнопку «ИЗМ». На дисплее появятся данные работы секундомера, работающего в режиме прямого отсчета времени и значения температуры в калориметрическом стакане.
Определите тепловой ход калориметрической установки. (Участок АВ на рис. 2.3) При работе в ручном режиме записывайте в рабочий журнал в таблицу 1 показания температуры через каждые 30 с. в течение пяти минут. Если измерения показывают, что в течение 5 мин температурные изменения достаточно равномерны и невелики, начинайте эксперимент.
В определенный момент времени, отметив его в рабочем журнале, высыпьте в калориметрический стакан через сухую воронку приготовленную навеску кристаллогидрата сульфата меди CuSO4•5H2O. Оставшейся в мерной колбе водой смойте остатки соли с воронки.
| Время измерений, с | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 | 300 |
| Температура измерений, о С |
За счет растворения соли происходит быстрое изменение температуры, поэтому, пока наблюдается рост температуры, фиксирутефиксируйте значения температуры через возможно малые промежутки времени (каждые 5–10 с).
После того, как растворение соли закончится, изменение температуры замедлится и температурный ход снова станет равномерным (участок СD на рис. 2.3), продолжайте измерения температуры через 30 с. еще в течение 5 мин.
После отключения тока нагревателя, рост температуры замедлится, а затем температура начнет медленно падать. Фиксируйте изменение температуры через каждые 30 с еще в течение 5мин..
Нажмите клавишу «ОТКЛ» на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3».
Выполните команду «Стоп» на экране монитора компьютера.
При работе установки с компьютером измерения температуры в зависимости от времени в течении всего эксперимента будут фиксироваться автоматически. В результате на мониторе компьютера появиться график, соответствующий изменению температуры системы в течении всего эксперимента. После его окончания расечатайтераспечатайте полученный график на принтере.
Опыт 2. Определение теплоты растворения безводной соли CuSO4
Взвесьте с точностью до 0,01 г
Затем проведите опыт по определению теплоты растворения безводной соли CuSO4. Опыт выполняется так же, как и опыт 1.
Результаты температурных измерений представьте в виде графика.
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами. Экспериментально определить теплоты нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием. Оценить достоверность полученных результатов.
Дистиллированная вода, 0,4 М HCl, 0,4 M CH3COOH, 6 М KOH.
Калориметрическая установка, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл
2.3.4. Порядок выполнения эксперимента
Опыт 3 Определение теплоты нейтрализации сильной кислоты сильным основанием
Определение теплоты нейтрализации сильной кислоты и сильного основания проводите в калориметрической установке, которая была описана выше.
С помощью мерной колбы налейте в калориметрический стакан 150 мл 0,4 М. раствора соляной кислоты. Оставшиеся в колбе следы соляной кислоты смойте в калориметр небольшим количеством дистиллированной воды.
В мерный цилиндр налейте 12 мл 6 М раствора КОН.
Опустите в калориметрический стакан сердечник магнитной мешалки, включите блок питания установки и, вращая ручку регулировки вращения магнитной мешалки, добейтесь оптимальной скорости ее вращения.
Выберите время работы электрического нагревателя, так как это описано в опыте 1. Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР» и начните выполнение опыта, нажав кнопку «ИЗМ».
Для того, чтобы результаты измерения фиксировались компьютером, одновременно выполните команду «СТАРТ» в меню программы«Expert001.exe» измерения данных на компьютере.
Определите тепловой ход калориметрической установки (участок АВ на рис. 2.4), записывая в таблицу 1 показания температуры через каждые 30 с. в течение 5 минут.
Влейте через воронку в калориметрический стакан 12 мл 6 М раствора КОН и с этого момента записывайте изменение температуры в калориметрической системе через возможно малые интервалы времени (5-10 с).
После того, как температура стабилизируется, в течение 5 минут фиксируйте изменение температуры через каждые 30 с.
Определите тепловое значение калориметрической установки как это описано в опыте 1 и закончите эксперимент нажатием клавиши «ОТКЛ». Выполните команду «Стоп» на экране монитора компьютера.
Постройте график зависимости температуры калориметрической системы в зависимости от времени или распечатайте его на компьютере.
Опыт 4. Определение теплоты нейтрализации слабой кислоты сильным основанием
Работу проводите так же, как и в опыте 3, только для реакции нейтрализации возьмите 150 мл 0,4 М раствора уксусной кислоты.
Рк +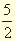
Чему равна энтальпия образования пентахлорида фосфора?