как определить коллаген какого типа
Как определить коллаген какого типа
• Основная функция коллагена состоит в обеспечении структурной опоры тканей
• Коллагены представляют собой семейство, состоящее более чем из 20 различных белков внеклеточного матрикса. Эти белки — наиболее распространенные в царстве животных
• Все коллагены организованы в тройные спирализованные «коллагеновые субъединицы», обладающие суперспиральной структурой и состоящие из трех отдельных полипептидов
• Коллагеновые субъединицы выходят из клеток и затем, во внеклеточном пространстве, собираются в более крупные фибриллы и волокна
• Мутации в коллагеновых генах вызывают множество патологических состояний, начиная от появления морщин до развития хрупкости костей и таких тяжелых заболеваний, как образование кожных волдырей
Семейство коллагенов включает более 20 белков, которые относятся к наиболее распространенным белкам клеток животных. У многоклеточных организмов коллагены существуют по крайней мере 500 млн лет. Почти все клетки животных синтезируют и секретируют по меньшей мере одну из форм коллагена.
Коллагены обеспечивают тканям структурную поддержку и существуют во множественных формах, организованных в различные структуры. Все белки семейства коллагенов характеризуются одним общим свойством: они собраны в тонкие (примерно 1,5 нм диаметром) тройные спиральные суперспирализованные структуры, состоящие из трех субъединиц коллагеновых белков, которые удерживаются вместе ковалентными и нековалентными связями.
где они связаны между собой другими белками внеклеточного матрикса, включая коллагены, связанные с фибриллами.
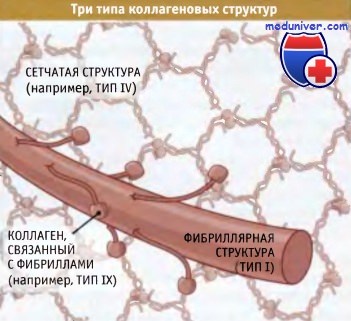
Суперспирализованные структуры бывают трех типов — фибриллярные, слоистые и связанные с фибринами:
• В фибриллярных коллагенах суперспирализованные спирали организованы в фибриллы или «канаты», которые обеспечивают прочность структуры вдоль единственнной оси (такая структура напоминает прочный стальной трос, образованный проволочными пучками). Когда эти фибриллы собраны в параллельно расположенные пучки, как в сухожилиях, они обеспечивают невероятную прочность структуры, которая способна противостоять усилиям, развиваемым мышцами, закрепленными на костях.
• Слоистые коллагены представляют собой сеть, состоящую из суперспирализованных спиральных структур. Они в меньшей степени устойчивы к мышечным усилиям, но гораздо лучше противостоят растяжению в нескольких направлениях. Сеть таких структур, например, характерна для кожи.
• Третий тип коллагена, известный как «фибриллярные связки», образует суперспирализованные спиральные структуры, связывающие коллагеновые фибриллы вместе.
Независимо от организации, коллагены образуют основную каркасную структуру внеклеточного матрикса. Такие входящие во внеклеточный матрикс белки, как фибронектин и витронектин, связываются с коллагенами и вплетены в структуры, образованные коллагеновым каркасом. Один из представителей семейства коллагенов представляет собой трансмембранный белок, который участвует в формировании межклеточных контактов.
Существует примерно 20 различных типов коллагена, большая часть которых может быть сгруппирована в четыре класса. Каждая из тройных спиралеобразных структур обозначается римской цифрой (I, II, III и т. д.). Каждая коллагеновая субъединица имеет обозначение как субъединица а, а ее типу присвоен номер (а1, а2, а3 и т. д.), после которого римской цифрой обозначен тип, в котором она находится. Например, основной фибриллярный коллаген хвоста (и других тканей) крыс относится к типу I и состоит из двух копий субъединиц а1(1) и одной копии субъединицы а2 (I).
На рисунке ниже представлена структура коллагеновых волокон. Три полипептидные субъединицы параллельно обернуты вокруг друг друга и образуют суперспирализованную спиральную структуру длиной 300 нм. Для коллагенов характерна повторяющаяся последовательность аминокислот, содержащая элемент глицин-X-Y, где X и Y могут представлять собой любую аминокислоту, но обычно это пролин и гидроксипролин соответственно.
Такая последовательность способствует плотной упаковке трех субъединиц и облегчает образование суперспиральной структуры. Субъединицы длиной 300 нм скрепляются вместе посредством ковалентных связей, которые образуются между N-концевым участком одной субъединицы и С-концевым участком примыкающей к ней. Суперспирализованные спиральные структуры располагаются параллельно, образуя между собой небольшие зазоры (64-67 нм). Эти зазоры обеспечивают характерный вид (исчерченность) фибрилл, видимый в электронном микроскопе.

характеру полимерных форм и по распределению в тканях. Некоторые группы включают коллагены нескольких типов.
Полностью собранные коллагеновые структуры (фибриллярные или сетчатые) по размерам оказываются гораздо больше, чем сами клетки; некоторые фибриллы могут достигать нескольких миллиметров длины. Таким образом, субъединицы коллагена синтезируются и секретируются в виде суперспирализованных спиральных структур, и окончательные этапы их сборки происходят вне клетки. Как показано на рисунке ниже, синтез коллагена и дальнейший его процессинг происходят на протяжении всего секреторного пути. При синтезе коллагеновые белки направляются в гранулярный эндоплазматический ретикулум (ЭПР) при участии частиц, распознающих сигнал и связанного с ними белкового аппарата.
Коллагеновые субъединицы синтезируются в виде крайне длинных полипептидов, которые называются проколлагены и содержат пропептиды, представляющие собой «хвосты», расположенные на амино- и карбоксильном концах.
После того как проколлагены попали в просвет ЭР, по мере транспорта из ЭР через аппарат Гольджи и в секреторные везикулы, они претерпевают серию модификаций. В процессе транспорта проколлагена через ЭР и аппарат Гольджи, к боковым цепям пролина и лизина, находящимся в средней части молекул проколлагена, добавляются гидроксильные группы (-ОН). При этом образуются гидроксипролин и гидроксилизин.
Эти модификации обеспечивают правильное образование водородных связей, которые скрепляют вместе три субъединицы в суперспирализованной спиральной структуре. Между амино- и карбоксиконцевыми частями пропептидов образуются дисульфидные связи, которые затем обеспечивают правильное расположение трех проколлагеновых субъединиц с образованием тройной спиральной суперспирализованной структуры. Затем спираль образуется спонтанно, в направлении от С-конца к N-концу.
Пропептиды препятствуют взаимодействию суперспирализованных спиралей друг с другом, тем самым предотвращая полимеризацию коллагена в клетке. Когда произошла секреция тройных спиралей проколлагена, ферменты, которые называются протеазы проколлагена, отщепляют пропептиды. Остающийся белок, известный под названием тропоколлагена, почти весь организован в тройную спираль и представляет собой основную структурную единицу коллагеновой фибриллы.
Фибриллы собираются просто: боковые цепи лизина в тропоколлагене модифицируются при действии фермента лизилоксидазы, образуя аллизины. Эти модифицированные лизины образуют ковалентные сшивки, которые обеспечивают полимеризацию тропоколлагенов. Лизилоксидаза представляет собой внеклеточный фермент, и эта стадия сборки фибрилл происходит только после выхода проколлагена из клетки. После сборки фибриллы могут объединяться, образуя большие пучки или волокна, характерные для фибриллярного коллагена.
Принимая во внимание всю важность коллагена в обеспечении структурной поддержки тканей, можно представить, какие тяжелые последствия для организма будет иметь нарушение процесса сборки фибрилл. Мутации в генах, кодирующих синтез коллагенов или ферментов, модифицирующих проколлаген, вызывают развитие множества генетических заболеваний, затрагивающих практически все ткани. Например, коллаген типа I представляет собой основной структурный белок костной ткани. Мутации в коллагеновых генах этого типа служат причиной незавершения остеогенеза, т. н. развития «болезни хрупких костей».
Мутации в коллагеновом гене типа IV приводят к нарушению сборки базальной ламины в большинстве эпителиальных тканей и к развитию такого кожного заболевания, как буллезный эпидермоз.
Клетки связываются с коллагеном посредством специфических рецепторов, называемых интегринами. Эти рецепторы обеспечивают возможность обратимого связывания клеток с коллагенами по мере их движения по внеклеточному матриксу. Интегриновые рецепторы также активируют пути передачи сигналов, так что связывание с коллагенами (и с другими белками внеклеточного матрикса) изменяет активность в клетке биохимических процессов и, таким образом, способствует контролю над ростом и дифференцировкой клеток.
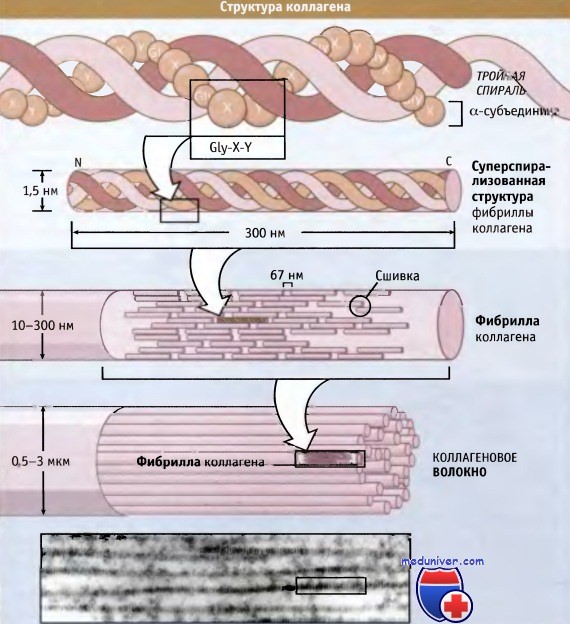
организация витой структуры в фибрилле (в середине) и фибрилл в коллагеновом волокне (внизу).
Наличие 67-нм зазора между соседними спиральными структурами обусловливает видимую в электронном микроскопе исчерченность фибрилл, составляющих волокно. 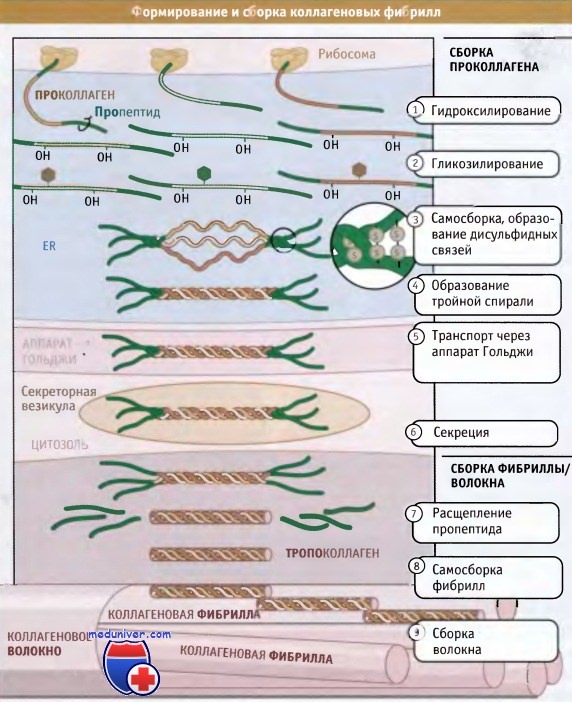
Однако сборка фибрилл происходит во внеклеточном пространстве после секреции тройных спиралей, обладающих витой структурой.
Для упрощения в тройных структурах не показаны гидроксильные группы и сахарные остатки. 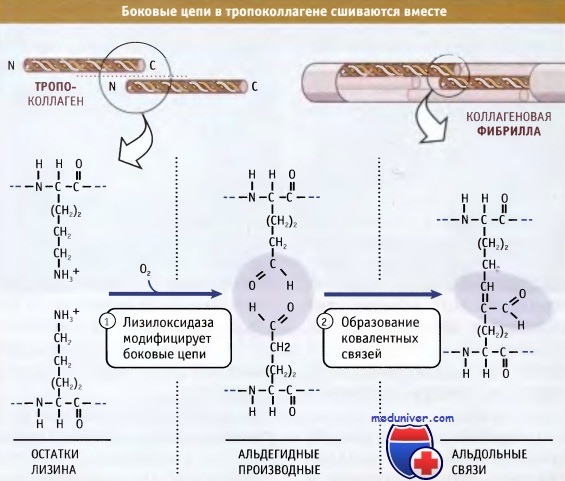
которые затем образуют между собой альдольную связь.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Как выбрать коллаген?
Содержание
Коллаген — белок, который состоит из нескольких аминокислот, среди которых: гидроксипролина, глицина, пролина, лизина и аргинина. Данное вещество входит в состав наших суставов, хрящей, связок, а также кожи и ногтей, из-за чего добавки и косметические средства с ним стали настолько популярны и пользуются высоким спросом последние несколько лет.
Кто-то пьет коллаген из-за проблем с суставами, кто-то — чтобы “продлить” молодость, при этом не все понимают, что для разных целей нужна своя добавка. Разберем по порядку основные нюансы в выборе коллагена.
Коллаген или аминокислоты?
Как уже было сказано ранее, коллаген состоит из аминокислот, среди которых 8 являются незаменимыми. Поэтому возникает резонный вопрос — не проще ли подобрать аминокислотный комплекс, который помимо стимуляции выработки коллагена обладает массой других полезных свойств?
В отличие от аминокомплекса, коллаген имеет более биодоступную гидролизированную форму, в котором аминокислотный профиль гораздо выше, чем в том же комплексе или протеине. То есть основных аминокислот, из которых состоит коллаген (пролин, гидроксипролин и глицин), там содержится больше.
Поэтому если ваша цель — оздоровление суставов или улучшение качества кожи и волос, то лучше остановить свой выбор именно на коллагене.
Типы коллагена
Следующий пункт при выборе коллагеновой добавки — тип коллагена. Всего их существует более 20, но нас интересуют три из них, у каждого из которых своя функция:
Таким образом, для улучшения состояния кожи нужно принимать добавку с коллагеном I и III типа, для суставов — II тип.
Виды коллагена
Когда говорят об источниках коллагена (или видах) подразумевают сырье, из которого он получен, и от вида этого сырья зависит эффективность и биодоступность добавки.
Животный (или бычий ) коллаген — самый популярный вид, который получают путем переработки верхнего слоя шкуры, а также суставов и хрящей крупного рогатого скота.
Такой коллаген хорошо усваивается, оказывает ранозаживляющее, восстанавливающее и увлажняющее действие. Стоимость такой добавки небольшая, но есть пара минусов: животный коллаген может вызвать аллергическую реакцию и уступает по количеству питательных веществ морскому или растительному.
Морской коллаген получают из эпидермиса морской рыбы, по аминокислотному составу он ближе к человеческому, поэтому гораздо лучше воспринимается организмом.
Главным преимуществом морского коллагена является то, что он стимулирует выработку собственного коллагена, а так же он менее аллергичен по сравнению с животным аналогом.
И морской и говяжий коллаген могут вызвать побочные эффекты в виде высыпаний на коже. Это редко связано с качеством самого продукта, часто такая реакция вызвана неправильной работой кишечника или недостаточной выработкой ферментов со стороны поджелудочной железы
Минусом может быть достаточно высокая цена и он требует особых условий хранения, которые подразумевает соблюдения температурного режима и абсолютной стерильности.
Наиболее редкий вид коллагена — растительный, который не совсем является коллагеном как таковым — это белок пшеницы. Он абсолютно гипоаллергенен и хорошо усваивается, но из-за сложного производства такая добавка стоит очень дорого.
Выбирать между морским или бычьим коллагеном нужно, исходя из конкретных целей: для бьюти-целей (кожа и волосы) подходит морской коллаген, а для здоровья суставов — животный.
Дополнительные компоненты в составе
При выборе добавки с коллагеном следует обращать внимание на состав: конечно, можно выбрать чистый продукт, но наличие дополнительных витаминов и минералов, которые улучшают усвоение коллагена, а также способствуют синтезу собственного, будет преимуществом.
В какой форме выбрать коллаген?
Коллаген выпускают в трех формах: капсулы/таблетки, порошок и жидкий. У каждой из этих форм есть свои достоинства:
Выбор формы больше зависит от удобства, но в случае каких либо проблем с ЖКТ, когда есть риск неполного усвоения активного вещества, преимущества за капсулами, так как они имеют специальную желатиновую оболочку. Подробнее о том, как правильно принимать коллаген разных форм и типов можно узнать в статье: «Как правильно принимать коллаген?»
Как определить коллаген какого типа
Коллаген — вид белка, синтезирующийся соединительной тканью. Именно он отвечает за упругость и эластичность кожи. Поэтому первые морщины — сигнал того, что содержание коллагена снизилось. Правильное питание — один из способов замедлить процесс разрушения этого белка.
Коллаген — это белок. 30–40% от всего белка в организме приходится именно на него. Коллаген поддерживает молодость кожи, но его присутствие отмечается также в ногтях, волосах, суставах и тканях кишечника. Всего существует 16 типов коллагена. Самыми распространенными (90%) являются всего 3 типа. Коллаген I и II типа находится в костях, коже, сухожилиях и связках; коллаген III типа — в суставах.
Организм человека способен производить необходимое количество коллагена самостоятельно. Однако после 25 лет его естественное производство начинает снижаться. Именно в этот период можно наблюдать появление первых морщин, а еще чуть позже может начаться и артрит. Теперь давайте посмотрим, что надо есть, чтобы это предотвратить.
Мясной бульон и рыба
Овощи, фрукты, ягоды
Яйца
Яйца — продукт, в котором, как и в костном бульоне, содержится непосредственно сам коллаген. Организм может его получить из желтка. В яйцах также есть сера, необходимая для производства коллагена и детоксикации печени, благодаря которой выводятся токсины, разрушающие коллаген в организме. Но слишком много их есть не стоит: норма — 2 яйца в день.
Семена
Кроме возрастного показателя на выработку белка влияет:
Научная электронная библиотека
1.2. Коллаген
Коллагены составляют основу структуры кожи, костей, хрящей, сухожилий, кровеносных сосудов и играют важную роль в сохранении нормальной структуры и функции соединительной ткани всех животных (Слуцкий, 1969, 1985; Риггз, Мелтон, 2000; Руденская, 2003).
Коллаген (К) – нерастворимый фибриллярный белок, первичная структура которого складывается из повторяющихся последовательностей триплетов аминокислот глицин-X-Y, где X и Y позиции чаще заняты, соответственно, пролином и гидроксипролином. Эти повторяющиеся последовательности позволяют трем коллагеновым полипептидам (называемым α-цепями) формировать полужесткие, очень стабильные трехспиральные молекулы (рис. 3). Они могут быть гомополимерными (три идентичные α-цепи) и гетерополимерными (две или три разные α-цепи). Под влиянием регулярно располагающихся остатков пролина и оксипролина цепь принимает форму ломаной спирали; это обусловливается жесткостью боковых групп пролина, а также тем обстоятельством, что пептидные связи, в образовании которых участвуют пролин и оксипролин, не могут образовать водородных связей. Остатки глицина образуют межцепочечные водородные связи, способствующие сохранению прочности структуры коллагена.


Рис. 3. Структура коллагена: а – электронная микрофотография коллагена соединительной ткани. Расстояние между повторяющимися структурными единицами равно 700 Å; б – конформация полипептидных цепей в трёхцепочечной молекуле тропоколлагена; в – ступенчатое расположение молекул тропоколлагена обусловливает появление в гидратированных волокнах коллагена повторяющихся структурных единиц, расстояние между которыми равно 700 Å (по Мусил и др., 1984)
Аминокислотные цепи коллагена обернуты друг вокруг друга и образуют «трехволоконный канат», где отдельные волокна связаны между собой водородными связями. Такая пространственная структура возможна, только если аминокислотная последовательность строго соблюдается.
В результате образуется трехволоконная фибриллярная молекула – тропоколлаген, обладающая большой прочностью на растяжение. Это название происходит от слова тропос – обращенный внутрь – из-за того, что коллагеновые волокна всех соединительных тканей, выстланы тропоколлагеновыми молекулами, соединенными «конец в конец» и «бок о бок» – в шахматном порядке. Гидроксильные группы некоторых остатков лизина и оксилизина участвуют в образовании связи между соседними молекулами тропоколлагена. Таким образом, формируется жесткое нерастяжимое волокно. Фибробласты синтезируют молекулы тропоколлагена и выбрасывают их в матрикс, и только здесь происходит сборка коллагеновых волокон (рис. 4).
Коллагены кожи содержат в больших концентрациях пролин и оксипролин (около 20 % от всех остальных аминокислот), глицин и аланин (свыше 50 % от содержания других аминокислотных остатков), ароматические и серосодержащие аминокислоты практически отсутствуют или содержатся в весьма малых количествах. Кроме того, коллаген является одним из немногих белков, содержащих оксипролин и оксилизин. Оксипролин и оксилизин образуются в молекуле проколлагена не в результате биосинтеза, а при гидроксилировании пролина и лизина, которое начинается в период трансляции коллагеновой мРНК на рибосомах (Неклюдов, 2003).
Рис. 4. Строение фибробласта и основные этапы синтеза коллагена. Г – аппарат Гольджи; Я – ядро; ШЭР – шероховатый эндоплазматический ретикулум; СП –секреторный пузырек; ТК – тропоколлаген; КВ – коллагеновое волокно
В настоящее время идентифицировано более 25 различных α-цепей, из которых формируется до 14 разных типов коллагеновых молекул, некоторые из них являются тканеспецифичными (Ленинджер, 1974; Риггз, Мелтон, 2000).
Таким образом, коллагены – это белки, которые:
б) могут состоять из трех цепей с повторяющимися последовательностями, обладающими способностью к сворачиванию в характерную тройную спираль. По меньшей мере, 19 белков определены в настоящее время как принадлежащие к коллагенам. 10 родственных им белков содержат коллагеноподобные домены.
Коллагеновые белки составляют около половины массы сухого вещества суставного хряща; вблизи суставной поверхности их концентрация приближается к 90 %. В других видах хрящевой ткани коллагены количественно преобладают над другими белками, обеспечивая прочность на растяжение и разрыв. (Слуцкий, 1985). Количественно преобладающим белком протеогликанового комплекса хрящевой ткани является коллаген второго типа (КII). Он в незначительных количествах обнаружен в других специализированных тканях, например, в стекловидном теле глаз некоторых видов животных. Хрящевой ткани присущ необычный полиморфизм коллагеновых компонентов, проявляющийся присутствием большого числа минорных коллагенов. Молекулярная формула КII хрящевой ткани имеет следующий вид: [α1(ΙΙ)]3, что означает наличие трех идентичных α1(II)-цепей, которые отличаются от α1(I)-цепей более высоким содержанием оксилизина. Столь высокая концентрация оксилизина способствует увеличению количества связанных с ним углеводов. По-видимому, такая структура обеспечивает большую сольватную оболочку коллагена типа II по сравнению с типами I или III. В процессе биосинтеза коллагена С-пропептиды соединяются между собой бисульфидными мостиками и после отщепления от молекулы образуют белок, который называется хондрокальцин, с м.м. около 100 000 Да (Слуцкий, 1985).
Коллаген одиннадцатого типа (КXI) составляет приблизительно 3 % хрящевого коллагена и образован двумя разными типами цепей (формула молекулы α1(XI)2 α2(XI)). Со старением организма его количество в хряще уменьшается в пользу коллагена пятого типа (КV) (Канунго, 1982; Риггз и Мелтон, 2000).
Для хрящевой ткани характерно наличие наибольшего количества минорных коллагеновых компонентов. Такой полиморфизм коллагенов позволяет считать минорные компоненты регуляторами адаптационной пластичности хряща, метаболизма хондроцитов и морфогенетических процессов (Слуцкий, 1985).
Содержание коллагена в различных тканях и органах сельскохозяйственных животных (КРС, свиньи) характеризуют следующие данные (% от массы сухого вещества): дерма – 80–90; ахиллово сухожилие – 86; костная ткань – 17,5–25; хрящи – 46–67; роговица и склера глаз – 70; мышцы – 10. При этом коллаген составляет от 25 до 33 % от общего количества белка (Титов, Апраксина, 1995). У костистых рыб коллагеновые белки преобладают в коже, сухожилиях, плавательном пузыре; у кольчатых червей и иглокожих в кожно-мускульном мешке; у моллюсков в кожных покровах и опорных хрящевых элементах.
Наиболее изучены свойства коллагенов в коже и мышечной ткани рыб. Коллаген кожи костистых рыб характеризуется частой встречаемостью молекул, состоящих из трех генетически различающихся α-цепочек, гетеротримера α1 α2 α3; среди изученных позвоночных животных цепочка α3 отмечена лишь у костистых рыб. В целом коллагены мышечной ткани костистых рыб, полученные методом электрофореза, идентичны соответствующим коллагенам типа I из кожи и имеют сходный аминокислотный состав. Однако коллагены мышечной ткани рыб более устойчивы к тепловой денатурации (более 100 °С), чем коллагены кожи, что объясняется более высокой степенью гидроксилирования пролина в мышечном коллагене. Термальная устойчивость мышечного коллагена определяется видом рыбы и по мере ее возрастания рыб можно расположить в следующем порядке: карп, угорь, скумбрия, сайра, кета.
В табл. 1 приведены данные о содержании коллагена и гексозаминов в соединительных тканях различных видов животных.
Составы субъячеек коллагена I типа из мышечной ткани и кожи являются идентичными у угря, скумбрии, сайры и карпа и отличаются у кеты. У последней коллаген кожи состоит из α1 α2 α3 гетеротримеров, а основная часть мышечного коллагена – из (α1)2α2 гетеротримеров (Богданов, Сафронова, 1993).
Содержание гексозаминов и коллагена в соединительной ткани животных





